Alteration of SH-group contents in red beet roots and vacuoles under osmotic stress
Автор: Ozolina N.V., Nesterkina I.S., Sitneva L.A., Lapteva T.I., Nurminsky V.N., Kolesnikova E.V., Salyaev R.K.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.9, 2013 года.
Бесплатный доступ
The content of sulfhydryl groups in homogenate of red beets and isolated vacuoles under the conditions of osmotic stress was determined. It was demonstrated that the common content of sulfhydryl groups in the isolated vacuoles was 2.4 times higher, than in the homogenate. Under the conditions of osmotic stress, it was primarily denoted the reduction of common content of sulfhydryl groups in homogenate and in the isolated vacuoles. The most interesting results were obtained in determination of correlations between protein and non-protein SH-groups. Under the conditions of osmotic stress, while the contents of non-protein SH-groups in the isolated vacuoles was reduced, non-protein SH-groups in homogenate was greatly increased. This may be explained by the influx of the substances containing SH-groups out of vacuoles. Obtained results allow us to conclude that vacuoles play an important role in plant cell antioxidant processes and in maintenance of intracellular redox-homeostasis.
Vacuoles, red beet roots, osmotic stress, sulfhydryl groups
Короткий адрес: https://sciup.org/14323719
IDR: 14323719
Текст научной статьи Alteration of SH-group contents in red beet roots and vacuoles under osmotic stress
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили корнеплоды столовой свеклы (Beta vulgaris L.), сорт Бордо. В экспериментах были использованы корнеплоды в период покоя, которые хранились при температуре 4-5оС. Эти корнеплоды подвергали гипер- и гипоосмотическому стрессу. Для создания гиперосмотического стресса корнеплоды в течение 3-х суток выдерживали (подсушивали) на открытом воздухе при комнатной температуре, что приводило к частичной потере массы корнеплодов и увеличению осмотической концентрации клеточного сока. Для создания гипоосмотического стресса очищенные корнеплоды выдерживали в течение суток в дистиллированной воде, в результате чего осмоляльность клеточного сока (общая концентрация растворенных частиц в 1 кг воды) уменьшалась. Осмоляльность оценивали на осмометре ОМКА 1Ц-01 (Россия). Характеристики стрессов приведены на рис. 1. Следует отметить, что при создании гипоосмотического стресса корнеплоды находились в воде в бескислородных условиях и поэтому подвергались гипоксии. Для сравнения был введён вариант гиперосмотического стресса с гипоксией. В этом случае корнеплоды выдерживали в растворе 1 М маннита, в результате чего получали гиперосмотический стресс, сопровождаемый гипоксией.
Содержание SH-групп определяли в гомогенате и во фракции вакуолей, выделенных их этих же корнеплодов. Выделение изолированных вакуолей проводили по описанной ранее методике (Саляев и др., 1981). Для определения суммарных тиоловых соединений 1 г корнеплода столовой свёклы или 0.2 мл фракции изолированных вакуолей гомогенизировали с 10 мл 0.1 М Трис-НСl буфера рН 7.5 с 5 мМ ЭДТА, отжимали через капроновую ткань, центрифугировали 15 мин при 5000 g на центрифуге КR-22 (Франция). В аликвотах супернатанта определяли суммарное содержание белка (Bradford, 1976) и SH-групп (Ellman, 1959). Затем для осаждения белка к 1 мл супернатанта прибавляли 10 мл охлаждённой смеси ацетона с 1 Н НСl (39:1) и центрифугировали при 8000 g в течение 20 мин. Осадок белка промывали холодным ацетоном, растворяли в 0.1 М Трис-HCI буфере рH 8.0, содержащем 1% додецилсульфат Na, и использовали для определения белковых SH-групп. О содержании небелковых SH-соединений судили по разнице между общим содержанием SH-групп в супернатанте и количеством SH-групп во фракции растворимых белков.
Общее содержание SH-групп во фракции изолированных вакуолей определялось также методом флуоресцентных зондов на спектрофлуориметре (RF-5301PC, Shimadzu). В качестве флуоресцентного зонда был использован N-(1-пиренил)малеимид, который способен связываться с SH-группами. В кювету поэтапно вносили 2.5 мл инкубационного раствора, зонд в конечной концентрации 6.6 мкМ и 0.1 мл вакуолей (концентрация белка 0.1 мг/мл). Инкубировали 15 минут при комнатной температуре. Измерение интенсивности флуоресценции зонда проводили при длине волны 396 нм (Козарезов и др., 2009).
В работе применяли следующие реактивы фирмы “Sigma-Aldrich”: Трис, 2-меркаптоэтанол, N-(1-пиренил)малеимид, 5,5-дитиобис(2-нитробензойная кислота) – реактив Элмана. Остальные реактивы были отечественного производства квалификации ХЧ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе изучали содержание тиоловых групп в покоящихся корнеплодах и во фракции изолированных вакуолей. Результаты этих исследований приведены в таблице 1. Общее содержание тиоловых групп в корнеплоде было в 2.4 раза меньше, чем во фракции изолированных вакуолей, что говорит о важной роли этого компартмента в редокс-гомеостазе растительной клетки и в её системе антиоксидантной защиты. В корнеплоде преобладали белковые тиоловые группы (56% от общего содержания SH-групп), тогда как во фракции изолированных вакуолей небелковые SH-группы (68% от общего содержания). Соотношение белковых SH-групп к небелковым, показанное в таблице 4, составляет 1.3 для корнеплода и 0.5 для фракции изолированных вакуолей, что говорит о значительном отличии по этому показателю и о существенном преобладании в вакуолях небелковых тиоловых групп.
На следующем этапе работы проводилось изучение динамики содержания тиоловых групп при разных видах осмотического стресса. В покоящемся корнеплоде, подвергнутом гипоосмотическому стрессу, отмечено небольшое (около 10%) увеличение общего содержания тиоловых групп (таблица 2) и более существенно менялось отношение белковых SH-групп к небелковым. Если в норме в гомогенате корнеплода преобладали белковые SH-группы, то при осмотическом стрессе начинают преобладать небелковые (таблица 4). В ответ на гиперосмотический стресс общее содержание тиоловых групп в корнеплоде снижалось, особенно, если этот стресс сопровождался гипоксией. Соотношение белковых SH-групп к небелковым также, как и при гипоосмотическом стрессе, отличалось от нормы и показало заметное преобладание небелковых SH-групп, хотя и не такое значительное как в варианте гипоосмотического стресса. Таким образом, при сравнении полученных данных, хорошо заметны различия, показывающие, что при более жёстком стрессе (с гипоксией) происходит более существенный сдвиг в сторону преобладания небелковых SH-групп. При сравнении изменений в составе белковых и небелковых тиоловых групп в корнеплоде при разных видах осмотического стресса отчётливо видно, что в условиях гипоосмотического стресса происходят более существенные отклонения от нормы по сравнению с гиперосмотическим стрессом.
По литературным данным, полученным, главным образом, на животных объектах, известно, что при разных стрессовых воздействиях происходит снижение общего содержания SH-групп. Так, Byshneva и Senchuk (2002) отмечали снижение в общем содержании SH-групп в хрусталике глаза после воздействия ультрафиолетовым излучением. В экспериментах, проведённых на мышцах мышей, было показано, что ишемические повреждения целостности мышц приводили к значительному (более чем в 3 раза) снижению общего содержания тиоловых групп (Hosseinzaden et al., 2007). При обработке печени крыс переменным низкочастотным магнитным полем также было отмечено достоверное снижение суммарного содержания тиоловых групп и был сделан вывод о том, что изменения в содержании суммарных тиоловых групп является одним из наиболее чувствительных изменений при действии стрессовых факторов (Кучина, Мартынюк, 2004).
В нашем случае общее содержание тиоловых групп во фракции вакуолей при разных видах осмотического стресса незначительное отличалось от нормы (таблица 3). Достоверное снижение на 20-25% отмечено только для гиперосмотического стресса с гипоксией. Существенное отличие было отмечено также в соотношении белковых и небелковых SH-групп (таблица 4). Так, в норме в 2 раза преобладали небелковые SH-группы, а при осмотическом стрессе – белковые, что было наиболее заметно при гипоосмотическом стрессе. Возможно это связано с защитной функцией вакуоли – с выходом из неё небелковых SH-групп в цитоплазму.
Сравнение общего содержания тиоловых групп в изолированных вакуолях проводилось двумя независимыми методами (с помощью реактива Элмана и с флуоресцентным зондом N-(1-пиренил)малеимидом) одновременно на одной фракции. Полученные результаты представлены в таблице 5. Они показали, что оба метода дают близкие результаты.
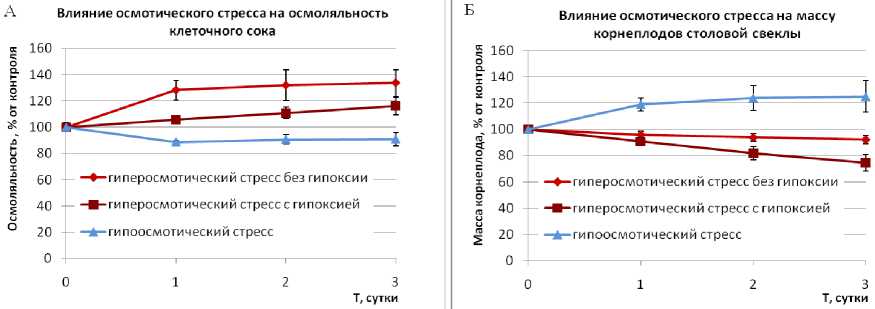
Рисунок 1. Характеристика гипо- и гиперосмотического стрессов.
Изменение массы корнеплода (А) и осмоляльности клеточного сока (Б) при разных видах осмотического стресса.
Таблица 1. Содержание SH-групп (мкмоль/мг белка) в гомогенате и во фракции изолированных вакуолей корнеплодов столовой свёклы в нормальных условиях.
|
Вариант опыта |
Общее содержание SH-групп |
Содержание белковых SH-групп |
Содержание небелковых SH-групп |
|
Гомогенат |
395±18 |
220±22 |
175±20 |
|
Фракция вакуолей |
949±50 |
300±71 |
649±60 |
Таблица 2. Содержание SH-групп в гомогенате корнеплодов столовой свёклы в норме и при разных видах осмотического стресса (в % от нормы из таблицы 1).
|
Вариант опыта |
Общее содержание SH-групп |
Содержание белковых SH-групп |
Содержание небелковых SH-групп |
|
Норма |
100 |
100 |
100 |
|
Гипоосмотический стресс |
115±8 |
41±2 |
203±5 |
|
Гиперосмотический стресс без гипоксии |
85±6 |
68±3 |
106±5 |
|
Гиперосмотический стресс с гипоксией |
76±4 |
46±9 |
114±7 |
Таблица 3. Содержание SH-групп во фракциях изолированных вакуолей корнеплодов столовой свёклы в норме и при разных видах осмотического стресса (в % от нормы из таблицы 1).
|
Вариант опыта |
Общее содержание SH-групп |
Содержание белковых SH-групп |
Содержание небелковых SH-групп |
|
Норма |
100 |
100 |
100 |
|
Гипоосмотический стресс |
94±25 |
223±26 |
85 |
|
Гиперосмотический стресс без гипоксии |
89±36 |
165±25 |
77 |
|
Гиперосмотический стресс с гипоксией |
74±10 |
158±17 |
70 |
Таблица 4. Соотношение белковых к небелковым SH-группам в гомогенате и во фракции изолированных вакуолей корнеплодов столовой свёклы в норме и при разных видах осмотического стресса.
|
Вариант опыта |
Норма |
Гипоосмотический стресс |
Гиперосмотический стресс без гипоксии |
Гиперосмотический стресс с гипоксией |
|
Гомогенат |
1.25 |
0.20 |
0.64 |
0.40 |
|
Вакуоли |
0.46 |
2.60 |
2.10 |
2.30 |
Таблица 5. Сравнение данных по общему содержанию SH-групп во фракциях изолированных вакуолей корнеплодов столовой свёклы в норме и при разных видах осмотического стресса (в % от нормы) разными методами.
|
Вариант опыта |
реактив Элмана |
N-(1-пиренил)малеимид |
|
Норма |
100 |
100 |
|
Гипоосмотический стресс |
94±25 |
83±9 |
|
Гиперосмотический стресс без гипоксии |
89±36 |
76±10 |
|
Гиперосмотический стресс с гипоксией |
74±10 |
80±24 |
По результатам исследований можно сделать следующие выводы:
-
1. Во фракции изолированных вакуолей общее содержание SH-групп в расчёте на 1 мг белка в 2.4 раза больше, чем в гомогенате корнеплодов.
-
2. При разных видах осмотического стресса и в корнеплодах и во фракции изолированных
-
3. Соотношение белковых SH-групп к небелковым значительно различается в корнеплодах и во фракции изолированных вакуолей. Причём, если в норме в вакуолях преобладают небелковые SH-группы, а при разных видах осмотического стресса белковые,
-
4. Изменения в содержании тиоловых групп были более выражены при гипоосмотическом стрессе, чем при гиперосмотическом. Осмотический стресс совместно с гипоксией приводит к увеличению отклонений от нормы как в общем содержании, так и в соотношении белковых и небелковых тиоловых групп.
вакуолей наблюдается, главным образом, снижение общего содержания тиоловых групп.
то в корнеплодах ситуация противоположная: в норме преобладают белковые SH-группы, а при осмотическом стрессе начинают преобладать небелковые. Изменение этих соотношений может быть связано с выходом из вакуолей небелковых SH-групп в цитоплазму.
Таким образом, результаты исследований свидетельсивуют о важной роли вакуоли в поддержании редокс-гомеостаза клетки и в антиоксидантной защите растительной клетки в условиях осмотического стресса.
Список литературы Alteration of SH-group contents in red beet roots and vacuoles under osmotic stress
- Козарезов, С.Н., Войтович, Т.Н., Зубрицкая, Г.П., Козлова, Н.М., Слобожанина,Е.И. (2009) Биофизические параметры мембран эритроцитов детей с бронхолегочной дисплазией в стадии хронической болезни. Медицинский журнал, 2(28), 62-66.
- Кучина, Н.Б., Мартынюк, В.С. (2004) Влияние ПеМП со сложным спектром на процессы перекисного окисления и антиоксидантную систему в разных тканях у белых крыс. Таврический медико-биологический вестник, 7(1), 159-165.
- Саляев, Р.К., Кузеванов, В.Я., Хаптагаев, С.Б., Копытчук,В.Н. (1981) Выделение и очистка вакуолей и вакуолярных мембран из клеток растений. Физиология растений, 28, 1295-1305.
- Bansal, A.K., Bilaspuri,G.S. (2008) Oxidative stress alters membrane sulfhydryl status, lipid and phospholipid contents of crossbred cattle bull spermatozoa. Anim. Respod. Sci., 104(2-4), 398-404.
- Bradford, D.P. (1976) A rapid and sensitive method for the quantitation of protein utilising the principal of protein-dye binding. Anal. Biochem., 72, 248-254.
- Byshneva, L.N., Senchuk, V.V. (2002) Effect of UV-radiation on the level of ascorbic acid, SH-groups, andactivity of glutathione reductase in the eye lens. Vopr. Med. Khim., 48(5), 455-460.
- Ellman, G. (1959) Tissue sulfhydryl groups. Arc. Biochem. Biophys. 82, 70-77.
- Hosseinzaden, H., Hossei, A., Nassiri-Asl, M., Sadeghnia, H.R. (2007) Effect of Salvia leriifolia Benth. root extracts on ischemia-reperfusion in rat skeletal muscle. BMC Complement. Altern. Med., 7, 23.


