Альтернативная модель оценки биосовместимости синтетических полипропиленовых эндопротезов для герниопластики
Автор: Пономарева Юлия Вячеславовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические науки и фундаментальная медицина
Статья в выпуске: 5-3 т.17, 2015 года.
Бесплатный доступ
В статье рассматривается альтернативная с применением культур клеток модель оценки биосовместимости разрешенных к применению в клинике синтетических протезирующих герниопластических материалов с оценкой их влияния на морфо-функциональные параметры клеток.
Культура фибробластов, биосовместимость, цитотоксичность, эндопротезы, герниопластика
Короткий адрес: https://sciup.org/148204183
IDR: 148204183 | УДК: 617.55-077.43:616-089.168.1
Текст научной статьи Альтернативная модель оценки биосовместимости синтетических полипропиленовых эндопротезов для герниопластики
В настоящее время свыше 60-ти мировых производителей для целей герниологии выпускают около 150 видов протезирующих материалов. Их химическую основу в большинстве случаев составляют 4 полимера, такие как: полипропилен, полиэтилентерефталат, поливинилиденфторид и политетрафторэтилен [1]. С каждым годом число протезирующих материалов возрастает, но в основном за счет изменения существующих.
Поиск новых материалов и усовершенствование имеющихся обусловлен их биосовместимостью, именно на ее улучшение направлены технологии по модификации структуры и поверхности. Любая имплантация сопровождается реакцией со стороны тканей в виде абсорбции белков на волокна, активации клеток воспаления и/или регенерации. Эндопротезирование большинством полимеров инициирует в тканях хроническое асептическое воспаление с последующей фиброзной трансформацией тканей в месте имплантации [2]. С этих позиций тестирование новых или модифицированных синтетических имплантатов с применением культур клеток может служить хорошей альтернативной моделью для скрининга их биосовместимости.
Цель исследования: провести оценку биосовместимости синтетических материалов на основе полипропилена in vitro.
Материалы и методы. Для тестирования на биосовместимость были использованы образцы сетчатых синтетических имплантатов на основе полипропилена как стандартные монофила-ментные – Optomesh (ОАО «Трикомед», Польша), Эсфил (ОАО «Линтекс», Россия), так и комбинированные Proceed («Этикон», Бельгия), Ultrapro («Этикон», Бельгия).
Пономарева Юлия Вячеславовна, кандидат медицинских наук, старший научный сотрудник Института экспериментальной медицины и биотехнологий.
Из образцов дермы человека были получены культуры фибробластов методом первичных эксплантатов. Клетки культивировали в стандартных условиях в пластиковых культуральных флаконах в термостате Sanyо-Incubator MIR-262 при температуре 370 С в среде Игла МЕМ +199 с добавлением 10% эмбриональной телячьей сыворотки. Для исследования использовали 4 пассаж дермальных фибробластов.
Тестирование проведено в чашках Петри диаметром 3 см. В них были помещены образцы эндопротезов 5х5 см и культуры фибробластов в посевной дозе 20 тысяч клеток/см2. В качестве контроля служили чашки Петри с полной ростовой средой и образцами исследуемого материала, в которые не высевали фибробласты, а также чашки Петри с культурой фибробластов, которые пассировали одновременно с экспериментальными. Все работы проведены в ламинарном боксе. Длительность эксперимента 7 суток.
На 2-е, 4-е и 7-е сутки в нативных препаратах при помощи инвертированного микроскопа были оценены адгезия клеток к волокнам эндопротеза, их морфология: целостность монослоя, форма и размер клеток, состояние цитолеммы, состояние цитоплазмы, структура ядра и ядрышек. Оценен цитотоксический эффект по плотности монослоя клеток на единицу площади (кл/мм2); количество поврежденных клеток (%); количество слущен-ных клеток в культуральной жидкости (кл/мл); соотношение живых и мертвых клеток (%) путем окрашивания трипановым синим с последующей визуализацией; время удвоения культуры (ч). На 7-е сутки клетки фиксировали 96% спиртом и окрашивали гематоксилином и эозином.
На 7-е сутки проведены биохимические исследования: в культуральной среде определена активность лактатдегидрогеназы (ЛДГ) [3]; фибронектин как в клетках, так и в культуральной среде методом ИФА с использованием стандартных наборов.
Статистическая обработка полученных данных по пролиферативной активности клеток проведена с использованием пакета прикладных программ Statistica 8.0 и Microsoft Office Excel 2008. Определено среднее арифметическое, среднеквадратическое отклонение. Сравнение групп проведено с использованием t-критерия Стьюдента.
Для проверки гипотезы о равенстве законов распределений в ходе биохимических исследований использовали критерий Манна-Уитни. Для описания признаков указывали медиану и межквартильный размах – 25-й и 75-й процентили. Для проверки равенства медиан нескольких выборок применяли критерий Краскела-Уоллиса. Во всех случаях различия считали достоверными при вероятности ошибки менее 5% (p<0,05).
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакция дермальных фибробластов в культуре на образцы стандартных монофиламентных полипропиленовых эндопротезов была практически идентичной.
Синтетический материал «Optomesh» не способствовал адгезии клеток к его волокнам, не изменял нормальной морфологии клеток, несколько замедлял рост клеток в культуре по данным морфометрии, не оказывал повреждающего действия на них (рис. 1).
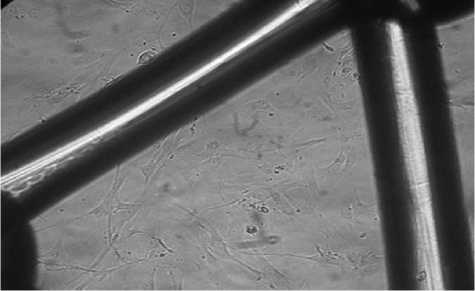
Рис. 1. Нативная культура дермальных фибробластов человека. Исследуемый материал «Оptomesh».
4 сутки культивирования. Инвертированный микроскоп. Увеличение 100
Плотность монослоя в присутствии тестируемого образца ко 2-м суткам составила 604,79 + 42,9 (1400,01 + 58,6), к 4-м – 1431,79 + 39,3 (1864,45 + 42,4); время удвоения культуры – 28 + 2,0 (23,5 + 1,5); количество слущенных клеток – 137 + 31,6 (613 + 38,1); соотношение живых и мертвых 80:20 (81:19); количество поврежденных – 3,63 + 0,8 (2,95 + 0,6).
Общая активность ЛДГ культуры с материалом – 706,8 (597,0), р<0,05. Процент активности ЛДГ в культуральной среде с образцом от общей активности – 12,5 (12,8), р>0,05. Синтетическая активность культуры по фибронектину в присутствии материала – 0,68 (0,4), р<0,05.
При тестировании образцов эндопротеза «Эсфил» на 2-е сутки плотность монослоя достигла – 574,73 + 21,3 (1284 + 46,6) при сохранении нормальной морфологии клеток, при этом адгезии клеток к его волокнам практически не было (рис. 2).

Рис. 2. Нативная культура дермальных фибробластов человека. Исследуемый материал «Эсфил».
4 сутки культивирования. Инвертированный микроскоп. Увеличение 100
К 4-м суткам плотность монослоя нарастала, достигая 1025,93 + 44,2 (1740,28 + 39,9); время удвоения культуры в экспериментальных образцах – 25,5 + 1,5 (23 + 2,0); количество слущенных клеток к концу эксперимента в присутствии материала – 777 + 44,1 (546 + 40,9); соотношение живых и мертвых 82:18 (84:16); количество поврежденных – 5,71 + 0,9 (3,19 + 0,9).
Общая активность ЛДГ культуры с образцом составила 1113,8 (597,0) р<0,05. Процент активности ЛДГ в культуральной среде с материалом от общей активности – 16,7 (14,6), р>0,05. Синтетическая активность культуры по фибронектину в присутствии образца – 0,55 (0,38), р<0,05.
Известно, что стандартные полипропиленовые синтетические сетчатые имплантаты «Optomesh» и «Эсфил» обладают гидрофобными свойствами, что в эксперименте препятствовало адгезии фибробластов в культуре. Даже при длительных сроках совместного культивирования адгезии фибробластов к волокнам тестируемых эндопротезов практически невозможна [4]. С этих позиций эндопротезы с гидрофобной поверхностью можно рассматривать как эффективные относительно профилактики бактериальных инфекций в зоне имплантации, но не способствующие процессам эффективной регенерации в тканях.
К концу эксперимента на поверхности обоих эндопротезов удалось выявить лишь незначительное число клеток. Наличие их возможно объяснить произошедшей за эти сроки абсорбцией белков культуральной среды на волокна материалов с последующей адгезией клеток.
Присутствие стандартных полипропиленовых имплантатов в тест-системе изначально достоверно снижало плотность монослоя. Нарастание плотности монослоя в тест-системах с образцами «Optomesh» происходило медленнее (р<0,05), а с образцами «Эсфил» быстрее, при этом число слущенных и поврежденных клеток к окончанию эксперимента в них было выше (р<0,05). Однако по параметру соотношения живые и мертвые полученные значения не имеют достоверных отличий.
По данным ЛДГ-теста, ни один из двух материалов не обладал прямым цитотоксическим действием на культуры клеток. В присутствии обоих материалов достоверно выявлено повышение синтетической активности клеток по фибронектину.
Образцы эндопротеза «Ultrapro» обладали выраженными антиадгезивными свойствами. Ко 2-м суткам тестирования материалов плотность монослоя составила 411,0 + 36,4 (1256 + 40,4). К 4-м суткам плотность монослоя достигла 609 + 50,1 (1701 + 48,8); время удвоения культуры в экспериментальных образцах –27 + 1,5 (23,5 + 1,2); количество слущенных клеток к концу эксперимента – 810,7 + 30,9 (420,3 + 26,8); соотношение живых и мертвых 79:21 (84:16); количество поврежденных клеток – 11,46 + 2,8 (4,1 + 2,1) (рис. 3).

Рис. 3. Нативная культура дермальных фибробластов человека. Исследуемый материал «Ultrapro».
4 сутки культивирования. Инвертированный микроскоп. Увеличение 100
Общая активность ЛДГ культуры с материалом составила 1708,4 (692,3). Процент активности ЛДГ в культуральной среде с материалом от общей активности – 28,5 (29,6), р>0,05. Синтетическая активность культуры по фибронектину в присутствии материала – 0,52 (0,59), р<0,05.
Несмотря на то, что эндопротез «Ultrapro» является композитным со сниженной долей полипропилена и с введенным в его структуру полиглекапрона, тестирование его на культурах клеток показало увеличение числа поврежденных и слущенных клеток (р<0,05) и меньшую скорость пролиферации и синтетической активности. Результаты сопоставимы с имеющимися данными об идентичной реакции культуры клеток как на легкие, так и на стандартные имплантаты, и снижение материалоемкости изделия не улучшает его биосовместимости [5].
Образцы эндопротеза «Proceed» не способствовали адгезии фибробластов на волокна и изменению морфологии клеток, но оказывали стимулирующее действие на рост культуры (рис. 4).
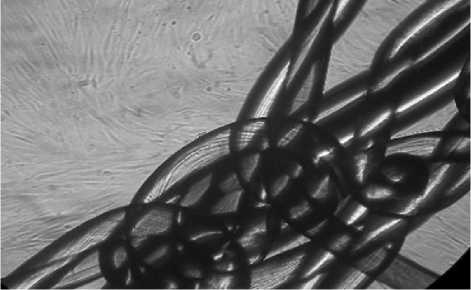
Рис. 4. Нативная культура дермальных фибробластов человека. Исследуемый материал «Procееd». 4 сутки культивирования.
Инвертированный микроскоп. Увеличение 100
Так, плотность монослоя на 2-е сутки составила 811,2 + 65,6 (1348,2 + 64,9). К 4-м суткам достигла 2036,91 + 55,3(1821,45 + 41,6); время удвоения культуры в экспериментальных образцах достигало – 20 + 1,5(23 + 1,5); количество слущенных клеток к концу эксперимента – 679 + 41,7 (581 + 39,9); соотношение живых и мертвых 81:19 (83:17); количество поврежденных клеток – 4,3 + 1,1 (3,3 + 1,0).
Общая активность ЛДГ культуры с материалом составила 812,8 (691,4). Процент активности ЛДГ в культуральной среде с образцами эндопротеза от общей активности – 33,2 (29,9), р>0,05. Синтетическая активность культуры по фибронектину в присутствии материала – 0,95 (0,62), р<0,05.
По данным морфометрии выявлено стимулирующее действие образцов материала «Proceed» на пролиферативную активность культуры (р<0,05), что подтверждено нарастанием плотности монослоя, укорочением времени удвоения. Полученные результаты можно интерпретировать с позиции комбинированного «строения» имплантата с наличием в его структуре окисленной регенерированной целлюлозы, введенной в его состав в качестве антиадгезионного слоя. Введение в состав материала большинства известных биодеградирующих компонентов способствует увеличению синтетического потенциала культуры [6]. Однако по некоторым данным в дальнейшем это способствует развитию дегенеративных изменений клеток [7].
Таким образом, оценка применяемых в клинике, модифицированных и новых протезирующих материалов для герниопластики с при- 3. менением культур клеток позволяет провести комплексную оценку: от цитотоксичности до необходимых в конкретной ситуации морфофунк- 4. циональных характеристик клеток. Проведенный .
анализ показал отсутствие цитотоксичности у исследуемых образцов, при этом реакция культуры дермальных фибробластов варьировала в 5. зависимости от химической структуры и свойств поверхности тестируемого материала.
Список литературы Альтернативная модель оценки биосовместимости синтетических полипропиленовых эндопротезов для герниопластики
- Bhaskaran A., Ambikavathy M. Incisional Hernia: A Review of Etiopathogenesis, Clinical Presentation, Complications and Management//J Clin Biomed Sci. -2013. Vol. 3 (1). Р. 3-11.
- Peniston S.J., L Burg K.J., Shalaby S.W. Effect of mesh construction on the physicomechanical properties of bicomponent knit mesh using yarns derived from degradable copolyesters.//J Biomed Mater Res B Appl. Biomater. 2012. Vol. 100. Р.1922 -1934.
- López E., Figueroa S., Oset-Gasque M.J., González M.P. Apoptosis and necrosis: two distinct events induced by cadmium in cortical neurons in culture.//Br J Pharmacol. 2003. Vol. 138(5). Р. 901-911.
- Canuto R.A., Saracino S., Oraldi M. Colonization by human fibroblasts of polypropylene prosthesis in a composite form for Hernia repair//Hernia.-2013. Vol. 17(2). Р. 241-249.
- Weyhe D., Hoffmann P., Belyaev O. The role of TGF-beta1 as a determinant of foreign body reaction to alloplastic materials in rat fibroblast cultures: comparison of different commercially available polypropylene meshes for hernia repair//Regul Pept. -2007. Vol. 138 (1). Р. 4-10.
- Weyhe D., Belyaev O., Buettner G. In vitro comparison of three different mesh constructions//ANZ J Surg. 2008. Vol. 78(1-2). Р.55-60.
- Langer C., Schwartz P, Krause P.//In-vitro study of the cellular response of human fibroblasts cultured on alloplastic hernia meshes. Influence of mesh material and structure. Chirurg. -2005. Vol. 76 (9). Р.876-885.


