Альтернативный путь дыхания в растениях: регуляция и функции
Автор: Гармаш Елена Владимировна
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Представлены и обсуждены данные по функционированию электрон-транс- портной цепи (ЭТЦ) растительных митохондрий. Сформулированы ключевые вопросы изучения энергетически малоэффективного альтернативного (циа- нидрезистентного) пути дыхания (АП) в поддержании дыхательного метабо- лизма углерода, окислительно-восстановительного баланса в ЭТЦ, контроле накопления активных форм кислорода в норме и при стрессе. На основе соб- ственных экспериментальных данных показано, что дыхание и соотношение дыхательных путей в растениях варьирует в зависимости от объекта, его функционального состояния, силы и продолжительности действия факторов среды. Сделан вывод о том, что вовлечение АП расширяет адаптивные воз- можности растительного организма, способствует поддержанию роста и защи- те от стресса. Обсуждены механизмы регуляции дыхания и возможное уча- стие АП в процессах апоптоза и поддержании взаимосвязи фотосинтеза и ды- хания. Определены перспективы развития дальнейших исследований.
Растительные митохондрии, дыхательная цепь, альтернативное дыхание, альтернативная оксидаза, регуляция, рост, стресс
Короткий адрес: https://sciup.org/14992398
IDR: 14992398 | УДК: 581.12:576.311.347
Текст научной статьи Альтернативный путь дыхания в растениях: регуляция и функции
Дыхание – универсальный процесс и фундаментальная основа жизни любой живой клетки. Ежесуточно растения окисляют в дыхании от 30 до 70% ассимилированного при фотосинтезе углерода. Интермедиаты и энергия, извлекаемая в процессе дыхания, необходимы для синтеза de novo и поддержания целостности и функциональной активности клеточных структур, специализированных тканей и органов растительного организма. Дыхание – это показатель функциональной стойкости растений и равноправный фотосинтезу элемент про- дукционного процесса. Дыхание выступает как механизм, ускоряющий эволюцию. Известно, что окисление ДНК образуемыми в процессе дыхания активными формами кислорода представляет собой важнейший инструмент природного мутагенеза [1]. Поэтому проблема дыхания с научных позиций привлекает исследователей уже около двух столетий.
В лаборатории экологической физиологии растений Института биологии Коми НЦ УрО РАН исследования дыхания растений ведутся более 30 лет. Сформулированы и разработаны фундаментальные вопросы физиологии дыхания растений [2]. В настоящее время в рамках исследования механизмов регуляции дыхания растений уделяется особое внимание изучению дыхательных путей в растительной клетке в норме и при стрессе.
Дыхание – это поэтапный компартментиро-ванный процесс. Первые этапы дыхания протекают в цитоплазме, а основной продукт гликолиза – пируват – диффундирует в специализированные дыхательные органеллы – митохондрии, где подвергается окислительному декарбоксилированию в цикле трикарбоновых кислот (ЦТК). В реакциях цикла образуются соединения с высоким восстановительным потенциалом – пиридиннуклеотиды НАДН и ФАДН 2 . На заключительном этапе восстановительные эквиваленты окисляются с образованием энергии в ЭТЦ, локализованной во внутренней мембране митохондрий.
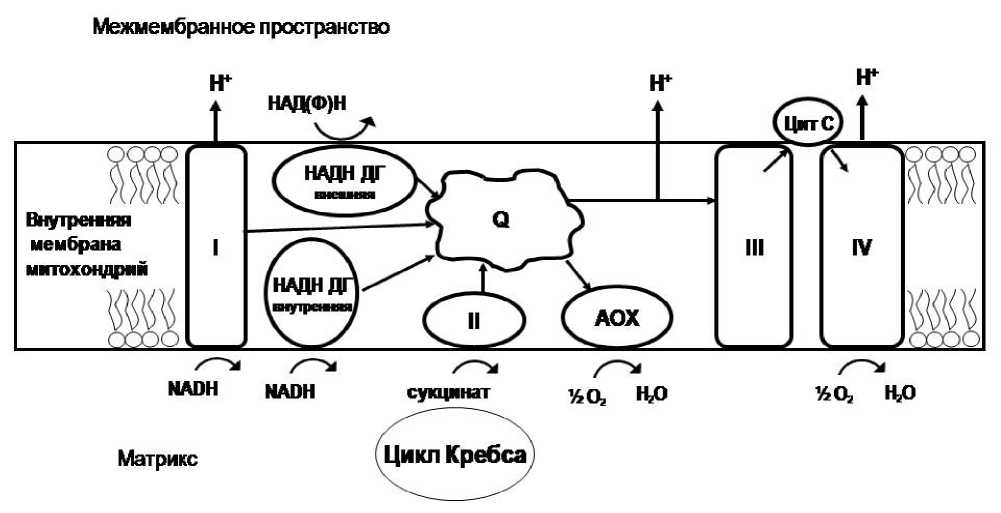
Основная ЭТЦ состоит из четырех трансмембранных белковых мультиферментных комплексов, двух небольших по молекулярной массе лабильных компонентов – убихинона и цитохрома с, выполняющих функцию переносчиков электронов между комплексами, и АТФ-синтазы. Перенос пары электронов по основному цитохромному пути (ЦП) от НАДН к кислороду с последующим синтезом трех молекул АТФ является универсальным для животных и растений.
Дыхательная цепь растений сложнее и пластичнее в функциональном плане, чем животных (рис. 1). Главной уникальной особенностью митохондрий высших растений, а также многих водорослей, мхов, папоротников и некоторых грибов является способность переноса электронов с пула убихинона на О 2 через альтернативную оксидазу [3]. Этот путь устойчив к действию цианида, поэтому назван цианидустойчивым (альтернативным).
Альтернативная оксидаза (АОХ) – убихинол-кислород-оксидоредуктаза – это низкомолекулярный белок (32 кДа), представляет собой один полипептид. АОХ выделена и идентифицирована более 20 лет назад [4]. Синтез белка кодируется ядерны- ми генами – Аох [5]. В мембране АОХ существует как мономер и димер. Активация фермента связана с восстановлением дисульфидной связи в сульфгидрильную [6].
Электронный транспорт по АП не связан с двумя участками генерации мембранного потенциала (комплексы III и IV). Лишь при окислении эндогенного НАДН градиент протонов может устанавливаться в комплексе I. Поэтому АП запасает мало энергии, большая часть рассеивается в виде тепла. Другими словами, альтернативный путь транспорта электронов снижает энергетическую эффективность дыхания, как минимум, на 60%. Тогда зачем растениям нужен этот путь?
Есть мнение, что альтернативное дыхание – это возникший в процессе эволюции растений способ поддержания дыхания в присутствии цианида. Многие растения (около 2500 видов) содержат цианогенные гликозиды, распад которых сопровождается образованием синильной кислоты и цианидов. Биологическая роль этих соединений может быть защитной, направленной против фитопатогенов или травоядных животных. Однако это не объясняет, почему АОХ есть у всех растений и какую роль она выполняет в клетке.
Хорошо известно, что АП участвует в термогенезе тканей цветка некоторых ароидных. Нагревание термогенных тканей облегчает испарение соединений, привлекающих насекомых-опылителей. Благодаря этому феномену, описанному еще Ламарком в XVIII в., в 30-х гг. XX в. было открыто циа-нидрезистентное дыхание (Okunuki, 1932, 1939; Van Herk, 1937, цит. по [7]). С тех пор минул почти век, но вопрос о механизмах регуляции и физиологической роли АП в нетермогенных тканях до сих пор остается открытым [3, 8, 9, 10].
Значительный вклад в развитие представлений об активации различных оксидаз и смены дыхательных путей в зависимости от интенсивности и
надндг
НАДН
АОХ
Цикл Кребса
Матрикс
NADH
NADH сукцинат
%О, Н,0
Межмембранное пространство
Внутренняя мембрана митохондрий
% О, НгО
н* А НАД(Ф)Н
Рис. 1. Цепь переноса электронов во внутренней мембране растительных митохондрий. Объяснения см. в тексте.
направленности процессов метаболизма, а также биологического состояния растения, внесла О.А. Семихатова. Она впервые обратила внимание на то, что в листьях разного возраста функционируют разные дыхательные системы [11]. Основную роль в дыхании молодых листьев играет цитохромокси-даза, а в зрелых – цианидустойчивая система, природа которой в то время была неизвестна [11].
Объяснение роли АП в нетермогенных тканях предложено в 1982 г. голландским ученым H. Lambers [12]. Согласно сформулированной им гипотезе «сверхпотока» («energy overflow») при насыщении цитохромного пути АП работает как «выхлопной клапан», через который «сжигается» избыток углеводов, который клетка не в состоянии эффективно использовать. Однако позже Lambers и его коллеги установили, что цитохромный и альтернативный пути дыхания конкурируют за электроны [13]. Поэтому гипотеза «сверхпотока» несколько трансформировалась. Считается, что АД участвует в поддержании баланса между углеводным метаболизмом и скоростью электронного транспорта, а именно в снижении высокого соотношения АТФ/АДФ за счет быстрого окисления НАДН без образования АТФ. При этом цикл Кребса продолжает функционировать. Такая ситуация может быть целесообразна для растений в период активного роста, когда они больше нуждаются в метаболитах для синтезов de novo , чем в АТФ. Нами показано, что скорость дыхания и подавление дыхания в присутствии специфического ингибитора АОХ были выше в корнях и листьях быстро растущих растений ячменя, чем у растений с низкой скоростью роста (рис. 2).
ем АОХ, в присутствии ингибиторов ЭТЦ [14]. Показано, что AOX участвует в стабилизации пула убихинонов (Q r /Q t ) in vivo [10]. Убедительным также является тот факт, что H 2 O 2 – вторичный мессенджер в сигнальном каскаде, приводящем к экспрессии гена Aox 1 [3].
Стимуляцию АП наблюдали при действии неблагоприятных факторов среды, которые могут вызвать окислительный стресс в клетке. Показано, что активность АП и количество белка АОХ возрастали при засухе, внедрении патогена [15], дефиците элементов минерального питания [16-18], низких положительных температурах [19-21]. В других работах не выявлено активации АОХ в ответ на действие факторов, в частности, низкой температуры [8, 21, 22]. Проанализировав литературу, мы предположили, что степень вовлечения АП и его физиологическая роль в ответ на изменение факторов зависят, в первую очередь, от силы и продолжительности действия фактора, устойчивости организма и его функционального состояния.
Нами проведены эксперименты с холодостойкими сортами ячменя ( Hordeum distichum L., с. Андрей, Новичок), длительно адаптированными к двум температурным режимам выращивания – 13/8ºС и 21/17ºС (день/ночь). Эти температуры ограничивают зону температурного оптимума роста данных сортов [23]. При пониженной температуре дыхание органов растений не проявляло чувствительности к ингибитору АОХ (рис. 3). Следовательно, можно полагать, что дыхание осуществлялось в основном по ЦП, без заметного участия АП. По-видимому, отсутствие чувствительности к ингибитору АОХ у холодостойкого сорта ячменя, выращи-
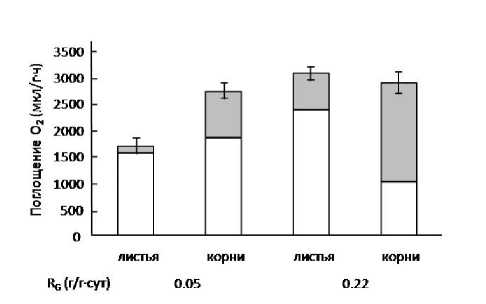
Рис. 2. Соотношение дыхательных путей в медленно- и быстрорастущих растениях ячменя ( Hordeum distichum L., с. Андрей). R G – относительная скорость роста, – SHAM-чувствительное (альтернативное) дыхание.
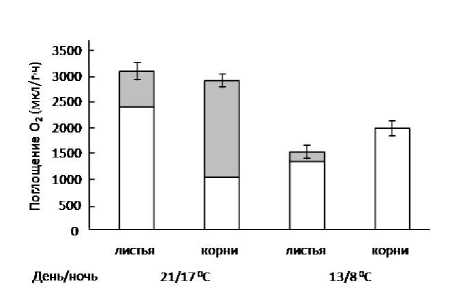
Рис. 3. Влияние температурного режима выращивания (день/ночь) на соотношение дыхательных путей в растениях ячменя ( Horedeum distichum L., с. Андрей). Обозначения как на рис. 2.
Другая функция АП связана с защитой клетки от окислительного стресса. Митохондрии являются местом образования активных форм кислорода (АФК), в частности супероксидрадикала и H2O2, чему способствуют торможение электронного транспорта и «перевосстановление» цепи. Активация АОХ приводит к снижению степени восстановлен-ности пула убихинонов за счет быстрого сброса электронов на кислород с образованием воды [14]. Прямым доказательством этой функции АП явились данные по накоплению АФК в тканях трансгенных растений табака с пониженным содержани- ваемого при более низкой (но в пределах температурного оптимума роста) температуре, обусловлено необходимостью сохранения максимальной энергетической эффективности дыхания для поддержания процессов жизнедеятельности. Это согласуется с современными представлениями о том, что регуляция энергетического метаболизма клетки направлена на избежание вовлечения АП [24].
В другом эксперименте изучали влияние кадмия на соотношение дыхательных путей в органах ячменя (Hordeum distichum L., сорт Новичок) при этих же температурных режимах [25]. Показано, что корни обработанных кадмием растений проявляли чувствительность к ингибитору АОХ – SHAM (рис. 4). Увеличение доли АП происходило на фоне повышения концентрации малонового диальдегида – продукта пероксидации липидов – свидетельствующем об окислительном стрессе. Известно, что АОХ препятствует генерации АФК в ЭТЦ митохондрий за счет быстрого сброса электронов на кислород и снижения степени восстановленно-сти пула убихинонов [3, 10, 19]. Значительное повышение доли АП (40% от общего дыхания) при низкой концентрации Cd (30 мкмоль/л) в корнях растений в условиях температурного режима 21/17º С, когда скорость общего дыхания еще достаточно высока, по-видимому, обусловлено необходимостью поддержания интенсивной работы ЦТК. Органические кислоты ЦТК способны связывать ТМ с последующей изоляцией в вакуоли [26]. Этот механизм мог активироваться и при сильном кадмиевом стрессе (100 мкмоль/л) в условиях более низкой температуры. Таким образом, активация АП является одним из механизмов поддержания гомеостаза подверженных стрессу кадмием клеток корней.
дыхание, снижая уровень АФК и препятствуя активации программируемой смерти клетки [27, 28]. Поэтому АОХ называют антиапоптическим белком (antiapoptotic protein) [27, 29].
В зеленых тканях растений фотосинтез и дыхание протекают в одной клетке. Однако долгое время эти процессы изучались автономно, и вопрос об их взаимодействии в фотосинтезирующей клетке остается до сих пор наименее изученным. Согласно современным данным на свету между хлоропластами и митохондриями идет активный обмен метаболитами. Дыхательные ферменты, в том числе альтернативные дегидрогеназы и АОХ в митохондриальной ЭТЦ, участвуют в окислении восстановительных эквивалентов, поступающих из цитозоля или хлоропластов в митохондрии при их близком контакте [30]. Это один из способов защиты клетки от фотоокисления.
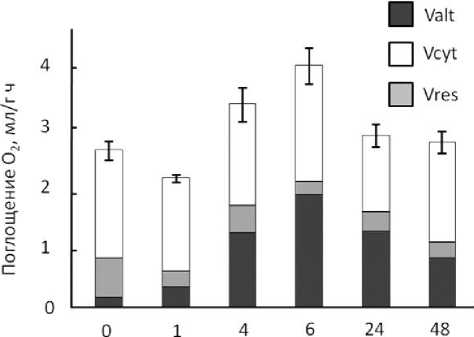
Нами исследовано вовлечение АП в дыхание листа пшеницы в процессе его зеленения [31]. Зеленение – процесс образования хлорофилла. В этиолированных проростках дыхание осуществлялось, главным образом, по цитохромному пути (рис. 5).
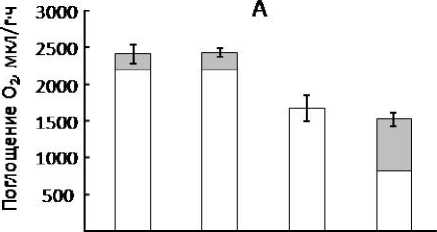
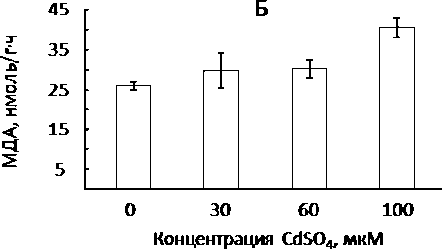
Рис. 4. Влияние кадмия на соотношение дыхательных путей (А) и активность ПОЛ (Б) в корнях ячменя ( Hordeum distichum L., с. Новичок) при пониженной температуре выращивания (день/ночь – 13/8 °С). Обозначения как на рис. 2.
Необходимо также назвать еще одну возможную причину усиления дыхания по АП в варианте c высокой концентрацией кадмия и пониженной температурой. На фоне остановки роста и частичной гибели растений вовлечение АОХ могло быть вызвано процессом вынужденной гибели клеток. Согласно современным данным митохондрии – главные участники апоптоза, сигнальными молекулами которого являются АФК [27]. Повышение АФК в клетке ведет к формированию специальных пор в мембране митохондрий и выходу цит с. Возможно, что на начальном этапе, когда цитохромный путь ограничен, АОХ поддерживает митохондриальное
Время на свету, ч
Рис. 5. Дыхание листьев пшеницы ( Triticum aesti-vum L., с. Иргина) в процессе зеленения.
– V alt , – Vcyt, – Vres – активность альтернативного, цитохромного и остаточного дыхания, соответственно.
Свет индуцировал вовлечение АП, доля которого в течение суток после начала освещения возрастала до 50% от общего дыхания. В этот же период зеленение сопровождалось увеличением пространственной зависимости расположения митохондрий в зоне нахождения хлоропластов, что указывает на наличие обмена метаболитами между органеллами [31]. Эксперимент показывает, что митохондрии играют важную роль в формировании фотосинтетического аппарата, а АП может участвовать в поддержании взаимосвязи фотосинтеза и дыхания.
Таким образом, энергетически малоэффективный АП является специфическим механизмом, поддерживающим клеточный гомеостаз и функционирование растений в различных условиях среды. Вовлечение АП расширяет адаптивные возможности растительного организма, способствует поддержанию роста и защите от стресса. Убедительными являются данные об участии АОХ в термогенезе специализированных тканей цветка ароидных, поддержании окислительно-восстановительного баланса в ЭТЦ митохондрий и препятствии формирования АФК, особенно в условиях стресса. В настоящее время наиболее сильно развиваются исследования о связи альтернативного дыхания с ростом, процессом апоптоза, генерацией тепла в «нетермогенных» тканях растений при гипотермии, защитой от фотоокисления и др. Спорными остаются вопросы регуляции активности и вовлечения АОХ in vivo. Мы обратили внимание на то, что дыхание и соотношение дыхательных путей в растениях варьируют в зависимости от объекта, его функционального состояния, продолжительности и силы действия внешних факторов, устойчивости к ним растительного организма. Идея многофункциональности АП нашла подтверждение в наших экспериментах.
Необходимо отметить, что исследование альтернативного пути дыхания вышло из рамок только фундаментальной проблемы. Показатели дыхания и соотношения дыхательных путей могут быть использованы для выявления реакции растений в ответ на изменение условий среды (глобальное потепление, увеличение СО 2 в атмосфере). Показано усиление активности АП в листьях Arabi-dopsis thaliana , селектированных для роста в условиях повышенной концентрации СО 2 [32]. В экспериментах, направленных на борьбу с митохондриальными болезнями человека, показано, что ген АОХ может быть успешно введен в человеческие клетки почки и фибробласты. Мутантные клетки проявляли толерантность к дефициту цитохромок-сидазы [33].
В заключение следует сказать, что вопросы регуляции активности и вовлечения альтернативного дыхания находятся в настоящее время в центре особенного внимания экспериментальных биологов, особенно за рубежом (Physiologia plantrum, Vol. 129, 2007; Vol. 137, 2009). Интенсивное получение сведений о функционировании этого уникального пути в растениях, с одной стороны, приближает нас к разгадке вопроса о причинах активации альтернативной оксидазы in vitro , in vivo , in situ , с другой – ставит перед исследователями много новых задач. Зная законы регуляции соотношения дыхательных путей, можно контролировать (на молекулярногенетическом уровне) жизнедеятельность не только, как оказалось, растений, но и человека. Надеемся, что мы внесем свою лепту в поток этой важной информации.
Автор признательна своему научному руководителю профессору Т.К. Головко, вдохновившей на изучение этой проблемы, а также за ценные советы при обсуждении работы.
Список литературы Альтернативный путь дыхания в растениях: регуляция и функции
- Скулачев В.П. Эволюция, митохондрии и кислород//Соросовский образовательный журнал, 1999. № 9. С. 1-7.
- Головко Т.К. Дыхание растений (физиологические аспекты). С-Пб.: Наука, 1999. 204 с.
- Vanlerberghe G.C., McIntosh L. Alternative oxidase: from gene to function//Annu. Rev. Plant Physiol. Plant Mol. Biol., 1997. Vol. 48. P. 703-734.
- Elthon T.E., McIntosh L. Characterization and solubilization of the alternative oxidase of Sauromantum guttatum mitochondria//Plant Physiol., 1986. Vol. 82. P. 1-6.
- Whelan J., Millar A.H., Day D.A. The alternative oxidase is encoded in a multigene family in soybean//Planta, 1996. Vol. 198. P. 197-201.
- Umbach A.L., Siedow J.N. Covalent and noncovalent dimers of the cyanide-resistant alternative oxidase protein in higher plant mitochondria and their relationship to enzime activity//Plant Physiol., 1993. Vol. 103. P. 845-854.
- Meeuse B.J.D. Thermogenic respiration in aroids//Annu. Rev. Plant Physiol., 1975. Vol. 26. P. 117-126.
- Головко Т.К., Пыстина Н.В. Альтернативный путь дыхания в листьях Rhodiola rosea L. и Ajuga reptans L.: возможная физиологическая роль//Физиология растений, 2001. Т.48. С. 846-853.
- Шугаев А.Г. Альтернативная CN-резистентная оксидаза митохондрий растений: структурная организация, механизмы регуляции активности, возможная физиологическая роль//Физиология растений, 1999. Т. 46. С. 307-320.
- Millenaar F.F., Lambers H. The аlternative oxidase: in vivo regulation and function//Plant Biol., 2003. Vol. 5. P. 2-15.
- Семихатова О.А. Смена дыхательных систем. Л.: Изд-во «Наука», 1969. 128 с.
- Lambers H. Cyanide-resistant respiration: a non-phosphorylating electron transport pathway acting as an energy overflow//Physiol. Plant., 1982. Vol. 55. P. 478-485.
- The cyanide-resistant oxidase: to inhibit or not inhibit, that is the question/D.A.Day, K.Krab, H.Lambers, A.L.Moore, J.N.Siedow, A.M.Wagner, J.T.Wiskich//Plant Physiol., 1996. Vol. 110. P.1-2.
- Maxwell D.P., Wang Y., McIntosh L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells//Proc. Nat. Acad. Sci USA., 1999. Vol. 96. P. 8271-8276.
- Maxwell D.P., Nickels R., McIntosh L. Evidence of mitochondrial involvement in the transduction of signals required for the induction of genes associated with pathogen attack and senescence//Plant J., 2002. Vol. 29. P. 269-279.
- Рахманкулова З.Ф., Федяев В.В., Подашевка О.А., Усманов И.Ю. Альтернативные пути дыхания и вторичный метаболизм у растений с разными типами адаптивных «стратегий» при дефиците элементов минерального питания//Физиология растений, 2003. Т. 50. С. 231-237.
- Energy metabolism of Plantago lanceolata as dependent on the supply of mineral nutrients/H.Lambers, F.Posthumus, I.Stulen, L.Lanting, S.van de Dijk, R.Hofstra//Physiol. Plant., 1981. Vol. 51. P. 85-92.
- The role of alternative oxidase in modulating carbon use efficiency and growth during macronutrient stress in tobacco cells/S.M.Sieger, B.K.Kristensen, C.A.Robson, S.Amirsadeghi, E.W.Eng, A.Abdel-Mesih, I.M.Moller, G.C.Vanlerberghe//J. Exp. Bot., 2005. Vol. 56. P. 1499-1515.
- Fiorani F., Umbach A.L., Siedow J.N. The Alternative oxidase of plant mitochondria is involved in the acclimation of shoot growth at low temperature. A study of Arabidopsis AOX1a transgenic plants//Plant Physiol., 2005. Vol. 139. P. 179-180.
- The distribution of electron tran-sport between the main cytochrome and alternative pathways in plant mitochondria during short-term cold stress and cold hardening/O.I.Grabelnych, O.N.Sumina, S.P.Funderat, T.P.Pobezhimova, V.K.Voinikov, A.V. Kolesnichenko//J. Thermal Biol., 2004. Vol. 29. P. 165-175.
- The electron partitioning between the cytochrome and altenative respiratory pathways during chilling recovery in two cultivars of maize differing in chilling sensitivity/M.Ribas-Carbo, R.Aroca, M.A.Gonzаlez-Meler, J.J.Irigoyen, M.Sanchez-Diaz//Plant Physiol., 2000. Vol. 122. P. 199-204.
- Иванова Т.И., Кирпичникова О.В., Шерстнева О.А., Юдина О.С. Годичный цикл дыхания листьев вечнозеленых растений//Физиология растений, 1998. Т.45. С. 906-913.
- Головко Т.К., Родина Н.А., Куренкова С.В.,Табаленкова Г.Н. Ячмень на Севере (селекционно-генетические и физиолого-биохимические основы продуктивности). Екатеринбург: УрО РАН, 2004. 186 с.
- Priault P., Vidal G., De Paepe R., Ribas-Carbo M. Leaf age-related changes in respiratory pathways are dependent on complex I activity in Nicotiana sylvestris//Physiol. Plant., 2007. Vol. 129. P. 152-162.
- Гармаш Е.В., Головко Т.К. Влияние кадмия на рост и дыхание ячменя при двух температурных режимах выращивания//Физиология растений, 2009. Т. 56. С. 382-387.
- Lösch R., Köhl K.I. Plant respiration under the influence of heavy metals//Heavy metal stress in plants. From molecules to ecosystem/Eds Prasad M.N.V., Hagemeyer J. Berlin: Springer-Verlag, 1999. P. 139-156.
- Plant mitochondrial pathway leading to programmed cell death/A.Vianello, M.Zancani, C.Peresson, E.Petrussa, V.Casolo, J.Krajnakova, S.Patui, E.Braidot, F.Macri//Physiol. Plant., 2007. Vol. 129. P. 242-252.
- Vanlerberghe G.C., Robson C.A., Yip J.Y.H. Induction of mitochondrial alternative oxidase in response to a cell signal pathway downregulating the cytochrome pathway prevents programmed cell death//Plant Physiol., 2002. Vol. 129. P. 1829-1842.
- Marechal E., Baldan B. Dual role of plant mitochondria in promoting PCD or cell survival//Trends Plant Sci., 2002. Vol. 7. P. 525-526.
- Noguchi K., Yoshida K. Interaction between photosynthesis and respiration in illuminated leaves//Mitochondrion, 2008. Vol.8. P. 87-99.
- Atkin O.K., Macherel D. The crucial role of plant mitochondria in orchestrating drought tolerance//Annals of Botany, 2009. Vol.103. P. 581-597.
- Engagement of alternative respiration in spring wheat seedlings during greening/E.V.Garmash, J.Kozlova, S.Plyusnina, R.Malyshev, Y.Yatsco, T.Golovko//Acta Biologica Cracoviensia, 2009. Vol.51. Suppl. 2. Abstracts of the 4th Conference of Polish Society of Experimental Plant Biology (Cracow, Poland, 21-25 September 2009). P. 43.
- Plastic and adaptive responses of plant respiration to changes in atmospheric CO2 concentration/M.A.Gonzalez-Meler, E.Blanc-Betes, C.E.Flower, J.K.Ward, N.Gomez-Casanovas//Physiol. Plant., 2009. Vol. 137. P. 473-484.
- The alternative oxidase, a tool for compensating cytochrome c oxidase deficiency in human cells/E.P.Dassa, E.Dufour, S.Goncalves, H.T.Jacobs, P.Rustin//Physiol. Plant., 2009. Vol. 137. P. 427-434.


