Амфиподы как индикаторы характера воздействия антропогенных факторов на прибрежные акватории Белого моря
Автор: Немова Нина Николаевна, Богдан Валентина Васильевна, Шкляревич Галина Андреевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (125), 2012 года.
Бесплатный доступ
Проведено сравнительное изучение морфометрических характеристик, липидного, фосфолипидного и жирнокислотного состава литоральных амфипод Белого моря при разных типах загрязнения. Комплексные исследования биохимического состава липидов и морфометрических особенностей амфипод показали степень ответной реакции организмов на действие поллютантов в условиях Крайнего Севера.
Амфиподы, размерные классы, ксенобиотики, соленость, липиды, кандалакшский залив, белое море
Короткий адрес: https://sciup.org/14750158
IDR: 14750158 | УДК: 574.4/.5
Текст научной статьи Амфиподы как индикаторы характера воздействия антропогенных факторов на прибрежные акватории Белого моря
В связи с наблюдаемой трансформацией экосистемы Белого моря актуальна оценка роли антропогенной составляющей в этих процессах и поиск методов их индикации. Основным фактором, определяющим нарушение стабильности экосистемы Белого моря, является загрязнение различными поллютантами. Объем сбрасываемых сточных вод в поверхностные водные объекты бассейна Белого моря постоянно увеличивается. Например, в 2005 году он составлял более 79 млн м3, причем 12,5 % сточных вод сброшены без предварительной очистки [6]. Ксено-биотики поступают в водные организмы из воды и донных осадков, а также по пищевым цепям, причем в условиях низких температур отмечается слабая и медленная деструкция загрязняющих веществ.
В основе биологических методов оценки качества вод лежит изучение эффектов воздействия на экосистемы и их структурные элементы (отдельные организмы, популяции, сообщества). Выбор параметров и индикаторов для мониторинга сопряжен не только с важностью сохранения компонентов природной среды, но и с получением достоверной и качественной информации о ее состоянии. Особое значение представляет изучение функционирования прибрежных экосистем, которые являются наиболее продуктивными, но и особо уязвимыми. Несколько последних десятилетий характеризуются значительным ростом углубленных исследований фауны беспозвоночных животных Белого моря, продемонстрировавших трансформацию прибрежных экосистем. Межгодовые мониторинговые исследования локальных поселений отдельных видов из сообществ ли- торального макрозообентоса в Кандалакшском заливе Белого моря показывают наличие резких флюктуаций основных биономических количественных показателей (плотность и биомасса), особенно четко проявляющихся у амфипод [17], [20], [21], [22]. Но они лишь констатируют факты различных процессов и явлений, происходящих в природных экосистемах, не позволяя разграничить комплексы вызывающих их причин на естественные и антропогенные. Гаммариды часто используются как индикаторы качества окружающей среды, так как быстро и четко отвечают на действие ксенобиотиков органической и неорганической природы [26].
Для систематического биомониторинга целесообразно оценивать изменения биохимических показателей клеточного метаболизма, которые считаются ранними и тонкими индикаторами воздействия неблагоприятных факторов среды на функциональные системы организма . В настоящее время рассмотрение особенностей антропогенного воздействия на метаболизм гидробионтов становится невозможным без расшифровки их влияния на структуру и функции клеток. При этом важная роль отводится липидам, выполняющим структурную, запасную и регуляторную функции. Полифункциональность липидов позволяет использовать их количественные показатели в качестве объективных критериев «степени благополучия» гидробионтов в различных условиях обитания.
Учитывая вышесказанное, изучали морфометрические и биохимические характеристики литоральных частей популяций амфипод Белого моря в условиях разной загрязненности и солености.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал был собран в 2001 году на литорали. Исследования проведены на заповедной Беломорской акватории Кандалакшского государственного заповедника в вершине Кандалакшского залива. Рисунок карты-схемы Кандалакшского залива с границами охраняемых территорий и акваторий Кандалакшс-кого государственного природного заповедника и указанием мест сбора материала для работ приведен в предшествующей работе [4]. Все измерения и определения проводились на материале, фиксированном в 4 % растворе формалина. Проводилась идентификация всех собранных животных с помощью бинокуляра МБИ-2.
В исследуемых районах Кандалакшского залива самым массовым видом был Lagunogam-marus oceanicus , поэтому мы имели основание сравнивать липидный состав проб из разных районов, поскольку он значительно различается у разных видов литоральных амфипод [4]. С целью исследования влияния загрязнения на размерно-возрастные показатели отбирали только особей этого вида. Каждый гаммарус после обсушивания на фильтровальной бумаге взвешивался на торсионных весах с точностью до 1 мг. Длина тела определялась от переднего края головы (рострума) до основания тельсона с помощью штангенциркуля с точностью до 0,1 мм. Особи с длиной тела менее 20 мм измерялись под бинокуляром с помощью окуляр-микрометра.
Определение возраста амфипод, пойманных в природе, обычно бывает затруднительно из-за отсутствия у них структур экзоскелетных образований, регистрирующих возрастные и сезонные (в период зимней приостановки роста) изменения. Поэтому возраст амфипод исследуют с помощью косвенных методов, основанных на сопоставлении различных размерных групп особей изучаемой части популяции [10]. Возраст литоральных амфипод с длиной тела до 10 мм определяется до 2–3 месяцев, от 5 до 19 мм – сеголетки, 20–30 мм – годовики, более 30 мм – двухгодовики [10].
Для определения липидного состава пробы амфипод (20–30 экз.) фиксировали 96 % этанолом. Липиды экстрагировали смесью хлороформа с метанолом (2:1) [7]. Фракционирование липидов проводили методом тонкослойной хроматографии на пластинках «Силуфол» в системе растворителей: петролейный эфир – серный эфир – уксусная кислота (90:10:1). Количественно липидные фракции определяли гидроксамат-ным методом [16]. Разделение основных классов фосфолипидов осуществляли методом высокоэффективной жидкостной хроматографии [24]. Метиловые эфиры жирных кислот липидов получали прямым метилированием [19] и анализировали методом газожидкостной хроматографии на приборе «Хроматэк Кристалл-5000.1».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние разных типов ксенобиотиков
Среди основных поллютантов, загрязняющих акваторию Белого моря, можно выделить вещества неорганической природы, органические вещества, нефтяные угелеводороды. Из неорганических загрязнителей тяжелые металлы при высокой токсичности и выраженном кумулятивном эффекте являются потенциально наиболее опасными. Для водоемов Крайнего Севера показано, что в тканях гидробионтов концентрация тяжелых металлов определяется главным образом уровнем их содержания в воде и донных отложениях, при этом в организмах их содержание в несколько раз ниже, чем в воде. Для прибрежных районов характерно накопление в гидробионтах таких тяжелых металлов (ТМ), как Cu, Ni, Zn, Cr, Pb.
В изучаемой части Белого моря существуют также проблемы органической перегрузки и эвтрофикации [25]. Органические загрязнители можно отнести к следующим категориям: природное органическое вещество – гумусовые кислоты, образующиеся при гниении древесины, и антропогенные органические загрязнители, чаще всего детергенты, жирные кислоты, присутствующие в бытовых стоках, фенолы, пестициды, а также нефтепродукты.
Нефтяное загрязнение Белого моря при ежегодном сбрасывании в воду до 40 т нефтепродуктов является наиболее сильным антропогенным воздействием, приводящим к перестройке видовой структуры [8]. При комплексном изучении действия загрязняющих веществ важная роль отводится нефтяным углеводородам – алифатическим и полициклическим ароматическим, которые концентрируются в поверхностных водах, толще воды, в осадках, во взвесях, в снеге, во льдах [15]. Наиболее токсичны полиаромати-ческие углеводороды [13], обладающие высокой токсичностью, канцерогенностью и максимальной растворимостью и входящие в международный перечень потенциально опасных веществ.
Для проведения сравнительных исследований зоны сбора проб были дифференцированы нами по принципу повышенной концентрации определенного типа поллютанта.
Акватория в районе г. Кандалакша – комбинированное загрязнение с преобладанием органических ксенобиотиков: сточные воды механического завода с высоким содержанием органики, древесные опилки с лесозавода, бытовые отходы и бытовые сточные воды. Район Лупчострова – загрязнение преимущественно веществами неорганической природы, в основном ТМ, входящими в стоки залива, обогащенными соединениями из состава апатитового концентрата. Акватория о. Малый – значительное нефтяное загрязнение. Контролем служили особи из условно чистой зоны – о. Ряшков.
Результаты анализа липидов показали как общие, так и специфические различия в содержании общих липидов и отдельных липидных фракций у амфипод в мониторинговых точках (см. таблицу). Под влиянием загрязнителей разной природы у опытных особей оказалось ниже количество общих липидов (при расчете к сухой массе вещества), чем в чистой зоне. При этом происходило уменьшение содержания фракции мембранных липидов – фосфолипидов (ФЛ). Содержание холестерина также снижалось относительно контрольных значений. У всех опытных амфипод также отмечено уменьшение количества запасных липидов (триацилглицеринов и эфиров холестерина). Использование запасных липидов на энергетические нужды считается защитной реакцией гидробионтов при длительном стрессе (см. таблицу).
Липидный состав амфипод из разных мониторинговых полигонов (липиды – в % к сухой массе, жирные кислоты – в % от суммы)
|
Показатели |
о. Ряш-ков, контроль |
г. Кандалакша |
о. Луп-чостров |
о. Малый |
|
Общие липиды |
9,9 |
8,7 |
7,0 |
5,7 |
|
Фосфолипиды |
6,6 |
6,0 |
4,7 |
2,8 |
|
Триацилглицерины |
1,5 |
1,7 |
1,5 |
1,2 |
|
Эфиры холестерина |
1,6 |
0,9 |
0,7 |
1,6 |
|
Холестерин |
0,16 |
0,14 |
0,15 |
0,10 |
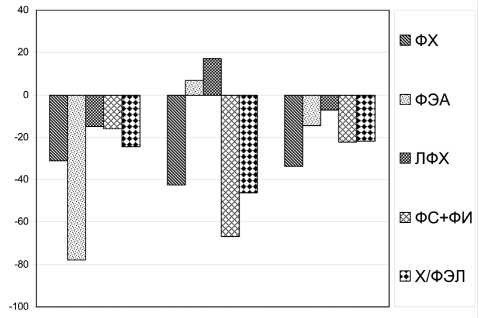
В структуре мембран показаны изменения в соотношениях индивидуальных фосфолипидов в условиях загрязнения по сравнению с чистой зоной (рис. 1). Общим для всех типов загрязнения являлось уменьшение уровня фосфатидил-холина (ФХ) при разнонаправленных изменениях в содержании лизопродукта. При менее значительных количественных отклонениях от нормы концентрации фосфатидилэтаноламина (ФЭА) величина отношения ФХ / ФЭА оказалась в условиях загрязнений ниже, чем в чистой зоне. Известно, что жидкостность мембран увеличивается при снижении величины отношения ФХ / ФЭА, что может служить показателем адаптивных перестроек, обеспечивающих нормальное функционирование многих мембраносвязанных ферментных систем в неблагоприятных ситуациях. Во всех опытных вариантах отмечено также уменьшение концентрации кислых фосфолипидов (фосфатидилсерин, фосфатидилинозитол) относительно контроля. Снижение их уровня обусловливает уменьшение активности Na,K-АТФ-азы и нарушение водно-солевого обмена, что является одним из первичных патогенетических звеньев токсикоза. Подобные изменения отмечались нами у рыб при некоторых токсических воздействиях [3].
Результаты исследования жирнокислотного состава липидов у амфипод из загрязненных районов Белого моря показали изменения по относительному содержанию как доминирующих, так и минорных жирных кислот, а также по суммарному содержанию кислот, сгруппированных по степени насыщенности по сравнению с чистой зоной. Так, опытные амфиподы содержали меньше насыщенных кислот, а уровень моно-еновых кислот был выше, чем у контрольных (см. таблицу). У них также была снижена величина отношения докозагексаеновой кислоты к эйкозапентаеновой (ДГК / ЭПК).
Кандалакша Лупчостров о. Малый
Рис. 1. Изменение фосфолипидного состава амфипод в разных районах (в % к контролю)
Наряду с отмеченной выше общей направленностью изменений в содержании липидов и жирных кислот у амфипод из загрязненных зон следует отметить и характерные различия в содержании структурных и запасных компонентов клеток в зависимости от превалирующих токсикантов. При сильном загрязнении неорганическими веществами в фосфолипидах отмечено наибольшее уменьшение уровня фос-фатидилхолина (ФХ), преобладающего в наружном листке бислоя, при некотором повышении ФЭА, располагающегося преимущественно во внутреннем листке бислоя. Следует отметить и наибольший уровень лизофосфатидилхолина (ЛФХ). Изучение характера адаптивных перестроек мембранных липидов у гидробионтов к условиям интоксикации показало, что если действие раздражителя велико по силе и продолжительности, то в цитоплазме и плазме крови постоянно присутствуют гемолитически активные продукты. Увеличение лизофосфолипидов мы наблюдали у рыб при различных экологических модуляциях [3]. Это может быть причиной нарушения функций биомембран, снижения физиологической эффективности энергетического и угнетения пластического обмена у гидробионтов. Известно, например, что ЛФХ в повышенных концентрациях выступает как ингибитор некоторых мембраносвязанных ферментов [5].
Механизм образования ЛФХ в разных случаях может иметь различные биохимические сочетания, но всегда должен включать активизацию фосфолипазы А2, гидролизующей ФХ. Обнаруженное нами у амфипод из района Лупчостров значительное повышение содержания ЛФХ может быть результатом действия тяжелых металлов на активность фосфолипазы А2. При этом также отмечено наименьшее содержание кислых фосфолипидов. Следует отметить, что при действии ксенобиотиков органической природы (органические вещества и нефть) наблюдалось сходство в изменчивости всех фосфолипидных фракций (рис. 2). Учитывая регуляторную роль индивидуальных ФЛ, можно полагать, что их различные отклонения от нормы обусловливают специфические изменения в отдельных звеньях метаболизма в клетках в зависимости от типа доминирующих ксенобиотиков.
При сильном загрязнении неорганическими веществами величина соотношения ФХ / ФЭА была наименьшей по сравнению с контролем и другими вариантами опыта, обусловливая уменьшение микровязкостности мембран. Однако более показательной в этом плане представляется величина отношения холестерина к фосфолипидам, от которой зависит состояние многих клеточных процессов. Существует точка зрения, что нарушение их оптимального соотношения приводит к развитию патологических процессов. Так, увеличение индекса холестерин / фосфолипиды при преимущественном воздействии неорганических веществ влечет за собой уменьшение проницаемости мембран и снижение скорости некоторых ферментативных реакций. Наибольшие изменения в фосфолипидном обмене обнаружены у амфипод под влиянием нефтепродуктов. Значительное уменьшение содержания структурных липидов, фосфолипидов, было связано с торможением их синтеза.
Функциональное состояние мембран во многом определяется составом связанных жирных кислот. Во всех исследуемых вариантах альтерации в содержании высоконенасыщенных длинноцепочечных кислот (ПНЖК) были незначительны (2–4 %). Но считается, что для модификации свойств мембраны важна не величина отклонения от нормы, а направленность изменений [5]. Некоторое увеличение доли полиеновых ацилов в липидах амфипод за счет эйкозапен-тоеновой кислоты (ЭПК) мы обнаружили при значительном органическом загрязнении. При преимущественном действии неорганических веществ практически не было различий в уровнях жирных кислот по сравнению с контролем, что свидетельствует об их слабом воздействии в существующих концентрациях на метаболизм жирных кислот, возможно, вследствие антагонистических взаимодействий отдельных ТМ. Отсутствие изменений в жирнокислотном составе мембранных липидов наблюдалось и у мол- люсков при действии сублетальных доз тяжелых металлов [1]. В опытных вариантах наименьшая доля ненасыщенных длинноцепочечных кислот в липидах отмечалась при преимущественном действии нефти. Поскольку ненасыщенные жирные кислоты являются главными субстратами перекисного окисления липидов, уменьшение их содержания при нефтяном загрязнении по сравнению с чистой зоной свидетельствует об индукции окислительного стресса у амфипод. В результате указанных модификаций в структуре мембран у амфипод может быть снижена двигательная активность, взаимосвязь которой с уровнем полиеновых жирных кислот в липидах рыб была установлена в работах Шульмана с соавторами [23]. Подтверждением этому служит малая подвижность амфипод, которая отмечалась при действии нефтепродуктов в экспериментальных и природных условиях [9], [12].
Известно, что характер соматического роста беспозвоночных является важным показателем состояния прибрежных экосистем. Проведенное сравнение морфометрических характеристик осенних амфипод из районов в черте г. Кандалакши, Лупчострова, о. Малый показало значительное уменьшение процента размерных классов больше 20 мм по сравнению с литоралью о. Ряш-ков относительно чистой зоны (рис. 2). Особи из этих полигонов содержали пониженный уровень фосфолипидов по сравнению с контрольной группой. Преобладание в указанных выше районах мелких особей, содержащих значительно меньше структурных липидов, вероятно, является результатом значительного антропогенного загрязнения Кандалакшского залива. При этом наибольшее снижение размерных характеристик и мембранных фосфолипидов происходило у литоральных амфипод в районе о. Малый в условиях значительного нефтяного воздействия . Снижение темпов соматического роста могло быть связано не только с дефицитом структурных липидов, но и белковых компонентов [2]. Ранее показано влияние различных концентраций тяжелых металлов на размеры амфипод [27].
Нарушение биохимического состава клеток обусловливает изменение физиологических реакций организмов, которые вызывают изменение функционального состояния особей и целых размерно-возрастных группировок видовых популяций. В исследованной нами части популяции литоральных Lagunogammarus oceanicus происходит преждевременная элиминация в результате значительного воздействия ксенобиотиков. Эта часть популяции, обитающая в загрязненной акватории, находится в процессе становления адаптации к сокращенному жизненному циклу. Такая же закономерность обнаружена в популяциях рыб при антропогенных нагрузках в условиях Кольского Севера, которая проявлялась в сжимании структурных рядов – размер-
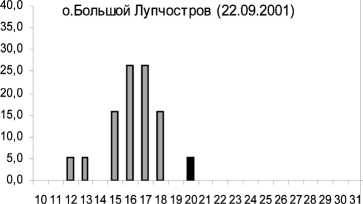
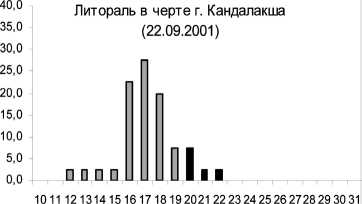
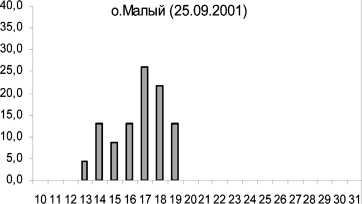
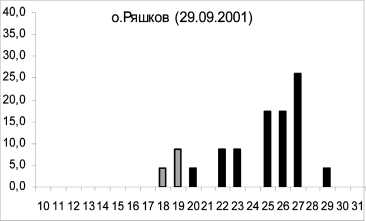
Рис. 2. Изменения размеров амфипод в различных по степени чистоты и загрязнения районах Кандалакшского залива Белого моря в осенний сезон
ных возрастных, нерестовых, что было связано с сокращением более энергоемких функций [14].
Таким образом, при различных типах загрязнения (органическое, неорганическое, нефтяное) отмечены общие и специфические изменения в составе липидных фракций и жирнокислотных радикалов, отражающие как защитные, так и дестабилизирующие процессы в организме амфипод. Особенности воздействия поллютантов проявляются как в количественных отклонениях показателей от нормы, так и в разной направленности изменений отдельных параметров. При этом нефтяное загрязнение приводило к наиболее выраженным нарушениям в липидном метаболизме клеток.
Отмеченные биохимические нарушения у особей в условиях загрязнения могут приводить и к изменениям в структуре популяций амфипод. Биометрический анализ литоральной части популяции Lagunogammarus oceanicus кутовой части Кандалакшского залива по сравнению с таковой из более мористой и чистой его части показал, что происходит уменьшение размеров тела и сокращение жизненного цикла амфипод, обитающих в условиях хронического комплексного загрязнения, особенно при воздействии нефтеуглеводородов.
ЗАКЛЮЧЕНИЕ
Трансформация экосистемы Белого моря обусловлена загрязнением воды токсикантами различной природы, изменением солености, характера питания, зараженности. Прибрежные экосистемы Кандалакшского залива Белого моря подвержены усиливающемуся антропогенному воздействию. В этих условиях эколого-морфологические и биохимические исследования яв- ляются неотъемлемой частью мониторинговых работ, приобретая особую важность в заповедных районах.
На основании морфометрических и биохимических показателей была проведена оценка состояния прибрежных акваторий в условиях различных антропогенной составляющих. В качестве тест-объектов биомониторинга использованы литоральные амфиподы Lagunogammarus оcеаnicus , достигающие в пробах более 80 %. Морфометрический анализ показал преобладание в мониторинговых зонах мелких особей, содержащих значительно меньше структурных липидов, что является результатом сильного загрязнения акватории Кандалакшского залива.
Обмен липидов тесно связан с резистентностью к неблагоприятным воздействиям, он вовлекается в специфические реакции защитноприспособительного характера. На основании результатов липидного анализа отмечены как количественные отклонения от фоновых значений, так и изменение направленности в содержании отдельных липидных фракций, а также в жирнокислотном составе липидов у осенних амфипод в различных условиях обитания в Белом море. Характер изменений при влиянии разных типов ксенобиотиков дает основание говорить о специфических особенностях их воздействия на липидный обмен. Негативный эффект обусловлен в основном нарушением структурной организации клеточных мембран. Реализация адаптивных биохимических механизмов обеспечивается преимущественно за счет снижения вязкостных свойств мембран, определяемых уровнем связанных ненасыщенных жирных кислот и соотношением отдельных мембранных фракций липидов, увеличивающих функциональную активность клеток. Ранее у ракообразных при незначитель- ных токсических нагрузках обнаруживалась стимуляция физиологических функций, а при усилении токсического воздействия – их угнетение [11]. Комплексная оценка с использованием молекулярных биомаркеров для прогнозирования состояния прибрежных экосистем при экологических модуляциях должна включать наряду с показателями пластического обмена и параметры энергетического обмена. В качестве адаптивной реакции при неблагоприятных воздействиях служит увеличение энергетических трат вследствие изменения направленности большинства метаболических систем организма и обмена веществ в целом, чему может препятствовать дефицит запасных липидов в клетках при длительном стрессовом воздействии.
БЛАГОДАРНОСТЬ
Выражаем благодарность администрации Кандалакшского государственного природного заповедника за предоставленную возможность сбора материала на акватории Кандалакшского залива Белого моря.
Список литературы Амфиподы как индикаторы характера воздействия антропогенных факторов на прибрежные акватории Белого моря
- Бельчева Н. Н., Челомин В. П. Влияние сублетальных доз тяжелых металлов на обмен гидрофобного матрикса мембранных структур клеток жабр морского двустворчатого моллюска. Владивосток: Дальнаука, 1988.
- Богдан В. В. Липидный состав высших ракообразных Северных морей//Современные проблемы физиологии и биохимии водных организмов. Петрозаводск: Изд-во КарНЦ РАН, 2005. С. 8-13.
- Богдан В. В., Сидоров В. С., Зекина Л. М. Липиды рыб при адаптации к различным экологическим условиям//Экологические проблемы онтогенеза рыб: физиолого-биохимические аспекты. М.: МГУ, 2001. С. 188-202.
- Богдан В. В., Шкляревич Г. А. Оценка состояния прибрежных экосистем Белого моря по эколого-биологическим и биохимическим показателям у амфипод//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2008. № 1. С. 61-73.
- Бурлакова Е. Б. Влияние липидов мембран на ферментативную активность//Липиды. Структура, биосинтез, превращения и функции. М.: Наука, 1977. С. 16-27.
- Государственный доклад о состоянии окружающей среды Республики Карелия в 2005 году/М-во сел., рыбного хоз-ва и экологии Респ. Карелия. Петрозаводск: ПетроПресс, 2006. 344 с.
- Кейтс М. Техника липидологии: Пер. с англ. М.: Мир, 1975. 322 с.
- Корякин А. С., Юрченко С. В. Сбросы загрязняющих веществ беломорской нефтебазой в Кандалакшский залив в 2004-2006 гг.//Экологические исследования беломорских организмов. СПб.: Изд-во СПбГУ, 2007. С. 59-60.
- Лаптева А. М. Закономерности реагирования бокоплавов на изменение химического состава воды//Проблемы рыбохозяйственной науки в творчестве молодых. Мурманск: Изд-во ПИНРО, 1985. С. 197-206.
- Луппова Е. Н. Особенности экологии литоральных бокоплавов Lagunogammarus oceanicus (Segerstrale, 1974) и Gammarus duebeni duebeni (Lilljeborg, 1851) в Баренцевом и Белом морях//Фауна беспозвоночных Карского, Баренцева и Белого морей (информатика, экология, биогеография). Апатиты: Изд-во КНЦ РАН, 2003. С. 240-325.
- Львова Т. Г. Особенности токсического воздействия на Daphnia magna солей тяжелых металлов//Современные проблемы физиологии и биохимии водных организмов. Петрозаводск: Изд-во КарНЦ РАН, 2004. С. 86-87.
- Миронов О. Г. Загрязнение нефтью//Общая экология. Биоценология. Гидробиология. М.: ВИНИТИ, 1976. Т. 3.
- Миронов О. Г., Писарева Н. А., Щекатурина Т. Л., Лапин Б. П. Исследование состава аренов в черноморских мидиях методом высокоэффективной жидкостной хроматографии (ВЭЖХ)//Гидробиологический журнал. Киев: Наукова думка, 1990. Т. 26. № 4. С. 59-62.
- Моисеенко Т. И. Стратегия адаптивных ответов организмов и популяций на антропогенный стресс//Биологические основы изучения, освоения и охраны животного и растительного мира, почвенного покрова Восточной Фенноскандии. Петрозаводск: Изд-во КарНЦ РАН, 1999. С. 143.
- Немировская И. А., Новигатский А. Н., Шевченко В. П. Оценка состояния экосистемы Белого моря (нефтяные углеводороды)//Современные экологические проблемы Севера (к 100-летию со дня рождения О. И. Семенова-Тян-Шанского. Ч. 2. Апатиты: Изд-во КНЦ РАН, 2006. С. 92-94.
- Сидоров В. С., Лизенко Е. И., Болгова О. М., Нефедова З. А. Липиды рыб. 1. Методы анализа//Лососевые (Salmonidae) Карелии. Петрозаводск: Изд-во КарНЦ РАН, 1972. С. 152-163.
- Фауна беспозвоночных Карского, Баренцева и Белого морей (информатика, экология, биогеография). Апатиты, 2003.
- Цветкова Н. Л. Прибрежные гаммариды северных и дальневосточных морей СССР и сопредельных вод. Л.: Наука. Ленингр. отд-ние, 1975. 257 с.
- Цыганов Э. П. Метод прямого метилирования липидов после ТСХ без элюирования с силикагеля//Лабораторное дело. 1971. № 8. С. 490-493.
- Шкляревич Г. А. Межгодовая динамика массовых видов бентоса на литорали Кандалакшского залива Белого моря//Биология моря. 1980. № 5. С. 26-32.
- Шкляревич Г. А. Экология сообществ макробентоса Белого моря: Автореф. дис.... д-ра биол. наук. Петрозаводск, 2002.
- Шкляревич Г. А., Разновская С. В. Литоральные амфиподы Кандалакшского залива Белого моря//Современные проблемы науки и образования. 2007. № 6. С. 168-172.
- Шульман Г. Е., Юнева Т. В. Роль докозагексаеновой кислоты в адаптациях рыб (Обзор)//Гидробиологический журнал. 1990. Т. 26. № 4. С. 43-51.
- Arduini A., Peschchera A., Dottori S., Sciarroni A., Serafini F., Calvani M. High performance liquid chromatography of long-chain acilcarnitine and phospholipids in fatty acid turnover stadies//J. of Lipid Research. 1996. Vol. 37. P. 684-689.
- Bryazgin V., Klimov A. Evaluation of the present state of the Pomor and Karelian coast and the Onega Bay of the White Sea//The Projects of the Investment Programs developed for the Perublic of Karelia by NEFCO/AMAR. Information Paper. Petrosavodsk, 1995. P. 6.
- Rinderhagen M., Ritterhoff J., Zauke G.-P. Crustaceans as bioindicators//Biomonitoring of Pollutant Water -Rewiews on Actual Topics. Environmental Research Forum. 2000. Vol. 9. P. 161-194.
- Wang X., Zauke G.-P. Relationship between growth parameter of the amphipod Gammarus zaddachi and the permeable body surface area determined by the acid-base titration method//Hydrobiologia. 2002. Vol. 482. P. 179-189.


