Амилоидная кардиомиопатия: значение и возможности диагностики методом магнитно-резонансной томографии
Автор: Ежикова М. В., Насонова С. Н., Устюжанин Д. В., Шария М. А., Жиров И. В., Терещенко С. Н.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Частота и распространённость амилоидной кардиомиопатии (АК) в последние годы значимо увеличивается, при этом диагноз выставляется зачастую уже на конечных стадиях заболевания. Это приводит к позднему назначению специфической терапии и, следовательно, к ухудшению прогноза пациентов. К сожалению, врачи недостаточно информированы о патогенезе АК, диагностических алгоритмах, что приводит к пролонгации времени от манифеста заболевания до постановки правильного диагноза. Несмотря на наличие большого количества масок АК, имеется специфический набор клинико-диагностических маркеров, т.н. «красных флагов», при обнаружении которых возможно заподозрить наличие амилоидоза. Кроме того, разработка диагностических алгоритмов с использованием неинвазивных методов визуализации может помочь не только в постановке диагноза АК на ранней стадии заболевания, но и определить тип амилоидоза, от которого зависит успех своевременности назначения болезнь-модифицирующей терапии. Целью настоящего обзора является анализ возможности использования МРТ критериев для попытки неинвазивного типирования амилоидоза и дифференциального диагноза между транстиретиновым амилоидозом (ATTR-амилоидоз) и амилоидозе легких цепей иммуноглобулинов (AL-амилоидоз).
Транстиретиновая амилоидная кардиомиопатия, магнитно-резонансная томография, отсроченное контрастирование гадолинием, картирование миокарда, внеклеточная объемная фракция
Короткий адрес: https://sciup.org/143183528
IDR: 143183528 | УДК: 616.132-002.77-07-085 | DOI: 10.38109/2225-1685-2024-4-91-97
Текст обзорной статьи Амилоидная кардиомиопатия: значение и возможности диагностики методом магнитно-резонансной томографии
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
UDC 616.132-002.77-07-085LBC 54.10
REVIEW
-
*1) Check for updates
*Margarita V. Ezhikova, Svetlana N. Nasonova, Dmitry V. Ustyuzhanin,
Merab A. Shariya, Igor V. Zhirov, Sergey N. Tereshchenko
AMYLOID CARDIOMYOPATHY: СLINICAL SIGNIFICANCE ANDDIAGNOSTIC VALUE OF MAGNETIC RESONANCE IMAGING
E.I. Chazov National Medical Research Center of Cardiology, 15 a Academician Chazov str., Moscow 121552, Russian Federation
Funding source. The authors declare that there is no external funding for the exploration and analysis work.
Conflict of interest. Merab A Shariya is a member of the editorial board of Eurasian heart journal, but had nothing to do with the decision to publish this article. The article passed the peer review procedure adopted in the journal. The author did not declare any other conflicts of interest.
Authors’ contribution. All authors confirm the compliance of their authorship according to the international ICMJE criteria. CRediT author statement: Margarita V. Ezhikova, Svetlana N. Nasonova, Dmitry V. Ustyuzhanin – conceptualization, development of the methodology and content of the manuscript, writing – preparation of the draft manuscript. Merab. A Shariya, Igor V. Zhirov, Sergey N. Tereshchenko, – formulation of the idea, scientific guidance of the research, editing of the manuscript.
И RKNPK22@MAIL.RU
Received: 26.01.2024 | Revision Received: 06.04.2024 | Accepted: 28.05.2024
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Амилоидоз – это системное инфильтративное заболевание, при котором белки-предшественники с нестабильной структурой образуют отложения – амилоидные фибриллы, которые инкорпорируются в различных органах: сердце, почки, печень, желудочно-кишечный тракт, нервная система, легкие, мягкие ткани. В настоящий момент известно 42 белка амилоидных фибрилл человека [1]. Поражение сердца носит название амилоидоз сердца или амилоидная кардиомиопатия. Стоит отметить, что амилоидные фибриллы откладываются не в кардиомиоците, а в интерстициальном пространстве и, таким образом, АК не следует рассматривать в качестве «болезни наполнения» (рис. 1) [2,3,4]. В 98% случаев амилоидная кардиомиопатия (АК) развивается при двух типах амилоидоза: амилоидозе легких цепей иммуноглобулинов (AL-амилоидоз) и транстиретиновом амилоидозе (ATTR). К AL-амилоидозу приводит повышенный синтез и отложение аномальных легких цепей иммуноглобулинов малигнизированными плазмацитами. АTTR развивается при отложении амилоида, образованного из транстиретина, и делится на два типа – ATTRwt (дикий или ненаследственный) и ATTRh (наследственный, семейный или вариантный) [1,4].
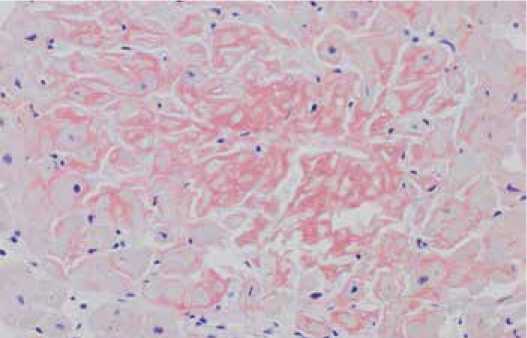
Рисунок 1. Микроскопия миокарда пораженного амилоидозом. Окраска конго-красный [4]
Figure 1. Microscopy of the myocardial tissue affected by amyloidosis. Congo red stain [4]
Проявлениями АК могут быть общая слабость, утомляемость, одышка, головокружение, перебои в работе сердца, синкопальные и пресинкопальные состояния, отеки нижних конечностей, непереносимость стандартных препаратов для лечения хронической сердечной недостаточности (ХСН). Кроме того, пациенты предъявляют жалобы, свидетельствующие о поражении других органов и систем: дисфагия, диспептические проявления, высыпания на коже, онемение пальцев рук и стоп, синдром сухого глаза, запястного канала, ортостатическая гипотензия. Примерно 13–17% всех причин ХСН с сохраненной фракцией выброса левого желудочка (ХСНсФВ ЛЖ) приходится на ATTR-АК. У 6-15% пациентов со стенозом аортального клапана (АС) также причиной служит ATTR-АК [3,5,6].
Золотым стандартом в диагностике АК с почти 100% чувствительностью является эндомиокардиальная биопсия. Однако из-за инвазивности метода и потенциальных осложнений, биопсия пораженного органа может быть предложена только в спорных клинических случаях [7]. Жизнеугрожающие осложнения при проведении биопсии, невозможность количественной оценки амилоидной нагрузки на все сердце, необходимость патологоанатомической экспертизы, которая ограничена несколькими ведущими центрами, заставили кардиологическое сообщество искать методики, позволяющие диагностировать амилоидоз малоинвазивными методами: эхокардиографические (ЭХО-КГ) методики с применением допплерографии, оценки деформации миокарда в режиме 2D-SPECKLE-TRACKING, сцинтиграфия миокарда, магнитно-резонансная томография (МРТ) сердца [8].
В настоящее время не существует единого метода диагностики, позволяющего поставить детальный диагноз, провести оценку морфологических и функциональных последствий АК. Все методы инструментальной диагностики имеют свои ограничения, и, следовательно, их необходимо рассматривать как взаимодополняющие друг друга, что лежит в основе мультимодального подхода в визуализации АК [3].
Примерно у 50% больных с AL-АК и у 20-40% с ATTR-АК на электрокардиограмме (ЭКГ) регистрируется низкий вольтаж комплексов QRS или непропорционально низкий вольтаж степени утолщения стенок, выявленного по данным ЭхоКГ или МРТ. У 70 % пациентов с АК регистрируются псевдоинфаркт-ные изменения при отсутствии зон нарушений локальной сократимости [3].
По данным ЭХО-КГ визуализируется, как правило, симметричное утолщение ЛЖ (более 12 мм) или правого желудочка (ПЖ) при отсутствии АС или длительно существующей артериальной гипертензии (АГ). Стенки ЛЖ имеют специфическую «светящуюся» структуру. Наблюдаются признаки диастолической дисфункции, дилатации предсердий, с нормальным или уменьшенным размером ЛЖ. ФВ ЛЖ в пределах нормальных значений, по мере прогрессирования заболевания ФВ может снижаться. Наблюдается снижение глобальной продольной деформации (GLS) базальных и средних сегментов ЛЖ при сохранной GLS апикальных сегментов – симптом «вишенки на торте» или «бычьего глаза» [3,6]. Чувствительность GLS около 88%, специфичность 72%. Важно отметить, что снижение GLS является независимым предиктором смертности, несмотря на ФВ ЛЖ. Более низкие значения GLS обычно наблюдаются при AL-АК по сравнению с ATTR-АК [6].
От назначения своевременной терапии зависит продолжительность жизни пациента. Важно не только поставить диагноз амилоидоза, но и определить его тип. При подозрении на АК, в первую очередь необходимо исключить AL-амилоидоз. Для этого определяют соотношение свободных каппа- и лямбда-легких цепей в сыворотке крови, выполняют электрофорез с иммунофиксацией белков сыворотки крови и мочи [7].
Высокоспецифичным (около 100%) неинвазивным диагностическим методом для подтверждения ATTR-АК, при исключении AL-АК, является сцинтиграфия с остеотропным радиофармпрепаратом [9]. Различают 4 степени накопления радиофармпрепарата: Grade 0, Grade 1, Grade 2, Grade 3. При степени накопления 2-3 наиболее вероятен диагноз АTTR-АК. Для определения типа АTTR-АК проводят генетический анализ [7].
Анализ литературы показывает, что за последнее десятилетие возрос интерес исследователей к применению МРТ у пациентов с амилоидозом. МРТ высокоинформативный метод неинвазивной оценки сердца и сосудов, широко применяющийся в кардиологической клинике. Метод является признанным «золотым» стандартом для оценки функции и характеристики ткани миокарда. Все это дает основание к изучению амилоидоза сердца с помощью МРТ как инструмента первичной, так и дифференциальной диагностики. Структурная и функциональная оценка сердца возможна благодаря различным методикам МРТ, таким как кино-режим, контрастирование, картирование миокарда [10].
Кино-МРТ. Кино-последовательность – это широко используемый режим, который включен во все протоколы исследования сердца методом МРТ [11]. В данном режиме изучается анатомия камер сердца и сосудов, точно определяются эндокардиальные и эпикардиальные границы. Выполняется серия ортогональных поперечных срезов и стандартных проекций через длинную ось (двухкамерное и четырехкамерное сечение) и короткую ось ЛЖ и составляются кино-МРТ-последовательности. При просмотре в этом режиме, уже можно заподозрить наличие амилоидоза, имея такие признаки как глобальное утолщение ЛЖ и ПЖ, нарушение систолической и диастолической функции.
В исследовании, проведенном Ana Martinez-Naharro и др. (2017) асимметричное утолщение межжелудочковой перегородки (МЖП) присутствовало у 79% пациентов с ATTR-АК и 14% с AL-АК; (p<0,001), симметричное утолщение наблюдалось у 18% с ATTR-АК и у 68% с AL-АК, а у 3% пациентов с ATTR-АК и 18% AL-АК не было признаков утолщения МЖП [12].
По данным литературы сообщается, что у 5% пациентов с ГКМП диагностируется ATTR-АК [13]. Кроме кардиальных изменений, которые визуализируются в данном режиме еще регистрируются и экстракардиальные. У 48% пациентов диагностируется плевральный выпот, у 35% перикардиальный [14].
Контрастирование. МРТ с отсроченным контрастированием – наиболее точный метод визуализации очагов поражения миокарда. Это одна из первых гистологически проверенных методик неинвазивного выявления амилоидоза сердца. Она позволяет максимально точно очертить конфигурацию патологического процесса, определить глубину повреждения [11]. У пациентов с АК внеклеточное пространство расширяется за счет амилоидной инфильтрации, что повышает концентрацию гадолиния в миокарде, усиливая степень контрастирования
-
[15]. Чувствительность и специфичность методики приближается к 85-90% [4].
В качестве контрастного вещества используются препараты на основе редкоземельного металла – гадолиния. Исследование выполняется через 15-20 мин после в/в ведения препарата. Поврежденный участок на постконтрастных МР-томограммах выглядит ярким. Рекомендуется использовать 1,5-2 кратную дозировку контрастного препарата (0,15-0,2 ммоль на 1 кг массы тела), что позволяет добиться оптимального контраста между нормальной тканью миокарда и зоной поражения [11].
Оценка миокарда при МРТ с контрастированием основана на характере распределения контрастного препарата. Типичные паттерны накопления контраста позволяют проводить дифференциальную диагностику между ишемическим и различными неишемическими причинами повреждения миокарда (рис. 1).
В здоровом миокарде внутриклеточное пространство составляет б о льшую часть объема мышцы, а молекулы гадолиния не попадают внутрь неповрежденного кардиомиоцита, распределяясь в небольшом внеклеточном пространстве. Через 10-15 мин после введения контрастный препарат полностью выводится из миокарда, если клеточные мембраны не повреждены. При хроническом течении заболевания контраст также проникает во внеклеточное пространство, что обусловлено небольшим количеством целых кардиомиоцитов и большим объемом внеклеточного пространства, и медленным вымыванием. Объем распределения контраста пропорционален интерстициальному расширению, вторичному по отношению к отложению амилоида [17].
Если проводить дифференциальную диагностику между AL-и ATTR-АК, то субэндокардиальное накопление гадолиния более характерно для AL-АК (рис. 2), а трансмуральное для ATTR-
Ишемический тип накопления

А-субэндокардиальный инфаркт

В-трансмуральный инфаркт

ДКМП миокардит
Неишемический тип накопления
А-митромиокардиальное контрастирование

ГКМП, перегрузка давлением Саркоидоз, миокардит,
ПЖ (например, пороки, болезнь Аидерсона- легочная гипертензия) Фаби, болезнь Чагса
В-субэпикардиальное контрастирование

Саркоидоз, миокардит, болезнь Аидерсона-Фаби, болезнь Чагса
В-субэндокардиальное контрастирование

Амилоидоз, системный склероз, трансплантированное сердце
Рисунок 2. Схематическое представление паттернов накопления парамагнитного контрастного препарата на МР-изображениях [15]Figure 2. Schematic representation of paramagnetic contrast agent accumulation patterns on MR images [15]
EURASIAN HEART JOURNAL, 4, 2024 93
АК (рис. 3) [17]. Вовлечение правого желудочка характерно для ATTR-АК [4]. Участки накопления не связаны с бассейнами коронарных артерий.
Отсроченное контрастирование – информативная диагностическая методика, которая не только улучшает выявление сердечного амилоидоза, но также играет важную прогностическую роль [19].
Недавнее крупное исследование Banypersad SM (2019) с участием 250 пациентов с амилоидом подтвердило, что 100% областей LGE, полученных с помощью PSIR-изображений, были правильными по сравнению только с 57% изображений MAG-IR. Наличие накопления прогнозировало худший исход: трансмуральное накопление приводило к более высокой смертности по сравнению с субэндокардиальным. Это справедливо как для AL-АК, так и для ATTR-АК. Двухлетняя выживаемость без накопления составила 92% при AL-АК и ATTR-АК, но она снижалась до 81% при субэндокардиальном и еще более драматически уменьшалась до 45% (AL) и 65% (ATTR) при трансмуральном накоплении [20].
Отсроченное контрастирование ПЖ также может играть роль в стратификации риска у пациентов с АК. До сих пор не было возможности точно дифференцировать AL-АК от ATTR-АК только на основе накопления гадолиния. В попытке решить эту проблему были разработаны диагностические шкалы, но они не получили широкого распространения [20].
Однако, отсроченное контрастирование имеет некоторые ограничения. Пациенты с АК часто страдают сопутствующим нарушением функции почек, которое может быть тяжелым, что за- трудняет введение гадолиния. Более того, у некоторых пациентов наблюдаются атипичные и неоднородные паттерны накопления, которые делают диагноз поражения сердца неопределенным [17].
Картирование. Новые методики МРТ оценки, такие как картирование позволяют преодолеть ограничения отсроченного контрастирования и расширяют диагностические возможности визуализации амилоидоза. Картирование миокарда – это пиксельная иллюстрация времени релаксации ткани. Время релаксации – это свойство любой ткани. Цвет каждого пикселя отражает значение показателей T1 или T2. Картирование позволяет качественно оценить диффузные изменения в миокарде. Эти последовательности можно получить за один цикл задержки дыхания, что актуально у тяжелых пациентов [21].
Картирование T1 и внеклеточный объем. Одноцентровые исследования показали информативность нативного (без экзогенного контрастирования) Т1 картирования при амилоидозе. При высокой амилоидной нагрузке можно ожидать увеличения времени Т1 [15]. В исследовании Karamitsos T.D. было продемонстрировано увеличение времени Т1 (измеренное по протоколу ShMOLLI) до 1140 мс у 53 пациентов с AL амилоидозом по сравнению со здоровыми добровольцами (958 мс) с пороговым значением 1020 мс, имеющим диагностическую точность 92% для АК [22]. Увеличение времени Т1 для каждого подтипа зависит от амилоидной нагрузки, технических характеристик томографа (рис. 4). Доказано, что для обоих подтипов АК время Т1 существенно связано с прогнозом [10].
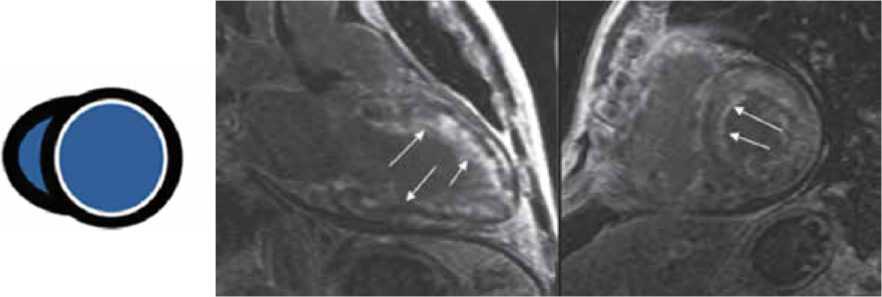
Рисунок 3. МР-томограммы. Отсроченное контрастирование. Визуализируется неравномерное субэндокардиальное накопление контрастного препарата миокардом ЛЖ [Собственное наблюдение]
Figure 3. MRI scans. Late gadolinium enhancement. Uneven subendocardial accumulation of the contrast agent by the LV myocardium is visualized [Own observation]
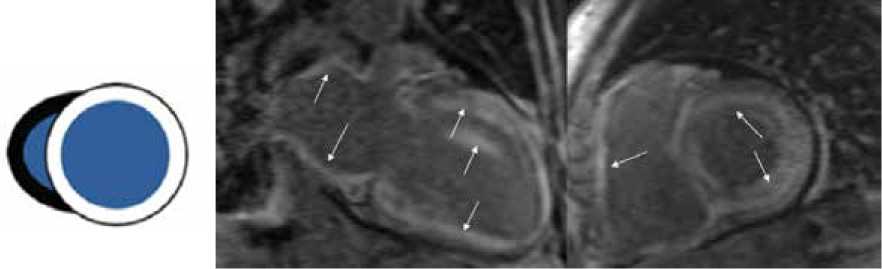
Рисунок 4. МР-томограммы. Отсроченное контрастирование. Визуализируется диффузное трансмуральное накопление в миокарде ЛЖ и ПЖ, а также в миокарде левого предсердия и волокнах папиллярных мышц [Собственное наблюдение]
Figure 4. MRI scans. Late gadolinium enhancement. Diffuse transmural accumulation is visualized in the myocardium of the LV and RV, as well as in the myocardium of the left atrium and fibers of the papillary muscles [Authors' observation]
94 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2024
Если картирование провести с применением контрастного препарата, то это добавляет к Т1-картированию еще одно измерение и позволяет неинвазивно количественно определять внеклеточную объемную фракцию (ECV – extracellular volume). ECV – это коэффициент, который отражает соотношение изменения значения Т1 между кровью и тканью миокарда после контрастирования. Рассчитывают ECV, используя соотношение разностей между скоростями релаксации миокарда после и до введения контраста и скоростями релаксации крови после и до введения контраста. Расчет ECV требует информации о гематокрите. Учитывая, что амилоидоз – это внеклеточный патологический процесс, определение ECV достаточно точно показывает амилоидную нагрузку на сердце, даже на начальной стадии заболевания. Зарегистрированные значения ECV миокарда колеблются от 44% до 61% в определенных случаях АК и 27±3% у здоровых добровольцев [15].
Сравнительные исследования нескольких заболеваний показывают, что ECV и T1 точно отличают амилоидоз от других заболеваний и состояний. Собственный сигнал T1 выше при AL, чем при ATTR, тогда как ECV выше при ATTR-АК [23].
ECV имеет важное прогностическое значение при АК и может позволить отслеживать прогрессирование заболевания или ответ на лечение АК [11]. Картирование T1 и оценка ECV с помощью CMR являются одними из самых ранних визуализирующих биомаркеров отложения сердечного амилоида. У пациентов с системным амилоидозом отмечаются высокие значения нативного T1 и ECV миокарда, даже при отсутствии накопления контраста. Поскольку системный амилоидоз является внеклеточным заболеванием, количественная оценка ECV представляет собой точную неинвазивную оценку отложения амилоида в сердце.
Общество сердечно-сосудистого магнитного резонанса и Европейская ассоциация сердечно-сосудистой визуализации еще в 2017 году опубликовали консенсусное заявление, в котором рекомендовалось использовать эти последовательности в клинической практике особенно с учетом того, что технические разработки постоянно совершенствуют различные аспекты картирования.
Т2-картирование. Долгое время для диагностики АК оценка Т2 взвешенных изображений не применялась, она использовалась для визуализации очага воспаления и отека миокарда. Однако, за последние годы в зарубежной литературе стали появляться данные о применении данного режима в типировании АК и оценки прогноза, особенно у пациентов со сниженной почечной функцией, ввиду наличия противопоказаний к введению гадолиния [18].
T2 зависит от состава межклеточной жидкости и отека, связанного с токсическим действием амилоида на кардиомиоциты, что приводит к увеличению времени T2 [20]. По данным исследования проведенного Tushar Kotecha и др, у пациентов с AL-АК среднее значение Т2 было 56 мс, с ATTR-амилоидозом – 54 мс, 49 мс у здоровых добровольцев [21].
Время T2, по-видимому, является прогностическим и оценивает ответ на лечение при AL, но не при ATTR, что, как полагают, связано с прямой кардиотоксичностью самих легких цепей, вызывающих большую степень отека [24].
Более сильная связь между временем T2 и AL –АК по сравнению с ATTR привела к недавно предложенной системе оценки, позволяющей отличить AL от подтипов ATTR [24]. Увеличение времени T2 характерно для AL-АК, в то время как, большинство других маркеров: масса миокарда ЛЖ, толщина стенки, трансмуральное накопление, вовлечение ПЖ в большей степени коррелируют с ATTR-АК (рис. 5).
Более существенную информацию дает суммарная оценка ECV и времени T2. Повышение ECV без увеличения T2 предполагает увеличение внеклеточного объема из-за фиброза или отложения амилоида. Повышение ECV с удлинением T2 указывает на повышенное содержание воды в миокарде, что может отражать отек (в основном внеклеточный отек). Это характерно для воспаления или вазодилатации [25]. Существует вероятность сопутствующего фиброза или отложения амилоида (особенно при амилоидозе легких цепей). Удлинение T2 при отсутствии изменений ECV может отражать внутриклеточный отек, что не характерно для любой формы АК [21].
В исследовании, проведенном A. Briasoulis и др. (2023) попытались комплексно оценить все возможности МРТ при диа-
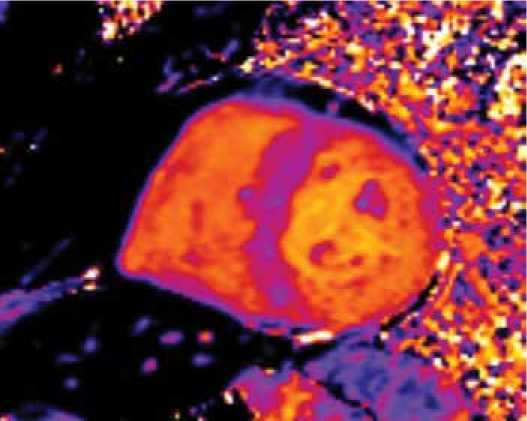
Рисунок 5. МР-томограмма в режиме Т1 картирования [Собственное наблюдение]
Figure 5. MR tomogram in T1 mapping [Authors' observation]
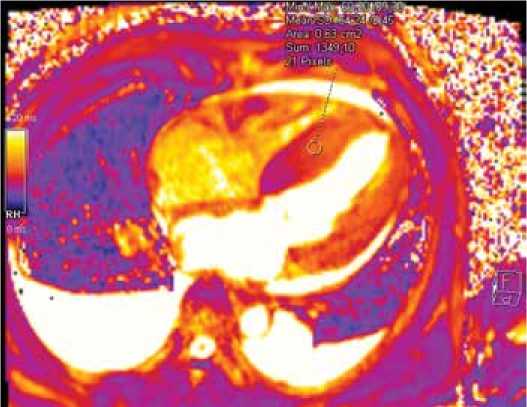
Рисунок 6. МР-томограмма в режиме картирования. Увеличение времени Т2 у пациента с AL-амилоидозом [Cобственное наблюдение]
Figure 6. MR tomogram in mapping. Increased T2 value in patient with AL amyloidosis [Authors' observation]
гностике и типировании амилоидоза. В опубликованном ими исследовании было включено 88 пациентов с АК. Целью работы являлось определение диагностической и прогностической ценности картирования T1, T2 и определение ECV не только сердца, но и печени, и селезенки, причем основное внимание уделялось бесконтрастным режимам. Из 88 пациентов у 71 больного был установлен диагноз AL-АК и у 17 пациентов – ATTR-АК, а группу контроля составили 33 пациента с АС и гипертрофией левого желудочка (ГЛЖ) и 15 здоровых добровольцев. Все исследуемые параметры МРТ значительно отличались у пациентов с AК по сравнению как с пациентами с ГЛЖ-АС, так и со здоровым контролем. Оценивалась взвешенность изображений по коэффициентам Т1, Т2. У пациентов с АК наблюдалось увеличение времени Т1 до 1422,5 мс, (1293 мс у пациентов с АС, 1242 – у здоровых добровольцев) Т2 – 57,2 мс, (48,6 мс у пациентов с АС, 47,8 мс – у здоровых добровольцев) ECV 45% (30% мс у пациентов с АС, 27% у здоровых добровольцев) (P<0,001).
Значения Т2 у пациентов с АК были не только значительно выше, чем у здоровых людей, но также и у пациентов с ГЛЖ-АК, что свидетельствует о роли внеклеточного отложения амилоида в развитии и прогрессировании АК. Диагностическая эффективность картирования T2 была подчеркнута AUC кривых ROC как для ROI нативного T2 (AUC: 87,6%), так и для глобального нативного T2 (AUC: 86,8%). Также это исследование показало, что Т2 картирование является прогностическим фактором смертности пациентов с АК [26].
Следует отметить, что референсные значения параметров картирования должны быть определены в каждом учреждении на группе здоровых лиц, так как показатели могут несколько отличаться и зависят от конкретного томографа.
Диффузионно-тензорная МРТ. Другой неконтрастный магнитно-резонансный метод, появившийся для характеристики АК – это МРТ с тензором диффузии (ТД). Отслеживая диффузию воды через ткань, МРТ-ТД позволяет оценить микроструктуру миокарда, количественно определить фракционную анизотропию, среднюю диффузионную способность и границы миокарда. В исследовании проведенном George Joy, et al. (2023) было показано, что МРТ-ТД может подтверждать патогенность саркомерного варианта и определять стадию патологического процесса при ГКМП [27]. В исследованиях, проведенных ранее подтверждается, что МРТ-ТД хорошо соответствует оценкам ECV для разных подтипов амилоида, но изменения границ миокарда в диастолу могут различаться между ATTR и AL [28]. Дополнительные проверочные исследования и стандартизация клинических протоколов являются следующими важными шагами для этой многообещающей методики у пациентов с АК [27].
Оценка деформации миокарда с помощью МРТ. Деформация миокарда – это изменение размеров (длины, толщины) кардиомиоцита между расслабленным и сокращенным состоянием. Проводится в стандартном кино-режиме. Оценивается продольная, циркулярная, радиальная деформации. Продольная деформация возникает вдоль продольной оси сердца вследствие укорочения миокарда от основания к верхушке. Циркулярная деформация возникает вдоль короткой оси окружности вследствие концентрического интрамурального укорочения миокарда вдоль изогнутой линии, параллельной поверхности эпикарда. Радиальная деформация предполагает утолщение миокарда в радиальном направлении к центру полости желудочка [29].
МР-оценка деформации миокарда способствует раннему вы- 96 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2024
явлению субклинической дисфункции ЛЖ (еще до снижения фракции выброса ЛЖ).
Пик циркулярной деформации, вариабельность времени пика циркулярной деформации, сохранность продольной апикальной деформации вероятно коррелируют с отложением амилоида и могут быть более чувствительными, чем отсроченное контрастирование для выявления ранних проявлений заболевания. Совокупность данных о продольной деформации миокарда и отсроченного контрастирования могут дифференцировать различные формы гипертрофии ЛЖ от АК [30]. При АК наблюдаются более низкие значения глобальной деформации. Кроме того, оценка циркулярной деформация показала более высокую чувствительность, чем LGE, для раннего выявления АК [31].
ЗАКЛЮЧЕНИЕ
Таким образом, анализ литературы показывает, что МРТ информативный неинвазивный метод визуализации у пациентов с подтвержденным амилоидозом или подозрением на него. В ряде работ получены высокие значения чувствительности – 95 % и специфичности – 98%. В сочетании с исследованиями моноклональных белков МРТ позволила дифференцировать АTTR и AL-АК с высокой точностью и прогностической ценностью. С появлением дополнительных опций при анализе МРТ изображений диагноз АК может выставляться на более ранних этапах. Попытки систематизировать использование МРТ критериев для типирования амилоидоза продолжаются, однако, современные профессиональные сообщества пока не рекомендуют полагаться только на МРТ критерии, как основные для дифференциального диагноза между АTTR и AL-АК.
Включение МРТ в диагностический алгоритм рекомендуется: - у пациентов с гипертрофией миокарда, выявленной при эхокардиографии, для оценки тканевых характеристик миокарда и возможного определения специфической этиологии гипертрофии;
-
- МРТ целесообразна для проведения дифференциальной диагностики ГКМП с другими инфильтративными заболеваниями и болезнями накопления (амилоидоз, саркоидоз, гемохроматоз, болезнь Фабри);
-
- у пациентов с некардиальным системным амилоидозом, у которых ранняя диагностика вовлечения миокарда с помощью методов картирования может быть полезна еще до развития выраженной гипертрофии.
Список литературы Амилоидная кардиомиопатия: значение и возможности диагностики методом магнитно-резонансной томографии
- Buxbaum JN, Dispenzieri A, Eisenberg DS et al. Amyloid nomenclature 2022: update, novel proteins, and recommendations by the International Society of Amyloidosis (ISA) Nomenclature Committee. Amyloid. 2022 Dec; 29(4):213-219. https://doi.org/10.1080/13506129.2022.2147636
- Dorbala S, Ando Y, Bokhari S, et al. ASNC/AHA/ASE/EANM/HFSA/ISA/SCMR/SNMMI expert consensus recommendations for multimodality imaging in cardiac amyloidosis: Part 1 of 2-evidence base and standardized methods of imaging. J Nucl Cardiol. 2019 Dec; 26(6):2065-2123. https://doi.org/10.1007/s12350-019-01760-6
- Jung MH, Chang S, Han EJ, Youn JC. Multimodal Imaging and Biomarkers in Cardiac Amyloidosis. Diagnostics (Basel). 2022 Mar 3; 12(3):627. https://doi.org/10.3390/diagnostics12030627
- Oda S., Kidoh M., Nagayama Y., et al. Trends in Diagnostic Imaging of Cardiac Amyloidosis: Emerging Knowledge and Concepts, RadioGraphics 2020; 40:961-981. https://doi.org/10.1148/rg.2020190069
- Ruiz-Hueso, R., Salamanca-Bautista, P., Quesada-Simón, M.A., et al. Estimating the Prevalence of Cardiac Amyloidosis in Old Patients with Heart Failure - Barriers and Opportunities for Improvement: The PREVAMIC Study. J. Clin. Med. 2023;12:2273. https://doi.org/10.3390/jcm12062273
- Kyrouac D., Schiffer W., Lennep B., et al. Echocardiographic and clinical predictors of cardiac amyloidosis: limitations of apical sparing. ESC Heart Fail. 2022 Feb;9(1):385-397. https://doi.org/10.1002/ehf2.13738
- Khedraki R. Cardiac amyloidosis: an update on diagnosis, current therapy, and future directions. Current Opinion in Cardiology. 2022 May 1;37(3):272-284. https://doi.org/10.1097/HCO.0000000000000953
- Терещенко С.Н., Жиров И. В., Моисеева О.М., и соавт. Практические рекомендации по диагностике транстиретиновой амилоидной кардиомиопатии (ATTR-КМП или транстиретинового амилоидоза сердца). Терапевтический архив. 2022;94(4):584-595. https://doi.org/10.26442/00403660.2022.04.201465
- Slivnick J.A., Alvi N., Singulane C.C., et al. Non-invasive diagnosis of transthyretin cardiac amyloidosis utilizing typical late gadolinium enhancement pattern on cardiac magnetic resonance and light chains. Eur Heart J Cardiovasc Imaging. 2023 May 31;24(6):829-837. https://doi.org/10.1093/ehjci/jeac249
- Yilmaz A., Bauersachs J., Bengel F., et al. Diagnosis and treatment of cardiac amyloidosis: position statement of the German Cardiac Society (DGK). Clin Res Cardiol. 2021 Apr; 110(4):479-506. https://doi.org/10.1007/s00392-020-01799-3
- Терновой С.К. Томография сердца. Ред. Сучкова О.В. - Москва: ГЭОТАР-Медиа,2018. C. 296. ISBN: 978-5-9704-4608-9
- Martinez-Naharro A., Treibel T.A., Abdel-Gadir A., et al. Magnetic Resonance in Transthyretin Cardiac Amyloidosis. J Am Coll Cardiol. 2017 Jul 25; 70(4):466-477. https://doi.org/10.1016/j.jacc.2017.05.053
- Damy T., Costes B., Hagège A.A., et al. Prevalence and clinical phenotype of hereditary transthyretin amyloid cardiomyopathy in patients with increased left ventricular wall thickness. Eur Heart J. 2016 Jun 14;37(23):1826-34. https://doi.org/10.1093/eurheartj/ehv583
- Dungu J.N., Valencia O., Pinney J.H., et al. CMR-based differentiation of AL and ATTR cardiac amyloidosis. JACC Cardiovasc Imaging. 2014 Feb;7(2):133-42. https://doi.org/10.1016/j.jcmg.2013.08.015
- Ribeiro V.F., Oliveira D.C.L., Neves D.G., et al. Cardiac Magnetic Resonance and amyloidosis: Review. Int. J. Cardiovasc. Sci. 2019;32(2):177-89. https://doi.org/10.5935/2359-4802.20190005
- Shah D.J., Judd R.M., Kim R.J., Technology insight: MRI of the myocardium. Nat Clin Pract Cardiovasc Med. 2005 Nov;2(11):597-605; quiz 606. https://doi.org/10.1038/ncpcardio0352
- Pan J.A., Kerwin M.J., Salerno M. Native T1 Mapping, Extracellular Volume Mapping, and Late Gadolinium Enhancement in Cardiac Amyloidosis: A Meta-Analysis. JACC Cardiovasc Imaging. 2020 Jun;13(6):1299-1310. https://doi.org/10.1016/j.jcmg.2020.03.010
- Banypersad S.M. The Evolving Role of Cardiovascular Magnetic Resonance Imaging in the Evaluation of Systemic Amyloidosis. Magn Reson Insights. 2019 May 1;12:1178623X19843519. https://doi.org/10.1177/1178623X19843519
- Терновой С.К., Путило Д.В., Стукалова О.В., Габрусенко С.А. Структура миокарда у пациентов с гипертрофией левого желудочка различного генеза по данным МРТ с отсроченным контрастированием. Российский Электронный журнал Лучевой диагностики, 2023;13(1):58-69. https://doi.org/10.21569/2222-7415-2023-13-1-58-69
- Banypersad S.M. The Evolving Role of Cardiovascular Magnetic Resonance Imaging in the Evaluation of Systemic Amyloidosis. Magn Reson Insights. 2019 May 1;12:1178623X19843519. https://doi.org/10.1177/1178623X19843519
- Kotecha T., Martinez-Naharro A., Treibel T.A., et al. Myocardial Edema and Prognosis in Amyloidosis. J Am Coll Cardiol. 2018 Jun 26;71(25):2919-2931. https://doi.org/10.1016/j.jacc.2018.03.536
- Karamitsos T.D., Piechnik S.K., Banypersad S.M., et al. Noncontrast T1 mapping for the diagnosis of cardiac amyloidosis. JACC Cardiovasc Imaging. 2013 Apr;6(4):488-97. https://doi.org/10.1016/j.jcmg.2012.11.013
- Fontana M., Banypersad S.M., Treibel T.A., et al. Differential Myocyte Responses in Patients with Cardiac Transthyretin Amyloidosis and Light-Chain Amyloidosis: A Cardiac MR Imaging Study. Radiology 2015;277(2):388-397 https://doi.org/10.1148/radiol.2015141744
- O’Brien, A.T., Gil, K.E., Varghese, J. et al. T2 mapping in myocardial disease: a comprehensive review. J Cardiovasc Magn Reson. 2022 Jun 6;24(1):33. https://doi.org/10.1186/s12968-022-00866-0
- Kidoh M, Oda S, Nakaura T, et al. Myocardial Tissue Characterization by Combining Extracellular Volume Fraction and T2 Mapping. J Am Coll Cardiol Img. 2022 Apr;15(4):700-704. https://doi.org/10.1016/j.jcmg.2021.02.029
- Briasoulis A., Lama N., Rempakos A., et al. Diagnostic and Prognostic Value of Non-late Gadolinium Enhancement Cardiac Magnetic Resonance Parameters in Cardiac Amyloidosis. Current Problems in Cardiology. 2023 Apr;48(4):101573. https://doi.org/10.1016/j.cpcardiol.2022.101573
- Joy G., Christopher I. Kelly., The I., et al. Microstructural and Microvascular Phenotype of Sarcomere Mutation Carriers and Overt Hypertrophic Cardiomyopathy. Circulation. 2023;148:808-818 https://doi.org/10.1161CIRCULATIONAHA.123.063835
- Khalique Z., Ferreira P.F., Scott A.D., et al. Diffusion Tensor Cardiovascular Magnetic Resonance in Cardiac Amyloidosis. Circulation: Cardiovascular Imaging. 2020 May;13(5):e009901. https://doi.org/10.1161/CIRCIMAGING.119.009901
- Rajiah P.S., Kalisz K., Broncano J., et al. Myocardial Strain Evaluation with Cardiovascular MRI: Physics, Principles, and Clinical Applications. Radiographics. 2022 Jul-Aug;42(4):968-990. https://doi.org/10.1148/rg.210174
- Giusca, S., Steen, H., Montenbruck, M. et al. Multi-parametric assessment of left ventricular hypertrophy using late gadolinium enhancement, T1 mapping and strain-encoded cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2021 Jul 12;23(1):92. https://doi.org/10.1186/s12968-021-00775-8
- Korosoglou G, Giusca S, André F., et al. Diagnostic Work-Up of Cardiac Amyloidosis Using Cardiovascular Imaging: Current Standards and Practical Algorithms. Vasc Health Risk Manag. 2021;17:661-673. https://doi.org/10.2147/VHRM.S295376


