Амилоидогенез при нейродегенеративных заболеваниях: возрастная макулярная дегенерация и болезнь Альцгеймера
Автор: Ермилов В.В., Нестерова А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Обзорные статьи
Статья в выпуске: 2 (62), 2019 года.
Бесплатный доступ
Геронтоофтальмологические заболевания (возрастная макулярная дегенерация, псевдоэксфолиативный синдром, псевдоэксфолиативная глаукома, старческая катаракта) представляют одну из важнейших проблем современной офтальмологии. Между тем лечение этих заболеваний продолжает строиться в основном на эмпирической основе из-за отсутствия не только достоверных данных об их этиологии, но даже единого мнения о патогенезе. В данном обзоре представлены современные взгляды на общность этиопатогенетических и морфологических проявлений болезни Альцгеймера и болезней глаза, связанных с возрастом, в аспекте амило-идогенеза. Подобный подход является перспективной попыткой уточнить механизмы возникновения и развития нейродегенеративных заболеваний, их маркеры, новые перспективы в лечении.
Амилоидогенез, болезнь альцгеймера, возрастная макулярная дегенерация, амилоидоз глаза
Короткий адрес: https://sciup.org/142224323
IDR: 142224323 | УДК: 617.735
Текст научной статьи Амилоидогенез при нейродегенеративных заболеваниях: возрастная макулярная дегенерация и болезнь Альцгеймера
Демографические изменения, которые произошли в последние десятилетия, заставили все экономически развитые страны обратить более пристальное внимание на проблемы геронтологии и гериатрии. Согласно последним расчетам экспертов ООН, к настоящему времени доля людей старше 60 лет в экономически развитых странах составляет более 20 % [1]. Поэтому решение вопросов, связанных с возможностью продления периода трудоспособного возраста и поддержания качества жизни, занимает ведущее место в среде профессионалов различных медицинских специальностей. С этой точки зрения, невозможно переоценить значение функциональной состоятельности зрительного анализатора, особенно в старшей возрастной группе.
Причины возникновения слабовидения у пожилых лиц разнообразны, но одно из первых мест занимают дистрофические поражения сетчатой оболочки глаза, а именно возрастная макулярная дегенерация.
Возрастная макулярная дегенерация (ВМД) является ведущей причиной необратимого снижения центрального зрения, приводящей к слепоте, занимая третье место в структуре заболеваемости у пожилых больных после глаукомы и диабетической ретинопатии [2]. ВМД представляет собой дистрофический процесс в собственной сосудистой оболочке глаза – хориоидее, базальном комплексе или мембране Бруха (МБ) и в структурных элементах сетчатки с вовлечением фоторецепторов [3]. Одной из ведущих причин снижения центрального зрения при ВМД является накопление патологического белкового материала в МБ и субретинальном пространстве, что приводит к формированию друз [3, 6]. Результаты многочисленных гистохимических и иммуногистохимических исследований продемонстрировали присутствие патологического белка β-амилоида (Аβ) в друзах – морфологических спутниках ВМД [3, 8, 10]. Анализ современной отечественной и зарубежной литературы свидетельствует о нарастающем интересе к изучению локального старческого амилоидоза глаза и его связи с нейродегенеративными заболеваниями (НДЗ), в частности болезнью Альцгеймера (БА).
БА – нейродегенеративное заболевание, признанное сегодня одной из самых распространенных причин старческого слабоумия. От него страдает в среднем в мире 5 % пожилых людей в возрасте 65–80 лет и около 25 % в возрасте после 80 лет [10]. С увеличением продолжительности жизни количество больных БА в общей структуре возраст-ассоциированных заболеваний постоянно растет. Морфологическим субстратом БА является гибель нейронов. Как отмечают авторы многочисленных исследований, в основе гибели нейронов при болезни Альцгеймера лежат процессы образования сенильных бляшек, центральное место в которых занимают депозиты патологического белка Аβ, и образование внутриклеточных нейрофибрилляр-ных сплетений в результате гиперфосфорилирования тау-белка [4, 10].
Результаты большого количества молекулярно-биологических исследований последних десятилетий показали ведущую роль белков-предшественников амилоида в патогенезе возрастных заболеваний [4]. Формы НДЗ, в основе патогенеза которых лежат изменения структуры и/или нарушение метаболизма специфических белков, приводящие к их агрегации или формированию агрегатов патогенных пептидов с последующим образованием характерных белковых или пептидных отложений, в настоящее время предлагается классифицировать как про-теинопатии. В последнее время широкое распространение получила гипотеза, подтверждаемая результатами целого ряда исследований, согласно которой первичными цитотоксическими агентами при развитии прoтеинопатий являются нерастворимые олигомеры склонных к агрегации белков, одним из которых является Аβ [4].
ВМД и БА относятся к полиэтиологическим заболеваниям, которые связаны взаимодействием ряда факторов, включающих каскад реакций, в том числе и амилоидный, характеризующийся сложными нарушениями метаболизма в тканях головного мозга и сетчатки. Привлечение новейших методов исследования позволило выявить молекулярные механизмы, лежащие в основе патогенеза ВМД и БА. Авторами показано, что под влиянием окислительного стресса, химических модификаций, генетических мутаций и других факторов происходит переход нормального, но потенциально амилоидогенного белка из растворимой формы в патогенную, склонную к агрегации форму, которая образует олигомеры и протофибриллы [4, 8]. Из них на заключительном этапе образуются зрелые фибриллы, формирующие белковые отложения как внутри клеток, так и за их пределами с формированием бета-амилоидных бляшек в структурах головного мозга при БА и друз в межклеточном пространстве в структурах гематорети-нального барьера при ВМД [4, 8].
В работах последних лет, посвященных изучению БА, высказано предположение, что сетчатка, имея много общего с мозгом (эмбриональное происхождение, анатомические особенности, физиологические характеристики), может служить легко доступным и неинвазивным методом изучения патологии, имеющей место в головном мозге [3, 10]. К настоящему времени увеличилось количество данных, свидетельствующих о том, что морфологические признаки БА обнаруживаются как в головном мозге больных БА, так и в сетчатке больных БА и животных трансгенных моделей БА [10]. В связи с этим особый интерес представляет изучение сочетания церебрального амилоидоза при БА и старческого локального амилоидоза глаза при ВМД.
С помощью селективных методов выявления амилоида и его типов нами было исследовано 336 глаз и головной мозг, взятый у 171 трупа. В работе использован количественный метод оценки свечения амилоид-положительных структур глаза и головного мозга, для чего применяли фотометрическую насадку ФМЭЛ-1А. Оценку свечения окрашенных тиофлавином-Т препаратов проводили в условных единицах по методу Г. Г. Автандилова. Сочетанная локальная форма амилоидоза глаза встретилась в 60,5 % наблюдений. При сочетании ВМД и БА у женщин амилоид обнаружился в возрасте на 10 лет раньше и в 2 раза чаще, чем у мужчин. Анализ полученных данных показал, что по мере старения возрастает частота сочетанного старческого амилоидоза глаза и головного мозга. Результаты проведенного нами исследования позволили сделать вывод, что сочетание локальных форм амилоидоза характеризуется содружественным отложением Аβ в сосудах и веществе головного мозга, а также в сосудах хориоидеи и структурных элементах заднего отдела глаза с типичными для локальных форм старческого амилоидоза иммуногистохимическими характеристиками. При этом интенсивность свечения амилоидных отложений в сосудах головного мозга была более выражена, чем в сосудах хориоидеи. Необходимо подчеркнуть, что отложения Аβ локализовались в сосудах всех слоев хориоидеи, однако в сосудах хориока-пиллярной пластинки встречались чаще и были более интенсивными. Обнаружено, что процент больных со старческим локальным амилоидозом глаза наиболее высок у пациентов с БА. Результаты проведенного исследования продемонстрировали несомненную, на наш взгляд, общность этиопатогенетических и морфологических проявлений БA и ВМД.
Учитывая общность метаболизма АРР при ВМД и БА, который может протекать по амилоидогенному и неамилоидогенному пути, мы в своем исследовании сочли возможным предположить следующий механизм развития β-амилоидопатии и нейродегенерации при ВМД (см. рис.).
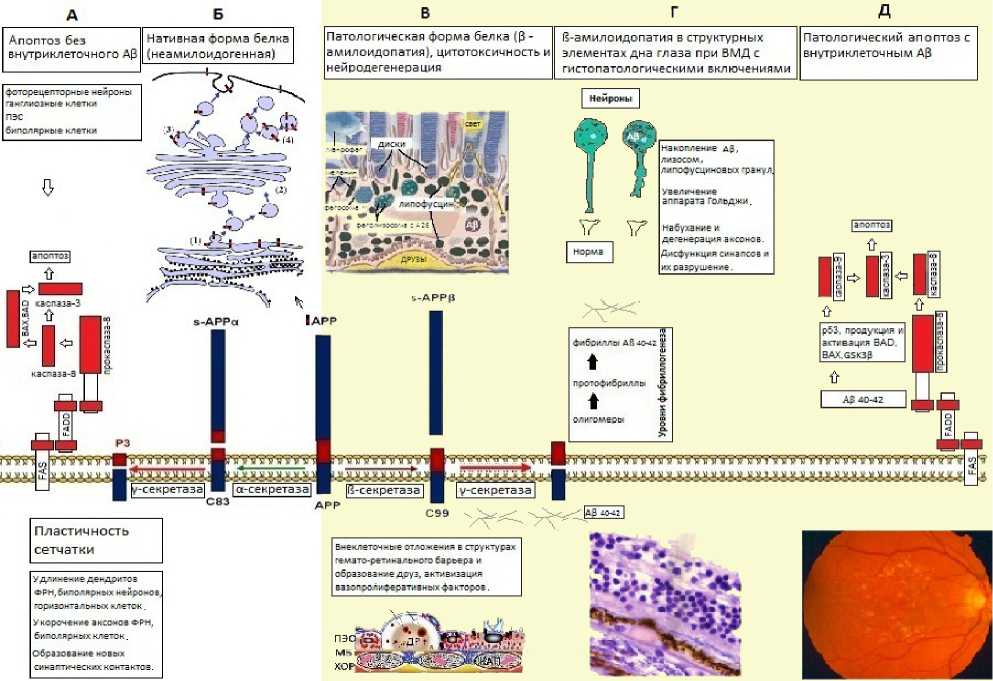
Рис. Развитие β-амилоидопатии при возрастной макулярной дегенерации:
А, Б – неамилоидогенный метаболизм АРР. FAS (first apoptotic signal) – трансмембранный белок, взаимодействующий с FAS-лигандом; FADD (Fas-associated death domain) – белок-адаптер, вызывающий активацию прокаспазы-8; BAD (Bcl-2-associated death promoter), BAX (Bcl-2-associated X protein) – белки митохондриального сигнального пути апоптоза; ФРН – фоторецепторные нейроны; 1 – ЭПС (эндоплазматическая сеть), 2 – аппарат Гольджи, 3 – лизосомы. 4 – эндосомы; sAPPα, P3, C83 – продукты неамилоидогенного расщепления АРР. В, Г, Д – амилоидогенный метаболизм АРР с патологическим апоптозом. МБ – мембрана Бруха, ХОР – хориоидея, ДР – друза, КАП – капилляры хориоидеи; sAPPβ, С99, Аβ40-42 – продукты амилоидогенного расщепления АРР; GSK3β (glucogen synthase kinase-3) – регуляторный белок, участвующий в активации р53; р53 – транскрипционный фактор, регулирующий активацию генов-активаторов апоптоза
В нормально стареющей и обладающей высокой степенью пластичности сетчатке [12] рецептор-опосредованному апоптозу подвергаются фоторецепторные нейроны, ганглиозные клетки и клетки ПЭС (см. рис. А). В результате взаимодействия Fas-лиганда и Fas-рецептора сигнал, идущий от мембраны, вызывает превращение неактивной прокаспазы-8 в её активную форму, которая, в свою очередь, активирует каспазу-3, а также инициирует митохондриальный сигнальный путь апоптоза.
Трансмембранный белок APP в норме присутствует во многих клетках, включая ПЭС, нейроны сетчатки и головного мозга (см. рис. Б).
Внутриклеточно АРР локализуется в аппарате Гольджи, эндоплазматической сети, лизосомах, эндосомах, ядерной оболочке, а также в клеточной мембране. Неамилоидогенный метаболический путь включает последовательное воздействие α- и γ-секретаз на АРР с образованием s-APPα, P3 и AICD (APP intracellular domain), участвующих в адекватном клеточном обмене.
В стареющем организме под влиянием факторов риска (см. рис. В) в клетках ПЭС и нейронах сетчатки снижается активность про-теосомно-лизосомальной системы, увеличивается количество фаголизосом, эндосом, гранул липофусцина. С возрастом в клетках ПЭС уменьшается количество меланиновых гранул и накапливаются фаголизосомы с высокотоксичными А2Е (бис-ретинилиден-этаноламин), изо А2Е и их окисленными эпоксиформами. Указанные внутриклеточные изменения вызывают развитие окислительного стресса и цитотоксичности.
В таких условиях метаболизм АРР протекает с участием β- и γ-секретаз, которые отделяют от APP склонные к β-кросстрансформации и фибриллогенезу полипептиды Аβ40 и Аβ42.
Этот процесс приводит к образованию олигомерных, префибриллярных и в конечном счете нерастворимых фибриллярных форм Аβ, откладывающихся в виде гистопатологических включений как внутриклеточно, так и внекле-точно (см. рис. Г). Амилоидогенный процессинг АРР заканчивается отложением Аβ в сетчатке, в материале друз, в структурах гематорети-нального барьера: мембране Бруха, сосудах хориоидеи (амилоидная ангиопатия). Внутриклеточный Аβ стимулирует аутофагию и способствует увеличению структурных компонентов аппарата Гольджи, количества лизосом и эндосом. Отложения внутриклеточного Аβ вызывают набухание и дегенерацию аксонов, дисфункцию синапсов и их разрушение.
Цитотоксический эффект внутриклеточного Аβ связан с его способностью активировать основной белок-«диспетчер» апоптоза – р53 (см. рис. Д), который, в свою очередь, напрямую инициирует каспазный каскад, а также ре-цептор-зависимый и митохондриальный сигнальные пути апоптотической гибели клеток.
Подобный механизм развития β-амилоидо-патии при ВМД, на наш взгляд, является вполне оправданным и учитывает современные представления о внутриклеточной патологии белков и механизмах клеточной гибели, основанные на достижениях молекулярной биологии [4–7, 9, 11, 13]. Таким образом, анализ новых обобщенных данных, полученных за последние годы в области изучения механизмов развития БА и ВМД, а также результаты наших собственных исследований позволяют выделить общее звено патогенеза в развитии этих заболеваний. Обнаружение сходных молекулярных механизмов патогенеза ВМД и БА, а также других НДЗ, включающих процессы патологической агрегации белков, формирования нерастворимых фибриллярных структур и депонирования их в виде гистопатологических включений в тканях мозга и заднего отдела глаза диктует целесообразность выделения группы заболеваний, характеризующихся наличием белковой патологии – протеинопатии. И при ВМД, и при БА лейтмотивом является агрегация нерастворимого протеина – Аβ, что позволяет, на наш взгляд, тракто- вать ВМД как протеинопатию, хотя работ, освещающих данное геронтоофтальмологическое заболевание в подобном контексте практически нет. Очевидно, что такой взгляд на проблему создает предпосылки для новых стратегий по созданию нейропротекторных и офтальмогериат-рических препаратов нового поколения.
Список литературы Амилоидогенез при нейродегенеративных заболеваниях: возрастная макулярная дегенерация и болезнь Альцгеймера
- Анисимов, В. Н. Эволюция концепций в геронтологии / В. Н. Анисимов, М. В. Соловьев. - СПб: Эскулап, 1999. - 130 с.
- Егоров, Е. А. Современные аспекты патогенеза, диагностики клиники и лечения возрастной макулярной дегенерации / Е. А. Егоров, И. А. Романенко // Офтальмология. - 2009. - Т. 6, № 1. - С. 97-103.
- Болезнь Альцгеймера и геронтоофтальмологические заболевания в аспекте амилоидогенеза / В. В. Ермилов [и др.] // Архив патологии. - 2013 -№ 2 - С. 37-42.
- Протеинопатии - формы нейродегенеративных заболеваний, в основе которых лежит патологическая агрегация белков / Т. А. Шелковникова [и др.] // Молекулярная билогия. - 2012.- Т. 46, № 3. - С. 402 - 415.
- Association of AMD-like retinopathy development with an Alzheimer's disease metabolic pathway in OXYS rats / O. S. Kozhevnikova // Biogerontology. - 2013. - № 14 (6). - Р. 753-762.
- Beta-amyloid deposition and functional impairment in the retina of the APPswe/PS1DeltaE9 transgenic mouse model of Alzheimer's disease / S. E. Perez [et al.] // Investigative Ophthalmology & Visual Science. - 2009. - № 50 (2). - Р. 793-800.
- Drusen proteome analysis: an approach to the etiology of age-related macular degeneration / J. W. Crabb [et al.] // Proc Natl Acad Sci U S A. - 2002. -№ 99. - Р. 14682-14687.
- Ermilov, V. The role of retinal pigment epithelium cells in amyloidogenesis of senile local eye amyloidosis with age-related macular degeneration 23rd European Congress of Pathology. 27 August -1 September 2011. Helsinki / V. Ermilov, O. Makhonina // Virchow's Arch. - 2011, - № 459 (Suppl. 1). - S1-S329, P. 190.
- Kayed, R. Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis / R. Kayed, E. Head, J. E. Thompson // Science. - 2003. - № 300 (5618). - Р. 486-489.
- Ocular manifestations of Alzheimer's disease in animal models / M. Parnell // Int. J. Alzheimers Dis. -2012. - Vol. 39. - P. 187 - 204.
- Ostrovskij M. A. Molecular mechanisms of the damaging effect of light on the structure of the eye and the system of protection against such damage / M. A. Ostrovskij // Success of biological chemistry. - 2005. - № 45. - Р. 173-204.
- Picken, M. M. Amyloid and Related Disorders / M. M. Picken, A. D. Guillermo, A. Herrera // Berlin: Springer Science+Business Media, LLC. - 2012. - 419 p.
- Zhang C. Ajzheimer's Disease-Related Amyloidopathy in Visual Impairment / C. Zhang // J. Addict Res Ther. - 2012. - S5.


