Анаэробный рост бактерий на метане с Fe (III) восстановлением, как электрон-акцептирующим процессом
Автор: Потехина Ж.С., Шерышева Н.Г., Бычек-гущина И.А., Готтшалк Г.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 2 т.2, 2000 года.
Бесплатный доступ
Метанокисляющие и Fe(III) восстанавливающие бактерии были выделены из анаэробных осадков реки Волги и горячих источников Камчатки. Увеличение титра клеток при культивировании в анаэробной среде сопровождалось продукцией Fe(II) в присутствии и отсутствии метана, но рост был более интенсивным, когда метан вводили в газовую фазу. Рост бактерий на оксигидроксиде сопровождался образованием черного осадка. На Fe(III) пирофосфате цвет раствора изменялся от желтого до темно-зеленого с последующим осветлением среды и фо рмированием белого осадка (вивианита). Изменения в соотношении фосфолипидов в фосфолипидной фракции бактерий выявлено в зависимости от культивирования в аэробных и анаэробных условиях.
Короткий адрес: https://sciup.org/148197615
IDR: 148197615
Текст научной статьи Анаэробный рост бактерий на метане с Fe (III) восстановлением, как электрон-акцептирующим процессом
Институт экологии Волжского бассейна РАН, г. Тольятти
2Институт микробиологии и генетики Геттингентского университета, Германия
Метанокисляющие и Fe(III) восстанавливающие бактерии были выделены из анаэробных осадков реки Волги и горячих источников Камчатки. Увеличение титра клеток при культивировании в анаэробной среде сопровождалось продукцией Fe(II) в присутствии и отсутствии метана, но рост был более интенсивным, когда метан вводили в газовую фазу. Рост бактерий на оксигидроксиде сопровождался образованием черного осадка. На Fe(III) пирофосфате цвет раствора изменялся от желтого до темно-зеленого с последующим осветлением среды и формированием белого осадка (вивианита). Изменения в соотношении фосфолипидов в фосфолипидной фракции бактерий выявлено в зависимости от культивирования в аэробных и анаэробных условиях.
В глубочайших слоях почв и вод, особенно в илах и придонных осадках кислород становится лимитирующим фактором, и огромное количество бактерий участвует в анаэробном разложении органического материала. Эти процессы ведут к образованию СО2 и СН4. Приблизительно один биллион тонн метана производится бактериями ежегодно. Большая часть метана окисляется бактериями, но около двух сотен миллионов тонн освобождается в атмосферу, что способствует разрушению озонового слоя. Биологическое окисление метана в анаэробных пресноводных, морских и гиперсоленых системах и анаэробных осадках является неоспоримым фактом, что демонстрировалось многочисленными исследованиями. Этот процесс чрезвычайно важен в контроле в атмосферу потоков метана, образующегося в экосистемах. Известно, что основная часть метана, образующегося при разложении органического вещества, связывается биологически в анаэробных условиях. Следовательно, микроорганизмы анаэробных сообществ являются мощным барьером в эмиссии метана в атмосферу. Проблема снижения потока метана в атмосферу требует изучения механизмов анаэробного связывания метана в водных и наземных экосистемах и, прежде всего, выявления ответственных за этот процесс микроорганизмов. Однако анаэробное биологи ческое окисление метана остается мало изученным метаболическим процессом. Организмы, осуществляющие связывание метана, до сих пор не идентифицированы, также не много известно о природе акцепторов электронов, вовлеченных в этот процесс. Цендер и Брок [1] высказали гипотезу, что сообщества, включающие метаногенные архибактерии могут быть ответственны за окисление метана в анаэробных экосистемах. Однако результаты, полученные в экспериментах по ингибированию метаногенов, показали, что анаэробное окисление метана связано с организмами, отличными от метаногенов а также сульфатредукторов [2]. Согласно Альпери-ну, электрон-акцептор, используемый организмами, окисляющими метан анаэробно, должен присутствовать в зоне окисления метана и продуцировать отрицательное изменение свободной энергии в реакции с метаном. Такими возможными акцепторами электронов являются оксиды железа, оксиды марганца и S(0), восстанавливающиеся до S(IV). Это означает, что анаэробное окисление метана может осуществляться либо организмами, использующими оксиды металлов, либо восстанавливающими серосодержащие компоненты как акцепторы электронов. Недавно было высказано предположение, что анаэробное окисление метана связано с метаболическим шунтом метаногенов, продуциру- ющих С02 и Н2 из метана [3], что термодинамически возможно, если парциальное давление Н2 держать низким с помощью ^-потребляющих сульфатредуцирующих бактерий.
Было высказано предположение, исходя из известных данных об энергетической выгодности реакций восстановления окисленных соединений железа и из расчета, что при восстановлении окисленного железа одним молем метана выделяется энергия в -425,76 кДж в реакции:
CH4+8Fe3++3H2O 8Fe2+ + HCO-3 + 9H+, что такой процесс in situ могут осуществлять метанокисляющие бактерии, используя соединения трехвалентного железа как акцепторы электронов [4].
Важность микробиологических процессов, связанных с восстановлением Fe(III) и Mn (IV) соединений в природных экосистемах демонстрировалась в работах Лавли и др. [5-8]. Было показано, что Fe(III) восстановление функционирует как последняя ступень в анаэробной деградации органической материи. Показано, что Fe(III) - один из наиболее важных потенциальных акцепторов электронов в затопляемых почвах (9) и многих водных осадках [10]. Энзимы Fe(III) восстановителей катализируют процессы восстановления в не содержащих сульфиды анаэробных экосистемах [7]. Известно большое количество филогенетически разнообразных микроорганизмов, способных к анаэробному окислению органических и неорганических веществ, использующих Fe(III) соединения в качестве акцепторов электронов. Aerobacter sp., Bacillus circulans, Bacillus polymyxa окисляют сахара [11], Geobacter metallireducens - ароматические углеводороды и органические кислоты [12], Pseudomonas sp.- Н 2 [13], штаммы рода Pelobacter - спирты (14,15). Метанол окислялся в сокультуре Shewanella putrefaciens и Clostridium sphenoides [16].
Данные ряда исследований [4,17,18] подтверждают гипотезу использования энергии Fe (III) восстановления в анаэробном окислении метана.
Способность к долговременному существованию двух коллекционных штаммов метанотрофных бактерий Methylomonas methanica и Methylomonas clara, известных как "строгие" аэробы была сообщена в работе [18]. Анаэробную питательную среду готовили с 100 мМ Fe(III) оксигидроксидом как предполагаемым акцепетором электронов. 20% метана вводили в газовую фазу, замещением азота. От 8-до 12% метана потребилось бактериями. Этот метаболизм обеспечил энергию поддержания бактерий в течение более чем двух лет.
В представленной работе мы изучали способность бактерий, выделенных из анаэробных осадков реки Волги, гейзеров Камчатки и музейных штаммов, использовать ряд Fe(III) соединений, как электрон-акцепторов в анаэробных условиях. Метан, единственный донор электронов, вводился в газовую фазу. Железовосстанавливающий штаммы рода Shewanella также исследовались в чистой культуре и в ассоциациях с метанотрофа-ми и Clostridium sp.
Известно, что группа метанотрофных бактерий имеет ряд биохимических и физиологических особенностей и характеризуется наличием комплекса сложных цитоплазматических мембран. Фосфолипиды являются важнейшим компонентом мембран и выполняют важную роль в их структуре и функции. Фосфолипиды и жирные кислоты регулируют активность многих связанных с мембранами ферментов [19]. Изменение в составе мембранных липидов, как было сообщено, является важной реакцией организма на стресс [20]. Данные по индивидуальному фосфолипидному составу являются таксономически значимыми. В то же время вариабельность содержания отдельных фосфолипидов внутри фосфолипидного пула бактерий зависит от многих параметров таких как температура, рН, состав среды, в том числе и от условий культивирования. Мы провели сравнительные исследования фосфолипидного состава штамма NT-1 в аэробных и анаэробных условиях существования бактерий.
Материалы и методы
Инокулюм для накопительных культур получен из образцов анаэробных осадков реки Волги. 5 мл каждого осадка суспендировали в 250 мл анаэробной основной сре- ды в стеклянных бутылках и поставлялись в лабораторию. Среда содержала (в г/л дистиллированной воды): KNO3-1; MgSO4x 7H2O-0,2; CaCl2-0,02; Na2HPO4 x12H2O-1;5; KH2PO4-0,7 (мг/л); EDTA-5;FeSO4x 7H2O-2; ZnSO4x 7H2O-0,1; MgCl2 x 4H2O-0,003; CoCl2 x 6H2O-0,2; CuCl2 x 5H2O-0,2; NiCl2 x 6H2O-0,02; Na2MoO4-0,03; H3BO3-0,3. Аморфный оксигидроксид Fe(III) железа (в конечной концентрации приблизительно 100 мМ) был добавлен в среду. Газовая фаза над накопительной культурой состояла из CH4:CO2:N2 в соотношении 40:10:50. Инкубировали при 300 С в темноте. Четыре чистые культуры были получены. Колонии образуются на агаровыx косякаx в течение 4-x дней. Колонии были розовые, бежевые и желтые.
Стандартная анаэробная теxника использовалась в приготовлении среды и даль-нейшиx исследованияx. После добавления резазурина среда кипятилась и немедленно оxлаждалась в потоке азота. Затем разливалась по 50 мл в 120 мл бутылки и продувалась азотом. Бутылки закрывали резиновыми пробками и алюминиевыми колпачками и автоклавировали при 121 0 С, 20 мин. 20мМ Fe(III) пирофосфат добавлялся в среду до автоклавирования, 20мМ цитрат - после автоклавирования из стерильного раствора, 100 мМ оксигидроксид - после отмывания в стерильной дистиллированной воде.
Использование метана как донора электронов изучалось сравнением роста численности бактерий и продукции Fe(II) при введении 20% метана в газовую фазу и без метана (контроль). Эксперименты выполнялись в двуx повторностяx.
Инокулят (10%) был добавлен из культуры, растущей на основной среде с метаном и Fe(III) оксигидроксидом.
В работе использовали штаммы Nr-1 Nr-2, выделенные из накопительной культуры метанотрофныx бактерий анаэробныx осадков реки Волги, К-2, ПД12 , выделенные из гидротерм Камчатки. Штамм Shewanella putrefaciens DSM 9461 был получен из немецкой коллекции микроорганизмов, Shewanella sp. выделен из почв. Штамм Methylomonas methanica 12, получен из Всесоюзной коллекции микроорганизмов.
Среда для культивирования бактерий содержала (г/л): пирофосфат Fe(III) -10; NaH 2 PO 4 - 0,6; NH 4 C1 - 1,5; MgSO 4 x 7H 2 O -0,1; MgCl2 x 6H 2 O -0,1; KCl - 0,1; Na 2 MoO 4 x 2H 2 O -0,001; витаминов раствор (21) - 10 мл; микроэлементов (22) - 3 мл; рН 7,0 -7,5.
Среда с добавлением резазурина кипятилась и дезаэрировалась потоком 100% N 2 затем разливалась с помощью газонепрони-цаемыx шприцов в заранее простерилизован-ные анаэробные пробирки. Предварительно продутая потоком азота бактериальная суспензия вводилась в пробирки с анаэробной средой из расчета 0,2 мл инокулята на 2 мл среды, остаточный O 2 связывали цистеином. 12% азота из газовой фазы каждой пробирки замещали таким же количеством смеси метана и СО 2 , в соотношении 90:10 .
Культивирование бактерий осуществляли при ТО 30ОС в стационарныx условияx и после 10 суток с перемешиванием среды на качалкаx.
Аналитическая техника
Fe(III) восстановление определялось измерением продукции Fe(II) в течение эксперимента. Количество Fe(II) растворенного после 15 мин. в 0,5 N HCl определялось с фер-розином [23].
Концентрация метана измерялась xро-матографически, на газовом xроматографе, модель 437А. Использовалась колонка с по-ропаком QS Milpore Corporation. Длина колонки 1,5 m, расxод газа 25 мл/мин. При Т0 пламенного ионизационного детектора 1100 С.
Количество метана определяли на интеграторе С1-100, используя внутренний стандарт 10% метан.
Число клеток определяли микроскопированием, прямым счетом в камере Горяева.
Клетки из 250 мл суспензии отделяли центрифугированием. Липиды экстрагировали по методу Блайда и Дайера [24]. Фосфолипиды разделяли на фракции на силикаге-левыx пластинкаx размером 60x60 мм с закрепленным слоем методом двумерной тонкослойной xроматографии в следующиx сис-темаx растворителей: xлороформ-метанол-бензол-ацетон-27% NH4OH (65:30:10:6) и
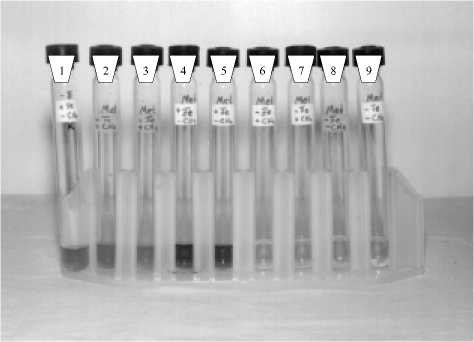
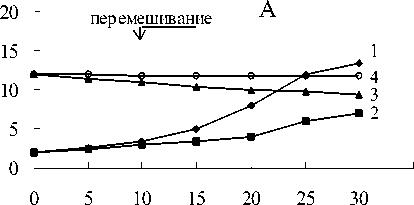
Рис. 1. Восстановление Fe(III) пирофосфата штаммом Methylomonas methanica:
1 - контроль без бактерий + Fe(III) - СН 4 ;
2,3 - бактерии + Fe(III) + СН 4, 4,5 - бактерии + Fe(III) - СН4; 6,7 - бактерии - Fe(III) + СН 4, 8,9 - бактерии - Fe(III) - СН 4
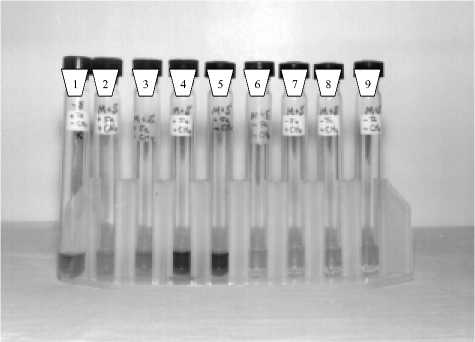
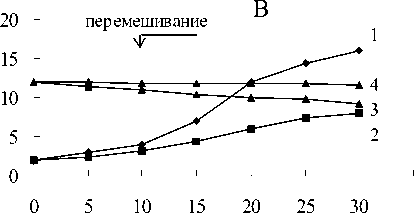
Рис. 3. Восстановление Fe(III) пирофосфата штаммами M. Methanica и Sh. putrefaciens: 1 - контроль без бактерий + Fe(III) + СН 4 ;
2,3 - бактерии + Fe(III) + СН 4, 4,5 - бактерии +Fe(III) + СН4; 6,7 - бактерии - Fe(III) + СН 4 ;
8,9 - бактерии - Fe(III) - СН 4
хлороформ-метанол-бензол-НСО 2 Н -H 2 O (70:30:10:5:4:1). Метод Васьковского использовали для количественного определения фосфолипидов [25].
Результаты
Выявлены общие, характерные для всех изучаемых чистых штаммов, особенности роста и продукции Fe(II) в условиях эксперимента.
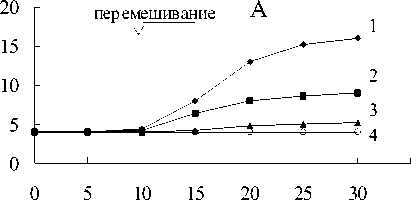
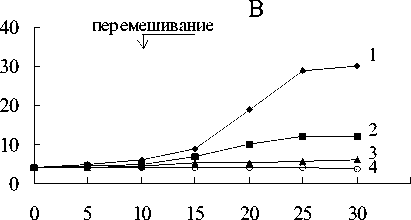
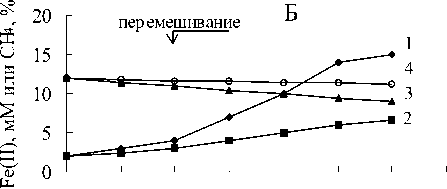
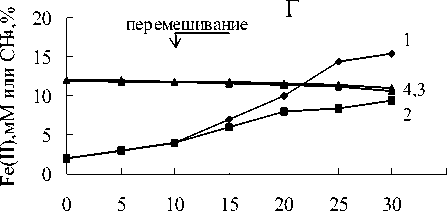
В средах с пирофосфатом железа и метаном в газовой фазе регистрировалось Fe(III) восстановление по изменению цвета среды с соломенно-желтого до темно-зеленого с последующим осветлением среды и образованием белого осадка (рис.1-4). Fe(III) пирофосфат полностью восстановился и около 25% начальной концентрации метана окислилось метанотрофами (рис.5).
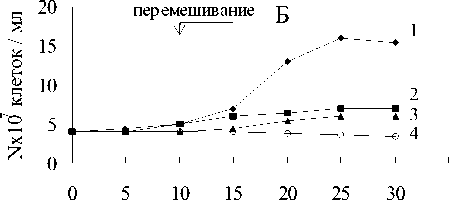
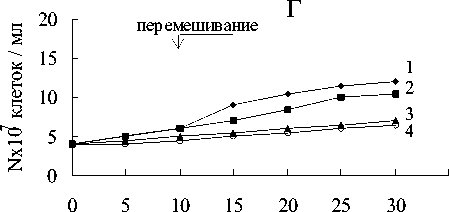
Титр клеток увеличился с 4х107 клеток/ мл до 12-30х107 клеток/мл (рис.6). Белый осадок восстановленного железа включал кристаллы вивианита (рис.7).
В вариантах с пирофосфатом железа и без метана в газовой фазе цвет среды изменялся с соломенно-желтого до темно-зеленого (рис.1-4). Химическими анализами регистрировалось 40 -60% восстановления пирофос-
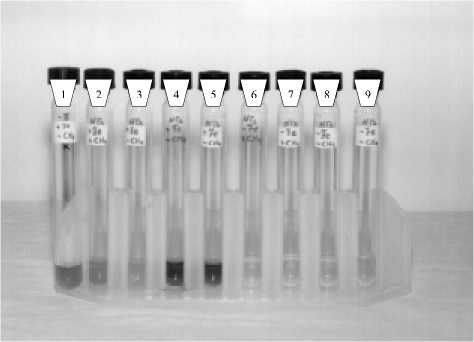
Рис. 2. Восстановление Fe(III) пирофосфата штаммом NF-2:
1 - контроль без бактерий +Fe(III) - СН 4 ;
2,3 - бактерии + Fe(III) + СН 4 ;
4,5 - бактерии + Fe(III) - СН 4 ;6,7 - бактерии -Fe(III) + СН4; 8,9 - бактерии - Fe(III) - СН 4
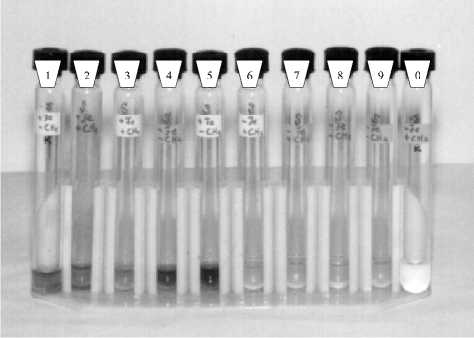
Рис. 4. Восстановление Fe(III) пирофосфата штаммом Shewanella putrefaciens: 1 - контроль без бактерий + Fe(III) + СН 4 ; 2,3 - бактерии + Fe(III) + СН 4 ; 4,5 - бактерии + Fe(III) - СН4, 6,7 - бактерии -Fe(III) + СН4; 8,9 - бактерии - Fe(III) - СНу 0 -контроль без бактерий - Fe(III) + СН 4
Nx1( 7 клеток / мл Nx1( 7 клеток / мл Fe(II), мМ или CH i ,% Fe(II), мМ или CIh, %
сутки
сутки
Рис. 5. Продукция Fe(II) и потребление метана штаммами:
А - M. methanica, Б - NF-2, В - К-2, Г - Sh. putrefaciens:
1 - Fe(II) на среде с метаном; 2 - Fe(II) на среде без метана;
3 - метан на среде с Fe(III) пирофосфатом; 4 - метан на среде без Fe(III) пирофосфата
сутки
сутки
0 5 10 15 20 25 30
сутки
сутки
сутки
сутки
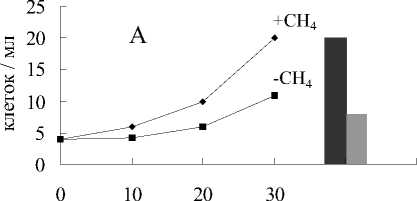
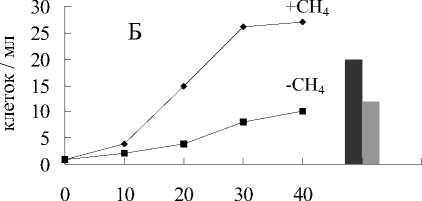
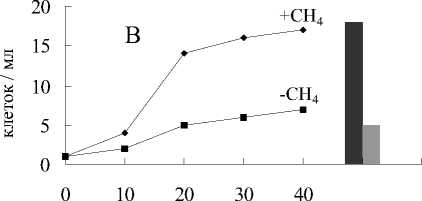
Рис. 6. Анаэробный рост бактерий: А - M.methanica, Б - Nr—2, В - К-2, Г - Sh. putrefaciens:
1 - титр клеток в среде с Fe(III) пирофосфатом и метаном; 2 - титр клеток и среде без Fe(III) пирофосфата с метаном; 3 - титр клеток в среде с Fe(III) пирофосфатом без метана;
4 - титр клеток в среде без Fe(III) пирофосфата и метана

а)

б)

в)

г)
д)
Рис. 7. Кристаллы вивианита, образовавшиеся в присутствии метана в газовой фазе при восстановлении Fe(III) пирофосфата штаммами: а - M.methanica; в - ИГ-2;дД- К-2.
Восстановление Fe(III) пирофосфата без метана в газовой фазе: б - M. Methanica; г - ИГ-2; е - К-2
е)
фата (рис.5) и наблюдался существенно меньший прирост численности клеток (рис.6).
В средах без пирофосфата железа, но с метаном в газовой фазе окислилось около 3% метана (рис.5), прирост биомассы был незначительный (рис.6).
В средах без пирофосфата железа и без метана не происходило никакого увеличения численности клеток (рис.6). В отсутствие бактерий в среде (контроль) не наблюдалось изменения цвета среды, восстановления пирофосфата, и окисления метана.
Штамм NT-1 рос, окисляя 20-25 % метана от начальной концентрации и восстанавливая все три Fe(III) соединения (рис.8). Увеличение титра клеток коррелировало с продукцией Fe(II), рост титра клеток был более интенсивным на всех Fe(III) соединениях, когда газовая фаза содержала метан. Не было значительного окисления метана, однако были существенные отличия в продукции Fe(II): до 20 мМ при культивировании с метаном и 810 мМ в вариантах без метана.
Рост бактерий на оксигидроксиде сопровождался формированием черного осадка. На пирофосфате происходило изменение цвета среды от соломенно-желтого до зеленого с последующим осветлением надосадочной жидкости и формированием белого осадка восстановленного железа при культивировании с метаном. В вариантах без метана цвет изменялся с соломенно-желтого до темно-зеленого.
В фосфолипидной фракции бактерий штамма NT-1 были найдены следующие компоненты: фосфотидилхолин(ФХ), фосфотиди-лэтаноламин(ФЭА), фосфатидилглицерин (ФГ), дифосфатидилглицерин ( ДФГ), фосфа-тидилсеринх (ФС) и неидентифицированный Х-липид (табл.1). Количественное соотношение фосфолипидов во фракции значительно варьировалось в зависимости от условий культивирования штамма. Так, культивирование в анаэробной среде сопровождалось возрастанием содержания ДФГ, ФХ, ФГ и х-
сутки
сутки
сутки
Рис. 8. Продукция Fe(II) и бактериальный рост штамма ИГ-1 на среде с Fe(III) пирофосфатом - А, гидроксидом железа - Б и цитратом железа В
Таблица1. Соотношение фосфолипидов штамма NP-1 в аэробной и анаэробной культуре
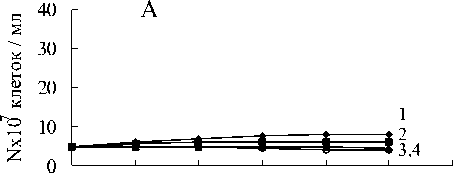
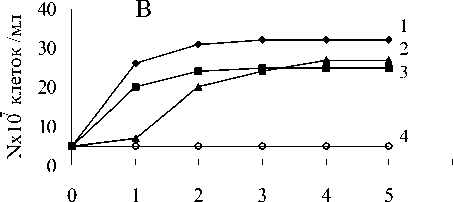
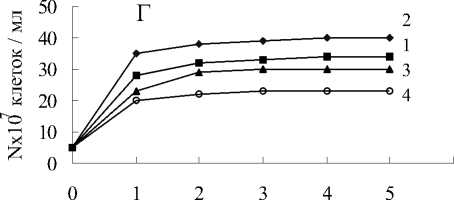
Штаммы ПД12 и Clostridium sp. не росли на метане в анаэробных условиях (рис.9).
Однако, при совместном культивировании прирост численности бактерий составил 25х107 клеток в мл среды на метане и пирофосфате, 19х107 клеток в мл на пирофосфате без метана и столько же на метане без пирофосфата уже за первые сутки культивирования. Рост титра бактерий в среде без метана и без Fe(III) пирофосфата не наблюдался. Существенно вырос титр клеток Shewanella sp. в сокультуре с Clostridium sp. (рис.9). Интересным является факт, что в данном случае, в отличие от сокультуры Clostridium sp. с мета-нотрофом ПД-12, констатирован примерно одинаковый прирост численности клеток в средах содержащих и не содержащих метан и пирофосфат железа.
Обсуждение и выводы
Исследование метанотрофных бактерий, выделенных из анаэробных осадков, очень важно для выяснения механизма окисления
0 1 2 3 4 5
сутки
Б
1-4
0 1 2 3 4 5
сутки
сутки
Рис. 9. Анаэробный рост бактерий: А-ПД-12;
Б - Clostridium sp., В - ПД-12 и Clostridium sp.; Г - Clostridium sp. и Shewanella sp.:
1 - титр клеток в среде с Fe(III) пирофосфатом и метаном;
2 - титр клеток в среде с Fe(III) пирофосфатом без метана;
3 - титр клеток в среде без Fe(III) пирофосфата с метаном;
4 - титр клеток в среде без Fe(III) пирофосфата без метана
сутки
и ассииляции С1-соединений в экосистемах.
Исследования, проведенные на чистых штаммах метанотрофных бактерий, показали полное восстановление Fe(III) соединений в среде, с продукцией 15 -20мМ Fe(II), сопровождающееся ростом численности бактерий и окислением метана в газовой фазе. Следовательно, бактерии получают энергию для поддержания и роста из диссимиляционной Fe(III) редукции, и могут использовать в дыхательном метаболизме не только 0 2 но и Fe(III) соединения. Существование бактерий в бескислородных условиях было связано с восстановлением Fe(III) соединений и снижением содержания метана в газовой фазе. Доказательством того, что энергия, освобождающаяся при окислении метана, используется микроорганизмами в конструктивном метаболизме является то, что больше бактериальных клеток синтезируется, если метан добавлен. Результаты, полученные на штаммах, выделенных из Волги, являются свидетельством биологического анаэробного связанного с Fe(III) редукцией окисления метана, образующегося при метаногенезе в анаэробных осадках реки.
Не регистрировалось потребление метана железовосстанавливающим штаммом Shewanella putrefaciens и не установлено какой субстрат использовали бактерии в качестве донора электронов.
Необходимо отметить, что процесс окисления метана чистыми культурами в лабораторных условиях слабый и требует длительного контакта жидкой и газообразной фазы при интенсивном перемешивании и оптимальной температуре. Такие условия маловероятны в природных экосистемах. Совместное культивирование бактерий в ассоциациях привело к интенсивному росту бактерий ПД12 и Clostridium, Shewanella sp. и Clostridium sp. Повидимому, значительное окисление метана в анаэробных природных экосистемах можно обьяснить тем, что процесс осуществляется в сообществах микроорганизмов со сложными синтрофными взаимосвязями, где важной составляющей являются адаптированные к анаэробиозу и способные не только окислять метан но и восстанавливать Fe(III) соединения, метанотрофные бактерии.
Мы обнаружили существенное увеличение количества ДФГ в фосфолипидной фракции в анаэробной культуре. Известно, что ДФГ локализуется исключительно на внутренних мембранах митохондрий эукариот и играет важную роль в организации и функционировании электрон-транспортной цепи. Его роль в мембранах прокариот менее ясна. Можно предположить, что ДФГ участвует в перестройке мембран и реорганизации электрон-транспортной цепи, связанной с адаптацией бактерий к существованию в бескислородных условиях.


