Аналитические особенности количественного определения производных бензимидазола методом высокоэффективной жидкостной хроматографии
Автор: Смирнова Л.А., Спасов А.А., Ращенко А.И., Сучков Е.А., Рябуха А.Ф., Кузнецов К.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 2 (38), 2013 года.
Бесплатный доступ
Проведен анализ существующих хроматографических методов анализа производных бензимидазола и имидазобензимидазола в биологических пробах. Определены особенности подбора условий экстракции и хроматографирования, обеспечивающие оптимальные валидационные характеристики.
Вэжх, количественное определение, бензимидазолы, имидазобензимидазолы
Короткий адрес: https://sciup.org/142149045
IDR: 142149045 | УДК: 651:547.785.5
Текст научной статьи Аналитические особенности количественного определения производных бензимидазола методом высокоэффективной жидкостной хроматографии
В медицинской практике широко используются лекарственные препараты на основе бензимидазола, проявляющие различную фармакологическую активность (дибазол, омепразол, пимозид, мебендазол, бемитил, этомерзол, афабазол и др.). Более 30 лет назад в Волгоградском государственном медицинском институте под руководством профессора Г. В. Ковалева было начато изучение фармакологической активности конденсированных производных бензимидазола, а именно имидазо(1,2-α)бензимида-зола. Синтез данных соединений осуществлен в Ростовском государственном университете под руководством А. М. Симонова и В. А. Анисимовой. В настоящее время в Волгоградском государственном медицинском университете и НИИ фармакологии находится на различных стадиях доклинических и клинических испытаний [2] ряд лекарственных веществ – эноксифол (це- ребропротекторное средство), антиаритмиче-ские средства амфедазол и ритмидазол, проти-водиабетическое средство диабенол, соединение с противоязвенной активностью РУ-64 и соединение РУ-1205 с местноанастезирую-щей активностью [1, 3, 4].
Производные имидазо(1,2-α)бензимидазола синтезированы в НИИ ФОХ РГУ. Химические структуры и химическая чистота (99,5 %) соединений подтверждена методами ИК-, ЯМР- и УФ-спектроскопии, а также методом тонкослойной хроматографии (ТСХ). Химические структуры лекарственных препаратов дибазол, бемитил, рит-мидазол, эноксифол, амфедазол, диабенол и соединения РУ-64 и РУ-1205 представлены в табл. 1.
Большое значение имеет выбор метода анализа при фармакокинетических исследованиях. Избранный метод должен иметь высокую чувствительность, возможность работы с малыми объемами проб, большую специфичность и избирательность, надежность, воспроизводимость и универсальность метода.
Существует большое количество методов высокоэффективной жидкостной хроматографии
(ВЭЖХ) для анализа лекарственных средств, производных бензимидазола. Основные хроматографические методы анализа лекарственных средств производных бензимидазола представлены в табл. 2.
Таблица 1
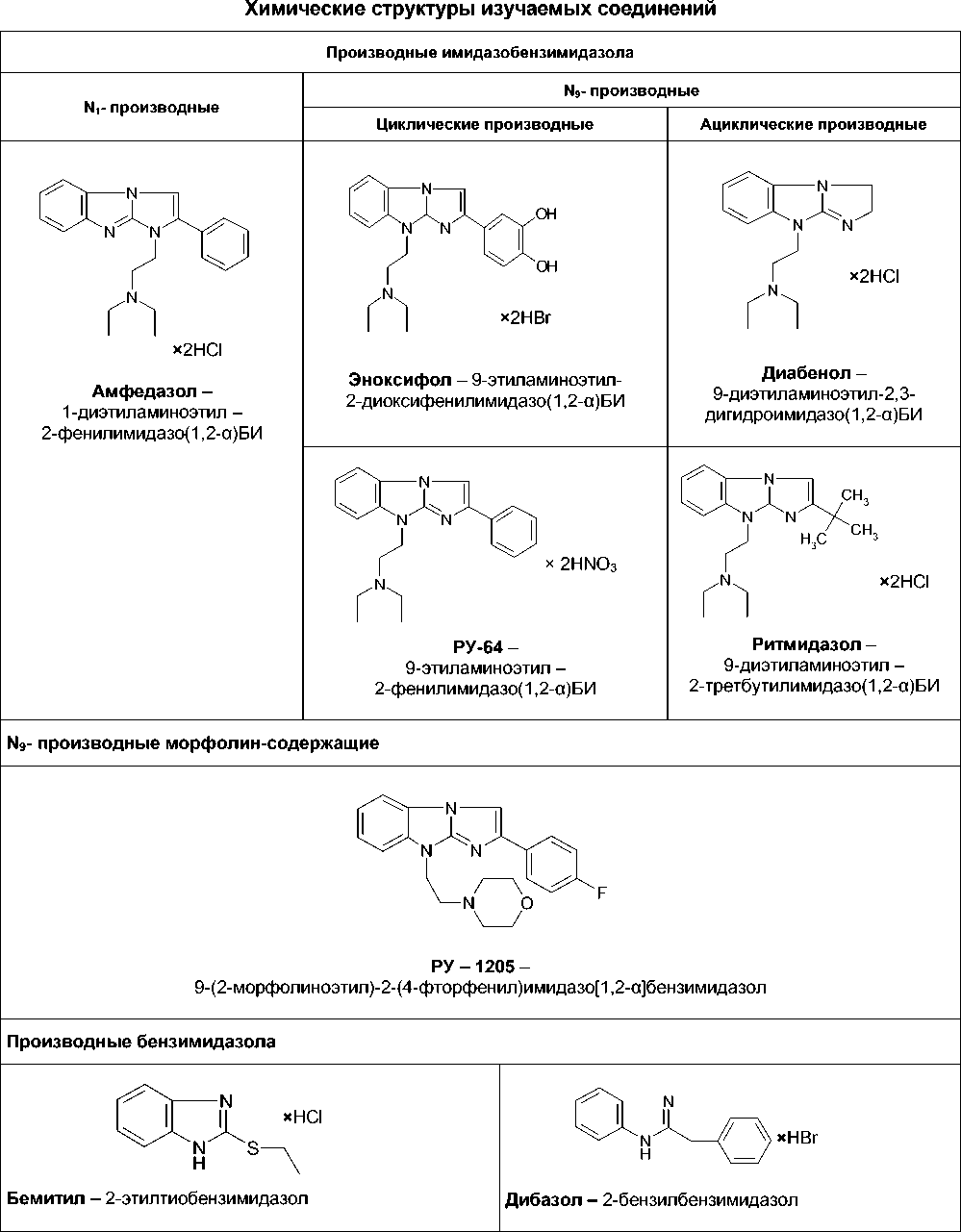
Таблица 2
|
Препарат |
Метод определения |
|
Бемитил 2-этилмеркаптобензимидазола гидробромид моногидрат N L іГ S • HBr • H2O N H |
t кол. = 210 °С; t исп. = 300 °С; газ-носитель – N 2 о. ч. – 30 мл/мин; τ уд. = 8 мин; детектор пламенно-ионизационный; чувствительность – 10 нг/м;
условия: t кол. = 185 °С, t исп. = 325 °С; τ уд. = 7 мин.
колонка с сорбентом Separon SGX C18 размером 4×250 мм, d частиц 5 мм («Элсико»); элюент – ацетатный буфер (рН = 3,6) и ацетонитрил в соотношении 1:1; давление в колонке 132–133 бар, υ потока 1 мл/мин, λ = 280 нм, чувствительность – 1 нг/мл |
|
Дибазол 2-бензилбензимидазола гидрохлорид N L IT V C • HCl \ / N H2 H |
λ = 280 нм, чувствительность – 50 нг/мл;
элюент: ацетонитрил-вода-диэтил-формамид-ортофосфорная кислота = 61:138:0,67:0,6; υ потока = 1,5 мл/мин; λ возб. = 219 нм; λ дет. = 350 нм; чувствительность – 0,01 мкг/мл |
|
Омепразол (Гастрозол) 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]бензимидазол OCH3 H3C CH3 L 1 3 O N N CS H 2 N H |
колонка: 150×4,5 мм с Lichrosorb SI 60,
элюент: ацетонитрил (34 %) – фосфатный буфер с рН = 7,7 (76 %); υ потока = 1 мл/мин; λ = 302 нм; чувствительность – 25 нмоль/л.
доза для крыс – 10–100 мкмоль/кг, доза для людей – 20 мкКи (20 мг); элюент: ацетонитрил (34%) – фосфатный буфер с рН = 7,7 (76%); чувствительность в органах крыс – 0,002–0,2 нмоль/мл |
Окончание табл. 2
|
Препарат |
Метод определения |
|
Мебендазол (Вермокс) 5-бензоил-2-метоксикарбониламино-бензимидазол O H NO 1 Та N O N H OCH 3 |
Радиография: 3Н – меченный мебендазол с удельной радиак-тивностью 12,7 мКи/г (0,47 ГБк/г); сцинтилляционный раствор: 6 г/л РРО (2,5-дифенилоксазол) в смеси толуол-этилцеллозольв (5:3); чувствительность – 11 (имп/мин)/нг |
|
Пантопразол 5-дифторметокси-2-[(3,4-диметокси-2-пиридинилметил)-сульфинил]-1Н-бензимидазол CH O F CHO 3 2 N CH O LA л CH3O NS II N O |
ВЭЖХ: λ = 286 нм; чувствительность – 0,03 мкг/мл |
|
Пимозид 1-[1-[4,4-бис-(п-фторфенил)бутил]-4-пиперидил]бензимидазолинон-2 F A O N NN F |
Радиография: 3Н – меченный пимозид; сцинтилляционный раствор: 2 мл этанолового извлечения + 10 мл раствора (2,5-бис-2-(5- трет бутилбенз- оксазолил)тиопен в толуене) |
|
Мибефрадил O O O CH 3 NN F CH N 3 H |
τ уд. = 10,7 мин; υ потока = 2 мл/мин; λ возб. = 270 нм, λ исп. = 300 нм;
колонка: НР fused-silica capillary column (50 % phenyl methyl silicone) длинной 15м и с внутренним d = 0,53 мм; t кол. = 247 – 285 °С; чувствительность – 0,1 нг/мл |
Хроматографические методы анализа со спектральной детекцией, разработанные для лекарственных средств, производных бензимидазола [3]
ЦЕЛЬ РАБОТЫ
Разработать высокочувствительные и селективные методы количественного определения в биологическом материале новых лекарственных средств, производных бензимидазола.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для количественного определения соединений нами был разработан метод ВЭЖХ. Использовались жидкостные хроматографы «Hewlett Packard» серии 1050 с УФ-детектором (США), Gilson серии 6000 с флуоресцентным детектором
(Франция) и Shimadzu серии LC-10AD с диодноматричным детектором (Япония). Для приготовления мобильной фазы использовали ацетонитрил (УФ210) («Лекбиофарм», Россия) и ацетатный буфер, состоящей смеси «х. ч. ледяной» уксусной кислоты («Реахим», Россия) и ацетата натрия (х. ч., «Реахим», Россия), а также раствор однозамещенного фосфата калия (х. ч., «Реахим», Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Препарат « Эноксифол» и продукт его окисления определяли на жидкостном хроматографе Gilson серии 6000 с флуоресцентным детектором на колонке С18 4,6 х 250 мм, 5цм. Подвижная фаза составляет смесь ацетонитрила (60 %) и ацетатного буфера рН 5,0 (40 %). Длина волны возбуждения 270 нм, длина волны эмиссии 330 и 410 нм. Чувствительность метода составляет для эноксифола 1 цг/мл и для продуктов его окисления 100 нг/мл. Идентификацию исследуемых веществ и расчет их концентрации проводили по методу абсолютных стандартов. Время удерживания для эноксифола составило 4,4–4,8 мин, для продукта окисления – 5,8–6,0 мин.
Для хроматографического анализа субстанции ритмидазола использовалась колонка Separon SGX С18 (4 х 100 мм), размером частиц 5 мкм фирмы «Элсико». В качестве подвижной фазы использовали элюент, содержащий 70 % ацетонитрила, 30 % ацетатного буфера 0,1М с рН 5,0. Скорость потока 0,5 мл/мин. Детектирование производили при длине волны 280 нм. Время удерживания ритмидазола при данных условиях составило 15 минут. Чувствительность метода 0,5 цг/мл. Для хроматографического анализа субстанции амфедазола использовалась колонка Separon SGX С18 (4 х 150 мм), размером частиц 5 мкм фирмы «Элсико». В качестве подвижной фазы использовали элюент, содержащий 70 % ацетонитрила, 30 % ацетатного буфера 0,1М с рН 5,0. Скорость потока 0,5 мл/мин. Детектирование производили при длине волны 270 нм. Время удерживания амфедазола при данных условиях составило 21 минуту. Чувствительность метода 0,1 цг/мл.
Хроматографическое определение соединения РУ-64 проводили на колонке BIO-SIL ODS-5S, 5 мкм (4 х 100 мм) со скоростью потока элюента (70 % ацетонитрила, 30 % ацетатного буфера рН 5,0) 1 мл/мин с УФ-детекцией при длине волны 265 нм и чувствительности метода 100 нг/мл, время удерживания 15 минут.
Определение препарата « Диабенол» на колонке (150 х 2 мм) силосорб С 18 (7 мкм); элюент-ацетонитрил и ацетатный буфер рН 5.0 в соотношении 1 : 1; скорость элюирования – 1 мл/мин; давление в колонке – 126 bar. Детектирование проводили при 280 нм. Чувствительность метода 1 цг/мл. Время удерживания 25 минут.
Соединение РУ-1205 хроматографировали на колонке SUPELCOSIL LC-18 (5 мкм; 100 мм х
-
4,6 мм). Для приготовления мобильной фазы использовали ацетонитрил и раствор однозамещенного фосфата калия 50 mМоль, рН = 6,7 в соотношении 1 : 1. Субстанцию вещества фиксировали при длине волны 205 нм. Чувствительность метода составляет 0,5 цг/мл. Время удерживания 8,5–9 мин.
Количественное определение бемитила проводили на колонке фирмы «Элсико» с сорбентом Separon SG-X С18 размером 4 х 250 мм, диаметр частиц 5 микрон. В качестве жидкой фазы использовали смесь, содержащую ацетатный буфер с рН 3,6 и ацетонитрил в соотношении 50 / 50 %. Давление в колонке 132–133 bar, скорость потока 1 мл/мин. Длина волны X = 280 nm. Чувствительность данного метода в 10 раз выше ранее существующих методов и позволяет определять биметил в количестве от 1ng/ml до 100 цд/ml. Дибазол определяли на колонке фирмы «Элсико» с сорбентом Separon SG-X С18 размером 4 х 250 мм, диаметр частиц 5 микрон. В качестве жидкой фазы использовали смесь, содержащую ацетатный буфер с рН 3,6 и ацетонитрил в соотношении 50 / 50 %. Давление в колонке около 130 bar, скорость потока 1 мл/мин. Длина волны λ = 254 нм. Время удерживания 16 минут. Чувствительность метода 10 нг/мл.
Экстракцию изучаемых соединений из биологических проб производили ацетонитрилом. Степень извлечения производных имидазобензимидазола из биологических проб составила (95,64 ± 3,99) %. При этом не наблюдалось зависимости степени экстракции от концентрации соединения в пробе. Для количественного определения веществ использовали метод абсолютной калибровки. Зависимость площадей пиков от концентрации веществ анализировалась методом регрессионного анализа в диапазоне концентраций от 0,1 до 50 мкг/мл. В результате было установлено, что калибровочные кривые носят линейный характер, с коэффициентом регрессии (R2) равным 0,99. Для изучаемых соединений были определены внутридневные процентные колебания (повторяемость метода), которые не превышали 20 % в изучаемых диапазонах концентраций. Междневные процентные колебания (воспроизводимость метода) для изучаемых соединений не превышала в основном 10 %.
При повторном проведении анализа, после 72 часов хранения водных растворов соединений при комнатной температуре, средние абсолютные процентные колебания находились в тех же пределах, показывая стабильность изучаемых веществ. При изучении влияния процессов замораживания и таяния было обнаружено, что средние абсолютные процентные колебания для изучаемых веществ находились в тех же пределах, что определяет стабильность веществ под влиянием данных факторов.
ЗАКЛЮЧЕНИЕ
Таким образом, лекарственные средства, производные бензимидазола и имидазо(1,2-α)
бензимидазола проявляют абсорбционную активность в ультрафиолетовой области спектра. Конденсированные производные бензимидазола обладают способностью к флюоресценции. Лекарственные средства, производные бензимидазола, имеют более интенсивное поглощение в УФ-области спектра. Для лекарственного вещества эноксифол более выражена флуоресцентная эмиссия, чем ультрафиолетовая абсорбция. Таким образом, при разработке хроматографических методов количественного определения необходимо учитывать фотоабсорбционные и фотоэмиссионные особенности изучаемых веществ при выборе детектирования.
Следует учитывать при хроматографическом анализе данных химических структур, что лучшее разделение достигается при большом содержании ацетонитрила и при pH буферных систем от 3,6 до 6,7. Способность данных веществ легко отделяться от компонентов биопробы при пробоподготовке обеспечивает возможность работать по методу абсолютной калибровки, без использования внутренних стандартов, значительно упрощая анализ.
Разработанные хроматографические методы анализа обладают достаточной селективностью и позволяют определять в биологических пробах, как сами лекарственные вещества, так и их возможные метаболиты. При этом времена удерживания стандартов лекарственных веществ позволяют отделять возможные метаболиты с меньшими временами удерживания от «мертвого объема» и фоновых веществ биологической пробы.
Таким образом, разработанные методы количественного определения являются высокоселективными и высокочувствительными, что позволяет эффективно использовать их для проведения фармакокинетических исследований конденсированных и не конденсированных производных бензимидазола.


