Анализ ассоциаций SNP (400 с > а) в гене IGF1 с показателями размера и массы у стерляди (Acipenser ruthenus Linnaeus, 1758)
Автор: Писаренко Н.Б., Бардуков Н.В., Никипелов В.И., Никипелова А.К., Харзинова В.Р., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Стерлядь (Acipenser ruthenus Linnaeus, 1758) относиться к видам осетровых рыб, представляющих интерес для выращивания в аквакультуре, поскольку характеризуется ранним половым созреванием и хорошо адаптируется к условиям содержания. В связи с развитием товарной аквакультуры возрастает спрос на разведение стерляди, имеющей высокую скорость роста, что обеспечивает наибольший экономический эффект. Для генетического улучшения популяций аквакультурной стерляди по этому экономически значимому признаку важно идентифицировать полиморфизмы, значимо связанные с особенностями роста рыбы. Удобный и эффективный подход к выявлению молекулярных маркеров, влияющих на полигенные признаки, - изучение ассоциаций между полиморфизмами в генах-кандидатах и показателями продуктивности. Известно, что инсулиноподобный фактор роста 1 (insulin-like growth factor 1, IGF1) играет важную роль в росте и развитии позвоночных. В представленной работе мы впервые секвенировали последовательности кДНК паралогичных генов инсулиноподобного фактора роста 1 стерляди и выявили на 7-й хромосоме несинонимичный полиморфизм (400 С > А) в 1-м экзоне и синонимичный SNP (479 С > А) - во 2-м экзоне. Также получены данные о влиянии генотипа по SNP (400 С > А) гена IGF1 на размеры и массу стерляди. Нашей целью было изучение полиморфизма кодирующей части гена IGF1 с помощью секвенирования кДНК, идентификация SNP и проведение ассоциативных исследований генотипов по размерно-весовыми показателями стерляди. Исследования проводили на сухонской (n = 58) и окской (n = 44) популяциях стерляди, содержащихся в установке замкнутого водоснабжения (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год). Окская популяция стерляди была привезена с Можайского производственно-экспериментального рыбоводного завода (Можайский городской округ, Московская обл.), сухонская - получена в ООО РТФ «Диана» (Кадуйский р-н, Вологодская обл.). Было выполнено чипирование рыбы и создана база данных, в которую заносили результаты бонитировки. Измерения проводили по 11 морфометрическим признакам. Тотальную РНК выделяли из фрагментов печени, мозга, мышцы, сердца и из крови с помощью комплекта реагентов РНК-ЭКСТРАН (НПО «Синтол», Россия). Синтез первой цепи ДНК на РНК-матрице проводили с использованием набора реагентов для проведения обратной транскрипции (НПО «Синтол», Россия). Геномную ДНК экстрагировали из консервированных в спирте фрагментов плавников с использованием набора для выделения геномной ДНК ДНК-ЭКСТРАН (НПО «Синтол», Россия). ПЦР выполняли на амплификаторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc.», США). Детекцию результатов ПЦР осуществляли в 1-2 % агарозном геле с использованием колориметрической системы гель-документирования Uvitec FireReader V10 imaging System («Cleaver Scientific», Великобритания). A. ruthenus относится к тетраплоидным видам, поэтому подбор специфичных праймеров проводили к двум паралогичным генам, локализованным на 7-й и 14-й хромосомах. Последовательности ДНК определяли методом секвенирования по Сэнгеру на генетическом анализаторе Нанофор 05 (НПО «Синтол», Россия) с использованием набора GenSeq (НПО «Синтол», Россия) согласно инструкциям производителя. Полиморфизм гена (С → A в позиции 400 Accession No. XM_034024781.3) определяли методом ПЦР в режиме реального времени (ПЦР-РВ) на приборе QuantStudio 5 («Thermo Fisher Scientific», США). Работу с полученными нуклеотидными последовательностями генов выполняли с помощью специального программного обеспечения Mega7. В результате множественного выравнивания были идентифицированы несинонимичный (400 С > А) и синонимичный (479 G > A) однонуклеотидные полиморфизмы (7-я хромосома). Несинонимичная мутация в позиции 400 С > А приводила к замене аминокислоты пролина (триплет ССТ) на гистидин (триплет САТ) и, как следствие, к изменению пространственной структуры белка и его функций. Ассоциативные исследования генотипов по локусу 400 С > А с размерами и массой стерляди показали, что рыбы с генотипом СС имели достоверно большую массу тела, общую длину, длину тела до конца средних лучей, пектровентральное расстояние и наибольший обхват тела (р А на общую длину стерляди (р А гена IGF1 можно рассматривать как потенциальный генетический маркер для отбора по показателям роста у стерляди. Однако мы считаем необходимым провести дополнительные ассоциативные исследования на более многочисленной популяции, а также изучить влияние комплексных генотипов на показатели роста.
Igf1, acipenser ruthenus, стерлядь, полиморфизм, snp, размерно-весовые показатели
Короткий адрес: https://sciup.org/142243780
IDR: 142243780 | УДК: 639.3:597.4/.5:575.22 | DOI: 10.15389/agrobiology.2024.4.680rus
Текст научной статьи Анализ ассоциаций SNP (400 с > а) в гене IGF1 с показателями размера и массы у стерляди (Acipenser ruthenus Linnaeus, 1758)
Для успешного развития товарной аквакультуры необходимо системное научное сопровождение отрасли, в том числе развитие ДНК-технологий. Важным шагом в этом служит поиск полиморфных локусов в генах-кандидатах и проведение ассоциативных исследований между различными генотипами и показателями продуктивности, а также использование полученных результатов в маркерной селекции (marker assisted selection, MAS) объектов аквакультуры.
У большинства изученных рыб от 40 до 60 % от общей массы тела приходится на скелетные мышцы (1), которые в основном представляют собой белые мышечные волокна, составляющие съедобную часть рыбы (2, 3). У костных рыб рост и развитие скелетных мышц зависит главным образом от доступности питательных веществ, которые модулируют ось GH/IGF1 (4, 5).
Инсулиноподобный фактор роста 1 (insulin-like growth factor 1, IGF1) — это митогенный полипептид, который принимает участие в регуляции развития и соматического роста позвоночных, а также играет ключевую роль как основной негативный регулятор выработки гормона роста (6, 7). IGF1 вовлечен в регуляцию белкового, липидного, углеводного и минерального обмена в клетках, дифференцировку и пролиферацию клеток и, в конечном счете, влияет на рост организма (8-10). Экспрессия мРНК у рыб обнаружена в желудочно-кишечном тракте, скелетных мышцах, жабрах, половых железах, почках, поджелудочной железе, селезенке, но наибольшая экспрессия наблюдается в печени (11-14). Печень — основной источник циркулирующего IGF1 (cIGF1), хотя некоторое количество cIGF1 поступает из других тканей, включая мышцы (15).
В исследованиях F. Chauvign с соавт. (16) на радужной форели установлено, что экспрессия мРНК IGF1 в мышцах резко повышается в ответ на возобновление питания. Следовательно, IGF1 идентифицирован как многообещающий ген-кандидат, участвующий в сигнальной системе клеточного уровня, которая регулирует рост миотомальных мышц рыб. Данные M.E. Picha с соавт. (17), B.R. Beckman с соавт. (18), C. Duan (19), D.A. Larsen с соавт. (20), B.K. Fox с соавт. (21) подтверждают, что содержание IGF1 в плазме или количество его мРНК в тканях положительно коррелируют со скоростью роста у различных видов рыб.
Было выполнено много исследований по поиску полиморфизмов в гене IGF1 и оценке его связи с показателями продуктивности объектов товарной аквакультуры (22). Выявленные однонуклеотидные полиморфизмы и микросателлиты, ассоциированные с показателями роста, предложено использовать в маркерной селекции рыб (23-26). Однако на стерляди подобные работы еще не проводились.
Стерлядь (Acipenser ruthenus, Linnaeus, 1758) — распространенный представитель осетровых видов рыб, известный своим относительно небольшим размером тела и широким ареалом по сравнению с другими осетровыми (27). Вид характеризуется ранним половым созреванием и высокоадаптивен к различным условиям содержания в аквакультуре (28). В настоящее время естественные популяции стерляди имеют охранный статус исчезающего вида (29). Восстановление и поддержание их численности в современных условиях возможно за счет развития аквакультуры. Стерлядь разводится в прудах, бассейнах и специализированных системах замкнутого водоснабжения (30). В связи с развитием товарной аквакультуры возрастает спрос на разведение стерляди, имеющей высокую скорость роста.
Рост рыб — один из наиболее важных экономических показателей в аквакультуре (31, 32). Однако у стерляди вызванная относительно длинным интервалом смены поколений изменчивость затрудняет достижение удовлетворительного генетического улучшения показателей роста при традиционной селекции. Использование полиморфизмов функциональных генов в качестве генетических маркеров — эффективный инструмент для решения селекционных задач в аквакультуре (33, 34).
В представленной работе мы впервые секвенировали последовательности кДНК паралогичных генов инсулиноподобного фактора роста 1 стерляди и выявили на 7-й хромосоме несинонимичный полиморфизм (400 С > А) в 1-м экзоне и синонимичный SNP (479 С > А) — во 2-м экзоне, а также исследовали влияние генотипа по SNP (400 С > А) гена IGF1 на размер и массу у стерляди.
Нашей целью было изучение полиморфизма кодирующей части гена IGF1 с помощью секвенирования кДНК, идентификация SNP и выявление ассоциаций между генотипами и размерно-массовыми показателями стерляди.
Методика. Исследования проводили на сухонской ( n = 58) и окской ( n = 44) популяциях стерляди, выращиваемой в установке замкнутого водоснабжения (УЗВ) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год). Окская популяция стерляди была привезена с Можайского производственно-экспериментального рыбоводного завода (Можайский городской округ, Московская обл.), сухонская — получена в ООО РТФ «Диана» (Ка-дуйский р-н, Вологодская обл.). В УЗВ периодически контролировали температуру воды (20-22 ° C), содержание аммония (NH 4 ) (< 0,5 мг/л), нитритов (NO 2 ) (0,1 мг/л), нитратов (NO 3 ) (20 мг/л), рН (7,2-7,6), содержание аммиака (NH 3 ) (< 0,01мг/л) и кислорода (О 2 ) (9,8-11,0 мг/л), чтобы поддерживать качество воды оптимальным для разведения рыбы.
Для проведения ассоциативных исследований было выполнено чипирование рыбы и создана база данных, в которую заносили результаты бонитировки. Измерения проводились одним оператором по 11 морфометрическим признакам (35): общая длина, длина тела до конца средних лучей, длина головы, наибольшая высота тела, длина хвостового стебля, пекто-вентральное расстояние, вентроанальное расстояние, наибольший обхват тела, наибольшая толщина тела, обхват хвостового стебля, высота хвостового стебля, масса тела.
Тотальную РНК выделяли из фрагментов печени, мозга, мышцы, сердца и крови с помощью комплекта реагентов РНК-ЭКСТРАН (НПО «Синтол», Россия) согласно инструкции производителя. Синтез первой цепи ДНК на РНК-матрице проводили с использованием набора реагентов для обратной транскрипции (НПО «Синтол», Россия) по методике производителя. Геномную ДНК экстрагировали из консервированных в спирте фрагментов плавников с использованием набора для выделения геномной ДНК ДНК-ЭКСТРАН (НПО «Синтол», Россия).
Концентрацию РНК оценивали cпектрофотометрически (NanoDrop 8000, «Thermo Fisher Scientific, Inc.», США). ПЦР выполняли на амплифи-каторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc.», США) в следующем режиме: 10 мин при 94 ° С (первичная денатурация); 30 с при 95 ° С (денатурация), 40 с при 62 ° С (отжиг праймеров на ДНК-матрице), 35 с при 72 ° С (элонгацию цепей) (40 циклов); 5 мин при 72 ° С (финальная 682
элонгация). Состав реакционной смеси на 20 мкл был следующим: 2 мкл 10½ Taq Turbo-буфера (ЗАО «Евроген», Россия), 2 мкл 2 мМ раствора dNTPs, 1 мкл 10 мМ смеси праймеров, 1 ед. Smart Таq-полимеразы (ЗАО «Диалат Лтд.», Россия). Добавляли ~ 50-100 нг исследуемой кДНК, до конечного объема доводили деионизированной водой. В реакции использовали следующие праймеры:
|
Ген |
Хромосома |
Нуклеотидная последовательность |
Температура \ отжига, ° C |
Длина ампликона, п.н. |
|
IGF1 |
7-я |
F: 5´-TATTTTGCTGGTCTTTGTAGTTCTGG-3´ |
63 |
520 |
|
R: 5´-CTAAATCCGGTAGTTCCTGTTGC-3´ |
63 |
|||
|
IGF1 |
14-я |
F: 5´-ATTGTGCTGCTCTTTGTAGTTTAGG-3´ |
63 |
526 |
|
R: 5´-CTACATCCGGTAGTTCCTGTTGC-3´ |
65 |
Детекцию результатов ПЦР осуществляли в 1-2 % агарозном геле с использованием колориметрической системы гель-документирования Uvitec FireReader V10 imaging System («Cleaver Scientific», Великобритания). Качественные образцы использовали в дальнейшей работе.
Эталонные последовательности были отобраны в базе данных GenBank (NCBI). Праймеры подбирали с помощью онлайн программы Олигокалькулятор (OligoCalk) и BioEdit v7.7.1.0 («Tom Hall», США). Реакционные смеси очищали с использованием набора Cleanup Mini (ЗАО «Евроген», Россия) и набора реагентов для очистки сиквенсных смесей SQ-Magno-Clean (ООО «НПФ «ЭПИТОП», Россия). Последовательности ДНК определяли секвенированием по Сэнгеру на генетическом анализаторе Нанофор 05 (НПО «Синтол», Россия) с использованием набора GenSeq (НПО «Синтол», Россия) согласно инструкциям производителя.
Методом ПЦР в режиме реального времени (ПЦР-РВ) на приборе QuantStudio 5 («Thermo Fisher Scientific», США) определяли полиморфизм гена (С ^ A в позиции 400 Accession No. XM_034024781.3). Работу с полученными нуклеотидными последовательностями генов выполняли с помощью специального программного обеспечения Mega7 (36). Третичную структуру белка моделировали с использованием интегрированного сервера прогнозирования структуры и функций белка IntFOLD (the IntFOLD Integrated Protein Structure and Function Prediction Server) (37).
Влияние полиморфизма оценивали, сравнивая показатели роста и развития ( M ±SEM) 102 особей разных генотипов по локусу 400 С > А с использованием t -критерия Стьюдента, а также с применением однофакторного и двухфакторного дисперсионного анализа в программе STATISTICA 10 («StatSoft, Inc.», США).
Результаты. Acipenseriformes пережили несколько этапов полиплои-дизации, что привело к появлению кариотипов, включающих от ~ 120 хромосом у некоторых видов до ~ 360 хромосом у видов, которые считаются додекаплоидными (38). По эволюционной шкале плоидности Acipenser ruth-enus относиться к тетраплоидным видам (4 n ) (39), поэтому система IGF у стерляди дополнительно осложнена присутствием паралогичных генов. При этом по функциональной шкале вид относят к диплоидным (2 n ) (40).
У стерляди ген IGF1 представлен двумя паралогами, расположенными на 7-й и 14-й хромосомах. Поэтому для проведения полимеразной цепной реакции были подобраны специфические праймеры для каждого паралогичного гена, чтобы секвенировать каждую последовательность отдельно (рис. 1). Эталонной последовательностью гена IGF1 для 7-й хромосомы была выбрана XM_034024781.3 (LOC117414927), для 14-й хромосомы — XM_034032300.3.
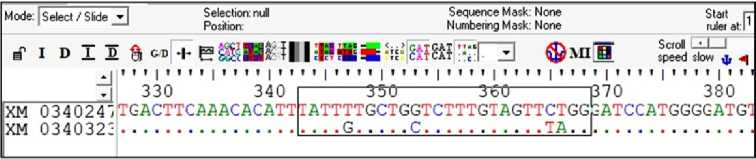
Рис. 1. Фрагмент выравнивания эталонных последовательностей гена IGF1 стерляди ( Acipenser uthenus , Linnaeus, 1758): верхняя последовательность — 7-я хромосома, нижняя — 14-я хромосома). Скриншот окна программы BioEdit.
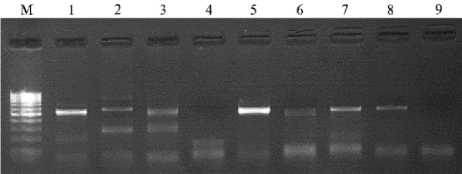
Рис. 2. Электрофореграмма результатов ПЦР-амплификации гена IGF1 стерляди ( Acipenser ruthenus , Linnaeus, 1758): М — ДНК-маркер 50 bp («Fermentas», Литва), 1 — печень (рыба ¹ 1), 2 — мозг (рыба ¹ 1), 3 — мышца (рыба ¹ 1), 4 — сердце (рыба ¹ 1), 5 — печень (рыба ¹ 2), 6 — кровь (рыба ¹ 2), 7 — мозг (рыба ¹ 2), 8 — мышца (рыба ¹ 2), 9 — сердце (рыба ¹ 2).
РНК выделяли из разных органов и тканей (печень, мозг, мышца, сердце, кровь). После выделения и обратной транскрипции получали кДНК и проводили ПЦР. По результатам анализа электрофореграммы продуктов амплификации гена IGF1 (рис. 2), наибольшее количество ПЦР-продукта было получено с РНК, выделенной из печени стерляди. В иссле-
дованиях на нескольких видах рыб установлено, что именно в печени наблюдалась самая высокая экспрессия гена IGF1 (11, 12). Поэтому для получения ПЦР-продукта хорошего качества и дальнейшего секвенирования
мы использовали кДНК на основе РНК из печени (рис. 3).
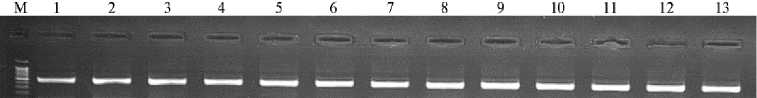
Рис. 3. Электрофореграмма результатов ПЦР-амплификации гена IGF1 стерляди ( Acipenser ruth-enus , Linnaeus, 1758): М — маркер молекулярных масс (DNA Ladder 100+ bp, ЗАО «Евроген», Россия), 1-13 — ПЦР-продукт гена IGF1 , расположенного на 7-й хромосоме (520 п.н.).
При выравнивании нуклеотидных последовательностей гена IGF1 , расположенного на 7-й хромосоме, были идентифицированы два SNPs. Положения SNPs были названы относительно начала эталонной последовательности XM_034024781.3. Мы обнаружили несинонимичную мутацию в позиции 400 п.н. (1-й экзон), где цитозин замещается на аденин (400 С > А), а также cинонимичную мутацию, не приводящую к изменению аминокислоты лейцин (Leu → Leu) в позиции 479 G > A (2-й экзон). При выравнивании нуклеотидных последовательностей гена IGF1 на 14-й хромосоме в исследованных фрагментах замен мы не выявили.
Рамка считывания содержала 537 п.н. и кодировала белок IGF1, в состав которого входят 178 аминокислот. В результате несинонимичной замены 400 С > А триплет ССТ замещался на САТ, что приводило к замещению аминокислоты пролина на гистидин (Pro → His).
На рисунке 4 показаны модели третичной структуры белка IGF1 с аминокислотой пролин и гистидин. Различие пространственной третичной структуры белка IGF1 можно объяснить тем, что пролин относится к классу аминокислот с неполярными R-группами, а гистидин — к классу с положительно заряженными полярными R-группами.
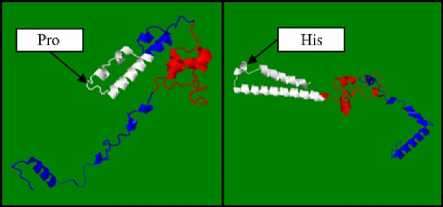
Рис. 4. Третичная структура белка IGF1 стерляди ( Aci-penser ruthenus , Linnaeus, 1758), в состав которого входит аминокислота пролин (слева) или аминокислота гистидин (справа) .
На фрагментах хроматограмм последовательностей гена IGF1 стерляди (рис. 5) в однонуклеотидном полиморфизме 400 С > А было четко видно наличие генотипов СС , АС и АА , в SNP 479 G > A — AA , AG и GG .
Для массового тестирования стерляди и дальнейших ассоциативных исследований была разработана тест- система по определению генотипов по SNP 400 С > А как наиболее перспективному. Известно, что полиморфизмы в промоторной области и мис-сенс-мутации в кодирующих областях с большей вероятностью имеют пря- мую связь с характеристиками, на которые влияет ген-кандидат, чем интронные полиморфизмы или молчащие мутации в кодирующей области (41). Методом ПЦР-РВ мы генотипировали 102 особи стерляди, принадлежащие к окской и сухонской популяциям.
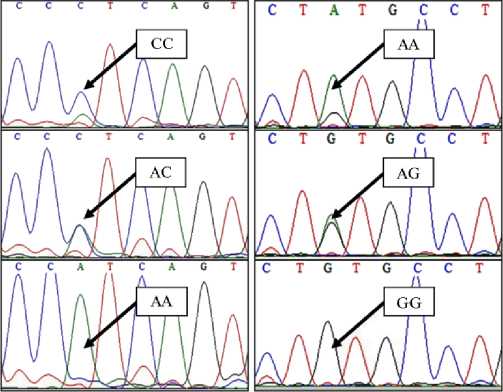
Рис. 5. Фрагменты хроматограмм последовательностей гена IGF1 стерляди ( Acipenser ruthenus , Linnaeus, 1758), расположенного на 7-й хромосоме: А — SNP (400 С > А), Б — SNP (479 G > A).
При оценке генетической структуры популяций стерляди по гену IGF1 (400 С > А, 7-я хромосома) наибольшее количество гомозигот АА и СС было выявлено в окской популяции (соответственно 38,6 и 11,4 %), а гетерозигот — в сухонской (56,9 %) (табл. 1). Частота аллелей А и С между группами различалась незначительно. Нарушения генетического равновесия не наблюдалось, значение χ 2 варьировало от 0,284 до 3,478.
1. Генетическая структура популяций стерляди ( Acipenser ruthenus , Linnaeus, 1758) по гену IGF1 (400 С > А, 7-я хромосома) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Популяция |
n |
Частота генотипов, % |
Частота аллелей |
χ 2 |
|||
|
АА |
АС |
СС |
А |
С |
|||
|
Сухонская |
58 |
36,2 |
56,9 |
6,9 |
0,647 |
0,353 |
3,478 |
|
Окская |
44 |
38,6 |
50,0 |
11,4 |
0,636 |
0,364 |
0,284 |
|
Всего |
102 |
37,3 |
53,9 |
8,8 |
0,642 |
0,358 |
3,062 |
При сравнении показателей продуктивности стерляди, принадлежа- щей к разным генотипам по локусу IGF1 400 С > А (табл. 2), установлено, что носители генотипа СС имели достоверно большую (р < 0,05) массу тела, общую длину тела, пектровентральное расстояние и обхват тела, чем рыба с генотипом АС. При этом следует отметить, что частота генотипа СС в исследуемой популяции была наименьшей (8,8 %). Наши результаты согласуются с данными других авторов, полученных на разных видах рыбы. У атлантического лосося (Salmo salar) установлено, что гомозиготные генотипы TT (SNP1, g.5763G > T) и АА (SNP3, g.4671A > C) имели наименьшую частоту встречаемости (соответственно 14,5 и 1,6 %) и были достоверно связаны (р < 0,05) с несколькими весовыми признаками (42). X.H. Li с соавт. (43) обнаружили, что большеротый окунь (Micropterus salmoides) с генотипом AA (частота 12,5 %) имел достоверно большую массу тела и наибольшую ширину тела, чем рыбы с генотипами AB или BB. В популяции обыкновенного карпа (Cyprinus carpio) установлено, что локус g.7627T > A был достоверно связан с массой и длиной тела. У рыб с генотипом AA средняя масса тела была на 5,9 % выше, а средняя длина тела — на 2,8 % больше, чем у особей с генотипом ТТ (34). Согласно нашим результатам, стерлядь с генотипом СС имела на 14,6 % большую массу тела и на 5,2 % — общую длину, чем рыба с генотипом АС.
-
2. Продуктивные показатели стерляди ( Acipenser ruthenus, Linnaeus, 1758) в среднем по двум популяциям (сухонской и окской) в зависимости от генотипа по гену IGF1, расположенному на 7-й хромосоме (400 С > А) ( M ±SEM; ФГБНУ ФИЦ ВиЖ им. академика Л.К. Эрнста, 2023 год)
-
3. Продуктивные показатели стерляди ( Acipenser ruthenus , Linnaeus, 1758) сухонской и окской популяций в зависимости от генотипа по гену IGF1, расположенному на 7-й хромосоме (400 С > А) ( M ±SEM; ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
Показатель
Генотип
АА
АС
CC
Окская
Число рыб, n
популяция 17
(Можайский ПЭРЗ)
22
5
Масса тела, г
462±23,0
447±16,2
509±27,1
Общая длина, cм
45,2±0,69
45,0±0,51
47,4±1,11
Длина тела до конца средних лучей, cм
38,1±0,46
37,5±0,46
39,2±0,78
Пектровентральное расстояние, cм
15,5±0,26
15,2±0,26
16,0±0,27*
Вектроанальное расстояние, cм
6,1±0,11
6,2±0,15
6,3±0,30
Наибольший обхват тела, cм
16,6±0,38
16,2±0,25
17,0±0,30
Наибольшая высота тела, cм
5,5±0,14
5,4±0,10
5,8±0,16
Наибольшая толщина тела, cм
4,3±0,11
4,2±0,08
4,4±0,12
Сухонска Число рыб, n
я популяци 21
я (ООО РТФ «Диана») 33
4
Масса тела, г
405±20,3
387±16,2
445±58,5
-
4. Результаты однофакторного и двухфакторного дисперсионного анализа для показателей роста и развития стерляди ( Acipenser ruthenus , Linnaeus, 1758) разных генотипов по гену IGF1 , расположенному на 7-й хромосоме (400 С > А) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Показатель |
Генотип |
||
|
АА ( n = 38) |
АС ( n = 55) |
CC ( n = 9) |
|
|
Масса тела, г |
430,1±15,74 |
410,8±12,25 |
480,6±30,03* |
|
Общая длина, cм |
45,9±0,49 |
45,1±0,38 |
47,6±1,16* |
|
Длина тела до конца средних лучей, cм |
38,1±0,35 |
37,3±0,33 |
39,1±0,98 |
|
Пектровентральное расстояние, cм |
15,2±0,19 |
14,8±0,16 |
15,8±0,33* |
|
Вектроанальное расстояние, cм |
5,8±0,12 |
5,9±0,10 |
6,2±0,24 |
|
Наибольший обхват тела, cм |
16,0±0,26 |
15,7±0,19 |
16,6±0,35* |
|
Наибольшая высота тела, cм |
5,4±0,09 |
5,3±0,07 |
5,6±0,15 |
|
Наибольшая толщина тела, cм |
4,1±0,07 |
4,0±0,05 |
4,1±0,04 |
* Различия между показателями у генотипа CC и генотипа AC статистически значимы при р < 0,05.
Также мы сравнили показатели роста и развития стерляди из окской и сухонской популяций (табл. 3). В целом сохранялась та же тенденция: носители генотипа СС имели большие значения по промерам и массе, чем гетерозиготы АС , однако достоверные различия были установлены только у стерляди окской популяции по пектровентральному расстоянию (р < 0,05).
|
Продолжение таблицы 3 |
|||
|
Общая длина, cм |
46,5±0,68 |
45,1±0,56 |
47,9±2,45 |
|
Длина тела до конца средних лучей, cм |
38,1±0,51 |
37,1±0,45 |
38,9±2,16 |
|
Пектровентральное расстояние, cм |
14,9±0,28 |
14,6±0,19 |
15,5±0,68 |
|
Вектроанальное расстояние, cм |
5,6±0,18 |
5,6±0,11 |
6,0±0,41 |
|
Наибольший обхват тела, cм |
15,6±0,33 |
15,3±0,26 |
16,2±0,69 |
|
Наибольшая высота тела, cм |
5,3±0,11 |
5,2±0,09 |
5,4±0,24 |
|
Наибольшая толщина тела, cм |
4,0±0,08 |
3,9±0,06 |
4,0±0,26 |
* Различия между показателями у генотипа CC и генотипа AC статистически значимы при р < 0,05.
С использованием однофакторного и двухфакторного дисперсионного анализа было изучено влияние фактора «генотип» по локусу IGF1 (400 С > А), а также факторов «генотип» по локусу IGF1 (400 С > А) и «принадлежность к популяции» (окская и сухонская) на размерно-весовые показатели стерляди (табл. 4).
|
Показатель |
Однофакторный Двухфакторный F □ p □ R2 F □ p □ R2 |
|
Масса тела Общая длина Длина тела до конца средних лучей Длина головы Пектовентральное расстояние Вентроанальное расстояние Наибольший обхват тела Обхват хвостового стебля Наибольшая толщина тела |
2,29 0,106 2,5 3,18* 0,011 9,7 3,10* 0,050 4,0 1,54 0,184 2,6 2,82 0,064 3,5 1,18 0,326 0,9 0,29 0,748 1,4 2,81* 0,021 8,2 2,81 0,066 3,5 2,26 0,054 5,9 0,92 0,404 0,2 3,79** 0,003 12,1 1,88 0,157 1,7 2,96* 0,016 8,9 0,85 0,432 0,3 2,66* 0,027 7,6 1,51 0,226 1,0 2,91* 0,017 8,7 |
Статистически значимо соответственно при р < 0,05 и р < 0,01.
Однофакторный дисперсионный анализ показал статистически значимое влияние генотипа по полиморфизму 400 С > А гена IGF1 только на общую длину стерляди (р < 0,05). Двухфакторный дисперсионный анализ выявил достоверное влияние генотипа и принадлежности к популяции на массу тела (р < 0,05), длину головы (р < 0,05), вентроанальное расстояние (р < 0,01), наибольший обхват тела (р < 0,05), обхват хвостового стебля (р < 0,05) и наибольшую толщину тела (р < 0,05) у исследуемых рыб.
Таким образом, обнаружены два однонуклеотидных полиморфизма в кодирующей области гена инсулиноподобного фактора роста 1 у стерляди из сухонской и окской популяций — SNP 400 С > А и SNP 479 G > A. Несинонимичная мутация в позиции 400 С > А приводит к замене аминокислоты пролина на гистидин и, как следствие, к изменению пространственной структуры белка. Ассоциативный анализ выявил наличие достоверного влияния генотипа по SNP 400 С > А на размеры и массу стерляди. Полученные результаты в целом указывают на потенциал использования полиморфизма гена IGF1 для генетического улучшения аквакультурной стерляди, однако необходимо увеличить число SNPs и проанализировать как отдельные полиморфизмы, так и комплексные генотипы, а также выполнить аналогичные исследования на расширенном поголовье стерляди.
Список литературы Анализ ассоциаций SNP (400 с > а) в гене IGF1 с показателями размера и массы у стерляди (Acipenser ruthenus Linnaeus, 1758)
- Weatherley A.H., Gill H.S. Dynamics of increase in muscle fibres in fishes in relation to size and growth. Experientia, 1985, 41: 353-354 (doi: 10.1007/BF02004500).
- Zhang G., Swank D.M., Rome L.C. Quantitative distribution of muscle fiber types in the scup Stenotomus chrysops. Journal of Morphology, 1996, 229(1): 71-81 (doi: 10.1002/(SICI)1097-4687(199607)229:1<71::AID-JMOR4-3.0.CO;2-S).
- SäNger A.M., Stoiber W. Muscle fiber diversity and plasticity. In: Fish Physiology /I.A. Johnston (ed.). Academic Press, 2001, 18: 187-250 (doi: 10.1016/s1546-5098(01)18008-8).
- Reinecke M., Bjornsson B.T., Dickhoff W.W., McCormick S.D., Navarro I., Power D.M., Gutierrez J. Growth hormone and insulin-like growth factors in fish: where we are and where to go. General and Comparative Endocrinology, 2005, 142(1-2): 20-24 (doi: 10.1016/j.ygcen.2005.01.016).
- Liu X., Zeng S., Liu S., Wang G., Lai H., Zhao X., Bi S., Guo D., Chen X., Yi H., Su Y., ZhangY., Li G. Identifying the related genes of muscle growth and exploring the functions by compensatory growth in Mandarin fish (Siniperca chuatsi). Frontiers in Physiology, 2020, 11: 1-14 (doi: 10.3389/fphys.2020.553563).
- Al-Samerria S., Radovick S. The role of insulin-like growth factor-1 (IGF-1) in the control of neuroendocrine regulation of growth. Cells, 2021, 10(10): 2664 (doi: 10.3390/cells10102664).
- Gahete M.D., Córdoba-Chacón J., Lin Q., Brüning J.C., Kahn C.R., Castaño J.P., Christian H., Luque R.M., Kineman R.D. Insulin and IGF-I inhibit GH synthesis and release in vitro and in vivo by separate mechanisms. Endocrinology, 2013, 154(7): 2410-2420 (doi: 10.1210/en.2013-1261).
- Chen T.Т., Marsh A., Shamblott M., Chan K.-M., Tang Y.-L., Cheng C.M., Yang B.-Y. Structure and evolution of fish growth hormone and insulin-like growth factor genes. In: Fish Physiology /N.M. Sherwood, C.L. Hew, A.P. Farrell, D.J. Randall (eds). Academic Press, 1994, 13: 179-209 (doi: 10.1016/S1546-5098(08)60067-9).
- Moriyama S., Ayson F.G., Kawauchi H. Growth regulation by insulin-like growth factor-I in fish. Bioscience Biotechnology and Biochemistry, 2000, 64(8): 1553-1562 (doi: 10.1271/bbb.64.1553).
- Pérez-Sánchez J., Simó-Mirabet P., Naya-Català F., Martos-Sitcha J.A., Perera E., Bermejo-Nogales A., Benedito-Palos L., Calduch-Giner J.A. Somatotropic axis regulation unravels the differential effects of nutritional and environmental factors in growth performance of marine farmed fishes. Frontiers in Endocrinology, 2018, 9: 1-24 (doi: 10.3389/fendo.2018.00687).
- Ayson F.G., de Jesus E.G.T., Moriyama S., Hyodo S., Funkenstein B., Gertler A., Kawauchi H. Diferential expression of insulin-like growth factor I and II mRNAs during embryogenesis and early larval development in rabbitfsh Siganus guttatus. General and Comparative Endocrinology, 2002, 126(2): 165-174 (doi: 10.1006/gcen.2002.7788).
- Vong Q.P., Chan K.M., Cheng C.H.K. Quantifcation of common carp (Cyprinus carpio) IGF-I and IGF-II mRNA by realtime PCR: diferential regulation of expression by GH. The Journal of Endocrinology, 2003, 178(3): 513-521 (doi: 10.1677/joe.0.1780513).
- Biga P.R., Schelling G.T., Hardy R.W., Cain K.D., Overturf K., Ott T.L. The eVects of recombinant bovine somatotropin (rbST) on tissue IGF-I, IGF-I receptor, and GH mRNA levels in rainbow trout, Oncorhynchus mykiss. General and Comparative Endocrinology, 2004, 135(3): 324-333 (doi: 10.1016/j.ygcen.2003.10.014).
- Inoue K., Iwatani H., Takei Y. Growth hormone and insulin-like growth factor I of a euryhaline fish Cottus kazika: cDNA cloning and expression after seawater acclimation. General and Comparative Endocrinology, 2003, 131(1): 77-84 (doi: 10.1016/s0016-6480(02)00650-0).
- Triantaphyllopoulos K.A., Cartas D., Miliou H. Factors influencing GH and IGF-I gene expression on growth in teleost fish: how can aquaculture industry benefit? Reviews in Aquaculture, 2020, 12(3): 1637-1662 (doi: 10.1111/raq.12402).
- Chauvign F., Gabillard J.C., Weil C., Rescan P.Y. Effect of refeeding on IGFI, IGFII, IGF receptors, FGF2, FGF6, and myostatin mRNA expression in rainbow trout myotomal muscle. General and Comparative Endocrinology, 2003, 132(2): 209-215 (doi: 10.1016/S0016-6480(03)00081-9).
- Picha M.E., Turano M.J., Beckman B.R., Borski R.R. Endocrine biomarkers of growth and applications to aquaculture: a mini review of growth hormone, insulin-like growth factor (IGF)-I, and IGF-binding proteins and potential growth indicators in fish. North American Journal of Aquaculture, 2008, 70(2): 196-211 (doi: 10.1577/A07-038.1).
- Beckman B.R., Fairgrieve W., Cooper K.A., Mahnken C.V.W., Beamish R.J. Evaluation of endocrine indices of growth in individual postsmolt coho salmon. Transactions of the American Fisheries Society, 2004, 133(5): 1057-1067 (doi: 10.1577/T03-098.1).
- Duan C. Nutritional and developmental regulation of insulin like growth factors in fish. The Journal of Nutrition, 1998, 128(2): 306S-314S (doi: 10.1093/jn/128.2.306S).
- Larsen D.A., Beckman B.R., Dickhoff W.W. The effect of low temperature and fasting during the winter on metabolic stores and endocrine physiology (insulin, insulin-like growth factor-I and thyroxine) of coho salmon, Oncorhynchus kisutch. General and Comparative Endocrinology, 2001, 123(3): 308-323 (doi: 10.1006/gcen.2001.7677).
- Fox B.K., Riley L.G., Hirano T., Grau E.G. Effects of fasting on growth hormone, growth hormone receptor, and insulin-like growth factor-I axis in seawater acclimated tilapia, Oreochromis mossambicus. General and Comparative Endocrinology, 2006, 148(3): 340-347 (doi: 10.1016/j.ygcen.2006.04.007).
- Писаренко Н.Б. Гены-кандидаты, перспективные для маркерной селекции объектов аквакультуры (обзор). Сельскохозяйственная биология, 2023, 58(6): 953-973 (doi: 10.15389/agrobiology.2023.6.953rus).
- Hu X., Li C., Shi L. A novel 79-bp insertion/deletion polymorphism in 3′-flanking region of IGF-I gene is associated with growth-related traits in common carp (Cyprinus carpio L.). Aquaculture Research, 2013, 44(10): 1632-1638 (doi: 10.1111/are.12091).
- Zhang H., Jawanjal N., Chae J., Jang M., Yoo B., Lee H.-H. Relationship between single nucleotide polymorphism of IGF-1 gene in Nile tilapia (Oreochromis niloticus) and weight gain. Journal of Fisheries and Marine Sciences,2023, 35(2): 222-232 (doi: 10.13000/JFMSE.2023.4.35.2.222).
- Ruan R.R., Yu J.H., Li H.X., Li J.L, Tang Y.K. Effects of IGF-1 genotype on weight gain and body shape in GIFT strain Oreochromis niloticus. Journal of Fishery Sciences of China, 2011, 18(3): 682-688 (doi: 10.3724/SP.J.1118.2011.00682).
- Wang H., Sun J., Lu X., Wang P., Xu P., Zeng L., Yu D., Li G. Identification of insulin-like growth factor I gene polymorphisms using high-resolution melting and its effect on growth traits in sinipercid species. Fisheries Science, 2013, 79: 439-446 (doi: 10.1007/s12562-013-0607-8).
- Müller T., Ittzés I., Szőke Zs., Hegyi Á., Mészáros E., Lefler K.K., Bokor Z., Urbányi B., Kucska B. Attempts on artificial induction of sexual maturation of sterlet (Acipenser ruthenus) and identification of late spermatogenesis stage in hermaphroditic fish. International Aquatic Research, 2018, 10(4): 293-297 (doi: 10.1007/s40071-018-0196-3).
- Akhavan S.R., Salati A.P., Falahatkar B., Jalali S.A.H. Changes of vitellogenin and lipase in captive sterlet sturgeon Acipenser ruthenus females during previtellogenesis to early atresia. Fish Physiology and Biochemistry, 2016, 42(3): 967-978 (doi: 10.1007/s10695-015-0189-8).
- Pikitch E.K., Doukakis P., Lauck L., Chakrabarty P., Erickson D.L. Status, trends and management of sturgeon and paddlefish fisheries. Fish and Fisheries, 2005, 6(3): 233-265 (doi: 10.1111/j.1467-2979.2005.00190.x).
- Золотов А.В. Организация и эффективность культивирования стерляди (Acipenser ruthenus) в замкнутой аквасистеме с выходом готовой продукции 40 тонн в год для условий Смоленской области. Наука, техникаиобразование, 2018, 6(47): 93-95 (doi: 10.20861/2312-8267-2018-47-006).
- Ali A., Al-Tobasei R., Lourenco D., Leeds T., Kenney B., Salem M. Genome-wide identification of loci associated with growth in rainbow trout. BMC Genomics, 2020, 21(1): 209 (doi: 10.1186/s12864-020-6617-x).
- Tran T.H., Nguyen H.T., Le B.T.N., Tran P.H., Nguyen S.V., Kim O.T.P. Characterization of single nucleotide polymorphism in IGF1 and IGF1R genes associated with growth traits in striped catfish (Pangasianodon hypophthalmus Sauvage, 1878). Aquaculture,2021, 538(2): 736542 (doi: 10.1016/j.aquaculture.2021.736542).
- Wenne R. Single nucleotide polymorphism markers with applications in aquaculture and assessment of its impact on natural populations. Aquatic Living Resources, 2018, 31: 2 (doi: 10.1051/alr/2017043).
- Feng X., Yu X., Tong J. Novel single nucleotide polymorphisms of the insulin-like growth factor-I gene and their associations with growth traits in common carp (Cyprinus carpio L.). International Journal of Molecular Sciences, 2014, 15(12): 22471-22482 (doi: 10.3390/ijms151222471).
- Крылова В.Д., Соколов Л.И. Морфологические исследования осетровых рыб и их гибридов. Метод. реком. М., 1981.
- Kumar S., Stecher G., Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 2016, 33(7): 1870-1874 (doi: 10.1093/molbev/msw054).
- McGuffin L.J., Edmunds N.S., Genc A.G., Alharbi S.M.A., Salehe B.R., Adiyaman R. Prediction of protein structures, functions and interactions using the IntFOLD7, MultiFOLD and ModFOLDdock servers. Nucleic Acids Research, 2023, 51(10): W274-W280 (doi: 10.1093/nar/gkad297).
- Birstein V.J., Hanner R., DeSalle R. Phylogeny of the Acipenseriformes: cytogenetic and molecular approaches. Environmental Biology of Fishes, 1997, 48: 127-155.
- Du K., Stöck M., Kneitz S., Klopp C., Woltering J.M., Adolfi M.C., Feron R., Prokopov D., Makunin A., Kichigin I., Schmidt C., Fischer P., Kuhl H., Wuertz S., Gessner J., Kloas W., Cabau C., Iampietro C., Parrinello H., Tomlinson C., Journot L., Postlethwait J.H., Braasch I., Trifonov V., Warren W.C., Meyer A., Guiguen Y., Schartl M. The sterlet sturgeon genome sequence and the mechanisms of segmental rediploidization. Nature Ecology & Evolution,2020, 4(6):841-852 (doi: 10.1038/s41559-020-1166-x).
- Fontana F., Zane L., Pepe A., Congiu L. Polyploidy in Acipenseriformes: cytogenetic and molecular approaches. In: Fish cytogenetics /E. Pisano, C. Ozouf-Costaz, F. Foresti, B.G. Kapoor (eds.). Enfield, Science Publisher, 2007.
- Ge W., Davis M.E., Hines H.C., Irvin K.M., Simmen R.C.M. Association of a genetic marker with blood serum insulin-like growth factor-I concentration and growth traits in Angus cattle. Journal of Animal Science, 2001, 79(7): 1757-1762 (doi: 10.2527/2001.7971757x).
- Tsai H.Y., Hamilton A., Guy D.R., Houston R.D. Single nucleotide polymorphisms in the insulin-like growth factor 1 (IGF1) gene are associated with growth-related traits in farmed Atlantic salmon. Animal Genetics, 2014, 45(5): 709-715 (doi: 10.1111/age.12202).
- Li X.H., Bai J.J., Ye X., Hu Y.C., Li S.J., Yu L.Y. Polymorphisms in the 5' flanking region of the insulin-like growth factor I gene are associated with growth traits in largemouth bass Microp-terus salmoides. Fisheries Science, 2009, 75(2): 351-358 (doi: 10.1007/s12562-008-0051-3).


