Анализ безопасности проведения послеоперационной лучевой терапии в режиме ускоренного гипофракционирования больным раком молочной железы I-IIIA стадии
Автор: Афонин Григории Владиславович, Гулидов Игорь Александрович, Рагулин Юрий Александрович, Бекетов Евгений Евгеньевич, Гамаюнов Сергей Викторович, Жариков Антон Андреевич, Иванов Сергей Анатольевич, Каприн Андрей Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Цель исследования - сравнительный анализ безопасности проведения послеоперационной лучевой терапии в режиме ускоренного гипофракционирования больным раком молочной железы I-IIIA стадии. Материал и методы. Материалом исследования послужили данные обследования и лечения 316 пациенток с диагнозом рак молочной железы I-IIIA стадий, получавших лечение в МРНЦ им. А.Ф. Цыба филиал ФГБУ «НМИЦ радиологии» Минздрава России с 2013 по 2018 г. Послеоперационный курс лучевой терапии в режиме гипофракционирования до СОД 40,5 Гр в РОД 2,7 Гр облучения получили 223 пациентки. Лучевая терапия в контрольной группе проводилась в конвенциональном режиме: РОД 2 Гр до СОД 50 Гр (n=93). Оценка качества жизни пациенток проведена при помощи опросника EQ-5D, состоящего из 2 страниц: описательная часть и визуально-аналоговая шкала (EQ VAS). Результаты. Установлено, что частота возникновения отека верхней конечности не зависит от режима фракционирования. Данное осложнение встречается чаще при облучении подмышечной области (в 37 % случаев) и при выполнении радикальной мастэктомии (в 17 % случаев). Качество жизни пациенток, оцененное при помощи опросника EQ-5D, не отличалось в исследуемых группах. Заключение. Послеоперационная лучевая терапия в режиме ускоренного гипофракционирования СОД 40,5 Гр в РОД 2,7 Гр является безопасной методикой и может применяться как после органосохраняющих операций, так и после радикальных мастэктомий. Использование данной методики является предпочтительным по сравнению с конвенциональным режимом ввиду сокращения сроков лечения при сопоставимых показателях качества жизни. Облучение подмышечной области достоверно увеличивает риск возникновения лимфедемы верхней конечности.
Онкология, рак молочной железы, лучевая терапия, качество жизни, лучевые осложнения, лимфедема
Короткий адрес: https://sciup.org/140254334
IDR: 140254334 | УДК: 618.19-006.6-089.168.1-08:615.849.1 | DOI: 10.21294/1814-4861-2020-19-2-25-33
Текст научной статьи Анализ безопасности проведения послеоперационной лучевой терапии в режиме ускоренного гипофракционирования больным раком молочной железы I-IIIA стадии
На протяжении многих лет рак молочной железы (РМЖ) является одним из самых распространённых онкологических заболеваний как в мире, так и в России [1]. Несмотря на современные достижения лекарственной терапии и совершенствование хирургических подходов, лучевая терапия остается важнейшим компонентом мультидисци-плинарного подхода в лечении данной патологии. В настоящее время все больший интерес вызывают режимы ускоренного гипофракционирования послеоперационной лучевой терапии. Методика характеризуется уменьшением срока проводимого лучевого лечения за счет увеличения дневных разовых очаговых доз облучения. По данным зарубежных и отечественных авторов, режимы гипофракционирования не уступают конвенциональному по показателям безопасности и онкологической эффективности [2, 3].
Проведение комбинированного лечения рака молочной железы зачастую сопровождается ранними и поздними лучевыми осложнениями. Их лечение представляет особую сложность для клиницистов и не всегда приводит к достижению удовлетворительных результатов. Одним из наиболее часто встречающихся осложнений комбинированного лечения РМЖ является отек верхней конечности. Его формированию способствуют несколько факторов. По мнению одних авторов, это в первую очередь травма, связанная с хирургическим лечением. Их данные свидетельствуют о том, что количество удаленных лимфоузлов влияет на формирование лимфатического отека [4, 5]. Другие исследования указывают на то, что риск возникновения лимфедемы является многофакторным и выше у пациенток с высоким индексом массы тела, получивших адъювантную лучевую терапию после обширных хирургических вмешательств и химиотерапевтического лечения [6–9]. Облучение подмышечных лимфоколлекторов также достоверно повышает частоту возникновения лимфатических отеков [10–11].
Полученные отдаленные результаты облучения лимфоколлекторов в режиме гипофракционирования исследований START-A и START-B демонстрируют отсутствие статистически значимых различий в частоте лучевых осложнений в исследуемых группах. Лишь в группе с режимом 13 фракций по 3,3 Гр частота побочных эффектов была выше по сравнению с конвенциональным режимом [12].
Еще одним значимым фактором при формировании плана лечения данной категории больных является качество жизни. Современные возможности медицины позволяют пациенту получить эффективное лечение, добиться стойкой ремиссии, а зачастую и полного излечения заболевания. Качество жизни должно быть на высоком уровне в процессе всего времени лечения и сохраняться после его завершения. В свою очередь, оценка данного показателя – актуальная и сложная задача и не всегда достоверно отображает состояние пациента. Однако существует ряд научных работ по изучению качества жизни больных раком молочной железы, получивших послеоперационную лучевую терапию. В международной практике c данной целью используются несколько видов опросников. Наиболее популярные из них EQ-5D и EORTC-QLQ-BR23. Опросники могут быть применены для оценки качества жизни пациенток, получивших послеоперационную лучевую терапию как на ранней стадии заболевания после проведенного органосохраняющего лечения [13], так и у пациенток, получивших лучевую терапию после мастэктомии [14].
Целью исследования явился анализ частоты поздних лучевых осложнений в зависимости от режима фракционирования и объема хирургического лечения, а также оценка качества жизни больных РМЖ.
Материал и методы
Материалом исследования послужили данные обследования и лечения 316 пациенток с РМЖ I–IIIA стадий, получавших лечение в МРНЦ им. А.Ф. Цыба филиал ФГБУ «НМИЦ радиологии» Минздрава России с 2013 по 2018 г. Распространенность опухолевого процесса оценивали по данным осмотра, пальпации, маммографии, ультразвукового исследования. Во всех случаях диагноз подтвержден морфологически, проведено иммуногистохимическое исследование и определен молекулярный подтип опухоли. Для исключения отдаленных метастазов всем больным проводилась рентгенография органов грудной клетки, остеосцинтиграфия, ультразвуковое исследование органов брюшной полости и органов малого таза. По показаниям выполнялось дополнительное обследование: ПЭТ/КТ, МРТ, СКТ. Опухолевый процесс стадировали по международной классификации TNM (7-е издание, 2010 г.).
Хирургическое лечение в объёме радикальной мастэктомии (РМЭ) с сохранением малой и большой грудной мышц получили 115 пациенток, органосохраняющее хирургическое лечение (ра-
Таблица 1/Table 1
Распределение РМЖ по молекулярному типу в группах
Distribution of molecular subtypes of breast in both groups
|
Режим лучевой терапии/ Radiotherapy regimen |
Молекулярный тип РМЖ/Molecular type of BC |
Всего/ Total |
||||
|
Люминальный А/ Luminal A |
Люминальный В/ Luminal B |
Her2+ |
Трижды-негативный/ Triple-negative |
|||
|
Her2- |
Her2+ |
|||||
|
РОД 2 Гр, СОД 50 Гр/ |
51 |
16 |
20 |
2 |
4 |
93 |
|
2 Gy per fraction, 50 Gy total dose |
(54,8 %) |
(17,2 %) |
(21,5 %) |
(2,2 %) |
(4,3 %) |
|
|
РОД 2,7 Гр, СОД 40,5 Гр/ |
103 |
52 |
26 |
9 |
33 |
223 |
|
2.7 Gy per fraction, 40.5 Gy total dose |
(46,2 %) |
(23,3 %) |
(11,7 %) |
(4 %) |
(14,8 %) |
|
|
Итого/Total |
154 |
68 |
46 |
11 |
37 |
316 |
|
(48,7 %) |
(21,5 %) |
(14,6 %) |
(3,5 %) |
(11,7 %) |
||
Таблица 2/Table 2
Распределение больных РМЖ по стадии заболевания в группах
Distribution of patients with breast cancer by stage
|
Режим лучевой терапии/ Radiotherapy regimen |
Стадия заболевания/Tumor stage |
Всего/ Total |
|||
|
IA |
IIA |
IIB |
IIIA |
||
|
РОД 2 Гр, СОД 50 Гр/ 2 Gy per fraction, 50 Gy total dose |
19 (20,4 %) |
22 (23,7 %) |
33 (35,5 %) |
19 (20,4 %) |
93 |
|
РОД 2,7 Гр, СОД 40,5 Гр/ 2.7 Gy per fraction, 40.5 Gy total dose |
68 (30,5 %) |
63 (28,2 %) |
41 (18,4 %) |
51 (22,9 %) |
223 |
|
Итого/Total |
87 |
85 |
74 |
70 |
316 |
|
(27,5 %) |
(26,9 %) |
(23,4 %) |
(22,2 %) |
||
Таблица 3/Table 3
Влияние вида хирургического лечения на формирование лимфедемы (для всех групп фракционирования)
Effect of the type of surgery on the development of lymphodema
|
Лимфедема/ Lymphodema |
Количество пациентов/Number of patients |
p |
|
|
РМЭ/Radical nastectomy |
ОСО/Organ-sparing surgery |
||
|
Нет/No |
96 (83 %) |
177 (94 %) |
<0,01 |
|
Есть/Yes |
19 (17 %) |
11 (6 %) |
|
Таблица 4/Table 4
Влияние облучения подмышечной области на формирование лимфедемы
Effect of axillary radiotherapy on the development of lymphodema
Послеоперационный курс лучевой терапии в режиме гипофракционирования до СОД 40,5 Гр в РОД 2,7 Гр получили 223 пациентки. Лучевая терапия в контрольной группе проводилась в конвенциональном режиме: РОД 2 Гр до СОД 50 Гр (n=93). Лучевое лечение в обеих группах проводилось 5 раз в неделю. Общая продолжительность лучевой терапии в исследуемой группе составила 15 рабочих дней, в контрольной группе на 10 рабочих дней больше. Обе группы сопоставимы по стадии заболевания, молекулярно-биологическому подтипу опухоли и объёму операций. В сравниваемых группах преобладал РМЖ люминального типа А (табл. 1, 2).
При проведении лучевой терапии использовались линейные ускорители электронов Philips SL-75 и SL-20. Стандартная подготовка включала в себя КТ-топометрию и дозиметрическое 2D-планирование лучевой терапии в системе «ROCS» для линейных ускорителей с энергией фотонов 6 МэВ. Лучевое воздействие на зоны регионарного метастазирования проводили в соответствии с отечественными и зарубежными рекомендациями. Системная терапия проводилась согласно отечественным и международным рекомендациям с учетом молекулярного типа опухоли, возраста пациентки и стадии заболевания.
Оценка острых лучевых реакций выполнялась в соответствии с критериями CTCAE v.4.03 [15]. Поздние лучевые повреждения ранжировались по шкале LENT SOMA [16]. Ультразвуковое исследование выполнялось после клинической оценки состояния кожи и подкожно-жировой клетчатки. Обследование проводилось на аппарате фирмы B-K Medical линейным датчиком с частотой 12 МГц. В процессе исследования использовался В ре- жим для оценки структуры и эхогенности мягких тканей, а также режимы цветового и энергетического допплеровского картирования для изучения васкуляризации облученной зоны. При оценке ультразвуковой картины во внимание принимались следующие критерии: наличие или отсутствие фиброза, снижение секуляризации и утолщение кожи (рис. 1).
Оценка качества жизни пациенток проведена при помощи опросника EQ-5D, состоящего из 2 страниц: описательная часть и визуальноаналоговая шкала (EQ VAS). Описательная часть включает в себя оценку пяти характеристик: подвижность, уход за собой, привычная повседневная деятельность, боль/дискомфорт, тревога/
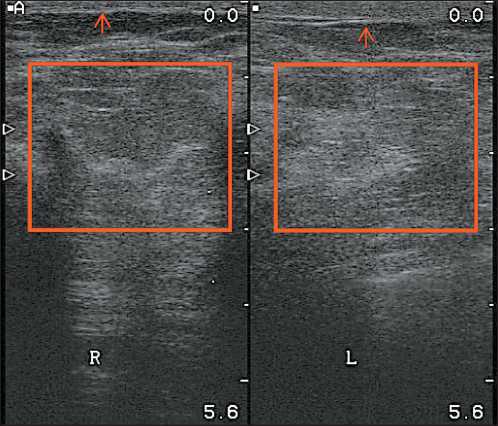
Рис. 1. УЗИ картина постлучевых изменений в левой молочной железе, утолщение кожи и выраженный фиброз в левой молочной железе
Fig. 1. Ultrasound image of post-radiation changes in the left breast. Skin thickening and severe fibrosis in the left breast депрессия. Каждая категория имеет 5 уровней: нет проблем, незначительные проблемы, умеренные проблемы, серьезные проблемы, крайне выраженные проблемы. Пациент самостоятельно заполняет опросник, делая отметку в ячейке с наиболее соответствующим описанием в каждой из 5 категорий. При последующей оценке каждая отметка переводится в цифровое выражение, где 1 – отсутствие проявления болезни, 5 – крайне тяжелая симптоматика. Визуально аналоговая шкала отражает самооценку здоровья респондента на 20сантиметровой вертикальной шкале с отметками от 0 до 100 и надписями сверху: «лучшее состояние здоровья, которое можно себе представить» и внизу: «худшее состояние здоровья, которое можно себе представить». Пациенты ставят крестик на шкале, указывая оцениваемое ими состояние здоровья, а затем переносят полученное по шкале значение в квадрат. Эта информация используется для оценки состояния здоровья пациентов [17, 18].
Статистическая обработка проводилась при помощи общепринятых статистических методик: критерия χ2, точного критерий Фишера, парного критерий Стьюдента. Накопление, хранение и обработку информации проводили на персональном компьютере с помощью электронных таблиц Microsoft Excel. Статистическую обработку про- водили в программе SPSS версии 22. Различия считались статистически значимыми при p<0,05.
Результаты
Нами были проанализированы случаи возникновения лимфедемы. Изучены факторы, повлиявшие на их возникновение. Полученные результаты указывают на то, что при выполнении РМЭ значимо увеличивается риск формирования отека верхней конечности (p<0,01). Напротив, органосохраняющие операции (ОСО) оказались более безопасными в этом отношении (табл. 3). Частота развития лимфедемы при радикальных мастэктомиях составила 17 %, что в 2,8 раза выше, чем при ОСО – 6 %.
В свою очередь, режим фракционирования статистически достоверно не повлиял на формирование лимфатического отека верхней конечности. Данное осложнение в основной группе возникало в 8 % случаев, в контрольной – в 14 %. В 38 случаях проводилось облучение подмышечной области. У 14 пациенток в отдаленном периоде возник отек верхней конечности. В группе пациенток, которым не проводилось облучение аксиллярной области, в 17 из 278 случаев была отмечена лимфедема верхней конечности. Частота лимфедемы (табл. 4) в случае облучения подмышечной области со-
Таблица 5/Table 5
Данные по прогнозируемой частоте проявления лимфедемы в зависимости от УЗИ-критериев Predicted incidence of lymphedema depending on ultrasound criteria
|
Критерий/ Criterion |
Частота проявления лимфостаза/ Frequency of lymphostasis |
Чувствительность/ Sensitivity |
Специфичность/ Specificity |
|
Фиброз/Fibrosis |
25 % |
93 % |
45 % |
|
Утолщение кожи/Skin thickening |
30 % |
83 % |
62 % |
|
Снижение васкуляризации/ Vascularization reduction |
28 % |
67 % |
67 % |
Таблица 6/Table 6
Данные по индексу состояния EQ-5D-5L Crosswalk Index пациенток до и после лечения
The EQ-5D-5L Crosswalk Index values before and after treatment
|
Критерий/ Criterion |
2,7–40,5 Гр/ 2.7–40.5 Gy До лечения/ После лечения/ Before treatment After treatment |
2–50 Гр/ 2–50 Gy |
|
|
До лечения/ Before treatment |
После лечения/ After treatment |
||
|
Среднее значение, стандартное отклонение/ Mean, standard deviation |
0,774 ± 0,082 0,782 ± 0,110 |
0,789 ± 0,061 |
0,795 ± 0,072 |
|
Доверительный интервал/ Confidence interval |
0,750 ^ 0,798 0,750 ^ 0,798 |
0,768 * 0,810 |
0,770 ^ 0,820 |
В табл. 5 представлены данные по прогностической ценности УЗИ-критериев (фиброз, утолщение кожи, снижение васкуляризации) в отношении проявления лимфатического отека верхней конечности. Частота проявления всех трех критериев была достоверно выше в исследуемой группе по точному критерию Фишера (р<0,01). Можно отметить, что наиболее сбалансированным с точки зрения чувствительности и специфичности оказался критерий «утолщение кожи». Менее ценным с точки зрения чувствительности оказался критерий «снижение васкуляризации». Фиброз был наиболее встречаемым сопутствующим фактором у пациенток с лим-фостазом (частота в 8,9 раза выше, чем в контроле).
Это отражается на высоком значении чувствительности данного показателя (93 %), однако низкая специфичность (45 %) не позволяет рассматривать изучаемый критерий как перспективный.
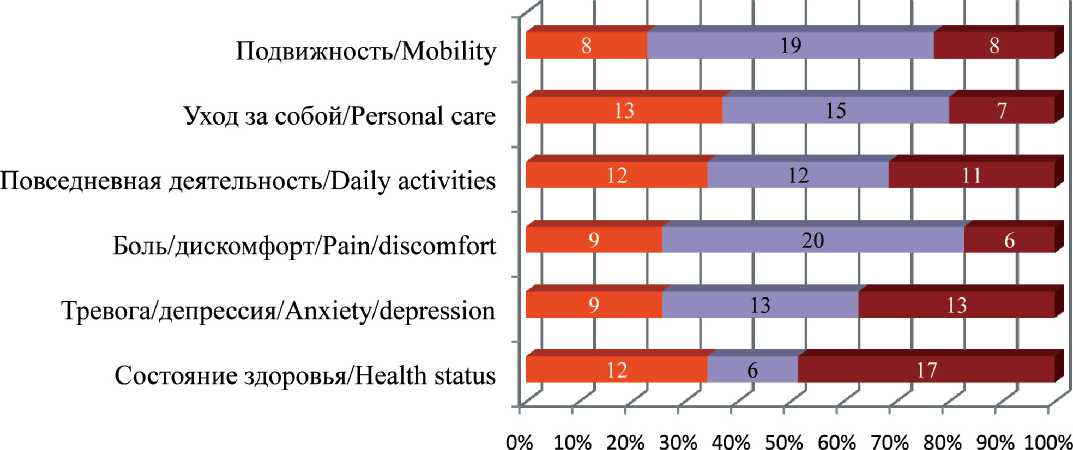
Проведена оценка качества жизни пациенток в обеих группах фракционирования при помощи опросника EQ-5D (рис. 2, 3). Сравнение ответов до и после лечения в каждой группе пациенток по парному критерию Стьюдента демонстрирует отсутствие различий показателей качества жизни при различных методиках фракционирования. В соответствии с методикой анализа опросников были рассчитаны значения индекса состояния до и после лечения в обеих исследуемых группах (табл. 6). Полученные результаты также указывают на отсутствие статистически значимых различий данного показателя между группами.
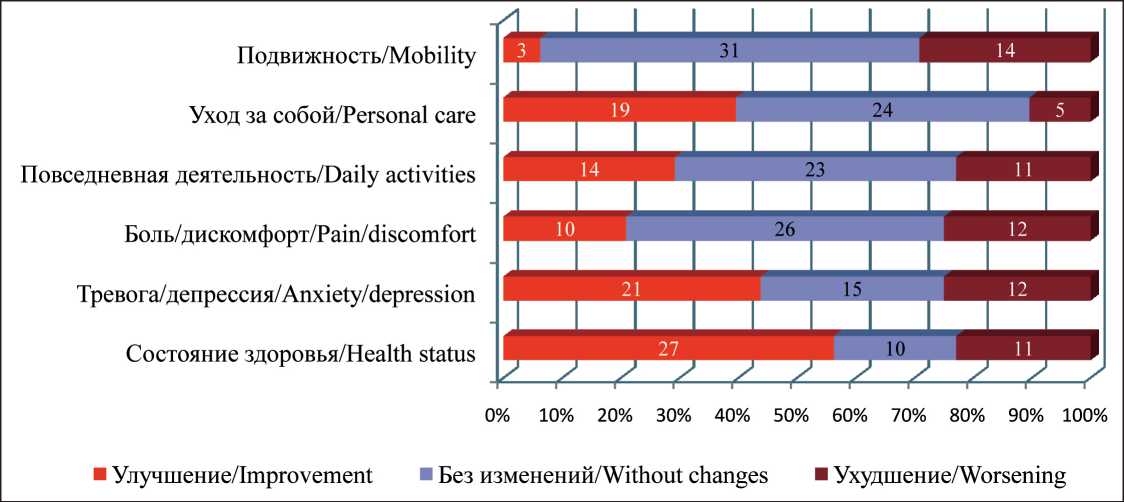
Рис. 2. Изменение состояния пациенток группы «2,7–40,5» по данным анкет EQ-5D (цифрами отмечено количество пациенток) Fig. 2. Changes in the quality of life of patients of the group «2.7–40.5» according to the questionnaire EQ-5D (the numbers indicate the number of patients)
■ Улучшение/Improvement ■ Без изменений/Without changes ■ Ухудшение/Worsening
Рис. 3. Изменение состояния пациенток группы «2–50» по данным анкет EQ-5D (цифрами отмечено количество пациенток) Fig. 3. Changes in the quality of life of patients of the group «2–50» according to the questionnaire EQ-5D (the numbers indicate the number of patients)
Обсуждение
Послеоперационная лучевая терапия в режиме ускоренного гипофракционирования является эффективным и безопасным методом лечения больных РМЖ. Рекомендации ведущих международных организаций основываются в основном на наиболее крупных исследованиях в данной области UK START. Однако применение ускоренного режима фракционирования после РМЭ по-прежнему ограничено. Результаты нашего исследования показывают, что режим ускоренного гипофракционирования может быть применим как после органосохраняющих операций, так и после РМЭ, так как не приводит к увеличению числа ранних и поздних лучевых осложнений. Наш опыт не противоречит данным зарубежных коллег. Так, в рандомизированном исследовании китайских исследователей по изучению лучевой терапии в режиме гипофракционирования у больных после мастэктомии получены сопоставимые результаты с группой классического фракционирования по показателям общей и безрецидивной выживаемости при одинаковых показателях острой и поздней лучевой токсичности. Ранняя кожная токсичность III степени оказалась выше в контрольной группе – 8 % против 3 % – в исследуемой. Отек верхней конечности в группах возникал с одинаковой частотой [19]. Анализ отдаленных результатов исследования START также показал безопасность режима гипофракционирования в отношении формирования лимфедемы [20]. На формирование отека верхней конечности повлияли такие факторы, как облучение аксиллярной области и объём операции, независимо от режима фракционирования, что должно быть учтено при формировании индивидуальных программ реабилитации пациенток и при планировании лечения.
Список литературы Анализ безопасности проведения послеоперационной лучевой терапии в режиме ускоренного гипофракционирования больным раком молочной железы I-IIIA стадии
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2018 году. М., 2018. 250 с.
- Haviland J.S., Owen J.R., Dewar J.A., Agrawal R.K., Barrett J., Barrett-Lee P.J., Dobbs H.J., Hopwood P., Lawton P.A., Magee B.J., Mills J., Simmons S., Sydenham M.A., Venables K., Bliss J.M., Yarnold J.R.; START Trialists' Group. The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised controlled trials. Lancet Oncol. 2013 Oct; 14(11): 1086-94. DOI: 10.1016/S1470-2045(13)70386-3
- Whelan T.J., Pignol J.P., Levine M.N., Julian J.A., MacKenzie R, Parpia S., Shelley W., Grimard L., Bowen J., Lukka H., Perera F., Fyles A., Schneider K., Gulavita S., Freeman C. Long-term results of hypofrac-tionated radiation therapy for breast cancer. N Engl J Med. 2010 Feb 11; 362(6): 513-20. DOI: 10.1056/NEJMoa0906260
- Rebegea L., Firescu D., Dumitru M., Anghel R. The incidence and risk factors for occurrence of arm lymphedema after treatment of breast cancer. Chirurgia (Bucur). 2015 Jan-Feb; 110(1): 33-7.
- Vieira R.A., daCosta A.M., deSouza J.L., Coelho R.R., de Oliveira C.Z., Sarri A.J., Junior R.J., Zucca-Matthes G. Risk Factors for Arm Lymphedema in a Cohort of Breast Cancer Patients Followed up for 10 Years. Breast Care (Basel). 2016 Feb; 11(1): 45-50. DOI: 10.1159/000442489


