Анализ цитотоксичности гуминовых веществ пелоидов
Автор: Жернов Юрий Владимирович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Средства коррекции экологического неблагополучия
Статья в выпуске: 1-8 т.13, 2011 года.
Бесплатный доступ
В статье рассмотрены результаты анализа цитотоксичности всех фракций гуминовых веществ пелоидов с помощью методики МТТ-диагностики. МТТ-тест проводился на клетках Т-лимфомы линии KE37.1-IIIB. Была использована спектрофотометрическая регистрация при длине волны 570 нм прибором ИФА-ридером Tecan Infinite M200. На основании полученных экспериментальных данных определено, что гуминовые, гиматомелановые, фульвовые и гумусовые кислоты не обладают выраженной цитотоксичностью в интервале исследуемых концентраций.
Гуминовые вещества, пелоиды, цитотоксичность
Короткий адрес: https://sciup.org/148199951
IDR: 148199951 | УДК: 57.083.37
Текст научной статьи Анализ цитотоксичности гуминовых веществ пелоидов
С момента открытия гуминовых веществ Францем Карлом Ахардом прошло 225 лет. За этот период был накоплен значительный материал по структуре и свойствам этих веществ, была определена их биологическая значимость для организма животных и человека. Уже в 1988 г. доктор медицины С.А. Виссер в своем выступлении на съезде Международного гуминового общества в Севилье (Испания) докладывал о возможности эффективного наружного и внутреннего применения гуминовых веществ при лечении ряда тяжелых заболеваний. На сегодняшний день доказаны многочисленные терапевтические эффекты гуминовых веществ: противовоспалительный, обезболивающий, противоотечный, гиперемический, антиревматический, антиоксидантный, антимикробный, противоопухолевый и другие. Но до сих пор в Российской Федерации не зарегистрировано в качестве лекарственного средства ни одного препарата, содержащего гуминовые вещества. В первую очередь это связано с их сложной нестехиометрической структурой. Данная проблема отягощается тем, что до сих пор не проведены исследования по оценки лекарственной цитотоксичности гуминовых веществ.
Цель исследования: оценка цитотоксичности природных высокомолекулярных органических соединений – гуминовых веществ пелоидов.
Объект исследования: фракции гуминовых веществ низкоминерализованных иловых сульфидных грязей (пелоидов): гуминовые (ГК), гиматомелановые (ГМК), фульвовые (ФК)
и гумусовые (ГсК) кислоты, которые различаются технологией извлечения из нативной грязи [1].
Гуминовые вещества относятся к поли-молекулярным полидисперсным соединениям нестехиометрического состава, имеющим стохастическое строение и включающим в свою структуру большинство известных функциональных групп органических соединений: карбонильные, спиртовые, карбоксильные, аминные и другие (рис. 1) [2].
Рис. 1. Структурный фрагмент молекулы гуминовых кислот (по Schulten, 1994)
Для количественного описания структуры изучаемых в работе гуминовых веществ пелоидов можно использовать набор параметров, включающих в себя атомные отношения конституционных элементов и их распределение между основными структурными фрагментами (табл. 1).
Материалы и методы. В данной работе использовался МТТ-тест (MTT-assay), широко применяемый в клинико-лабораторных и экспериментальных исследованиях для оценки клеточной и лекарственной цитотоксичности. Данный тест основан на способности группы ферментов, катализирующих окислительновосстановительные реакции – митохондриальных и цитоплазматических дегидрогеназ живых метаболически активных клеток, конвертировать и восстанавливать производные тетразолия – бесцветный водорастворимый 3-(4,5- диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразо-лиум бромид (синоним МТТ, желтый тетразол) в формазан (рис. 2) [3].
Таблица 1. Элементный состав, степень окисленности, бензоидности и коэффициенты экстинкции гуминовых веществ пелоидов
|
Определяемый показатель |
Фракции гуминовых веществ пелоидов |
|||||
|
ФК |
ГМК |
ГК |
ГсК |
|||
|
02 О К “ ч н О О ° О ° ’S Й а 5 5 о к ® Н н о Я 5 Й и m о |
углерод |
масс. |
28,58 ± 0,17 |
59,49 ± 0,19 |
55,18 ± 1,70 |
55,78 ± 0,01 |
|
мольн. |
19,01 ± 0,15 |
40,20 ± 0,17 |
42,89 ± 0,20 |
41,60 ± 0,74 |
||
|
водород |
масс. |
6,18 ± 0,19 |
5,22 ± 0,12 |
3,56 ± 0,36 |
4,01 ± 1,30 |
|
|
мольн. |
49,34 ± 1,60 |
42,33 ± 0,05 |
33,21 ± 0,24 |
35,88 ± 1,42 |
||
|
азот |
масс. |
2,10 ± 1,84 |
1,83 ± 1,69 |
5,16 ± 0,79 |
4,16 ± 0,91 |
|
|
мольн. |
1,20 ± 0,67 |
1,06 ± 0,54 |
3,44 ± 0,14 |
2,66 ± 0,58 |
||
|
кислород |
масс. |
58,90 ± 0,61 |
31,26 ± 0,14 |
34,10 ± 0,16 |
34,97 ± 0,14 |
|
|
мольн. |
29,36 ± 0,14 |
15,84 ± 0,05 |
19,88 ± 0,05 |
19,56 ± 0,07 |
||
|
сера |
масс. |
4,24 ± 1,47 |
2,2 ± 0,17 |
2,00 ± 0,01 |
1,08 ± 0,32 |
|
|
мольн. |
1,06 ± 0,16 |
0,56 ± 0,05 |
0,58 ± 0,25 |
0,30 ± 0,46 |
||
|
Н/С |
2,59 |
1,05 |
0,77 |
0,86 |
||
|
О/С |
1,55 |
0,39 |
0,46 |
0,47 |
||
|
степень окисленности |
+0,50 |
-0,26 |
+0,15 |
+0,08 |
||
|
степень бензоидности |
6,87 |
20,01 |
32,69 |
20,97 |
||
|
коэффициент экстинкции |
7,50 |
5,30 |
2,70 |
2,60 |
||
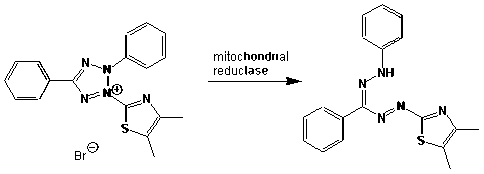
Рис. 2. Реакция перехода желтого тетразола (МТТ) в формазан, под действием митохондриальной редуктазы
Формазан кристаллизуется внутри клетки в виде фиолетово-голубых кристаллов. Перевод кристаллов формазана в раствор осуществляют с помощью подходящих органических растворителей, таких как, диметилсульфоксид (ДМСО), додецилсульфат натрия или изопропанол. Последующая спектрофотометрия этого раствора позволяет точно сопоставить изменение оптической плотности по отношению к контролю с изменением количества жизнеспособных клеток, а в цитотоксических исследованиях оценить специфическую гибель клеток, индуцированную тем или иным цитотоксическим агентом [4]. В качестве тест-культуры служили человеческие клетки Т-лимфомы линии KE37.1-IIIB. Клетки культивировали в модифицированной среде Dulbecco's Eagle's Medium (DME), содержащей 10% эмбриональной телячьей сыворотки, 4мМ L-глютамина, 1,5 г/л бикарбоната натрия, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, при 37оС во влажной атмосфере с 5% СО2 [5]. Оценка гибели клеток линии KE37.1-IIIB, индуцированной гуминовыми веществами, проводилась с помощью ИФА-ридера Tecan Infinite M200. Для этого в лунки 96-луночной плоскодонной культуральной планшеты вносили по 100 мкл суспензии клеток (~105 кл/мл) и 100 мкл исследуемой концентрации (с учетом разбавления в лунке) препарата гуминовых веществ. Планшеты инкубировали в течение 24 часов. За 4 часа до окончания инкубационного периода вносили МТТ. МТТ-тест проводили по методике Niks M. и Otto M. [5]. В каждую лунку планшеты с клеточными суспензиями вносили 20 мкл раствора МТТ (5 г/л) и инкубировали на протяжении 4 ч при 37оС в темноте во влажной атмосфере c 5% СО2. По окончании инкубации супернатант осторожно удаляли с помощью планшетного насоса, а в каждую лунку добавляли по 200 мкл ДМСО. Осадок ресуспендировали и 10 мин инкубировали в темноте при комнатной температуре. Показания оптической плотности считывали на ИФА-ридере Tecan Infinite M200 при длине волны 570 нм. Гибель Т-лимфомных клеток рассчитывали путем сравнения оптической плотности контроля среды, принятой за 100%, с оптической плотностью в опытных пробах. Цитотоксичность исследуемое вещество проявляет, если его процентный показатель оптической плотности меньше 70%. Если показатель оптической плотности превышает 70%, то данное вещество не проявляет выраженной токсичности на культуру клеток.
Результаты. МТТ-тест показал, что все исследуемые фракции гуминовых веществ пе-лоидов в исследуемом интервале концентраций от 1% до 0,00125% не оказывают выраженную цитотоксичность к клеткам Т-лимфомы человека линии KE37.1-IIIB (рис. 3). Кроме этого, в ходе эксперимента было выявлено, что гуминовые вещества пелоидов усиливают протекторную функцию исследуемой тест-культуры, так как их показатели оптической плотности превышают показатели контроля. Наибольшим протекторным эффектом обладает фракция гиматомелановых кислот пелоидов.
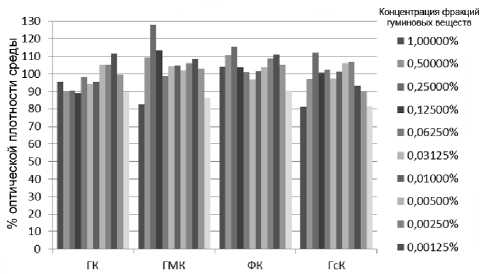
Рис. 3. Диаграмма показателей МТТ теста фракций гуминовых веществ пелоидов
Выводы: гуминовые, гиматомелановые, фульвовые и гумусовые кислоты пелоидов не обладают выраженной цитотоксичностью в интервале исследуемых концентраций, что дает возможность создания на их основе лекарственных фармако- и химиотерапевтических препаратов различного назначения. Отсутствие выраженной цитотоксичности гуминовых веществ пе-лоидов может быть обусловлена тем, что формирование живых систем организмов в процессе эволюции происходило именно в гуминовом фоне. Естественный гуминовый фон не оказывает неблагоприятного влияния на организм человека, а выполняет защитную функцию, выступая в качестве совокупности экзогенных антиоксидантных и протективных факторов.
Работа выполнена при поддержке гранта Международного гуминового общества (IHSS) на базе Институтов вирусологии и экологической химии (Institut für Ökologische Chemie (IOEC), Institut für Vi-rologie (VIRO)) Гельмгольц-Центра Мюнхен (Helmholtz Zentrum München) в 2011 г.
Список литературы Анализ цитотоксичности гуминовых веществ пелоидов
- Аввакумова, Н.П. Пелоидопрепараты как средство повышения эффективности пелоидотерапии. Сообщение 2. Способ получения пелоидопрепаратов гуминового ряда/Н.П. Аввакумова, Е.К. Баталова, А.И. Агапов//Вопросы курортологии, физиотерапии и лечебной физкультуры. 1999. № 2. С. 74-77.
- Чуков, С.Н. Структурно-функциональные параметры органического вещества почв в условиях антропогенного воздействия//СПб., Санкт-Петербургский государственный университет, 2007. С. 142.
- Mosmann, Tim. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays//J. Immunol. Methods. 1983. Vol. 65 (1-2). Р. 55-63.
- Kremb, S. EASY-HIT: HIV Full-Replication Technology for Broad Discovery of Multiple Classes of HIV Inhibitors/S. Kremb, M. Helfer, W. Heller et al.//Antimicrobial Agents and Chemotherapy. December 2010. Vol. 54, No. 12. P. 5257-5268.
- Niks, M. Towards an optimized MTT assay/M. Niks, M. Otto//J. Immunol. Meth. 1990. Vol. 130, № 1. P. 149-151.


