Анализ дефицита гомологичной рекомбинации при раке предстательной железы
Автор: Иевлева А.Г., Алексахина С.Н., Соколенко А.П., Отраднова Е.А., Никитина А.С., Кашко К.А., Смина М.В., Морозова Н.С., Шестакова А.Д., Кулигина Е.Ш., Имянитов Е.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.24, 2025 года.
Бесплатный доступ
Актуальность. Мутации в генах репарации ДНК по механизму гомологичной рекомбинации (Homologous Recombination Repair, HRR) ( BRCA2, ATM, CHEK2, NBN и др.) обнаруживаются у 20-25 % пациентов с метастатическим раком предстательной железы (РПЖ) и служат основанием для назначения терапии PARP-ингибиторами. Чувствительность к этим препаратам обусловлена дефицитом гомологичной рекомбинации (Homologous Recombination Deficiency, HRD) в опухоли. Роль повреждений в иных генах, помимо BRCA1/2 , в возникновении HRD до сих пор полностью не выяснена. Цель исследования - оценить присутствие дефицита гомологичной рекомбинации ДНК при РПЖ с мутациями в разных генах HRR. Материал и методы. Парные образцы опухолевой и нормальной ДНК от 272 пациентов с РПЖ были исследованы при помощи таргетной NGS-панели HiSNP Ultra Panel v1.0 (Nanodigmbio). На основании полученных профилей нарушений копийности был определен индекс HRD, объединяющий 3 характеристики хромосомной нестабильности: количество протяженных участков потери гетерозиготности (LOH), хромосомных разрывов между фрагментами разной копийности длиной более 10 Мб (LST) и участков аллельного дисбаланса в области теломер (TAI). Величина индекса HRD была сопоставлена в разных категориях РПЖ при помощи критерия Манна-Уитни.
Рак предстательной железы, дефицит гомологичной рекомбинации, хромосомная нестабильность, индекс hrd, мутации в генах гомологичной рекомбинации, parp-ингибиторы
Короткий адрес: https://sciup.org/140309648
IDR: 140309648 | УДК: 616.65-006.6:575.113 | DOI: 10.21294/1814-4861-2025-24-1-59-69
Текст научной статьи Анализ дефицита гомологичной рекомбинации при раке предстательной железы
Рак предстательной железы (РПЖ) является вторым по частоте злокачественным новообразованием у мужчин. В отличие от локализованных форм, имеющих практически 100 % 5-летнюю выживаемость, метастатический гормонорезистентный РПЖ (мгрРПЖ) плохо поддается терапии и характеризуется неблагоприятным прогнозом [1]. Важным шагом для поиска новых возможностей терапии РПЖ стало установление высокой частоты нарушений в генах репарации ДНК, в частности гомологичной рекомбинации ДНК (homologous recombination repair, HRR), при данном типе опухолей. До 20–25 % метастатических карцином простаты содержат наследственные или соматические мутации в генах HRR. Дефицит репарации по механизму гомологичной рекомбинации (homologous recombination repair deficiency, HRD) делает опухолевые клетки уязвимыми к ДНК-повреждающим воздействиям и ассоциирован с чувствительностью к производным платины и ингибиторам поли(АДФ-рибоза)-полимеразы (PARP-ингибиторам). В 2020 г. PARP-ингибиторы олапариб и рукапариб были одобрены к применению для мгрРПЖ с мутациями в генах репарации ДНК; в дальнейшем одобрение получили также комбинации олапариба, рукапариба и нирапариба с антиандрогенными препаратами второго поколения [2].
Несмотря на эти многообещающие результаты, ряд вопросов относительно генетической диагностики и отбора пациентов на терапию PARP-ингибиторами при РПЖ остается открытым. К примеру, дизайн исследований PARP-ингибиторов при РПЖ предусматривал тестирование ограниченного числа генов гомологичной рекомбинации (ATM, BRCA1, BRCA2, BARD1, BRIP1, CDK12, CHEK2, FANCA, NBN, PALB2, RAD51, RAD51B, RAD51C, RAD51D, RAD54L). Очевидно, что поиск отдельных мутаций может «упускать» опухоли с феноменом HRD, вызванным повреждениями не включенных в панели локусов или иными, например эпигенетическими, причинами.
Более универсальным по сравнению с поиском отдельных мутаций способом предсказания чувствительности к ДНК-повреждающей терапии может служить анализ функциональных последствий дефицита репарации ДНК. На примере BRCA1/2 -ассоциированных опухолей показано, что отсутствие эффективной коррекции двуни-тевых разрывов ДНК в геноме приводит к повышенной хромосомной нестабильности за счет активации альтернативных, менее точных путей репарации, и появлению специфических профилей структурных и однонуклеотидных мутаций. Для BRCA1/2 -зависимых карцином характерны присутствие профиля однонуклеотидных замен 3-го типа (COSMIC mutational signature 3), особого паттерна потерь гетерозиготности, повышенное число делеций с гомологичными фланкирующими областями, преобладание делеций над инсерция-ми, повышенная частота делеций размером более 10 п.о. и др. [3–5] Наиболее надежная идентификация последствий дефицита гомологичной рекомбинации достигается с помощью полногеномного или полноэкзомного секвенирования, однако эти методы недоступны для рутинного практического использования.
Приемлемой альтернативой может выступать анализ отдельных показателей геномной нестабильности и признаков HRD на основе таргет-ных панелей для NGS. В 2016 г. был предложен т.н. индекс HRD (HRD score), объединяющий 3 характеристики хромосомной нестабильности: количество участков потери гетерозиготности размером более 15 Мб (genomic LOH), хромосомных разрывов между фрагментами с разной копийно-стью протяженностью более 10 Мб (large-scale state transitions, LST) и участков аллельного дисбаланса в области теломер (telomeric allelic imbalance, TAI) [6]. Этот показатель имеет предиктивное значение для PARP-ингибиторов и препаратов платины при раке молочной железы (РМЖ) и раке яичника (РЯ) [6–11]. Диагностическая и предиктивная роль этих характеристик при РПЖ менее изучена. Неизвестно также, какие пороговые значения HRD score или аналогичных показателей значимы для РПЖ: имеются сведения о том, что в случае мутаций BRCA1/2 при РПЖ уровень хромосомной нестабильности в целом ниже, чем при BRCA -зависимом РМЖ или РЯ [12, 13].
Цель исследования – изучение феномена дефицита гомологичной рекомбинации при РПЖ с помощью определения индекса HRD, а также сопоставление этого индекса у пациентов с мутациями в разных генах HRR.
Материал и методы
Материалом для исследования послужили опухоли предстательной железы от пациентов, прошедших молекулярно-генетическое тестирование в НМИЦ онкологии им. Н.Н. Петрова в 2022–24 гг., c известным статусом мутаций в генах HRR. В число исследованных случаев вошла группа из 58 РПЖ с патогенными/предположительно патогенными мутациями в хотя бы одном из 34 генов HRR (табл. 1) и группа из 214 РПЖ без мутаций. Статус задействованных в HRR генов (BRCA1, BRCA2, ATM, PALB2, BARD1, RAD51, RAD51B, RAD51C, RAD51D, RAD54L, CDK12, BRIP1, CHEK2, FANCA, NBN, ATR, BLM, CHEK1, FANCC, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCL, FANCM, MRE11, PPP2R2A, RAD50, RAD52, RBBP8, RPA1, SLX4, XRCC2, TP53) был определен при помощи таргетного высокопроизводительного секвенирования с использованием панели HRR35 (Nanodigmbio, КНР). Оценка профилей нарушений копийности в исследуемой выборке была осуществлена в результате таргетного NGS-анализа с применением панели HiSNP Ultra Panel v1.0 (Nanodigmbio, КНР). Панель зондов HiSNP позволяет проанализировать статус более 52 000 частых однонуклеотидных полиморфизмов (SNP) с шагом около 50Kb и подходит для определения показателя дефицита гомологичной рекомбинации HRD score (индекс HRD). Материалом для NGS-анализа служили парные образцы ДНК, выделенные из лейкоцитов крови и архивных опухолевых образцов, содержащих не менее 10 % опухолевых клеток. Выделение ДНК из срезов архивного гистологического опухолевого материала выполнялось с применением набора ExtractDNA FFPE (Евроген, Россия).
Для пробоподготовки ДНК-библиотек для секвенирования применялся набор реактивов NadPrep EZ DNA Library Preparation Kit (Nanodigmbio, КНР). Концентрация и качество полученных ДНК-библиотек оценивались на флуориметре Qubit (Thermo Fisher Scientific) и на фрагментном анализаторе Fragment Analyzer 5200 (Agilent). ДНК-библиотеки с концентрацией не менее 500 нг смешивали для обогащения по 12 штук. Обогащение с таргетными зондами выполнялось с применением набора реактивов NadPrep Hybrid Capture Reagents (Nanodigmbio, КНР) по протоколу производителя. Для циркуляризации библиотек использовался набор NadPrep Universal Circularization Kit (Nanodigmbio, КНР). Секвенирование готовых ДНК-библиотек выполнялось в режиме парных прочтений по 150 циклов в каждую сторону на оборудовании DNBSEQ-50 (MGItech, КНР).
Первичная биоинформатическая обработка данных секвенирования состояла из стандартных этапов: генерации файлов FASTQ, оценки качества и выравнивания полученных последовательностей на референсный геном человека hg19 с помощью инструмента BWA. Анализ соматических нарушений копийности и построение соответствующих графиков (CNV plots) были выполнены с помощью интегрированного в пакет GATK инструмента
Таблица 1/table 1
characteristics of the studied prostate cancer sample
|
Параметры/Parameters |
Выборка РПЖ/PC sample (n=272) |
|
Медиана возраста на момент диагноза (возрастной диапазон), лет/ Median age (age range), years |
65 (42–85) |
|
Размер опухоли (T)/Tumor size (T) |
|
|
T1 |
7 (2,6 %) |
|
T2 |
52 (19,1 %) |
|
T3 |
65 (23,9 %) |
|
T4 |
36 (13,2 %) |
|
nd |
112 (41,2 %) |
|
Вовлеченность лимфоузлов (N)/Lymph node involvement (N) |
|
|
N0 |
73 (26,8 %) |
|
N1 |
77 (28,3 %) |
|
nd |
122 (44,9 %) |
|
Отдаленные метастазы (М)/Distant metastasis (М) |
|
|
M0 |
55 (20,2 %) |
|
M1 |
97 (35,7 %) |
|
nd |
120 (44,1 %) |
|
Стадия/Stage |
|
|
1 |
6 (2,2 %) |
|
2 |
24 (8,8 %) |
|
3 |
11 (4,0 %) |
|
4 |
109 (40,1 %) |
|
Нет данных/No data |
122 (44,9 %) |
|
Индекс Глисона/Gleason score |
|
|
<8 |
162 (59,6 %) |
|
≥8 |
81 (29,8 %) |
|
nd |
29 (10,7 %) |
|
Присутствие мутаций в генах HRR/Mutations in HRR genes |
|
|
Да/Yes |
58 (21,3 %)* |
|
Нет/No |
214 (78,7 %) |
Примечания: * – включая мутации BRCA2 (n=9), ATM (n=12), CHEK2 (n=8), NBN (n=4), CDK 12 (n=4), FANCM (n=3), BRCA1 (n=3), BLM (n=3), MRE11 (n=2), сочетание мутаций ATM и BRCA2 (n=1), ATM и BRCA1 (n=1), CHEK2 и ATM (n=1), по одному случаю с мутациями ATR, BARD1, BRIP1, FANCA, FANCG, RAD54L, XRCC2 ; таблица составлена авторами.
Характеристика исследованной группы РПЖ
Notes: * Including mutations in BRCA2 (n=9), ATM (n=12), CHEK2 (n=8), NBN (n=4), CDK 12 (n=4), FANCM (n=3), BRCA1 (n=3), BLM (n=3), MRE11 (n=2), mutations in ATM and BRCA2 (n=1), ATM and BRCA1 (n=1), CHEK2 and ATM (n=1), and single mutations in ATR, BARD1, BRIP1, FANCA, FANCG, RAD54L, XRCC2 ; created by the authors.
ACNV [14]. Индекс HRD рассчитывался как сумма показателей LOH, TAI и LST [6].
Сравнение величины индекса HRD в разных категориях РПЖ выполнялось с помощью критерия Манна–Уитни. Распределение клинических характеристик в группах больных с высоким и низким HRD score с осуществлялось с использованием точного критерия Фишера.
Результаты
Индекс HRD при РПЖс мутациями в генах HRR
Индекс HRD был проанализирован по отдельности в группах опухолей с мутациями в генах BRCA2, ATM, CHEK2, NBN, BRCA1 и CDK12 и среди остальных РПЖ с единичными мутациями в разных генах – участниках системы HRR. В 9
случаях с мутациями BRCA2 (6 наследственных и 3 соматических мутации) (рис. 1) медиана индекса составила 41, и в 8 из 9 случаев он был выше 25. Из 6 РПЖ с герминальными мутациями 5 имели потерю гетерозиготности (Loss Of Heterozygosity, LOH) BRCA2 в опухоли, величина индекса HRD в них составила 25, 38, 40, 42, 105.
В 12 РПЖ с мутациями ATM (8 соматических мутаций, 2 наследственные с потерей гетерозиготности в опухоли и 2 случая с сочетанием наследственной и соматического вариантов) медиана HRD score (22,5) оказалась ниже, чем в BRCA2-ассоциированных опухолях, с пограничным уровнем достоверности (p=0,051, Mann–Whitney).
В группе из 8 опухолей с мутациями CHEK2 (7 наследственных мутаций, включая 3 случая потери гетерозиготности в опухоли, и 1 соматическая) индекс HRD также был ниже, чем в РПЖ c мутациями BRCA2 (медиана – 7,5, p=0,006) или ATM (p=0,041).
В оставшихся 29 случаях с повреждениями различных генов системы HRR медиана индекса HRD составила 14, что было значимо ниже, чем в присутствии мутаций BRCA2 (p=0,004). При этом в 4 опухолях с мутациями NBN (2 наследственные мутации без LOH и 2 соматические) индекс HRD равнялся 0, 3, 9, 46; а в трех РПЖ с мутациями BRCA1 (2 герминальных без LOH и одно сочетание наследственного и соматического варианта) – 5, 6 и 20.
В анализ были включены 4 РПЖ с соматическими вариантами CDK12 , в двух из них в опухоли присутствовали двойные мутации. Примечательно, что в обеих карциномах с двойными мутациями наблюдался высокий уровень хромосомной нестабильности (HRD score 39 и 48), в то время как в РПЖ с единичными мутациями CDK12 – более низкий (HRD score 8 и 21).
Индекс HRD при РПЖбез мутаций в генах HRR
Среди 214 РПЖ без выявленных повреждений в генах HRR индекс HRD был существенно ниже (медиана 9), чем в BRCA2 -ассоциированных карциномах (p=0,0003), не отличался от группы с отдельными менее частыми мутациями в разных генах HRR (n=29) (p=0,448) и был несколько ниже, чем в опухолях с мутациями ATM (p=0,05).
Помимо напрямую задействованных в HRR локусов, во всех опухолях были протестированы мутации в гене TP53 . Сравнение карцином с соматическими вариантами TP53 (n=35) и без них
(n=179) продемонстрировало ассоциацию между статусом TP53 и индексом HRD. Этот показатель был значительно выше при наличии мутаций TP53 (медиана HRD score – 28 и 8 соответственно, p<0,00001). Данная закономерность не наблюдалась при анализе HRR-позитивных случаев (p=0,441) (рис. 2).
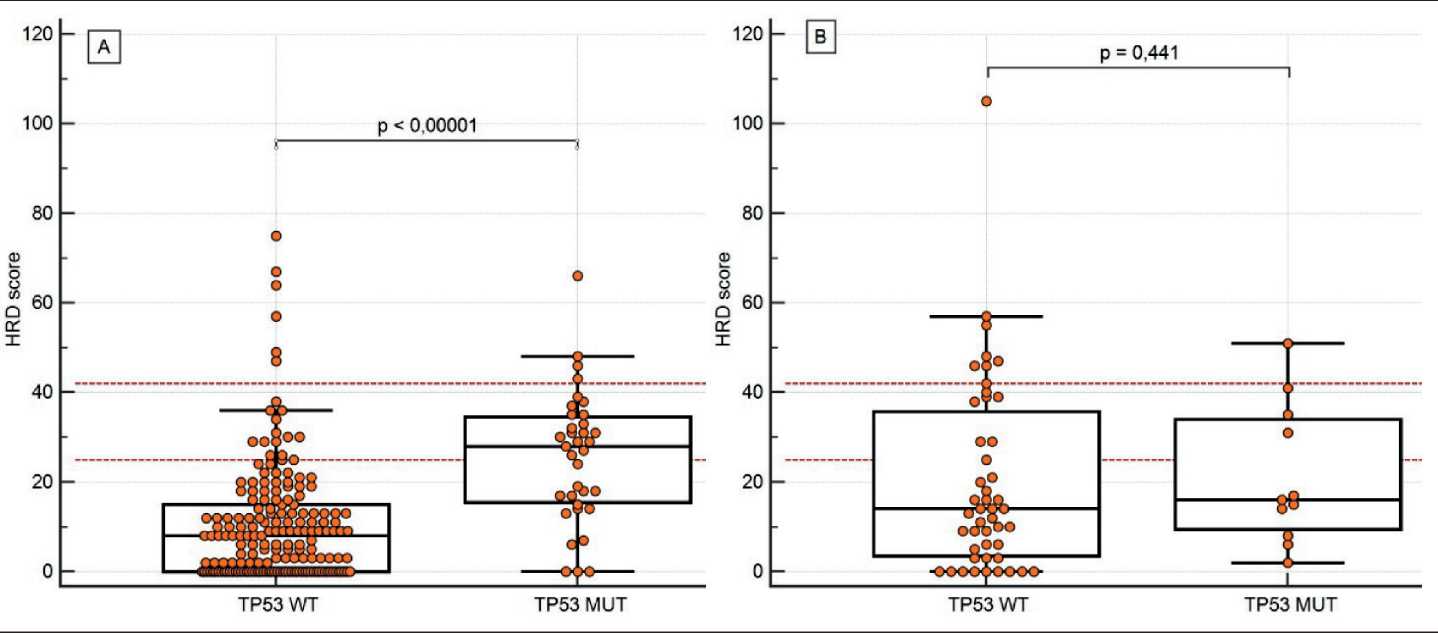
Рис. 2. Ассоциация между индексом HRD и присутствием соматических мутаций TP53: А – в опухолях без мутаций HRR;
B – в опухолях с мутациями HRR. Горизонтальными линиями отмечены пороговые значения индекса HRD: предлагаемое в данной работе (25) и «традиционное» (42). Примечание: рисунок выполнен авторами
Fig. 2. Association between HRD index and the presence of somatic TP53 mutations. A – in tumours without HRR mutations;
B – in tumours with HRR mutations. Horizontal lines indicate HRD index thresholds: proposed in this study (25) and “traditional” (42). Note: created by the authors
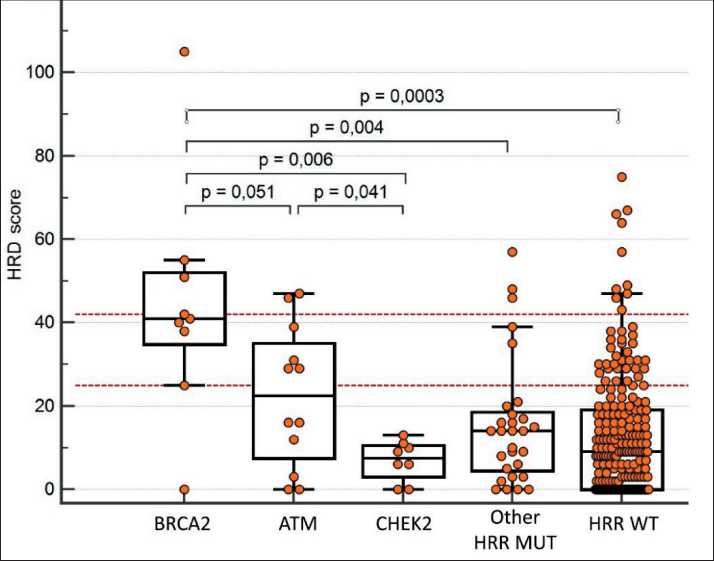
Рис. 1. Распределение индекса HRD в РПЖ c мутациями в генах BRCA2, ATM, CHEK2, других генах HRR (Other HRR MUT) и в опухолях без выявленных мутаций HRR (HRR WT). Горизонтальными линиями отмечены пороговые значения индекса HRD: предлагаемое в данной работе (25) и «традиционное» (42). Примечание: рисунок выполнен авторами Fig. 1. Distribution of HRD index in BCR with mutations in BRCA2, ATM, CHEK2, other HRR genes (Other HRR MUT) and in tumours without identified HRR mutations (HRR WT). Horizontal lines indicate HRD index thresholds: proposed in this paper (25) and “traditional” (42). Note: created by the authors
Выбор порогового значения индекса HRD для определения наличия дефицита гомологичной рекомбинации при РПЖ
Биаллельная инактивация гена BRCA2 – классический пример генетических нарушений, приводящих к дефициту гомологичной рекомбинации. Общепринятое пороговое значение индекса HRD для диагностики дефицита гомологичной рекомбинации (42) было рассчитано при анализе BRCA1/2 -позитивных карцином яичника: 95 % таких опухолей имели индекс ≥42 [6]. Для определения порогового значения при РПЖ мы применили аналогичный подход, то есть использовали BRCA2 -позитивные опухоли в качестве «эталона». Практически все РПЖ c мутациями BRCA2 (8/9, 89 %), за исключением одного случая без потери гетерозиготности, имели HRD score ≥25. Эта величина была принята в качестве альтернативного порогового значения для разграничения присутствия/ отсутствия HRD. При использовании этого порога доля случаев с предполагаемым дефицитом гомологичной рекомбинации составила 19/58 (32,8 %) при РПЖ c любыми мутациями HRR (включая BRCA2, ATM, CHEK2 и более редкие мутации) и 40/214 (18,7 %) в опухолях без мутаций (p=0,03). Помимо BRCA2 -ассоциированных опухолей, среди РПЖ c мутациями HRR индекс HRD ≥25 наблюдался при мутациях ATM (n=6), CDK12 (n=2), FANCA (n=1), FANCM (n=1), NBN (n=1).
Анализ ассоциаций между дефицитом гомологичной рекомбинации и клиническими параметрами
Индекс HRD выше 25 ассоциировался с высоким (≥8) индексом Глисона, вовлеченностью региональных лимфоузлов (N1), первичнометастатическим заболеванием (M1) и не был связан с возрастом пациентов или размером первичной опухоли (табл. 2).
Обсуждение
Критерием для отбора пациентов на лечение PARP-ингибиторами в клинической практике является идентификация наследственных или соматических повреждений в генах HRR. Например, препарат олапариб может быть назначен при наличии мутации в любом из 14 вошедших в первоначальное клиническое испытание генов HRR. Вместе с тем, все больше клинических и экспериментальных данных свидетельствуют о разном вкладе этих генов в формирование HRD и эффективность терапии. Так, в исследовании олапариба очевидный позитивный эффект наблюдался у больных с мутациями BRCA1/2 , а в присутствии повреждений ATM или других генов он был минимальным или отсутствовал [15]. Изучение процессов мутагенеза при инактивации разных участников системы HRR показало, что «выключение» BRCA1/2, RAD51, XRCC2, PALB2 приводит к формированию характерных для дефицита репарации ДНК мутационных профилей и связано с чувствительностью клеток к препаратам платины, PARP-ингибиторам, антрациклинам, ингибиторам топоизомеразы II и I. В то же время ATM-/- и CHEK2-/- клеточные линии не были чувствительны к вышеперечисленным группам препаратов и не имели характерных для HRD геномных профилей [16]. В недавно опубликованном метаанализе был сделан вывод, что применение PARP-ингибиторов целесообразно при мутациях BRCA1/2, PALB2,
Таблица 2/table 2
Анализ ассоциаций между дефицитом гомологичной рекомбинации и клиническими параметрами associations between homologous recombination deficiency and clinical parameters
|
Параметры/Parameteres |
Индекс HRD<25/ HRD score <25 (n=213) |
Индекс HRD ≥25/ HRD score ≥25 (n=59) |
Значимость отличий, p/ Significance of comparison, p |
|
Медиана возраста (возрастной диапазон), лет/ Median age (age range), years |
65 (42–85) |
65 (47–75) |
0,796 |
|
Размер опухоли (T)/Tumor size (T) |
|||
|
T1–2 |
43 (38,4 %) |
16 (33,3 %) |
0,595 |
|
T3–4 |
69 (61,6 %) |
32 (66,7 %) |
|
|
Вовлеченность лимфоузлов (N)/Lymph node involvement (N) |
|||
|
N0 |
62 (58,5 %) |
11 (25,0 %) |
0,0003 |
|
N1 |
44 (41,5 %) |
33 (75,0 %) |
|
|
Отдаленные метастазы (М)/Distant metastasis (М) |
|||
|
M0 |
44 (41,9 %) |
11 (23,4 %) |
0,030 |
|
M1 |
61 (58,1 %) |
36 (76,6 %) |
|
|
Индекс Глисона/Gleason score |
|||
|
<8 |
146 (75,7 %) |
15 (30,6 %) |
0,0001 |
|
≥8 |
47 (24,4 %) |
34 (69,4 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
CDK12 и не эффективно при генетических дефектах ATM или CHEK2 [17]. По совокупности имеющихся данных можно выделить гены с позитивной ( BRCA1/2, PALB2, RAD51, RAD54L ) или предположительно меньшей/негативной предиктивной значимостью ( ATM, CHEK2 ) [15, 16, 18] в отношении PARP-ингибиторов. Одновременно с этим для значительного числа повреждений в других генах, задействованных в репарации ДНК ( NBN, FANCM, FANCA, BLM, MRE11A, BARD1, BRIP1 и др.), сведения о влиянии на формирование HRD или эффективность терапии пока практически отсутствуют.
Основной задачей данного исследования стало сопоставление величины индекса HRD при повреждениях в различных генах HRR с целью установить, какие из них действительно ассоциируются с повышением хромосомной нестабильности по типу HRD. Помимо наиболее часто встречающихся при РПЖ нарушений, затрагивающих BRCA2, ATM и CHEK2, в работу были включены опухоли с мутациями в генах NBN (n=4), FANCM (n=3), BLM (n=3), MRE11A, ATR, BARD1, BRIP1, FANCA, FANCG, RAD54L, XRCC2. Результаты исследования продемонстрировали, что только меньшая часть РПЖ с мутациями HRR имеет выраженный дефицит гомологичной рекомбинации (HRD score ≥42) и что инактивация разных генов действительно связана с неодинаковым уровнем хромосомной нестабильности. В частности, опухоли с мутациями BRCA2 имели значительно более высокий индекс HRD, чем все остальные категории РПЖ – карциномы без мутаций HRR, с мутациями в генах ATM и CHEK2 или в других локусах HRR (рис. 1). Помимо BRCA2-ассоциированных опухолей, HRD score ≥42, являющийся общепринятым пороговым значением для диагностики HRD, наблюдался только в 5 случаях: в РПЖ с мутациями ATM (n=2), CDK12 (n=1), NBN (n=1), FANCM (n=1). Вместе с тем, HRD score ≥42 был обнаружен только в 4 из 9 BRCA2-позитивных карцином. Данный порог является клинически значимым при РМЖ и РЯ и позволяет выявить 95 % BRCA-позитивных опухолей этих локализаций [6]. Наши данные и результаты нескольких подобных исследований указывают на то, что для РПЖ, в том числе BRCA2-ассоциированного, характерны более низкие значения HRD score [12, 13, 19]. Это, в свою очередь, может означать, что клинически релевантный пороговый уровень индекса HRD при РПЖ также может отличаться от значения 42. Мы применили в качестве альтернативного порогового уровня величину индекса, которая позволяет идентифицировать практически все (8/9, 89 %) BRCA2-ассоциированные РПЖ. При таком пороговом значении к категории HR-дефицитных опухолей были отнесены 40/214 (18,7 %) РПЖ без выявленных мутаций HRR. Можно отметить, что четверть из них (то есть 10/214, 4,7 % случаев без мутаций HRR) имели HRD score выше 42. Таким образом, анализ хромосомной нестабильности с применением как более строгого (HRD score ≥42), так и предлагаемого более «мягкого» критерия (HRD score ≥25,) позволяет значительно расширить круг пациентов, которым может быть показано лечение PARP-ингибиторами или препаратами платины.
Причинами высокой геномной нестабильности в РПЖ без выявленных мутаций HRR могут быть биаллельные соматические делеции BRCA2 – известно, что до трети всех случаев HRD при метастатических опухолях простаты связаны с т.н. глубокими делециями (deep deletions) этого гена, которые невозможно детектировать без специальных методов анализа и/или полногеномного секвенирования [20–22]. Помимо этого, причинами HRD могут выступать эпигенетическая инактивация участников HRR или мутации генов, не вошедших в число 34 проанализированных в данной работе локусов.
В исследуемую выборку вошли 4 случая с мутациями BRCA1 : 1 – с сочетанием наследственного и соматического вариантов, 2 – с наследственной мутацией без LOH в опухоли, 1 – с герминальной мутацией BRCA1 без LOH и с соматической мутацией ATM . Примечательно, что ни в одном из них индекс HRD не превысил установленный пороговый уровень 25. Эти результаты согласуются с данными о том, что при РПЖ биаллельная инактивация BRCA1 встречается значительно реже, чем BRCA2 , и, соответственно, BRCA1 -ассоциированные опухоли реже имеют признаки HRD [13].
В нашем исследовании была подтверждена ассоциация между повышенным уровнем хромосомной нестабильности и соматическими мутациями TP53 , которая была описана при раке простаты и опухолях других локализаций [12, 23, 24]. Эта ассоциация, однако, была справедливой лишь в группе опухолей без идентифицированных повреждений в генах HRR. Вероятно, мутации TP53 можно считать суррогатным маркером или дополнительным фактором для скрининга HRD в таких опухолях – более половины (57 %) TP53 -мутированных РПЖ имели индекс HRD выше 25, из них 11,4 % – выше 42.
Клиническую значимость предлагаемого порогового уровня индекса HRD, а также возможность использовать мутации TP53 в качестве дополнительного маркера HRD при опухолях предстательной железы предстоит определить в дальнейших клинических исследованиях.
Заключение
В отличие от РПЖ c мутациями BRCA2 , большинство опухолей c мутациями в генах CHEK2, NBN, BLM, FANCM, BRCA1 , по-видимому, не характеризуются выраженным дефицитом гомологичной рекомбинации. В случае повреждений гена ATM только часть РПЖ имеет высокий индекс
HRD. По сравнению c поиском мутаций HRR определение индекса HRD позволяет выявить значительное число дополнительных случаев РПЖ с дефицитом гомологичной рекомбинации, потенци- ально чувствительных к PARP-ингибиторам. Присутствие соматических мутаций TP53 в опухолях без мутаций HRR ассоциировано с повышенным уровнем хромосомной нестабильности.


