Анализ факторов риска осложнений каротидной эндартерэктомии в ранний период после инсульта
Автор: Якубов Р.А., Хайрутдинов А.И., Тарасов Ю.В., Валиуллин Д.Х., Якубова В.Т., Комаров Р.Н., Щаницын И.Н., Бажанов С.П.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нейрохирургия
Статья в выпуске: 3 т.18, 2022 года.
Бесплатный доступ
Цель: анализ предикторов осложнений каротидной эндартерэктомии в ранний восстановительный период после инсульта. Материал и методы. Проведен ретроспективный анализ результатов ранней каротидной эндартерэктомии у 88 пациентов с симптомным стенозом внутренней сонной артерии (ВСА) более 50% (по данным NASCET, North American Symptomatic Carotid Endarterectomy Trial) в сроки до 30 дней после инсульта. Проведен однофакторный и регрессионный анализ предикторов инсульта, инфаркта миокарда, 30-дневной летальности. Результаты. Ипсилатеральный инсульт наблюдался у трех пациентов (3,4%). В одном случае инсульт был летальным. Среди значимых факторов риска при однофакторном анализе выявлены женский пол (р=0,009; ОШ=5,31; ДИ95%: 3,42-8,26), стеноз оперированной артерии
Острый инсульт, ранняя каротидная эндартерэктомия, стеноз сонной артерии, факторы риска
Короткий адрес: https://sciup.org/149141762
IDR: 149141762 | УДК: 616.133:616-009.86
Текст научной статьи Анализ факторов риска осложнений каротидной эндартерэктомии в ранний период после инсульта
1Введение . Последние международные руководства по профилактике повторного инсульта при атеросклеротическом поражении ВСА рекомендуют выполнение каротидной эндартерэктомии (КЭАЭ) в ближайшие дни после транзиторной ишемической атаки и в сроки 7–14 дней после малого инсульта (модифицированная шкала Рэнкина — Modified Rankin Scale, mRS ≤ 3) при отсутствии противопоказаний (уровень доказательности IIb) [1]. При тяжелых ин-валидизирующих инсультах в настоящий момент не накоплен достаточный опыт ранних операций для включения в рекомендации. Получены достаточно противоречивые результаты, однако в большинстве работ сделан вывод о невысоком риске ранних операций при учете объема поражения и риска геморрагической трансформации. Тенденция к уменьшению сроков операции объясняется высоким риском повторного нарушения мозгового кровообращения в ранние сроки после инсульта, с одной стороны, и значительным снижением риска операции — с другой [2]. Эффективность и безопасность хирургического лечения возросла благодаря более высокому техническому уровню операций, применению статинов и двойной антиагрегантной терапии, хорошей послеоперационной коррекции артериальной гипертензии, более тщательному отбору пациентов при оценке объема поражения и риска геморрагической трансформации головного мозга по КТ и МРТ, а также применению каротидного стентирования у пациентов высокого соматического риска.
Выявление больных с наибольшим риском повторного инсульта и наименьшим риском послеоперационных осложнений на основе прогностических факторов и индивидуальный подход к тактике лечения позволит значительно улучшить результаты лечения, даже после тяжелых инвалидизирующих инсультов [3].
Цель исследования — анализ предикторов осложнений каротидной эндартерэктомии в ранний восстановительный период после инсульта.
Материал и методы. Проведен ретроспективный анализ предикторов осложнений после ранней КЭАЭ у пациентов после инсульта разной степени тяжести. Начиная с 2009 по 2019 г. в базу данных включали пациентов, пролеченных после КЭАЭ в ранние сроки после инсульта. Всего в исследование включены 88 пациентов, прооперированных по поводу сим-птомного стеноза ВСА более 50% (NASCET) в сроки до 30 дней после инсульта. Критерии исключения: возраст <18 лет и >85 лет, транзиторная ишемическая атака и ретинальная ишемия, нестабильное течение («крещендо» транзиторной ишемической атаки, «инсульт в ходу»), тяжелые инвалидизирующие инсульты (National Institutes of Health Stroke Scale — Шкала инсульта Национального института здоровья:
NIHSS >22; mRS >4), обширный инсульт по данным МРТ и КТ (по шкале программы Alberta для оценки ранних КТ-изменений при инсульте — Alberta stroke program early CT score; ASPECTS <6; зона ишемии более ⅓ бассейна васкуляризации средней мозговой артерии), инфаркт головного мозга с геморрагическим компонентом, геморрагический инсульт в анамнезе в течение последних 6 мес., инсульт, манифестирующий эпилептическими припадками, ранее перенесенный инсульт с выраженными остаточными нарушениями (mRS >2), другие заболевания центральной нервной системы с выраженными неврологическими нарушениями, сопутствующая выраженная кардиальная патология (инфаркт миокарда в течение 1 мес.) или полиорганная недостаточность (шкала Американского общества анестезиологов — American Society of Anaesthesiologists: ASA >4), операции по поводу рестеноза, аневризмы и патологической извитости ВСА, по поводу стеноза менее 50% с изъявленной бляшкой и окклюзии ипсилатеральной ВСА или средней мозговой артерии, каротидное стентирование. Были также исключены пациенты с неуточненными данными о времени после инсульта.
Перед операцией оценивали сопутствующую патологию, индекс коморбидности Charlson и анестезиологический риск по классификации ASA. Неврологический статус оценивался при поступлении и после операции по шкалам NIHSS (0–5 — малый, 6–15 — умеренный, >15 — большой инсульт) и mRS (малый инсульт — mRS 0–2, большой инсульт — 3–5). По данным ультразвукового исследования (УЗИ) оценивали степень и протяженность стеноза сонной артерии (NASCET) и структуру атеросклеротической бляшки по Gray-Weale (1-й тип — гипоэхогенная, 2-й тип — гетерогенная с преобладанием гипоэхогенных зон (более 50%), 3-й тип — гетерогенная с преобладанием гиперэхогенных зон (более 50%), 4-й тип — гетерогенная). По данным МРТ и КТ оценивали расположение и размер очага инфаркта по его максимальному диаметру. Объем инфаркта оценивали по формуле расчета объема усеченного эллипса
V=-X(AXB ХС) 6 , где A, B и C — три размера очага в разных плоскостях.
Признаками большого очага считали максимальный диаметр более 30 мм и объем более 4000 мм3. Степень поражения головного мозга оценивали по шкале ASPECTS [4].
Хирургическое лечение проводилось под эн-дотрахеальным наркозом. Для нейромониторинга применяли церебральную оксиметрию (ЦО) (оксиметр Equanox) и характер ретроградного кровотока. При снижении ЦО на 20% или в абсолютных значениях ниже 45% применяли временное внутрипросветное шунтирование. После операции проводили
Таблица 1
Клинические и инструментальные данные пациентов, различия в группе без осложнений и группе с MACE через 30 дней после операции
Статистический анализ полученных данных осуществляли с использованием программы IBM SPSS Statistica 22. Для оценки нормальности распределения количественных признаков использовали методы Колмогорова — Смирнова и Шапиро — Уилка. Применяли непараметрические методы статистики: расчет U -критерия Манна — Уитни, критерия знаковых рангов Вилкоксона для связанных групп, критерия χ2 (точный критерий Фишера при частоте наблюдений менее 5). Оценивали влияние различных предикторов на риск основных нежелательных клинических явлений: инсульта/инфаркта миокарда и 30-дневной летальности (MACE, Major Adverse Cardiovascular Events — Основные неблагоприятные сердечно-сосудистые события) после каротидной эндартерэктомии. Чтобы учесть возможные искажения, при однофакторном анализе в модель логистической регрессии для расчета отношения шансов и 95% доверительного интервала (ДИ) были включены переменные со значимостью p <0,5. Для оценки связи параметров применяли корреляционный анализ по методу Спирмена (до 0,3 — слабая связь, 0,3-0,7 — умеренная, 0,7-1,0 — сильная). Прово-
дили логистический регрессионный анализ для выявления факторов риска. Переменные, включенные в регрессию, имели р <0,5 при однофакторном анализе. Использовали обратный пошаговый подход с вероятность включения 0,05 и вероятностью исключения 0,1 или более. Для выявления порога значимых значений количественных признаков строили ROC-кривые с оценкой индекса Юдена. Различия считались статистически значимыми для всех используемых методов при уровне р <0,05.
Результаты. В ранний послеоперационный период не выявлено системных осложнений (почечная недостаточность, легочная недостаточность, пневмония, инфекция мочевыводящих путей). В 2,3% (2/88) случаев развилось кровотечение, и потребовалась ревизия. В одном случае выявлено кровотечение по линии шва анастомоза, наложены дополнительные швы на анастомоз, в другом случае источник кровотечения не выявлен. Преходящая периферическая нейропатия наблюдалась в 11,4% (10/88) случаев. Ипсилатеральный инсульт наблюдался у трех пациентов (3,4%, 3/88). В одном случае инсульт был летальным. Таким образом, инсульт/инфаркт миокарда и летальность (MACE) через 30 дней после операции наблюдались в 3,4%. У одного пациента интраоперационно выявлена протяженная бляшка и выполнено протезирование ВСА. На вторые сутки развилась клиника острого нарушения мозгового кровообращения, выявлен перегиб и тромбоз протеза. Пациент скончался на вторые сутки после операции. В двух других случаях на вторые сутки после операции развился ишемический инсульт в бассейне оперированной артерии с регрессом симптоматики в течении 3-5 дней. В табл. 1 пред-
|
Предикторы развития инсульта |
Все пациенты ( n =88) |
Без осложнений ( n =85) |
MACE 30 дней ( n =3) |
Р- |
|
Прием препаратов |
||||
|
Аспирин |
80 (91) |
77 (91 %) |
3 (100%) |
0,749 |
|
Клопидогрел |
5 (6) |
5 (6) |
0 |
0,837 |
|
Антикоагулянты |
6 (7) |
6 (7) |
0,807 |
|
|
β-блокаторы |
8 (9) |
8 (9) |
0,749 |
|
|
Нитраты |
6 (7) |
6 (7) |
0,807 |
|
|
Статины |
74 (84) |
71 (84%) |
3 (100%) |
0,591 |
|
Сторона операции (слева), n (%) |
49 (57) |
49 (58%) |
0 |
0,083 |
|
Cтепень стеноза (NASCET), %, Me (квартили) |
80 (70–90) |
80 (70–90) |
65 (60–70) |
0,039 |
|
Степень стеноза (NASCET) <70%, n (%) |
30 (34%) |
27 (32%) |
3 (100%) |
0,037 |
|
Протяженность бляшки, мм, Me (квартили) |
16 (15–20) |
16 (15–20) |
20 (20–40) |
0,078 |
|
Протяженность бляшки >18 мм, n (%) |
44 (50%) |
44 (52%) |
3 (100%) |
0,241 |
|
Контрлатеральная ВСА: |
||||
|
стеноз >50%, n (%) |
54 (61) |
51 (60%) |
1 (33%) |
0,565 |
|
окклюзия, n (%) |
8 (9) |
8 (9%) |
0 |
0,749 |
|
Интракраниальный стеноз ВСА, n (%) |
2 (2) |
2 (2%) |
0 |
0,966 |
|
Структура бляшки по Gray-Weale, n (%) |
||||
|
1 — однородные гипоэхогенные |
14 (16) |
14 (16%) |
0 |
0,229 |
|
2 — неоднородные с преобладанием гипоэхогенных структур |
35 (40) |
35 (41 %) |
1 (33%) |
|
|
3 — неоднородные с преобладанием гиперэхогенных структур |
30 (34) |
28 (33%) |
2 (67%) |
|
|
4 — однородные гиперэхогенные |
9 (10) |
9 (10) |
0 |
|
|
ASPECTS, баллы, Me (квартили) |
9 (8–10) |
9 (8–10) |
7 (6–8) |
0,045 |
|
ASPECTS <8, n (%) |
20 (23) |
18 (21%) |
2 (67%) |
0,128 |
|
Нет очаговых поражений, n (%) |
31 (35) |
31 (36) |
0 |
0,275 |
|
Очаговые изменения |
47 (53) |
44 (52%) |
||
|
Кистозно-глиозные изменения |
8 (9) |
8 (9%) |
3 (100%) |
|
|
Макс. размер очага, мм, Me (квартили) |
26 (12–45) |
26 (11–45) |
26 (18–53) |
0,66 |
|
Макс. размер очага >30 мм, n (%) |
11 (13) |
10 (12%) |
1 (33%) |
0,51 |
|
Объем очага, см3, Me (квартили) |
3,4 (0,8–17) |
3,4 (0,8–17) |
1,8 (1,1–27) |
0,761 |
|
Объем очага >4000 мм3, n (%) |
11 (13) |
10 (12%) |
1 (33%) |
0,51 |
|
Множественные очаги, n (%) |
11 (13) |
9 (11%) |
2 (67%) |
0,04 |
|
Зона ишемии головного мозга (бассейны), n (%) |
||||
|
передняя мозговая артерия |
38 (43) |
35 (41 %) |
3 (100%) |
0,512 |
|
средняя мозговая артерия |
11 (13) |
11 (13%) |
0 |
|
|
вертебробазилярный бассейн |
5 (6) |
5 (6%) |
||
|
NIHSS до операции, Me (квартили) |
7 (3–12) |
7 (3–12) |
6 (3–8) |
0,631 |
|
NIHSS (0–5), n (%) |
42 (48) |
41 (48%) |
1 (33%) |
0,609 |
|
NIHSS (6–15), n (%) |
36 (41) |
34 (40%) |
2 (67%) |
|
|
NIHSS (>15), n (%) |
10 (11) |
10 (11%) |
0 |
|
|
NIHSS после операции, Me (квартили) |
4 (2–6) |
4 (2–6) |
3 (3) |
0,752 |
|
mRS до операции, Me (квартили) |
2 (1–3) |
2 (1–3) |
2 (1–3) |
0,585 |
|
mRS 0–2, n (%) |
46 (52) |
44 (52%) |
2 (67%) |
0,534 |
|
mRS 3–5, n (%) |
42 (48) |
41 (48%) |
1 (33%) |
|
|
mRS после операции, Me (квартили) |
2 (1–2) |
2 (1–2) |
2 (1–4) |
0,674 |
|
Предикторы развития инсульта |
Все пациенты ( n =88) |
Без осложнений ( n =85) |
MACE 30 дней ( n =3) |
Р- |
|
Тип операции |
||||
|
Эверсионная КЭАЭ, n (%) |
50 (57) |
49 (58%) |
1 (33%) |
0,781 |
|
КЭАЭ с заплатой, n (%) |
18 (21) |
18 (21%) |
0 |
|
|
КЭАЭ без заплаты, n (%) |
14 (16) |
13 (15%) |
1 (33%) |
|
|
КЭАЭ и резекция извитости, n (%) |
2 (2) |
2 (2%) |
0 |
|
|
Протезирование ВСА, n (%) |
1 (1) |
0 |
1 (33%) |
|
|
Гибридная операция**, n (%) |
3 (3) |
3 (3%) |
0 |
|
|
Временный шунт, n (%) |
6 (7) |
6 (7%) |
0,807 |
|
|
Время пережатия ВСА, мин |
17 (15–26) |
17 (15–26) |
15 (14–31) |
0,893 |
|
Время операции, мин |
85 (71–90) |
85 (72–90) |
80 (65–90) |
0,897 |
|
Церебральная оксиметрия, n (%) |
59 (67) |
56 (66%) |
3 (100%) |
0,341 |
|
ЦО ипсилатерально исходно, абс, Me (квартили) |
63 (60–65) |
63 (60–65) |
61 (61–63) |
0,772 |
|
ЦО контрлатерально исходно, абс, Me (квартили) |
65 (62–67) |
65 (62–67) |
64 (63–68) |
0,836 |
|
Межполушарная разница пережатие, абс, Me (квартили) |
6 (5–9) |
6 (5–9) |
5 (4–6) |
0,909 |
|
Снижение ЦО ипсилатерально макс., %, Me (квартили) |
7 (5–12) |
7 (5–12) |
8 (6–10) |
0,807 |
|
Снижение ЦО ипсилатерально более 20%, n (%) |
6 (7) |
6 (7%) |
0 |
0,895 |
|
Повышение ЦО после пуска кровотока, абс, Me (квартили) |
7 (5–10) |
7 (5–10) |
8 (6–11) |
0,836 |
|
Повышение ЦО ипсилатерально более 15%, n (%) |
3 (3) |
3 (3%) |
0 |
0,945 |
|
Реанимация, дни, Me (квартили) |
1 (1) |
1 (1) |
2 (1–3) |
0,541 |
|
Госпитализация, дни, Me (квартили) |
8 (6–10) |
8 (6–10) |
10 (8–12) |
0,585 |
|
Гистоморфологическое исследование, n (%) |
||||
|
Стабильная бляшка |
31 (35) |
30 (35%) |
1 (33%) |
0,983 |
|
Преимущественно стабильная |
26 (29) |
25 (29%) |
||
|
Нестабильная без разрыва |
27 (31) |
26 (31%) |
||
|
Нестабильная с разрывом |
4 (5) |
4 (5%) |
0 |
|
Примечание: ИМТ — индекс массы тела, Me — медиана, ' — точный критерий Фишера, критерий U — Манна — Уитни; " — КЭАЭ и стентирование общей сонной артерии ( n =1), стентирование ВСА в суб- и интракраниальном отделах ( n =2).
ставлены результаты анализа предикторов развития инсульта после операции.
Медиана времени после перенесенного инсульта до хирургического лечения составила 20 дней (квартили, 14-25). У 24 (27%) пациентов операция выполнена в первые 2 нед., у 64 (73%) в сроки 14-30 дней. Срок выполненной операции не влиял на исходы. Среди причин увеличения срока хирургического вмешательства были недооцененный стеноз по дан- ным первичного УЗИ, отказ неврологов от раннего направления на оперативное лечение к сосудистому хирургу, отказ пациента от раннего вмешательства, позднее обращение к сосудистому хирургу, тяжелый инвалидизирующий инсульт, тяжелое соматическое состояние пациента.
Среди значимых факторов риска при однофакторном анализе выявлены женский пол ( p =0,009; оШ=5,31; ДИ95%: 3,42-8,26), стеноз оперированной
Таблица 2
Одно- и многофакторный регрессионные анализы значимых факторов риска развития послеоперационного инсульта и основных нежелательных клинических явлений в течение 30 дней
|
Предиктор |
Однофакторный анализ (точный критерий Фишера) |
Многофакторный логистический регрессионный анализ |
|||||
|
р |
отношение шансов |
ДИ (95%) |
коэффициент регрессии |
стан дартная ошибка |
р |
||
|
Возраст <60 лет |
0,166 |
6,09 |
0,53 |
70,7 |
–3,5 |
8853 |
0,999 |
|
Женский пол |
0,009 |
5,31 |
3,42 |
8,26 |
19,5 |
4199 |
0,997 |
Выявлена слабая корреляция структуры бляшки при УЗИ перед операцией по Gray-Weale с результатами гистоморфологического исследования после операции ( р =0,015, коэффициент корреляции Спирмена = –0,259). По данным нашего исследования, как структура бляшки по данным УЗИ, так и гисто-морфологическая картина не влияли на исходы операций.
У пациентов с осложнениями выявлено более тяжелое поражение головного мозга по шкале ASPECTS до операции (р=0,045), однако размер очага поражения не являлся фактором риска, несмотря на то, что среди пациентов в 13% (11/88) был выявлен большой очаг (максимальный размер более 30 мм, объем более 4000 мм3). Тяжесть инсульта по шкалам NIHSS и mRS также не оказывала значимого влияния на исходы. Необходимо отметить, что среди пациентов в 48% (42/88) случаев наблюдали умеренный и тяжелый инсульты (mRS 3–5), а в 11% случаев (10/88) тяжесть по шкале NIHSS перед операцией составила более 15 баллов. После операции отмечено статистически значимое улучшение неврологического статуса у большинства исследуемых пациентов (рис. 1).
Значимых различий по интраоперационным параметрам (времени операции, применении внутрипросветного шунта, данным ЦО) не выявлено. Переменные со значимостью p <0,5 при однофакторном анализе были включены в модель множественной логистической регрессии. Многофакторный анализ не выявил значимых факторов риска 30-дневного инсульта и смерти после операции (табл. 2).
Обсуждение. Данные исследований последних лет говорят о возможности безопасного выполнения
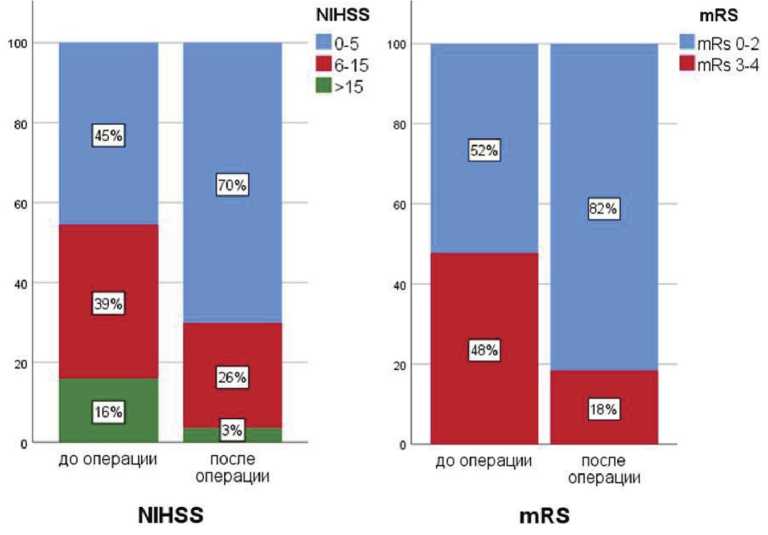
Рис. 1. Сравнение неврологического статуса по шкалам NIHSS и mRS до и после операции
КЭАЭ в острый и ранний восстановительный периоды после инсульта, в том числе и тяжелого инвалидизи-рующего поражения [3, 5]. Несмотря на то, что за последние годы значительно изменились методы и повысилась эффективность медикаментозной терапии, даже при полноценном современном лечении риск повторного инсульта увеличивается с первых 72 ч и достигает 26% в первые 2 нед. [2, 6]. Независимыми факторами риска повторных инсультов в стационаре, по данным крупного исследования F. Yu с соавт. ( n =1021), оказались атеросклероз магистральных артерий, мочевая инфекция или легочные осложнения и высокий уровень глюкозы в крови [7]. Кроме того, к факторам риска относят сахарный диабет, артериальную гипертензию, мужской пол, возраст >75 лет, тяжесть поражения (стойкий неврологический дефицит, транзиторную ишемическую атаку, транзиторную ретинальную ишемию), критический стеноз сонной артерии (85-99%), отсутствие коллатералей по ангиографии, перемежающуюся хромоту [8].
Параллельно с улучшением консервативного лечения улучшались и результаты хирургического лечения атеросклеротического поражения сонных артерий. Повысился технический уровень операций, выросла частота применения статинов и двойной антиагрегантной терапии, стала более эффективной коррекция артериальной гипертензии в послеоперационный период. Развитие методов КТ и МРТ позволило проводить более тщательную оценку поражения головного мозга. Кроме того, централизация хирургии сонных артерий, а также отказ от КЭАЭ в пользу каротидного стентирования у пациентов высокого соматического риска улучшили результаты лечения. На риск осложнений после КЭАЭ влияют несколько факторов (возраст, ишемическая болезнь сердца, сахарный диабет, пол, артериальная гипертензия, степень стеноза сонной артерии и клинические проявления). В крупном исследовании K. M. Bennett, J. E. Scarborough, C. K. Shortell независимыми факторами после КЭАЭ оказались ASA >3, возраст >80 лет, тяжелый неврологический дефицит, время операции >150 мин, инсулинзависимый сахарный диабет, нарушение свертываемости крови, анатомические особенности (протяженная бляшка, высокая бифуркация, и т. д.), применение β-блокаторов [9], однако остается неясным, какие из перечисленных факторов имеют наибольшее значение именно при ранних операциях. В последние годы появилось несколько ретроспективных исследований по оценке предикторов инсульта и осложнений после ранних КЭАЭ при симптомном стенозе сонной артерии: экстренная операция (0–48 ч), возраст >80 лет, высокий хирургический риск (возраст >80 лет, клинически значимое поражение сердца (застойная сердечная недостаточность, положительные стресс-пробы, показания к хирургии сердца), тяжелая легочная недостаточность, окклюзия контрлатеральной сонной артерии, паралич контрлатерального гортанного нерва, лучевая терапия или хирургическое вмешательство на шее в анамнезе, рестеноз после каротидной эндартерэктомии), дислипидемия, хроническая обструктивная болезнь легких, инсулинзависимый сахарный диабет, ASA >2, прием β-блокаторов, отсутствие приема аспирина и статинов, окклюзия контрлатеральной сонной артерии, стеноз ипсилатеральной артерии <70%, размер очага поражения головного мозга, mRS >2, NIHSS >10, время операции >150 мин, применение временного шунта, интракраниальная ангиопластика [10–14].
В настоящее время эффективность выполнения операции в острейший период инсульта (до 48 ч) не доказана. По данным P. De Rango с соавт., риск пе-риоперационного инсульта после КЭАЭ в сроки до 48 ч после всех острых нарушениях мозгового кровообращения составил 5,3% (95% ДИ, 2,8-8,4), в то же время после транзиторной ишемической атаки — 2,7% (95% ДИ, 0,5-6,9), а после инсульта — 8,0% (95% ДИ, 4,6-12,2) [15]. В большинстве исследований экстренные операции являлись фактором риска развития периоперационных осложнений. В нашем исследовании экстренная операция без осложнений в послеоперационный период была выполнена только в двух случаях.
Полагается, что польза от КЭАЭ у женщин несколько ниже из-за более высокого риска периоперационных осложнений. Метаанализ трех рандомизированных клинических исследований показал, что риск инсульта или смерти после ранних КЭАЭ через 120 дней после процедуры у женщин был выше, чем у мужчин (6,9 и 5,4 % соответственно), хотя при каротидном стентировании — не зависел от пола (8,5 и 9,0% соответственно) [16]. Однако P.M. Rothwell с соавт. при пересмотре результатов рандомизированных клинических исследований NASCET и ECST показали, что у женщин КЭАЭ имеет преимущество именно при ее выполнении в ранний период. Это преимущество быстро уменьшается в первые несколько недель, в то время как у мужчин польза наблюдается даже при отсроченной КЭАЭ [17]. Следовательно, остается дискутабельным вопрос о выборе тактики лечения в зависимости от пола. О возможной причине отличий в исходах КЭАЭ у мужчин и женщин были выдвинуты различные гипотезы, такие как гормональное и генетические различия в ответе на ишемическое повреждение, ВСА меньшего диаметра, меньшая протяженность и другой состав атеросклеротической бляшки (более стабильная), при всем том ни одна гипотеза не имеет убедительных и надежных доказательств. В нашей работе при однофакторном анализе женский пол оказался значимым предиктором осложнений.
В ряде исследований пожилой возраст оказался независимым фактором риска осложнений при ранних КЭАЭ [10, 12, 14]. Между тем результаты нашего исследования не выявили связи между пожилым возрастом и осложнениями после операции, при этом в исследование вошли всего четыре пациента (4,5%) старше 80 лет.
По данным Y. Huang и соавт., фактором риска осложнений ранних КЭАЭ является высокий хирургический риск, включающий возраст >80 лет, клинически значимое поражение сердца (застойную сердечную недостаточность, положительные стресс-пробы, показания к операции на сердце), тяжелую легочную недостаточность, окклюзию контрлатеральной сонной артерии, паралич контрлатерального гортанного нерва, лучевую терапию или хирургическое вмешательство на шее в анамнезе, рестеноз после КЭАЭ [14]. Высокий анестезиологический риск (ASA 3 и 4) сопряжен с повышением периоперационного риска, особенно при КЭАЭ в первые 3 нед. после инсульта [18]. В ряде работ в качестве фактора риска послеоперационных осложнений анализировали прием различных лекарственных препаратов. Выявлено увеличение риска у пациентов, не принимающих аспирин и статины [10, 14], однако при регрессионном анализе только прием β-блокаторов значимо увеличивал риск повторного инсульта после ранней КЭАЭ [10].
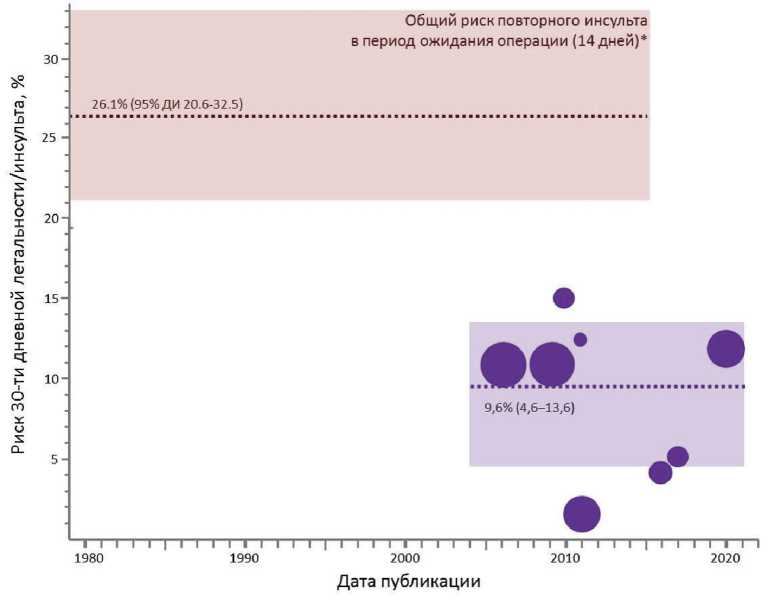
Рис. 2. Сравнение риска 30-дневной летальности/инсульта после ранней КЭАЭ (<15 дней) после инвалидизирующего инсульта (представлена медиана и квартили, полученные при анализе опубликованных исследований, включающих пациентов с большим инсультом) и риска повторного инсульта в период ожидания операции (14 дней) по данным метаанализа (1950–2015) P. Tsantilas с соавт. [2]
В нашем исследовании соматический статус, анестезиологический риск и сопутствующая патология, в том числе индекс коморбидности Charlson, и прием различных лекарственных препаратов не стали значимыми факторами риска.
Однако мы не нашли исследований и не обнаружили в нашей работе доказательств того, что структура бляшки является предиктором осложнений ранних КЭАЭ. Мы выявили слабую корреляцию данных гистоморфологического исследования с УЗИ перед операцией, что говорит о необходимости более тщательной оценки предоперационных данных и внедрения новых методов оценки нестабильности бляшки, таких как контрастная сонография, МР-ангиография в Black-blood режиме и т. д.
Интересно, что однофакторный анализ в нашем исследовании показал больший риск послеоперационных осложнений у пациентов со стенозом сонной артерии <70%. Такие же данные получили в своей работе A. Tanious с соавт. [12]. Объяснением этого может быть менее выраженное коллатеральное русло при малом стенозе и более выраженный реперфузионный синдром после операции, однако это требует дополнительных исследований.
В последнем метаанализе 43 исследований (96658 пациентов), опубликованном D. G. Kokkinidis в 2020 г., подтверждена роль окклюзии контрлатеральной сонной артерии в развитии инсульта после КЭАЭ, но не после каротидного стентирования [19]. Несмотря на то, что такие же данные выявлены и после ранних КЭАЭ [12], в нашем исследовании это не подтвердилось, вероятно, что связано с недостаточным объемом выборки.
Если наличие геморрагического пропитывания головного мозга является несомненным фактором ри- ска раннего вмешательства, то до сих пор остается неясным, влияет ли объем и локализация поражения на результаты хирургического лечения. Большинство исследователей склоняется к тезису о том, что КЭАЭ после острого инсульта является безопасной только при небольшом объеме инфаркта и легком неврологическом дефиците [8]. Несмотря на это, в исследования последних десяти лет все чаще стали включать пациентов с большим объемом поражения и тяжелым инвалидизирующим инсультом. В ряде работ неожиданно оказалось, что наличие ипсилатерального очагового поражения, за исключением геморрагического пропитывания, не предсказывает клинический результат, и риск операций при большом объеме ишемического очага может не отличаться [3, 5]. В противоположность этому, в исследовании R. Pini с соавт., проведенном на отобранной и однородной группе пациентов с тяжелым инсультом (mRS 3 или 4) и большим объемом поражения (более 4000 мм3), выявлено то, что ранняя операция (до 4 нед. после инсульта) сопряжена со значительно большей частотой инсульта и смерти по сравнению с пациентами, оперированными отсрочено [20]. Однако это исследование также имело ретроспективный и наблюдательный характер и небольшой объем выборки. На рис. 2 представлено сравнение риска повторного инсульта в период ожидания операции и риска инсульта/летальности после ранней КЭАЭ в случае большого инвалидизи-рующего инсульта. Таким образом, для корректной оценки роли объема и тяжести поражения головного мозга в развитии послеоперационных осложнений при ранних вмешательствах необходимы крупные проспективные исследования. В нашем анализе не выявлено значимого повышения риска осложнений при большом объеме поражения по данным КТ, несмотря на то, что среди пациентов в 13% случаев был выявлен очаг размером более 30 мм и объем более 4000 мм3. Тем не менее при однофакторном анализе нами установлено, что наличие множественных поражений по данным КТ и тяжелое поражение головного мозга по шкале ASPECTS до операции значимо повышало риск инсульта после операции. Шкала ASPECTS успешно применяется при оценке риска и пользы интракраниальной тромбэктомии в острой стадии инсульта. Некоторые исследователи попытались использовать эту шкалу в качестве предиктора инсульта и смерти после ранней КЭАЭ [4], но их результаты, как и наши, не показали значимой связи шкалы ASPECTS с частотой осложнений.
По мнению большинства исследователей, тяжесть неврологического дефицита — значимый фактор риска неудовлетворительных исходов ранних КЭАЭ [12]. В настоящей работе большая доля пациентов (48%) имели умеренный и тяжелый неврологические дефициты перед операцией (mRS 3–5, NIHSS 6–22). Несмотря на это, мы не смогли выявить значимого влияния тяжести поражения на риск возникновения послеоперационных осложнений. Выполнение ранней КЭАЭ имеет цель не только предотвратить повторный инсульт, но и восстановить перфузию головного мозга и улучшить неврологическое восстановление. Нами отмечено статистически значимое улучшение неврологического статуса, в том числе и при тяжелой степени инсульта.
Заключение. Уменьшение сроков выполнения операции после инсульта в настоящее время обусловлено не только высоким риском повторного инсульта, но и снижением риска операции. Это связано, в том числе, и с более тщательным отбором пациентов и анализом факторов риска послеоперационных осложнений. К сожалению, проведено только несколько ретроспективных исследований по выявлению факторов риска инсульта после раннего хирургического вмешательства при симптомном стенозе сонной артерии. В нашем исследовании значимыми факторами риска 30-дневного инсульта и смерти после операции при однофакторном анализе оказались женский пол, стеноз ипсилатеральной сонной артерии <70% и наличие множественных очагов поражения головного мозга, однако многофакторный регрессионный анализ не выявил значимых факторов риска. Для уточнения полученных результатов необходимы дальнейшие крупные исследования.
Ограничения. Основным ограничением данной работы является ретроспективный анализ полученных данных и небольшой размер выборки, что могло привести к ошибке II типа, однако важно отметить, что в настоящее научное изыскание включены пациенты с разной степенью тяжести инсульта и объемом поражения головного мозга, то есть та когорта пациентов, которая часто упускается из виду в подобных исследованиях.
Список литературы Анализ факторов риска осложнений каротидной эндартерэктомии в ранний период после инсульта
- Powers WJ, Rabinstein AA, Ackerson T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke a guideline for healthcare professionals from the American Heart Association / American Stroke A. Stroke, 2019; 50 (12): E344–418.
- Tsantilas P, Kühnl A, Kallmayer M, et al. Stroke risk in the early period after carotid related symptoms: A systematic review. J Cardiovasc Surg (Torino), 2015; 56 (6): 845–52.
- Tsantilas P, Kühnl A, Kallmayer M, et al. A short time interval between the neurologic index event and carotid endarterectomy is not a risk factor for carotid surgery. J Vasc Surg, 2017; 65 (1): 12–20. e1.
- Aviv RI, Mandelcorn J, Chakraborty S, et al. Alberta stroke program early CT scoring of CT perfusion in early stroke visualization and assessment. Am J Neuroradiol, 2007; 28 (10): 1975–80.
- Capoccia L, Sbarigia E, Speziale F, et al. Urgent carotid endarterectomy to prevent recurrence and improve neurologic outcome in mild-to-moderate acute neurologic events. J Vasc Surg 2011; 53 (3): 622–8.
- Naylor AR. Time is brain: An update. Expert Rev Cardiovasc Ther 2015; 13 (10): 1111–26.
- Yu F, Liu X, Yang Q, et al. In-hospital recurrence in a Chinese large cohort with acute ischemic stroke. Sci Rep 2019; 9 (1): 14945.
- Zaidat OO, Alexander MJ, Suarez JI, et al. Early carotid artery stenting and angioplasty in patients with acute ischemic stroke. Neurosurgery 2004; 55 (6): 1237–42.
- Bennett KM, Scarborough JE, Shortell CK. Predictors of 30‑day postoperative stroke or death after carotid endarterectomy using the 2012 carotid endarterectomy-targeted American College of Surgeons National Surgical Quality Improvement Program database. J Vasc Surg 2015; 61 (1): 103–11.
- Blay E, Balogun Y, Nooromid MJ, Eskandari MK. Early carotid endarterectomy after acute stroke yields excellent outcomes: An analysis of the procedure-targeted ACS-NSQIP. Ann Vasc Surg 2019; (57): 194–200.
- Borghese O, Pisani A, Lapergue B, Di Centa I. Early carotid endarterectomy for symptomatic stenosis of internal carotid artery in patients affected by transient ischemic attack or minor-to-moderate ischemic acute stroke: A single-center experience. Ann Vasc Surg 2020; (65): 232–9.
- Tanious A, Pothof AB, Boitano LT, et al. Timing of carotid endarterectomy after stroke: retrospective review of prospectively collected national database. Ann Surg 2018; 268 (3): 449–56.
- Nordanstig A, Rosengren L, Strömberg S, et al. Editor’s choice — very urgent carotid endarterectomy is associated with an increased procedural risk: The carotid alarm study. Eur J Vasc Endovasc Surg 2017; 54 (3): 278–86.
- Huang Y, Gloviczki P, Duncan AA, et al. Outcomes after early and delayed carotid endarterectomy in patients with symptomatic carotid artery stenosis. J Vasc Surg 2018; 67 (4): 1110–19. e1.
- De Rango P, Brown MM, Chaturvedi S, et al. Summary of evidence on early carotid intervention for recently symptomatic stenosis based on meta-analysis of current risks. Stroke 2015; 46 (12): 3423–36.
- Brown MM. Short-term outcome after stenting versus endarterectomy for symptomatic carotid stenosis: A preplanned metaanalysis of individual patient data. Lancet 2010; 376 (9746): 1062–73.
- Rothwell PM, Eliasziw M, Gutnikov SA, et al. Sex difference in the effect of time from symptoms to surgery on benefit from carotid endarterectomy for transient ischemic attack and nondisabling stroke. Stroke 2004; 35 (12): 2855–61.
- Eckstein HH, Ringleb P, Dörfler A, et al. The carotid surgery for ischemic stroke trial: A prospective observational study on carotid endarterectomy in the early period after ischemic stroke. J Vasc Surg 2002; 36 (5): 997–1004.
- Kokkinidis DG, Chaitidis N, Giannopoulos S, et al. Presence of contralateral carotid occlusion is associated with increased periprocedural stroke risk following cea but not CAS: A meta-analysis and meta-regression analysis of 43 studies and 96,658 patients. J Endovasc Ther 2020; 27 (2): 334–44.
- Pini R, Faggioli G, Vacirca A, et al. The benefit of deferred carotid revascularization in patients with moderate-severe disabling cerebral ischemic stroke. J Vasc Surg 2020; 73 (1): 117–24.


