Анализ геропротекторного потенциала ретиноевой кислоты на модели Drosophila melanogaster
Автор: Н.С. Тимушева, Н.Р. Пакшина, Е.Н. Прошкина, А.А. Москалев
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 7 (83), 2025 года.
Бесплатный доступ
Ретиноевая кислота, производное витамина А, является важным компонентом сигнализации между клетками в организме. В то же время имеются противоречивые данные о ее влиянии на продолжительность жизни организма. В данной работе исследовано влияние ретиноевой кислоты на длительность жизни особей Drosophila melanogaster и их устойчивость к индуктору окислительного стресса параквату. Ретиноевая кислота в концентрациях 10 и 500 мкмоль/л оказала геропротекторный эффект на самок дрозофил, вызвав увеличение медианной продолжительности жизни и возраста 90 % смертности на 2–5 и 6 % соответственно. Но данное вещество не влияло на выживаемость самцов, так же как устойчивость к прооксиданту параквату особей обоих полов. Положительное действие ретиноевой кислоты на продолжительность жизни может быть обусловлено активацией генов репарации ДНК mei-9 и okr.
Продолжительность жизни, стрессоустойчивость, ретиноевая кислота, Drosophila melanogaster
Короткий адрес: https://sciup.org/149149442
IDR: 149149442 | УДК: 591.139.57.042 | DOI: 10.19110/1994-5655-2025-7-5-13
Текст научной статьи Анализ геропротекторного потенциала ретиноевой кислоты на модели Drosophila melanogaster
Старение – это биологический процесс, характеризующийся снижением функциональности организма и уменьшением его устойчивости к стрессовым факторам [1]. В результате этого организм теряет способность поддерживать гомеостаз, что делает его более восприимчивым к повреждениям и развитию возрастных заболеваний, что, в свою очередь, ухудшает общее состояние здоровья и еще больше ускоряет процессы старения. В то же время в настоящее время описан спектр препаратов, называемых геропротекторами, которые способствуют долголетию и замедляют связанные со старением изменения в организме [2]. Поиск новых препаратов, проявляющих геропротекторные свойства, является перспективной задачей биологии, экологии и медицины.
Ретиноевая кислота, производное витамина А, является важным компонентом сигнализации между клетками в организме, включая развитие, дифференцировку клеток и старение. В основном она действует путем взаимодействия с рецепторами ретиноевой кислоты (RAR) и ретиноидными X-рецепторами (RXR). Они являются ДНК-свя-зывающими регуляторами транскрипции, образуют гетеродимеры и связи с ДНК в специфических элементах ответа ретиноевой кислоты (RARE), которые вовлечены в разнообразные сигнальные клеточные пути [3, 4].
Дефицит ретиноевой кислоты и нарушение сигнализации рецепторов ретиноевой кислоты приводят к дегенеративным процессам, сопровождающим старение. Например, ретиноевая кислота необходима для регулирования синаптической пластичности, важной для обучения и памяти. Нарушение работы рецепторов этого вещества вызывает нейровоспаление, окислительный стресс, митохондриальную дисфункцию и нейродегенерацию, что может быть одной из причин снижения когнитивных способностей при старении и нейродегенеративных заболеваниях [5, 6]. Ретиноевая кислота важна для поддержания гомеостаза кишечного барьера и уравновешивания иммунитета, которые представляют собой важнейшие детерминанты старения организма. Применение ретиноевой кислоты и воздействие на ее рецепторы рассматривают как перспективную стратегию для подавления роста злокачественных опухолей, стимуляции противоракового иммунитета и преодоления химиорезистентности [7]. Также в настоящее время расширяется спектр информации о роли данного соединения и его предшественника, витамина А, в здоровье сердечно-сосудистой системы, опорно-двигательного аппарата и поддержании нормального метаболизма [8, 9]. Кроме того, ретиноевая кислота и ее производные играют ключевую роль в обеспечении здоровья кожи и могут замедлять процессы старения, улучшая внешний вид и функциональные характеристики кожи [10]. В то же время в исследованиях на модельных животных показаны противоречивые данные о влиянии потребления этого вещества на длительность жизни организма [11, 12].
В данной работе мы исследовали влияние ретиноевой кислоты на продолжительность жизни (ПЖ) и устойчивость особей Drosophila melanogaster к индуктору окислительного стресса параквату.
Материалы и методы
Линия Drosophila melanogaster и условия содержания. Для всех представленных экспериментов использовали линию дикого типа Canton-S из Коллекции лабораторных линий плодовых мушек Drosophila (ИБ ФИЦ Коми НЦ УрО РАН, г. Сыктывкар, Россия).
Мух содержали при температуре +25° C, 12-часовом режиме освещения, в климатической камере Binder KBF720-ICH (Binder, Германия) на питательной среде (1 г на 1 л): агар-агар – 5,2, сухие дрожжи – 32,1, глюкоза – 136,9, кукурузная мука – 92 [13]. Для предотвращения роста простейших грибов и бактерий добавляли 10%-ный раствор метил-4-гидроксибензоата (Sigma-Aldrich, США) и 50%-ный раствор пропионовой кислоты (Sigma-Aldrich, США). Мух переносили на свежую среду два раза в неделю.
Обработка ретиноевой кислотой. На поверхность питательной среды наносили по 30 мкл на пробирку 0,2 % ДМСО (для контрольной группы) или раствор ретиноевой кислоты (R2625, Sigma-Aldrich, США) в 0,2 % ДМСО в концентрациях 0,1; 1; 10; 100 и 500 мкмоль/л.
Анализ продолжительности жизни. Самцов и самок дрозофил собирали в течение 24 ч после вылупления имаго, сортировали с использованием анестезии углекислым газом и помещали в пробирки с ретиноевой кислотой или контрольным раствором. Количество погибших мух подсчитывали ежедневно. Далее рассчитывали параметры ПЖ (среднюю и медианную ПЖ, возраст 90 % смертности, время удвоения интенсивности смертности (MRDT)) и строили кривые выживания. Статистическую обработку проводили с помощью непараметрических критериев. Кривые выживаемости сравнивали с использованием критерия Колмогорова-Смирнова [14]. Критерии Мантеля-Кок-са [15] и Гехана-Бреслоу-Вилкоксона [16] применяли для оценки статистических различий в медианной ПЖ. Метод Ванг-Аллисона использовали для оценки различий в возрасте 90 % смертности [17]. Статистический анализ данных осуществляли с помощью программного обеспечения STATISTICA, версия 6.1 (StatSoft, США) и R, версия 2.15.1 (The R Foundation). Для каждого экспериментального варианта анализировали 50-160 мух. Исследования проводили в четырех независимых биологических повторностях.
Обработка паракватом. Самцов и самок дрозофил сортировали с использованием анестезии углекислым газом и содержали в пробирках с ретиноевой кислотой или контрольным раствором до возраста 15 сут. Для оценки устойчивости к окислительному стрессу мух по одной помещали в стеклянные пробирки со средой, содержащей 2 % агара, 5 % сахарозы и 20 ммоль/л индуктора окислительного стресса параквата (метилвиологен дихлорид гидрат, 856177, Sigma-Aldrich, США). Далее проводили анализ с использованием DAM2 Drosophila Activity Monitor (Trikinetics, США). Данные о двигательной активности мух регистрировали каждые 30 мин. Воздействие параквата продолжалось до гибели всех животных. Мертвых мух идентифицировали по прекращению двигательной активности. Статистический анализ был аналогичен анализу ПЖ. Для каждого экспериментального варианта анализировали самцов и самок в количестве 32. Эксперименты проводили в трех независимых биологических повторностях.
ОТ-ПЦР в реальном времени. Анализ экспрессии генов проводили с использованием целых дрозофил в возрасте 15 сут в количестве 10 особей на каждый вариант эксперимента. РНК выделяли с помощью набора Aurum Total RNA mini kit (Bio-Rad, США). Концентрацию общей РНК определяли набором Quant-iT RNA Assay Kit (Invitrogen, США). Обратную транскрипцию проводили с помощью набора iScript cDNA Synthesis Kit (Bio-Rad, США). Смесь для ОТ-ПЦР готовили с помощью набора qPCRmix-HS SYBR (Евроген, Россия) с праймерами, указанными в табл. 1. Реакцию осуществляли на приборе CFX96 Real-Time PCR Detection System (Bio-Rad, США) при следующих параметрах: один цикл при 95° C в течение 30 сек; 40 циклов при 95° C в течение 10 сек и 60° C в течение 30 сек. Уровни экспрессии целевых генов рассчитывали относительно экспрессии референтных генов (β-Tubulin, RpL32, EF1α) с помощью программного обеспечения CFX Manager 3.1 (Bio-Rad, США) методом 2–∆∆Ct. Статистический анализ эффектов исследуемых препаратов осуществляли с использованием U-критерия Манна-Уитни. Эксперимент проводили в двух независимых биологических повторностях, по три технических повторности в каждой.
Таблица 1
Праймеры для проведения ПЦР
Table 1
Primers for PCR
|
Ген |
Прямой праймер |
Обратный праймер |
|
β-Tubulin |
GCAACTCCACTGCCATCC |
CCTGCTCCTCCTCGAACT |
|
RpL32 |
GAAGCGCACCAAGCACTTCATC |
CGCCATTTGTGCGACAGCTTAG |
|
EF1α |
AGGGCAAGAAGTAGCTGGTTTGC |
GCTGCTACTACTGCGTGTTGTTG |
|
D-Gadd45 |
AAGTCGCGCACAGATACTCACG |
TTTGTTGGTTCGGCAGCTGGTC |
|
Rrp1 |
AGGATGGTCTGCAGTTGATTGACC |
CGTTTGCGCACTTGGTTTCCTG |
|
mei-9 |
TTCCGGCAATCTTGTGCTTGTG |
TCCAGATAAACGCGCTCTCTTTC |
|
mus210 |
AGAAGACGGTGCATTTGAGATTGC |
ATGGGATGACAAGCGCCTTGATG |
|
Brca2 |
CAACCGAAGCAAGGCAGGATTC |
TCTGCCATAGTTCCTGGACCTTCC |
|
spn-B |
ATCACGCAATCCCATCGAGGAC |
TCCGGTGCGAGAACATTAACCTG |
|
okr |
AGTCGGCCGAGAAGCATTTCAC |
GCAGCGCTTACACTTGAGCTTG |
|
Ku80 |
AGCTTCAGAATGTCGCAACTACC |
TCGTTGAAATCGAAGAGCAGGAG |
|
Sod1 |
TGCACGAGTTCGGTGACAACAC |
TCCTTGCCATACGGATTGAAGTGC |
|
Prx5 |
CCGATGAGCTGAAGTCCAAG |
TTGCCGTTCTCCACCACCAG |
|
Hsp27 |
ACTGGGTCGTCGTCGTTATTCG |
CGCGCGACGTGACATTTGATTG |
|
Hsp68 |
TGGGCACATTCGATCTCACTGG |
TAACGTCGATCTTGGGCACTCC |
|
Atg1 |
AGACTCTTCCTCGTGCAACTAGC |
GCTTGAGATCACGATGCACAATTC |
|
Atg5 |
CTCGTCAAGCTCAACTCCAAGG |
GTTGACCAATCCCAGCCAAAGC |
|
Ire1 |
GACAGTGAGGACAGCCGAATTATC |
GCGATTGCGGATCCTTGTGTATC |
Подготовку образцов и анализ экспрессии генов проводили с использованием оборудования ЦКП «Молекулярная биология» (ИБ ФИЦ Коми НЦ УрО РАН, г. Сыктывкар, Россия).
Результаты и их обсуждение
Нами было изучено влияние ретиноевой кислоты в концентрациях 0,1-500 мкмоль/л на длительность жизни дрозофил линии дикого типа Canton-S в четырех независимых биологических повторностях. У особей обоих полов добавление в питательную среду этого вещества изменяло среднюю, медианную ПЖ и возраст 90 % смертности в пределах 2-9 % (p<0,05) в сторону как увеличения, так и уменьшения этих параметров. Эффекты слабо воспроизводились между повторностями (табл. 2, 3). При совмещении полученных данных мы не наблюдали статистически значимых различий у самцов, но обнаружили положительное влияние ретиноевой кислоты в концентрациях 10 и 500 мкмоль/л на медианную ПЖ самок (2-5 %, p<0,05) и возраст 90 % смертности (6 %, p<0,05) (рис. 1).
В проведенных ранее исследованиях было показано, что ретиноевая кислота и ее производные могут оказывать благоприятное влияние на ПЖ модельных организмов. Например, потребление данного соединения в составе питательной среды продлевает жизнь нематод Caenorhabditis elegans за счет влияния на экспрессию генов, участвующих в процессах старения, в частности, генов коллагена [12]. Введение ретиноидов, инкапсулированных в наночастицы, мышам G93A с моделью бокового амиотрофического склероза приводило к улучшению двигательной активности, увеличению ПЖ и нейропротекции [18]. Но в другой работе с этими мышами длительный прием диетической добавки с ретиноевой кислотой, напротив, укорачивал жизнь [19].
Несмотря на описанные противоречивые данные, ретиноевую кислоту часто рассматривают как препарат, который может быть полезен при лечении связанных со старением заболеваний и даже синдромов преждевременного старения. В частности, транскриптомный анализ показал, что при болезни Альцгеймера нарушается регуляция многих генов, чувствительных к ретиноевой кислоте, и корепрес-соров ее рецепторов [20]. Ретиноиды подавляют экспрессию хемокинов и нейровоспалительных цитокинов в микроглии и астроцитах, которые активируются при болезни Альцгеймера. Стимуляция рецепторов ретиноевой кислоты и ретиноидных X-рецепторов замедляет накопление амилоидных белков, снижает нейродегенерацию и тем самым предотвращает негативные изменения у мышей с моделью болезни Альцгеймера [5]. В то же время ретиноевая кислота снижала уровень прогерина через регуляцию транскрипции в фибробластах с фенотипом синдрома Хатчинсона-Гилфорда и плюрипотентных стволовых клетках. Ее применение нормализовало пролиферацию клеток (в фибробластах), дифференцировку клеток (в стволовых клетках) и активность белков ответа на повреждение ДНК [21, 22].
У дрозофил линии дикого типа положительный эффект ретиноевой кислоты оказался выражен в небольшой степени и больше всего проявлялся у самок при применении максимальной концентрации 500 мкмоль/л. Далее мы оценили влияние вещества в данной концентрации на выживаемость дрозофил при воздействии индуктора окислительного стресса параквата. Однако ни в одной из биологических повторностей мы не наблюдали статистически значимого влияния исследуемого вещества на устойчивость дрозофил к прооксиданту (табл. 4).
В ряде исследований показано, что ретиноевая кислота и связанные с ней рецепторы и белки играют важную роль в поддержании митохондриальной функции и защите от действия свободных радикалов, обеспечивая устойчивость к усиливающим окислительный стресс воздействиям. Например, у мышей, которых подвергали гипоксии или обработке липосахаридами, ретиноевая кислота ингибировала продукцию активных форм кислорода и малонового диальдегида, улучшала экспрессию транскрипционного фактора Nrf2 и антиоксидантный статус. В результате наблюдали снижение повреждений в тканях организма [23, 24]. При введении грызунам клеток меланомы последующее применение инкапсулированной липосомами ретиноевой кислоты снижало окислительный стресс и воспаление, улучшало липидный профиль почти до нормального уровня, а также увеличивало продолжительность жизни [25]. В модели целебральной ишемии ретиноевая кислота предотвращала активацию микроглии и астроцитов, снижала уровень провоспалительных цитокинов, предположительно, за счет антиоксидантных и противовоспалительных свойств [26]. Более того, в работе на фибробластах человека, подвергшихся воздействию УФ-излучения, ретиноевая кислота ингибировала экспрессию лигазы Hrd1, которая обеспечивает убикви-
Таблица 2
Влияние ретиноевой кислоты на параметры продолжительности жизни самцов Drosophila melanogaster
Table 2
The effect of retinoic acid on the lifespan parameters of male Drosophila melanogaster
|
Обработка |
Концентрация, мкмоль/л |
Повторность |
X±SE |
M |
90% |
MRDT |
N |
|
Отрицательный контроль |
0 |
2 |
58,0±0,6 |
58 |
69 |
4,6 |
157 |
|
3 |
52,6±1,0 |
55 |
60 |
4,9 |
58 |
||
|
4 |
54,7±0,7 |
56 |
63 |
5,5 |
133 |
||
|
Контроль (0,2 % ДМСО) |
0 |
1 |
55,2±0,8 |
59 |
66 |
5,1 |
155 |
|
2 |
54,5±0,6 |
58 |
66 |
4,7 |
156 |
||
|
3 |
52,8±1,1 |
55 |
62 |
4,6 |
50 |
||
|
4 |
58,1±1,0 |
59 |
70 |
5,9 |
150 |
||
|
Ретиноевая кислота |
0,1 |
1 |
56,2±0,7 |
59 |
66 |
5,0 |
156 |
|
2 |
54,9±0,9 |
57 |
67 |
5,9 |
156 |
||
|
3 |
53,9±0,9 |
55 |
61 |
4,1 |
59 |
||
|
4 |
53,4±1,0 *** |
56 *** |
66 |
6,0 |
150 |
||
|
1 |
1 |
56,7±0,7 |
59 |
66 |
5,2 |
154 |
|
|
2 |
52,9±1,0 |
51 |
66 |
6,1 |
152 |
||
|
3 |
54,5±1,2 * |
59 |
66 |
5,0 |
58 |
||
|
4 |
56,0±0,9 * |
58 * |
67 |
6,0 |
152 |
||
|
10 |
1 |
57,5±0,7 |
59 |
67 |
5,3 |
155 |
|
|
2 |
56,9±0,6 |
58 * |
65 |
5,0 |
157 |
||
|
3 |
52,6±1,2 |
54 |
62 |
5,8 |
56 |
||
|
4 |
57,8±0,7 |
58 |
70 |
5,3 |
154 |
||
|
100 |
1 |
58,8±0,8 *** |
60 *** |
70 *** |
5,3 |
160 |
|
|
2 |
53,9±0,8 |
52 |
65 |
6,0 |
157 |
||
|
3 |
50,6±1,2 |
51 |
63 |
6,6 |
71 |
||
|
4 |
53,7±0,8 *** |
56 *** |
64 * |
5,5 |
159 |
||
|
500 |
1 |
60,5±0,6 *** |
61 *** |
68 *** |
4,3 |
151 |
|
|
2 |
54,3±0,9 |
57 |
65 |
6,1 |
152 |
||
|
3 |
50,6±1,2 |
51 |
63 |
6,4 |
89 |
||
|
4 |
55,8±0,8 *** |
56 ** |
67 |
5,9 |
152 |
Таблица 3
Влияние ретиноевой кислоты на параметры продолжительности жизни самок Drosophila melanogaster
Table 3
The effect of retinoic acid on the lifespan parameters of female Drosophila melanogaster
|
Обработка |
Концентрация, мкмоль/л |
Повторность |
X±SE |
M |
90% |
MRDT |
N |
|
Отрицательный контроль |
0 |
2 |
62,1±0,7 |
64 |
72 |
4,8 |
151 |
|
3 |
56,9±1,3 |
59 |
67 |
4,6 |
55 |
||
|
4 |
51,3±1,9 |
59 |
72 |
12,4 |
152 |
||
|
Контроль (0.2 % ДМСО) |
0 |
1 |
62,0±1,0 |
66 |
74 |
5,8 |
152 |
|
2 |
59,2±1,0 |
61 |
71 |
6,0 |
154 |
||
|
3 |
57,1±1,2 |
62 |
69 |
4,7 |
57 |
||
|
4 |
57,1±1,1 |
63 |
77 |
9,2 |
134 |
||
|
Ретиноевая кислота |
0,1 |
1 |
63,0±1,1 ** |
66 |
80 *** |
7,5 |
159 |
|
2 |
59,2±1,0 |
62 |
72 |
6,5 |
156 |
||
|
3 |
58,5±1,0 |
60 |
68 |
5,0 |
90 |
||
|
4 |
58,0±1,4 * |
62 |
73 *** |
7,5 |
154 |
||
|
1 |
1 |
59,8±1,1 * |
62 |
74 ** |
6,8 |
157 |
|
|
2 |
61,1±0,9 |
62 |
76 |
6,4 |
158 |
||
|
3 |
60,5±1,0 |
62 |
71 |
5,2 |
86 |
||
|
4 |
62,3±0,9 |
62 |
77 |
5,9 |
151 |
||
|
10 |
1 |
63,7±1,1 * |
66 |
73 |
6,6 |
156 |
|
|
2 |
60,0±1,0 |
62 |
72 |
6,2 |
159 |
||
|
3 |
62,2±1,3 * |
66 |
72 |
5,0 |
79 |
||
|
4 |
60,7±1,0 |
62 |
72 *** |
5,9 |
154 |
||
|
100 |
1 |
62,4±1,1 * |
66 |
75 |
6,4 |
160 |
|
|
2 |
61,0±0,9 |
63 |
75 * |
6,2 |
157 |
||
|
3 |
58,9±1,2 |
61 |
71 |
5,2 |
87 |
||
|
4 |
58,4±1,3 |
62 |
71 *** |
6,6 |
153 |
||
|
500 |
1 |
64,2±1,2 *** |
67 |
80 *** |
6,9 |
150 |
|
|
2 |
60,5±0,9 |
61 |
72 |
6,4 |
155 |
||
|
3 |
56,7±1,4 |
60 |
65 |
5,5 |
49 |
||
|
4 |
64,6±0,9 |
66 * |
77 |
5,4 |
147 |
Условные обозначения. Здесь и в табл. 3: X±SE - средняя ПЖ (сут); M -медианная ПЖ (сут); 90 % - возраст 90 % смертности (сут); MRDT - время удвоения интенсивности смертности (сут); N - количество особей в выборке.
Примечание. * различия с контролем (0,2 % ДМСО) статистически значимы при p<0,05 (четвертый столбец - критерий Мантеля-Кокса, пятый - критерий Гехана-Бреслоу-Вилкоксона, шестой столбец - метод Ванг-Аллисона); ** p<0,01; *** p<0,001.
Keys. Here and in Table 3: X±SE - average lifespan (days); M - median lifespan (days); 90 % - age of 90 % mortality (days); MRDT - doubling time of mortality intensity (days); N - number of individuals in the sample.
Note. * differences with the control (0.2 % DMSO) are statistically significant at p<0.05 (the fourth column is the Mantel-Cox test, the fifth column is the Gehan-Breslow-Wilcoxon test, the sixth column is the Wang-Allison method); ** p<0.01; *** p<0.001.
тилирование и деградацию Nrf2. Следовательно, ретиноевая кислота может способствовать усилению выработки Nrf2 в стрессовых условиях через данный механизм [27].
В то же время положительные эффекты ретиноевой кислоты на устойчивость биологической системы к про-оксидантным воздействиям, по-видимому, значительно зависят от применяемых доз и наблюдаются при относительно небольших концентрациях. Так, низкая концентрация ретиноевой кислоты – 10 нмоль/л, стимулировала в кардиомиобластах экспрессию своих ядерных рецеп- торов и индуцировала защитные механизмы, которые справлялись с повреждениями и повышали выживаемость после лазерного облучения. Обработанные клетки также в меньшей степени вырабатывали активные формы кислорода и лучше поддерживали митохондриальный потенциал. Кардиомиобласты, обработанные фармакологической концентрацией ретиноевой кислоты 1 мкмоль/л, напротив, демонстрировали повышение уровня маркеров окислительного стресса и воспаления и имели такую же выживаемость, как в контрольной группе [28]. Более того, в исследовании на культуре раковых клеток человека было показано, что высокие дозы ретиноевой кислоты оказывают цитотоксическое действие за счет индукции выработки активных форм кислорода, подавления NRF2 и его генов-мишеней, а также повышения уровня апоптоза через митохондриальный механизм [29]. Возможно, мы не наблюдали положительное действие изучаемого препарата на устойчивость к прооксиданту параквату из-за выбора слишком высокой дозы.
Ретиноевая кислота является важным звеном в координации транскрипции генов и мультифункциональным эпигенетическим регулятором. Например, она может уси-
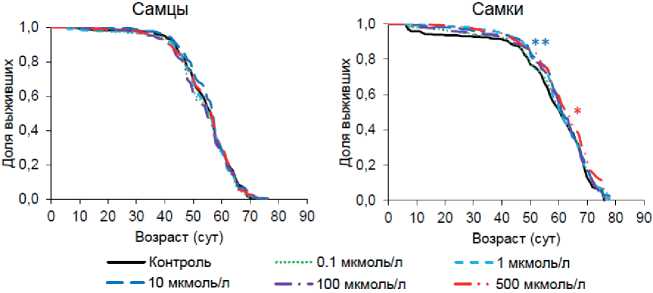
Рисунок 1. Кривые выживаемости особей Drosophila melanogaster , содержащихся на питательной среде с добавлением ретиноевой кислоты.
Условные обозначения. * p<0,05; ** p<0,01 (критерий Колмогорова-Смирнова).
Figure 1. Survival curves of Drosophila melanogaster individuals maintained in a nutrient medium supplemented with retinoic acid.
Keys. * p<0.05; ** p<0.01 (Kolmogorov-Smirnov test).
Таблица 4
Влияние ретиноевой кислоты на выживаемость особей Drosophila melanogaster при воздействии индуктора окислительного стресса параквата
Table 4
The effect of retinoic acid on the survival of Drosophila melanogaster individuals exposed to the oxidative stress inducer paraquat
|
Обработка |
Пол |
Повторность |
X±SE |
M |
90% |
N |
|
Контроль (0,2 % ДМСО) |
Самцы |
1 |
53,5±2,3 |
52 |
69 |
32 |
|
2 |
55,2±2,9 |
53 |
74 |
32 |
||
|
3 |
49,4±2,1 |
51 |
63 |
32 |
||
|
Самки |
1 |
55,0±3,5 |
52 |
49 |
32 |
|
|
2 |
72,3±3,4 |
73 |
95 |
32 |
||
|
3 |
60,1±3,3 |
61 |
84 |
32 |
||
|
Ретиноевая кислота в концентрации 500 мкмоль/л |
Самцы |
1 |
53,7±2,7 |
51 |
75 |
32 |
|
2 |
53,1±2,9 |
53 |
66 |
32 |
||
|
3 |
55,8±2,0 |
55 |
69 |
32 |
||
|
Самки |
1 |
60,9±4,0 |
61 |
90 |
32 |
|
|
2 |
70,3±4,5 |
78 |
96 |
31 |
||
|
3 |
53,3±3,1 |
52 |
82 |
31 |
Примечание. X±SE - средняя выживаемость (сут); M - медианная выживаемость (сут); 90% - возраст 90 % смертности (сут); N - количество особей в выборке.
Keys. X±SE - average lifespan (days); M - median lifespan (days); 90 % - age of 90 % mortality (days); N - number of individuals in the sample.
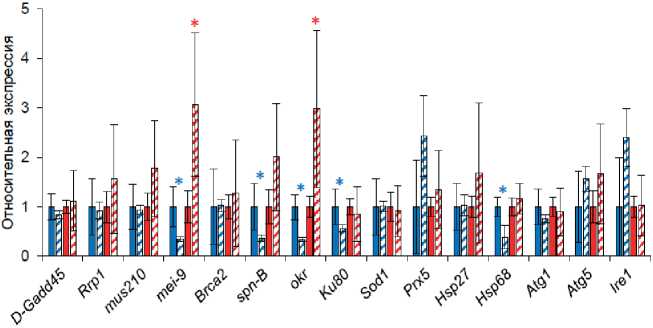
■ Самцы, контроль и Самцы, ретиноевая кислота
■ Самки, контроль 0 Самки, ретиноевая кислота
Рисунок 2. Влияние ретиноевой кислоты на экспрессию генов стресс-ответа и долгожительства у Drosophila melanogaster .
Условное обозначение. * p<0,05 (U-критерий Манна-Уитни).
Figure 2. The effect of retinoic acid on the expression of stress response and longevity genes in Drosophila melanogaster.
Key. * p<0.05 (Mann-Whitney U-test).
ливать репрессивную структуру гетерохроматина, обеспечивая контроль над делением и дифференцировкой клеток и защиту генетического материала. Описанная активность определяет способность ретиноевой кислоты влиять на различные сигнальные пути, в том числе, связанные со старением, возраст-зависимыми заболеваниями и стрессоустойчивостью [3, 20, 30-32].
С целью выявления возможных молекулярно-генетических механизмов действия ретиноевой кислоты мы проанализировали транскрипционную активность генов, вовлеченных в ответ на стресс и регуляцию ПЖ организма: гена распознавания повреждений ДНК - D-Gadd45 (гомолог GADD45 ); гена эксцизионной репарации оснований - Rrp1 (гомолог APE1 ); генов эксцизионной репарации нуклеотидов - mei-9 и mus210 (гомологи XPF, XPC ); генов репарации двухцепочечных разрывов ДНК путем гомологичной рекомбинации - Brca2, spn-B, okr (гомологи BRCA2, XRCC3, RAD54 ); гена репарации двухцепочечных разрывов ДНК путем негомологичного воссоединения концов - Ku80 ; генов антиоксидантной защиты - Sod1 и Prx5 ; генов белков теплового шока - Hsp27 и Hsp68 ; генов аутофагии - Atg1 и Atg5 ; гена ответа на стресс эндоплазматического ретикулума - Ire1 .
У самцов дрозофилы исследуемые соединения в большинстве случаев приводили к снижению транскрипционной активности генов репарации ДНК и протеостаза (включая mei-9, spn-B, okr, Ku80, Hsp68 ) в 1,8-3,0 раза (p<0,05). В то же время у самок ретиноевая кислота в концентрации 500 мкмоль/л повышала активность гена эксцизионной репарации нуклеотидов mei-9 и гена гомологичной рекомбинации okr в 3,0 раза (p<0,05) (рис. 2). Эти гены отвечают за механизмы репарации ДНК и могут быть связаны с долгожительством, усиливая работу клеточной защиты от повреждений и снижая нестабильности генома при старении [33-35]. Показано, что сверхэкспрессия гена mei-9 приводит к увеличению медианной ПЖ у дрозофил [33].
Имеется несколько работ, где продемонстрировано влияние ретиноевой кислоты на экспрессию генов и белков, отвечающих за восстановление повреждений ДНК, в основном, на клеточ- ных культурах. Например, обработка ретиноевой кислотой плюрипотентных эмбриональных клеток карциномы человека для индукции дифференциации повышала их выживаемость при воздействии УФ-излучения и увеличивала экспрессию генов эксцизионной репарации нуклеотидов, включая XPC и XPF [36]. Ретиноевая кислота приводила к повышению жизнеспособности клеток в коре головного мозга молодых и старых мышей, обработанных Aβ. Она предотвращала и улучшала восстановление двунитевых разрывов ДНК, усиливала экспрессию протеинкиназы ATM, регулировала сигнальные пути RARα/β/γ, PPARβ/δ и антиамилоидогенные белки на посттрансляционном уровне [37, 38].
В то же время ретиноевая кислота в высоких концентрациях является генотоксическим агентом. В проведенном нами ранее исследовании данное вещество оказывало радиосенсибилизирующее действие на дрозофил и повышало уровень повреждений ДНК [39]. В клетках пигментного эпителия сетчатки ретиноевая кислота увеличивала уровень активных форм кислорода, щелочно-лабильных участков в ДНК, одноцепочечных разрывов ДНК и приводила к гибели клеток [40]. В исследованиях на культурах клеток грызунов показано, что данному негативному действию препятствует активация белка RAD54 (ортолог okr дрозофилы) [41]. В нашей работе ретиноевая кислота могла также выступать в качестве генотоксического воздействия, которое приводило к активации генов репарации ДНК и вызывала увеличение ПЖ по механизму гормезиса.
Таким образом, мы изучили влияние ретиноевой кислоты на ПЖ и выживаемость особей Drosophila melanogaster при воздействии индуктора окислительного стресса параквата. Данное вещество в концентрациях 10 и 500 мкмоль/л оказало геропротекторный эффект на самок дрозофил, вызвав увеличение медианной ПЖ и возраста 90 % смертности на 2-5 и 6 % соответственно, но не влияло на устойчивость к прооксиданту параквату. Положительное действие ретиноевой кислоты на длительность жизни может быть обусловлено активацией генов репарации ДНК mei-9 и okr .


