Анализ инфекционных осложнений у онкологических больных в 2014-2016 гг.
Автор: Агинова Виктория Викторовна, Дмитриева Наталья Владимировна, Петухова Ирина Николаевна, Григорьевская Злата Валерьевна, Багирова Наталья Сергеевна, Терещенко Инна Васильевна, Дьякова Светлана Андреевна, Калинчук Татьяна Алексеевна, Дмитриева Анна Игоревна, Винникова Валерия Дмитриевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.18, 2019 года.
Бесплатный доступ
Цель исследования - проанализировать инфекционные осложнения (ИО), вызванные мультирезистентными микроорганизмами в зависимости от противоопухолевого лечения. Материал и методы. Исследовано 229 онкологических больных с инфекционными осложнениями противоопухолевого лечения. Результаты. Среди исследованных больных превалировали пациенты, страдавшие раком легкого (26,6 %), раком желудка (25,3 %) и раком пищевода (14,4 %). Развившиеся после операции ИО отмечены у 83,4 % исследованных больных, их причиной были мультирезистентные Acinetobacter baumannii (40,6 %), Klebsiella pneumoniae (28,5 %), Pseudomonas aeruginosa (19,5 %), Staphylococcus spp. (9,4 %), Enterococcus spp. (1,8 %). Заключение. Инфекционные осложнения чаще развиваются у послеоперационных онкологических больных (p
Послеоперационные инфекционные осложнения, мультирезистентные микроорганизмы, опухоли торако-абдоминальной области, антибактериальные препараты, иммунная система
Короткий адрес: https://sciup.org/140254272
IDR: 140254272 | УДК: 616-006-06:616.9 | DOI: 10.21294/1814-4861-2019-18-4-43-49
Текст научной статьи Анализ инфекционных осложнений у онкологических больных в 2014-2016 гг.
The purpose of the study was to analyze infectious complications caused by multi-drug-resistant organisms depending on anticancer therapy. Material and Methods. A total of 229 cancer patients with infectious complications of cancer therapy were included into the study. Results. Lung cancer was the most predominant cancer (26.6 %) followed by gastric cancer (25.3 %) and esophageal cancer (14.4 %). Infectious complications occurring after surgery were observed in 83.4 % of the patients. Infectious complications caused by Acinetobacter baumannii were the most common (40.6 %), followed by Klebsiella pneumoniae (28.5 %), Pseudomonas aeruginosa (19.5 %), Staphylococcus spp . (9.4 %), and Enterococcus spp . (1.8 %). Conclusion . Infectious complications occurred more frequently in postoperative cancer patients (p<0.02), and the ESKAPE group pathogens were the leading cause of these infections.
Онкологические заболевания продолжают оставаться одной из самых актуальных проблем современной медицины. По данным ВОЗ, рак является второй из основных причин смерти в мире. В 2018 г. от этого заболевания умерли 9,6 млн. человек. Рак становится причиной практически каждой шестой смерти в мире. Около 70 % случаев смерти от рака происходит в странах с низким и средним уровнем дохода [1]. Есть и более обнадеживающая статистика: число проживших более 5 лет после постановки первичного диагноза достигло 43,8 млн [2].
Лечение онкологических заболеваний является наиболее сложной задачей современной медицины. Химиотерапия, хирургия и лучевая терапия являются самыми распространенными видами лечения рака [3]. Хирургические вмешательства первостепенны при лечении злокачественных опухолей, так как обеспечивают максимальное удаление опухолевой ткани [4]. Химио- и лучевая терапия существенно повышают эффективность проводимого лечения. Однако любые инвазивные вмешательства могут сопровождаться инфекционными осложнениями, что особенно неблагоприятно для онкологических больных. Основным фактором, определяющим процесс развития инфекции, а также эффективность антимикробной терапии, является функциональная активность иммунной системы [5–7]. Риск развития инфекции у онкологических больных существенно повышен в связи с наличием опухолевой интоксикации, истощения, анемии, длительностью и объемом оперативных вмешательств, обширной интраоперационной кровопотерей, а также предшествующей химио-или лучевой терапией и/или использованием глюкокортикоидных препаратов. При этом инфекции в большинстве случаев имеют нозокомиальную природу, протекают крайне тяжело и плохо поддаются терапии вследствие высокой резистентности возбудителей [8–10]. Особую сложность для лечения представляют грибково-бактериальные ассоциации возбудителей.
Наиболее часто в качестве этиологических агентов нозокомиальных инфекций выступают бактерии группы ESKAPE, которая включает в себя ряд микроорганизмов, часто обладающих множественной (MDR) и экстремальной (XDR) лекарственной устойчивостью: кишечная палочка, золотистый стафилококк, Klebsiella pneumoniae, Acinetobacter baиmanni, cинегнойная палочка и Enterococcus spp. [7, 9–13]. По данным многочисленных исследований установлено, что в стационарах различного профиля формируется специфичный состав нозокомиальной микрофлоры, который обусловлен, в первую очередь, направлением лечения в клинике. Например, часто выделяемыми возбудителями инфекционных осложнений онкологических больных при инфекциях кровотока, нижних дыхательных путей, мочевыводящих путей, микрофлоры раневого отделяемого и отделяемого дренажей становятся S. aureus, E. faecalis, E. faecium, P. aeruginosa, А. baumanni, К. pneumonae, E. coli. Подавляющее большинство микроорганизмов, выявленных при инфекционных осложнениях у таких пациентов, устойчивы к антибиотикам. Очевидно, что в стационарах онкологического профиля формируется особенная, часто эндемичная, нозокомиальная микрофлора, что позволяет говорить о необходимости выделения в отдельную ветвь исследований инфекций, возникающих при лечении пациентов в онкологии.
У онкологических больных лечение таких инфекций представляет особую сложность, так как для них характерно снижение иммунологического ответа, наличие сопутствующих заболеваний, нарушение многих видов обмена. Хирургическое лечение, химио- и лучевая терапия влияют на состояние естественных биологических барьеров, обеспечивающих устойчивость организма к инвазии инфекционных агентов из внешней среды или изменению патогенности сапрофитов, обитающих на коже и слизистых оболочках [14].
Целью исследования явился анализ инфекционных осложнений, вызванных резистентными бактериальными микроорганизмами, в зависимости от вида противоопухолевого лечения.
Материал и методы
Культивирование микроорганизмов проводилось по стандартным микробиологическим методикам с применением стандартизированных питательных сред, согласно нормативным документам (Приказ МЗ СССР № 535 от 22 апреля 1985 г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений»).
Видовую принадлежность микроорганизмов в этой группе больных определяли колориметрическим методом на современных автоматических анализаторах: Vitek-2 System (Франция), MicroScan WalkAway (Германия/США), а также методом матрично-ассоциированной лазерной десорбции/ ионизации – время-пролетной масс-спектрометрии (MALDI-TOF) и программного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия). Определение лекарственной устойчивости к антибиотикам проводили согласно ISO 20776-1:2006 и ГОСТ Р ИСО 20776-1-2010 турбидиметрическим методом при помощи анализаторов «Vitek 2» и методом флюоресцентной детекции на анализаторе «Microscan WalkAway – 40 SI».
Для доказательства нозокомиальной природы наиболее часто выделяемых микроорганизмов на первом этапе были использованы такие методы фенотипического типирования, как биотипирова-ние и устойчивость к антимикробным препаратам. Данные показатели определяли на микробиологических анализаторах «Vitek 2» (производитель BioMerieux), «Microscan WalkAway – 40 SI» (производитель Siemens Healthcare Diagnostics). На втором этапе был применен кластерный анализ изолятов (MSP Dendrogram – древовидная кластеризация), что позволило верифицировать случаи внутрибольничного инфицирования на основе клональной общности штаммов микроорганизмов. Изначально каждый штамм рассматривался как отдельный кластер, далее происходило объединение близлежащих кластеров в один и т. д. и сравнение их с имеющимися данными в библиотеке масс-спектров. Масс-спектрометрический анализ осуществляли с помощью времяпролетного MALDI-масс-спектрометра Microflex TM (производитель Bruker), насыщенного азотным лазером 337 нм. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 2000 до 20000. Для записи, обработки и анализа масс-спектров использовали программное обеспечение компании Bruker Daltonics (Германия): flexControl 2,4 (Build 38) и flexAnalysis 2,4 (Build 11). Точность измерения масс составляла ± 2 Да.
Статистическую обработку результатов проводили с помощью программ Excel (Microsoft, США), Statistica 10,0 (Statsoft, Znc., США). Оценивали достоверность различий сравниваемых величин с помощью параметрического t-критерия Стьюдента. Различия считали достоверными при р≤0,05.
Результаты
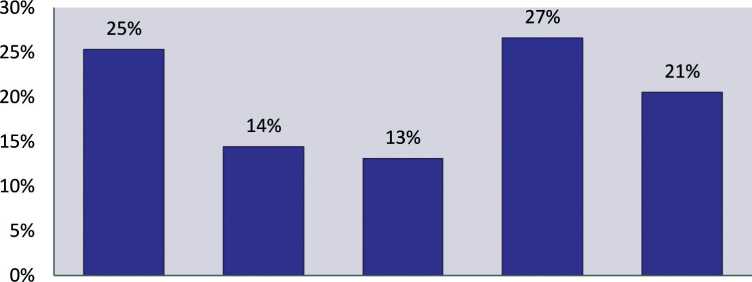
Рис. 1. Соотношение установленных диагнозов у больных, включенных в исследование
Таблица 1
Распределение пациентов с инфекционными осложнениями в зависимости от вида опухоли и метода лечения
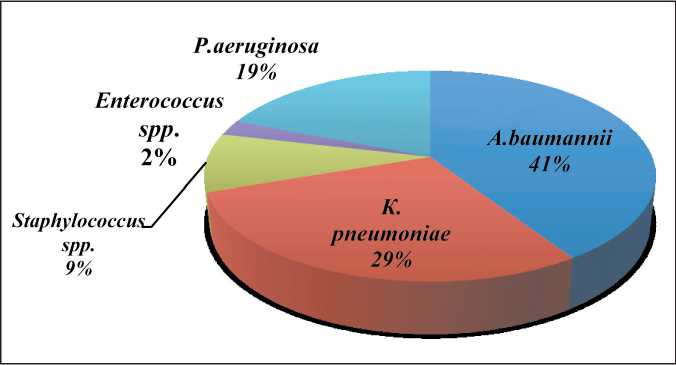
Рис. 2. Соотношение этиологически значимых возбудителей инфекционных осложнений
(табл. 1). Наибольшее количество инфекционных осложнений у онкологических больных возникло после хирургических вмешательств (p<0,02).
Проведен анализ частоты встречаемости возбудителей инфекционных осложнений у пациентов исследуемой группы (рис. 2). При определении количества выделенных изолятов учитывался критерий этиологической значимости возбудителей. Причиной инфекционных осложнений явились A. baumannii в 41,0 % случаев, К. pneumoniae – в 29,0 %, P.aeruginosa – в 19,0 %, бактерии рода Staphylococcus – в 9,0 % . Доля энтерококков была невелика и составила 1,8 %. Полученные результаты соответствуют данным мониторинга возбудителей инфекций в онкологической клинике за период 2008–16 гг.
При определении лекарственной устойчивости возбудителей инфекционных осложнений установлено, что большая часть штаммов (n=154)
MSP Dendrogram
neumoniae neumoniae neu
„___________lae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae pneumoniae
1000 800 600 400 200 0
Distance Level
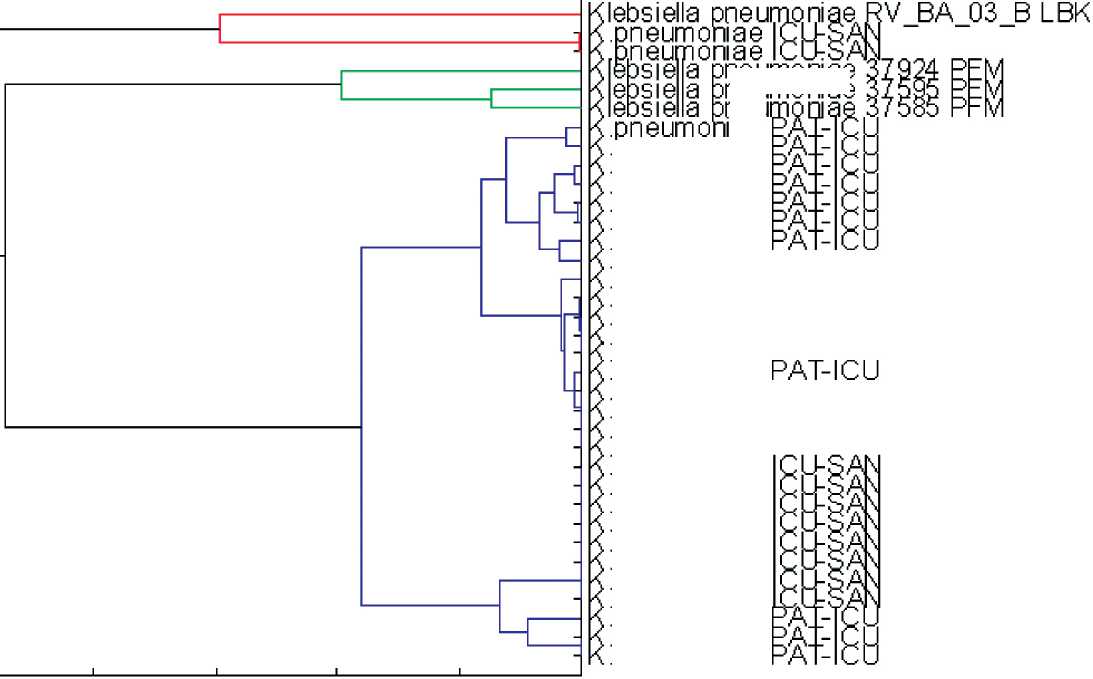
Рис. 3. MSP-дендрограмма К. pneumoniae
микроорганизмов обладала множественной и экстремальной лекарственной устойчивостью (табл. 2–4). Данные, представленные в таблицах, иллюстрируют принадлежность выделенных возбудителей к группе экстремально резистентных (чрезвычайно устойчивых) бактерий (XDR), которые являются эпидемиологически значимыми из-за их устойчивости хотя бы к одному антибиотику во всех классах антимикробных препаратов, кроме 1–2 классов, или же к одному или нескольким ключевым противомикробным агентам.
С целью установления нозокомиальной природы возбудителей была проведена оценка филогенетического родства штаммов, циркулирующих в клинике, и этиологических агентов инфекционных осложнений онкологических больных, в частности, построены и проанализированы дендрограммы некоторых видов «проблемных» микроорганизмов на масс-спектрометре Maldi Tof (Bruker). В результате была построена MSP-дендрограмма 35 штаммов К. pneumoniae, выделенных в 2016 г. из патологических материалов больных и объектов внешней среды, подлежащих санитарному контролю (рис. 3). На дендрограмме имеется три отдельных масс-спектрометрических пика – красный, зеленый и синий. В красный вошли 2 штамма, полученных по результатам санитарных анализов. Эти штаммы родственны библиотечному RV_BA_03_BLBK. Три штамма зеленого пика соответствуют библиотечным штаммам, внесенным в библиотеку спектров масс-спектрометра (Bruker). Самым многочисленным оказался синий пик, который состоит из двух клонов. Согласно дендрограмме, клоны штаммов К. pneumoniae санитарных анализов и клинических изолятов объединяются в единый кластер, что говорит об их генетическом родстве. Отсутствие в кластере библиотечного штамма указывает на то, что это микроорганизмы,
Таблица 2
Устойчивость A. baumannii (n=93) к различным антибактериальным препаратам
Заключение
Инфекционные осложнения у больных развиваются на различных этапах противоопухолевого лечения. Как правило, такого рода осложнения вызваны резистентными бактериальными микроорганизмами. Материалы настоящего исследования показали, что инфекционные осложнения наиболее часто развиваются в послеоперационном периоде – 75,1 % (p<0,02). У пациентов, получающих химио- и лучевую терапию, инфекции выявлены в 17,9 и 7,0 % случаев соответственно. В целом этиологическими агентами инфекционных осложнений явились бактерии группы ESKAPE. Более чем в
Список литературы Анализ инфекционных осложнений у онкологических больных в 2014-2016 гг.
- WHO. Cancer [Internet]. URL: https://www.who.int/ru/news-room/ fact-sheets/detail/cancer (cited: 01.05.2019).
- UN News [Internet]. URL: https://news.un.org (cited: 01.05.2019).
- Arruebo M., Vilaboa N., Saez-Gutierrez B., Lambea J., Tres A., Val-ladares M., Gonzalez-Fernandez A. Assessment of the evolution of cancer treatment therapies. Cancers (Basel). 2011 Aug 12; 3(3): 3279-330. DOI: 10.3390/cancers3033279
- Гольденшлюгер Н.И. Оперативное лечение рака: эффективность, методы и подходы, локализации [Интернет]. URL: http://onkolib.ru/ lechenie-raka/operaciya (дата обращения: 01.05.2019).
- Дмитриева Н.В., Петухова И.Н., Смолянская А.З. Инфекционные осложнения в онкологической клинике. Практическая онкология. 2001; 1(5): 18-20. [Dmitrieva N.V., Petukhova I.N., Smolyanskaya A.Z. Infectious complications in the oncological clinic. Practical Oncology. 2001; 1(5): 18-20. (in Russian)].


