Анализ эффективности первичного лечения рака яичников IА-IIА стадий
Автор: Журман В.Н., Нечушкина В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Цель исследования - определить эффективность первичного лечения больных раком яичников IА-IIА стадий. Материал и методы. В исследование включено 336 пациенток с гистологически подтвержденным раком яичников IА-IIA стадий, получавших лечение в Приморском краевом онкологическом диспансере с 2004 по 2021 г. Проанализированы общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) в зависимости от клинико-морфологических факторов: гистологического типа рака, мутации BRCA1/2 , профиля клиники, где выполнено хирургическое лечение, хирургического стадирования и варианта химиотерапии. Обследование на мутацию в гене BRCA1/2 выполнялось методом секвенирования нового поколения.
Рак яичников, ia-iia стадии, хирургическое стадирование, первичное лечение
Короткий адрес: https://sciup.org/140307915
IDR: 140307915 | УДК: 618.11-006.6-08 | DOI: 10.21294/1814-4861-2024-23-5-17-25
Текст научной статьи Анализ эффективности первичного лечения рака яичников IА-IIА стадий
В Приморском крае рак яичников (РЯ) в 2022 г. занимал 3-е место (4,1 %) в структуре заболеваемости злокачественными новообразованиями женских половых органов (в России 3-е место, 4,5 %) [1]. Доля пациенток с I–II стадиями заболевания составила 44,9 % (в России – 42,4 %) [2]. За последние десять лет удельный вес пациенток с впервые в жизни установленным диагнозом РЯ I–II стадий увеличился на 10–15 %, что, вероятно, обусловлено низкой частотой выполнения адекватного хирургического стадирования. В 30–35 % выполнение всех действий хирургического стадирования позволяет диагностировать диссеминированный процесс [3, 4]. В Приморском крае в структуре смертности от злокачественных новообразований женских половых органов рак яичников занимает 2-е место (3,8 %) (в России 1-е место, 5,6 %) [1].
Первичное хирургическое лечение РЯ I–II стадий включает установление стадии, для чего необходимо применение методик определения хирургической стадии и полной циторедуктивной операции. Частота микрометастазов в большом сальнике при раннем РЯ составляет 20 % [5–9]. Выполнение биопсии брюшины в 5 % случаев повышает стадию рака яичников с I до II и в 2,5 % случаев – с I до III [10–12]. Частота поражения регионарных лимфоузлов при I стадии составляет 10 %, при II стадии – 27 %, при III стадии – 62 % [13–14].
По данным исследования ACTION, наиболее значимыми факторами, неблагоприятно влияющими на общую выживаемость при ранних стадиях РЯ, являются неадекватное определение стадии, низкая степень дифференцировки опухоли – серозный, светлоклеточный или недифференцированный рак [15–17]. При неадекватном определении стадии показано повторное хирургическое вмешательство. Это снижает риск рецидива и позволяет в определенных случаях отказаться от адъювантной химиотерапии у больных ранним раком яичников.
Целью исследования явилось изучение эффективности первичного лечения больных раком яичников IА–IIА стадий.
Материал и методы
В ретроспективный анализ включено 336 пациенток с гистологически подтвержденным раком яичников IА–IIA стадий, получавших лечение в Приморском краевом онкологическом диспансере в период с 2004 по 2021 г. Проведен анализ общей выживаемости и выживаемости без прогрессирования в данной группе пациенток в зависимости от ряда клинико-морфологических факторов: гистологического типа рака яичников, мутаций генов BRCA1/2 , профиля клиники первичного хирургического лечения, хирургического стадирования и варианта химиотерапии.
Обследование на определение мутаций в генах BRCA1/2 выполнялось с 2017 г. в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения» на базе референтной лаборатории (лаборатория фармакогеномики, Институт химической биологии и фундаментальной медицины СО РАН) методом секвенирования нового поколения NGS (Next Generation sequencing). На исследование направлялись опухолевый материал и/или здоровая ткань (кровь) больных серозной карциномой high-grade.
Полученные параметры обрабатывались с помощью стандартных методов статистического анализа с использованием программы «IBM SPSS Statistics 26».
Результаты
В группу больных раком яичников IA–IIA стадий включено 336 пациенток. Средний возраст составил 52,12 ± 12,13 года. При этом РЯ IА стадии диагностирован у 130 (38,7 %), IB стадии – у 20 (5,9 %), IC стадии – у 153 (45,6 %), IIA стадии – у 33 (9,8 %) больных. Чаще всего встречалась серозная карцинома high-grade: из 179 (53,3 %) пациенток серозная карцинома low-grade диагностирована у 92 (27,4 %), серозная карцинома без указания степени злокачественности – у 49 (14,6 %) больных. Реже всего встречались эндометриоидная карцинома, светлоклеточная карцинома и опухоль Бреннера – в 3,6; 0,8 и 0,3 % случаев соответственно. В данной группе больных медиана продолжительности жизни (ПЖ) не достигнута, 5-летняя общая выживаемость (ОВ) составила 82,1 ± 2,9 %, медиана выживаемости без прогрессирования (ВБП) – 185,0 ± 31,7 мес, 5-летняя ВБП – 65,6 ± 3,5 %.
Наиболее благоприятной патоморфологической формой рака яичников по течению заболевания была серозная карцинома low-grade – медиана ПЖ не достигнута, 5-летняя ОВ – 84,1 ± 6,5 %, по сравнению с больными серозной карциномой high-grade, при которой медиана ПЖ составила 109,0 ± 13,9 мес, 5-летняя ОВ – 75,0 ± 4,7 % (р=0,01;
ОР=0,4: 95 % ДИ 0,2–0,9). У 49 пациенток отсутствуют данные о степени злокачественности опухолевых клеток, что не позволяет ее отнести ни к серозной карциноме low-grade, ни к серозной карциноме high-grade, в этой группе максимальная медиана ПЖ не достигнута, 5-летняя ОВ составила 85,7 ± 6,2 % (р <0,01; ОР=0,2: 95 % ДИ 0,1–0,5). Достоверно выше ВБП была у больных серозной карциномой low-grade – медиана составила 245,0 ± 0,0 мес, 5-летняя – 74,5 ± 7,1 %, по сравнению с больными серозной карциномой high-grade, у которых медиана ВБП составила 67,0 ± 14,8 мес, 5-летняя ВБП – 49,0 ± 5,7 % (р=0,02; ОР=0,4: 95 % ДИ 0,2–0,8). При этом у больных серозной карциномой яичников без указания степени злокачественности отмечены самые высокие данные ВБП – медиана не достигнута, 5-летняя составила 85,7 ± 6,2 % (рис. 1 и 2).
У 80 из 179 (44,7 %) больных серозной карциномой high-grade проведено обследование на определение мутаций в генах BRCA1/2 , из них мутации в генах BRCA1/2 выявлены у 14 (17,5 %) из 80 больных, мутация отсутствовала у 66 (82,5 %) из 80 больных. Значимое влияние наличия мутаций в генах BRCA1/2 на ОВ и ВБП не выявлено.
Преимущества в отношении ОВ отмечаются у пациенток, которым выполнено первичное хирургическое лечение в специализированном стационаре онкогинекологического профиля, – медиана ПЖ не достигнута, 5-летняя ОВ – 83,2 ± 3,4 %, по сравнению с больными, которым проведено хирургическое лечение в стационарах гинекологического профиля, – медиана ПЖ составила 109 ± 23,8 мес, 5-летняя ОВ – 70,8 ± 7,2 % (р=0,04; ОР=2,4: 95 % ДИ 1,3–4,2). У больных, которым первичное хирургическое лечение проведено в стационарах онкогинекологического профиля, медиана ВБП составила 245,0 ± 74,2 мес, 5-летняя ВБП – 71,1 ± 3,9 %, у пациенток, которым хирургическое лечение проведено в стационарах гинекологического профиля, медиана ВБП составила 78,0 ± 23,7 мес, 5-летняя ВБП – 54,8 ± 7,5 % (р=0,02; ОР=1,8: 95 %
ДИ 1,1–2,8). Повторное хирургическое лечение выполнено 15 (4,5 %) из 336 пациенток, с целью радикального объема или адекватного хирургического стадирования в специализированном стационаре онкогинекологического профиля. Повторное хирургическое вмешательство выполнялось в среднем через 25–30 дней. При анализе ОВ и ВБП у пациенток с повторным хирургическим лечением в специализированном отделении не выявлено значимых преимуществ ОВ и ВБП. Тем не менее отмечена тенденция к улучшению медианы ВБП у пациенток с повторным хирургическим лечением в специализированном отделении (рис. 3 и 4).
Нами проанализировано влияние выполнения процедур хирургического стадирования на ОВ и ВБП. Вариантом выполнения хирургического
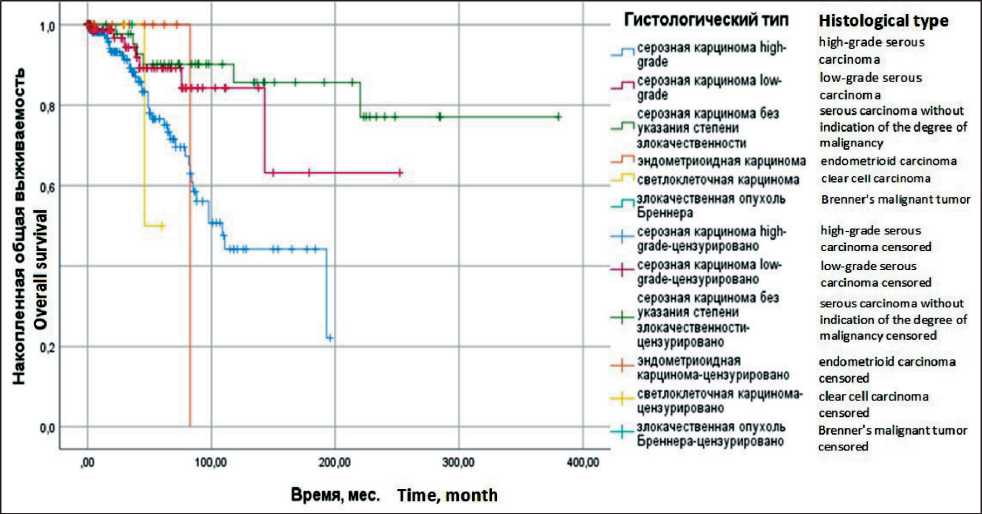
Рис. 1. Общая выживаемость больных раком яичников ІА–ІІА стадий в зависимости от гистологического типа опухоли (метод Каплана–Мейера). Примечание: рисунок выполнен авторами
Fig. 1. Overall survival in patients with stage ІA–ІІA ovarian cancer, depending on the histological type of tumor (Kaplan–Meyer method). Note: created by the authors
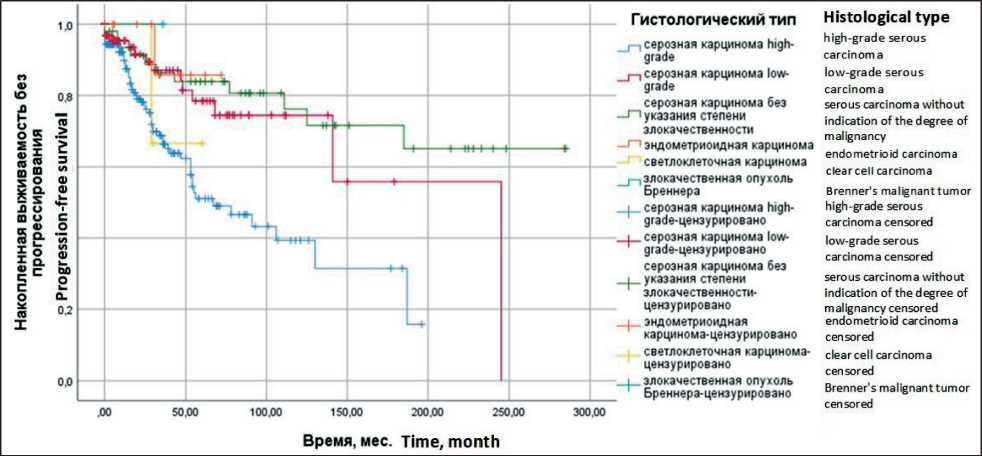
Рис. 2. Выживаемость без прогрессирования больных раком яичников ІА–ІІА стадий в зависимости от гистологического типа опухоли (метод Каплана–Мейера). Примечание: рисунок выполнен авторами
Fig. 2. Progression-free survival in patients with stage ІA–ІІA ovarian cancer, depending on the histological type of tumor (Kaplan–Meyer method). Note: created by the authors
стадирования являлось выполнение всех этапов, указанных в клинических рекомендациях. Частичное выполнение или невыполнение стадирования, а также отсутствие данных о стадировании расценивались нами как невыполненное хирургическое стадирование. Следовательно, оценить влияние адекватного определения хирургической стадии на ОВ и ВБП при раке яичников IА–IIA стадиий крайне сложно, так как оно было выполнено лишь в 12,5 % случаев, у 18,8 % пациенток в протоколах операций отсутствовали какие-либо данные о его проведении. Тем не менее максимальная медиана ПЖ и 5-летней ОВ была у больных, которым проведены все процедуры хирургического ста-дирования, медиана ПЖ не достигнута, 5-летняя
ОВ – 94,3 ± 3,2 %, ниже у больных, которым не проводилось хирургическое стадирование или проводилось не в полном объеме, медиана ПЖ составила 128,0 ± 0,0 мес, 5-летняя ОВ – 77,6 ± 3,9 % (р=0,008; ОР=2,5: 95 % ДИ 1,2–5,2). Также медиана ВБП и 5-летняя ВБП выше в группе больных, которым проводилось хирургическое стадирование, – 245,0 ± 51,6 мес и 80,1 ± 5,4 % соответственно, ниже у больных, которым хирургическое стадирование не выполнялось, – 106,0 ± 24,5 мес и 59,5 ± 4,5 % соответственно (р=0,010; ОР=2,2: 95 % ДИ 1,2–4,0).
С целью сохранения репродуктивной функции органосохраняющее лечение выполнялось пациенткам с серозным раком яичников low-grade IA и
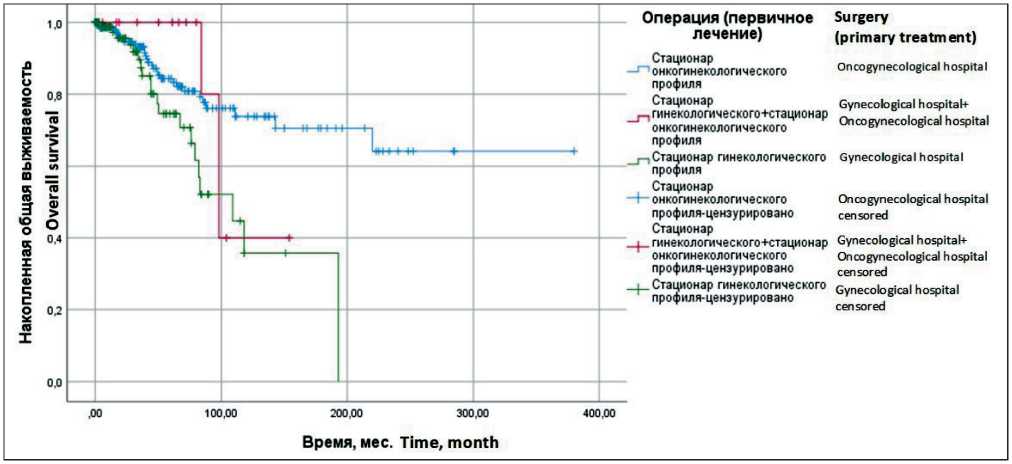
Рис. 3. Общая выживаемость больных раком яичников ІА–ІІА стадий в зависимости от места проведения операции (первичного лечения) (метод Каплана–Мейера). Примечание: рисунок выполнен авторами
Fig. 3. Overall survival in patients with ovarian cancer of stages ІA–ІІA, depending on the place of surgery (primary treatment) (Kaplan–Meyer method). Note: created by the authors
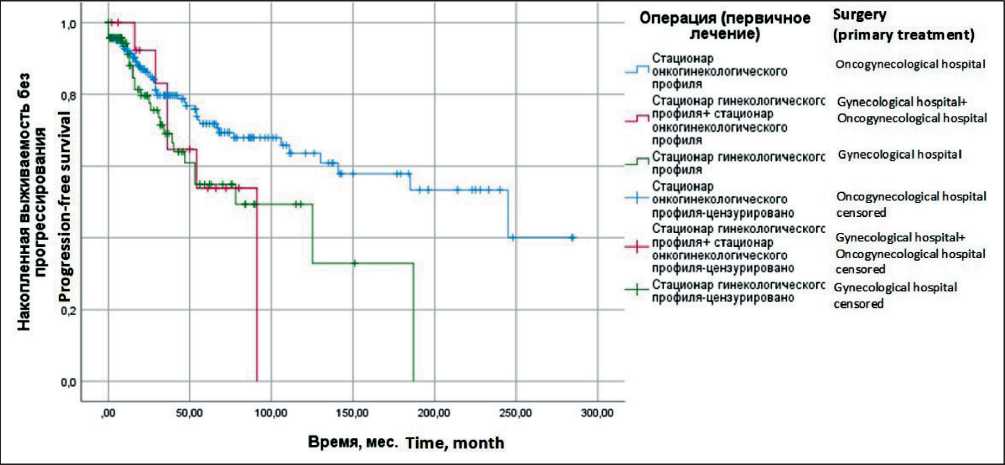
Рис. 4. Выживаемость без прогрессирования больных раком яичников ІА–ІІА стадий в зависимости от места проведения операции (первичного лечения) (метод Каплана–Мейера). Примечание: рисунок выполнен авторами
Fig. 4. Progression–free survival in patients with ovarian cancer of stages ІA–ІІA, depending on the place of surgery (primary treatment) (Kaplan–Meyer method). Note: created by the authors
IC1. Нами проанализированы ОВ и ВБП у пациенток с серозным раком яичников low-grade IA и IC1 в зависимости от объема выполненной операции – органосохраняющее лечение или радикальная операция. Оказалось, что эти 2 группы пациенток имеют одинаковые ОВ и ВБП, достоверных различий не получено, медиана ПЖ и медиана ВБП не достигнуты, 5-летняя ОВ в группе пациенток с органосохраняющим лечением составила 93,7 ± 4,6 %, с радикальным – 97,3 ± 3,2 %, 5-летняя ВБП – 96,1 ± 6,3 и 98,7 ± 5,3 % соответственно.
Также нами проанализированы варианты химиотерапии, для этого мы разделили пациенток на три группы: 1-я группа (n=289) – больные, которым назначалась химиотерапия комбинацией препаратов платины и таксанов; 2-я группа (n=19) – больные, которые получали химиотерапию по схеме препараты платины и нетаксановые агенты; 3-я группа (n=28) – больные, которым не назначалась химиотерапия. Медиана ПЖ была значимо выше у пациенток, которым назначалась химиотерапия комбинацией препаратов платины и таксанов – не достигнута, 5-летняя ОВ – 89,2 ± 3,6 %, по сравнению с пациентками, получившими химиотерапию комбинацией препаратов платины и нетаксановых агентов, у которых медиана ПЖ составила 111 ± 0,0 мес, 5-летняя ОВ – 70,6 ± 5,1 % (р=0,001; ОР=0,3: 95 % ДИ 0,2–0,7). ВБП была достоверно выше у больных, получавших химиотерапию комбинацией препаратов платины и таксанов, – медиана ВБП не достигнута, 5-летняя ВБП – 81,9 ± 4,4 %, по сравнению с больными, которым назначалась химиотерапия препаратами платины и нетаксановые агенты и у которых медиана ВБП составила 78,0 ± 21,0 мес, 5-летняя ВБП – 58,6 ± 5,1 % (р=0,001; ОР=0,4: 95 % ДИ
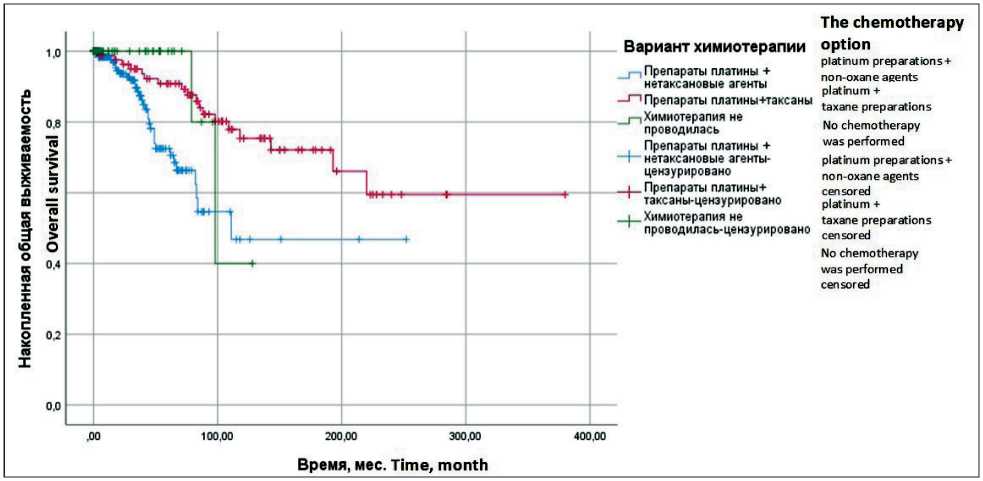
Рис. 5. Общая выживаемость больных раком яичников ІА–ІІА стадий в зависимости от вида химиотерапии (метод Каплана–Мейера). Примечание: рисунок выполнен авторами
Fig. 5. Overall survival in patients with stage ІA–ІІA ovarian cancer depending on chemotherapy (Kaplan–Meyer method). Note: created by the authors
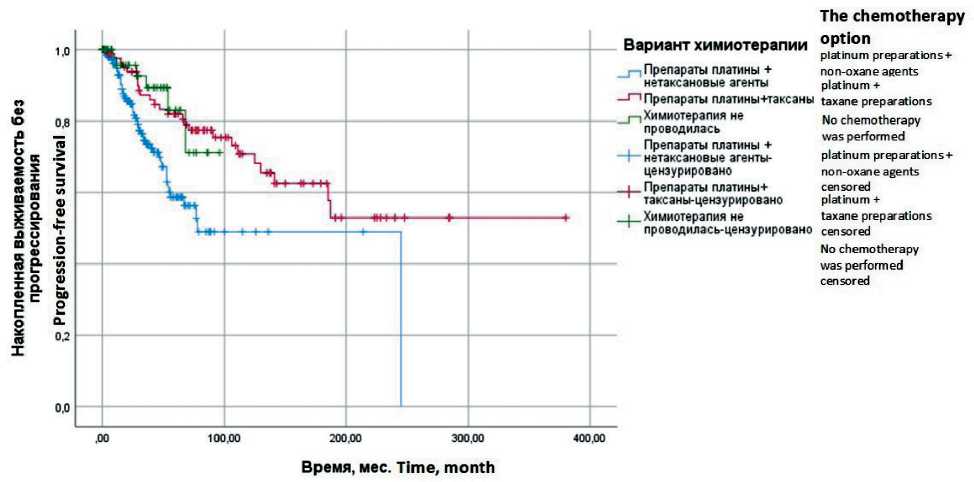
Рис. 6. Выживаемость без прогрессирования больных раком яичников ІА–ІІА стадий в зависимости от химиотерапии (метод Каплана-Мейера). Примечание: рисунок выполнен авторами
Fig. 6. Progression–free survival in patients with stage ІA–ІІA ovarian cancer depending on chemotherapy (Kaplan-Meyer method) Note: created by the authors
0,3–0,7). Обращает на себя внимание тот факт, что у больных, которым не проводилась химиотерапия, медиана ПЖ составила 98,0 ± 14,1 мес, 5-летняя ОВ – 80,0 ± 17,9 %, но отсутствуют значимые различия по сравнению с группой больных, которым назначалась комбинация препаратов платины и таксанов или комбинация препаратов платины и нетаксановых агентов. Выявлены достоверные различия между группой пациенток, которым назначалась комбинация препаратов платины и нетаксановых агентов, медиана ВБП составила 78,0 ± 21,0 мес, 5-летняя ВБП – 58,6 ± 5,1 %, по сравнению с пациентками, которые не получали химиотерапию и у которых медиана ВБП не достигнута, 5-летняя ВБП – 83,0 ± 7,8 % (р=0,018; ОР=0,4: 95 % ДИ 0,2–0,9). Это обусловлено тем, что при пра- вильным отборе больных отсутствие химиотерапии безопасно и не ухудшает ОВ и ВБП (рис. 5 и 6).
Многофакторный анализ показал, что статистически значимыми факторами, влияющими на ОВ у пациенток с РЯ IА–IIА стадий, являются гистологический тип опухоли и место проведения первичного хирургического лечения: серозный РЯ low-grade, серозная карцинома без указания степени злокачественности опухоли снижают риск смерти на 60 и 80 % соответственно. Первичное хирургическое лечение, выполненное в стационарах гинекологического профиля, повышает риск смерти в 2,1 раза (табл. 1). Фактором, достоверно влияющим на ВБП, является гистологический тип опухоли. Так, при серозной карциноме low-grade риск прогрессирования снижается на 60 %, а при
Таблица 1/table 1
Общая выживаемость больных раком яичников iА–iiА стадий в зависимости от клиникоморфологических факторов (многофакторный анализ, регрессия Кокса)
Overall survival of patients with stage iia ovarian cancer depending on clinical and morphological factors (multifactorial analysis, Cox regression)
|
Фактор/The factor |
р |
ОP (95 % ДИ)/ RR (95 % CI) |
|
Гистологический тип/Histological type |
||
|
Серозная карцинома high-grade/Serous carcinoma high-grade |
– |
С |
|
Серозная карцинома low-grade/Serous carcinoma low-grade |
0,03 |
0,4 (0,2 – 0,9) |
|
Не указан/Not specified |
0,001 |
0,2 (0,1 – 0,5) |
|
Эндометриоидная карцинома/Endometrioid carcinoma |
0,38 |
0,4 (0,1–3,0) |
|
Светлоклеточная карцинома/Clear cell carcinoma |
0,56 |
1,8 (0,2–13,4) |
|
Злокачественная опухоль Бреннера/Brenner's malignant tumor |
0,98 |
0,0 (0,0–2,4×10303) |
|
Место проведения операции/Location of the operation |
||
|
Специализированные стационары онкогинекологического профиля/ |
С |
|
|
Specialized oncogynecological hospitals |
||
|
Стационары гинекологического профиля + специализированные стационары онкогинекологи-ческого профиля/Gynecological hospital + specialized oncogynecological hospitals |
0,79 |
0,8 (0,3–2,8) |
|
Стационары гинекологического профиля/Gynecological hospital |
0,01 |
2,1 (1,7 – 3,7) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 2/table 2
Выживаемость без прогрессирования больных раком яичников iА–iiА стадий в зависимости от клинико-морфологических факторов (многофакторный анализ, регрессия Кокса)
Progression-free survival in patients with ovarian cancer of stages ia–iia, depending on clinical and morphological factors (multifactorial analysis, Cox regression)
|
Фактор/The factor |
р |
ОP (95 % ДИ)/ RR (95 % CI) |
|
Гистологический тип/Histological type |
||
|
Серозная карцинома high-grade/High-grade serous carcinoma |
– |
С |
|
Серозная карцинома low-grade/Low-grade serous carcinoma |
<0,01 |
0,4 (0,2 – 0,8) |
|
Не указан/Not specified |
<0,01 |
0,3 (0,1 – 0,6) |
|
Эндометриоидная карцинома/Endometrioid carcinoma |
0,13 |
0,2 (0,03–1,5) |
|
Светлоклеточная карцинома/Clear cell carcinoma |
0,80 |
0,8 (0,1–5,6) |
|
Злокачественная опухоль Бреннера/Brenner's malignant tumor |
0,97 |
0,0 (0,0–5,3×10258) |
|
Место проведения операции/Location of the operation |
||
|
Специализированные стационары онкогинекологического профиля/ |
С |
|
|
Specialized oncogynecological hospitals |
||
|
Стационары гинекологического профиля + специализированные стационары онкогинекологи-ческого профиля/Gynecological hospital + specialized oncogynecological hospitals |
0,34 |
1,5 (0,6–3,6) |
|
Стационары гинекологического профиля/Gynecological hospital |
0,03 |
1,7 (1,0–2,7) |
Примечание: таблица составлена авторами.
Note: created by the authors.
серозной карциноме без указания степени злокачественности – на 70 %. У больных, которым хирургическое лечение выполнено в стационарах гинекологического профиля, риск прогрессирования повышается в 1,7 раза (табл. 2).
Обсуждение
Заключение
На основании нашего анализа около 30 % больных раком яичников IA–IIA стадий в Приморском крае получали первичное хирургическое
Список литературы Анализ эффективности первичного лечения рака яичников IА-IIА стадий
- Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2021. 252 с. [Malignant tumors in Russia in 2020 (morbidity and mortality). Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2021. 252 p. (in Russian)].
- Состояние онкологической помощи населению России в 2021 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2022. 239 с. [Cancer care for the population of Russia in 2021. Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2022. 239 p. (in Russian)].
- Нечушкина В.М., Морхов К.Ю., Абдурагимова З.Т., Кузнецов В.В., Сельчук В.Ю., Дмитриев В.Н. Хирургическое лечение рака яичников ранних стадий. Современная онкология. 2018; 20(2): 61–65. [Nechushkina V.M., Morkhov K.Yu., Abduragimova Z.T., Kuznetsov V.V., Selchuk V.Yu., Dmitriev V.N. Surgery for early-stage ovarian cancer. Journal of Modern Oncology. 2018; 20(2): 61–65. (in Russian)].
- Orr B., Edwards R.P. Diagnosis and Treatment of Ovarian Cancer. Hematol Oncol Clin North Am. 2018; 32(6): 943–64. doi: 10.1016/j.hoc.2018.07.010.
- Young R.C., Decker D.G., Wharton J.T., Piver M.S., Sindelar W.F., Edwards B.K., Smith J.P. Staging laparotomy in early ovarian cancer. JAMA. 1983; 250(22): 3072–6.
- Ran X., He X., Li Z. Comparison of Laparoscopic and Open Surgery for Women With Early-Stage Epithelial Ovarian Cancer. Front Oncol. 2022; 12. doi: 10.3389/fonc.2022.879889.
- Buchsbaum H.J., Brady M.F., Delgado G., Miller A., Hoskins W.J., Manetta A., Sutton G. Surgical staging of carcinoma of the ovaries. Surg Gynecol Obstet. 1989; 169(3): 226–32.
- Yuan Z., Zhang Y., Cao D., Shen K. Surgical staging of apparent early-stage ovarian mucinous carcinoma. World J Surg Oncol. 2022; 20(1): 307. doi: 10.1186/s12957-022-02758-0.
- Arie A.B., McNally L., Kapp D.S., Teng N.N. The omentum and omentectomy in epithelial ovarian cancer: a reappraisal: part II—The role of omentectomy in the staging and treatment of apparent early stage epithelial ovarian cancer. Gynecol Oncol. 2013; 131(3): 784–90. doi: 10.1016/j.ygyno.2013.09.013.
- Bolze P. A., Collinet P., Golfier F., Bourgin C. Chirurgie des stades précoces des cancers ovariens. Article rédigé sur la base de la recommendation nationale de bonnes pratiques cliniques en cancérologie intitulée «Conduites à tenir initiales devant des patientes atteintes d’un cancer épithélial de l’ovaire» élaborée par FRANCOGYN, CNGOF, SFOG, GINECO-ARCAGY sous l’égide du CNGOF et labellisée par l’INCa. Gynecologie, obstetrique, fertilite & senologie. 2019; 47(2): 168–79. doi: 10.1016/j.gofs.2018.12.007.
- Lee J.Y., Kim H.S., Chung H.H., Kim J.W., Park N.H., Song Y.S. The role of omentectomy and random peritoneal biopsies as part of comprehensive surgical staging in apparent early-stage epithelial ovarian cancer. Ann Surg Oncol. 2014; 21(8): 2762–6. doi: 10.1245/s10434-014-3648-z.
- Hao Z., Yu Y., Yang S. The impact of omentectomy on causespecific survival of Stage I-IIIA epithelial ovarian cancer: A PSM-IPTW analysis based on the SEER database. Front Surg. 2022; 9. doi: 10.3389/fsurg.2022.1052788.
- Fournier M., Stoeckle E., Guyon F., Brouste V., Thomas L., Mac- Grogan G., Floquet A. Lymph node involvement in epithelial ovarian cancer: sites and risk factors in a series of 355 patients. Int J Gynecol Cancer. 2009; 19(8): 1307–13. doi: 10.1111/IGC.0b013e3181b8a07c.
- Hoogendam J.P., Vlek C.A., Witteveen P.O., Verheijen R., Zweemer R.P. Surgical lymph node assessment in mucinous ovarian carcinoma staging: a systematic review and meta-analysis. BJOG. 2017; 124(3): 370–8. doi: 10.1111/1471-0528.14226.
- Sainz de la Cuesta R., Goff B.A., Fuller A.F. Jr, Nikrui N., Eichhorn J.H., Rice L.W. Prognostic importance of intraoperative rupture of malignant ovarian epithelial neoplasms. Obstet Gynecol. 1994; 84(1): 1–7.
- Zimmermann J.S.M., Radosa J.C., Radosa M.P., Sklavounos P., Schweitzer P.A., Solomayer E.F. Survey of current practices and opinions of German Society of Gynecologic Endoscopy members regarding the treatment of ovarian neoplasia by robotic surgery. Arch Gynecol Obstet. 2021; 303(5): 1305–13. doi: 10.1007/s00404-020-05876-w. Erratum in: Arch Gynecol Obstet. 2022; 305(2): 545. doi: 10.1007/s00404-021-06136-1.
- Kinay T., Kizilkaya Y., Altinbas S.K., Tapisiz O.L., Ustun Y.E. Feasibility and Safety of Laparoscopic Surgery in Large Ovarian Masses. Gynecol Minim Invasive Ther. 2022; 11(4): 215–20. doi: 10.4103/gmit.gmit_122_21.
- Тюляндина А.С., Коломиец Л.А., Морхов К.Ю., Нечушкина В.М., Покатаев И.А., Румянцев А.А., Тюляндин С.А., Урманчеева А.Ф., Хохлова С.В. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб. Злокачественные опухоли: Практические рекомендации RUSSCO. 2022; 12(3s2): 198–211. [Tyulyandina A.S., Kolomiets L.A., Morkhov K.Yu., Nechushkina V.M., Pokataev I.A., Rumyantsev A.A., Tyulyandin S.A., Urmancheeva A.F., Khokhlova S.V. Practical recommendations for the drug treatment of ovarian cancer, primary peritoneal cancer and fallopian tube cancer. Malignant tumors: Practical recommendations of RUSSCO. 2022; 12(3s2): 198–211. (in Russian)].
- Timmers P.J., Zwinderman K., Coens C., Vergote I., Trimbos J.B. Lymph node sampling and taking of blind biopsies are important elements of the surgical staging of early ovarian cancer. Int J Gynecol Cancer. 2010; 20(7): 1142–7. doi: 10.1111/igc.0b013e3181ef8e03.
- Altın D., Taşkın S., Ortaç F. Short review of current implementations of sentinel lymph node mapping in gynecologic cancers. J Turk Ger Gynecol Assoc. 2021; 22(3): 242–8. doi: 10.4274/jtgga.galenos.2021.2021.0025.
- Peters I.T., van Haaften C., Trimbos J.B. If the Mountain Does Not Come to Mohammad: The Significance of Guest Operations for Early Stage Ovarian Cancer. J Gynecol Surg. 2014; 30(5): 265–72. doi: 10.1089/gyn.2013.0088.
- Chatterjee S., Chen L., Tergas A.I., Burke W.M., Hou J.Y., Hu J.C., Ananth C.V., Neugut A.I., Hershman D.L., Wright J.D. Utilization and Outcomes of Chemotherapy in Women With Intermediate-Risk, Early-Stage Ovarian Cancer. Obstet Gynecol. 2016; 127(6): 992–1002. doi: 10.1097/AOG.0000000000001404.
- Nasioudis D., Latif N.A., Simpkins F., Cory L., Giuntoli R.L. 2nd, Haggerty A.F., Morgan M.A., Ko E.M. Adjuvant chemotherapy for early stage endometrioid ovarian carcinoma: An analysis of the National Cancer Data Base. Gynecol Oncol. 2020; 156(2): 315–9. doi: 10.1016/j.ygyno.2019.11.125.
- Trimbos B., Timmers P., Pecorelli S., Coens C., Ven K., van der Burg M., Casado A. Surgical staging and treatment of early ovarian cancer: long-term analysis from a randomized trial. J Natl Cancer Inst. 2010; 102(13): 982–7. doi: 10.1093/jnci/djq149.


