Анализ эффективности различных белковых покрытий для оптимизации эндотелизации полимерных матриксов
Автор: Е.А. Великанова, В.Г. Матвеева, Е.А. Сенокосова, М.Ю. Ханова, Е.О. Кривкина, Л.В. Антонова
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Обоснование. В связи с постоянным увеличением количества операций по восстановлению кровотока в пораженных сосудах актуальна разработка синтетических протезов. Одним из ключевых факторов их успешности является повышение адгезионных свойств внутренней поверхности, поскольку быстрая эндотелизация сосудистых протезов считается фактором, необходимым для предотвращения тромбозов и гипертрофии неоинтимы. Цель исследования: определить влияние модификации поверхности полимерных матриксов фибрином, фибронек- тином или коллагеном I типа на адгезию и жизнеспособность эндотелиальных клеток. Методология и методы исследования. Исследовали полимерные матриксы, изготовленные методом электроспиннинга из смеси поли(3-гидроксибутирата-ко-3-гидроксивалерата) и поли(ε-капролактона). Образцы матриксов покрывали коллагеном I типа, фибронектином или фибрином. Затем на матриксы заселяли эндотелиальные клетки пупочной вены человека (HUVEC), культивировали 3 сут. В качестве контроля использовали немодифицированные матриксы и лунки культурального планшета. Жизнеспособность клеток оценивали сочетанной окраской Hoechst 33342 и этиди- ум бромидом. Метаболическую активность клеток изучали с помощью МТТ-теста. Адгезию клеток анализировали по окрашиванию на F-актин. Статистический анализ результатов выполняли в программе GraphPrism 7.0. Результаты. Установлено, что по количеству адгезированных клеток и их метаболической активности матриксы с коллагеном не отличались от немодифицированных. Покрытие фибронектином продемонстрировало более высокие показатели адгезии клеток к поверхности. Однако достаточно высокий уровень гибели клеток в этой группе указывает на то, что подобная модификация не может в полной мере обеспечить нормальное функционирование клеток. Наконец, наилучшие результаты мы наблюдали при использовании фибринового покрытия, которое по показателям адгезии и жизнеспособности эндотелиальных клеток было сравнимо с культуральным пластиком. Заключение. Модификация поверхности полимерных матриксов фибрином позволяет значительно улучшить их адгезионные свойства и может быть использована при разработке полимерных протезов сосудов малого диаметра.
Тканевая инженерия, протезы сосудов малого диаметра, электроспиннинг, фибрин, эндотелиальные клетки
Короткий адрес: https://sciup.org/149141594
IDR: 149141594 | УДК: 616.1-77:[576.311.34:547.962]:57.085.23 | DOI: 10.29001/2073-8552-2023-38-1-160-166
Текст научной статьи Анализ эффективности различных белковых покрытий для оптимизации эндотелизации полимерных матриксов
The study was supported by the Ministry of Science and Higher Education of the Russian Federation within the framework of the Agreement on the provision of grants from the federal budget in the form of subsidies in accordance with paragraph 4 of Article 78.1 of the Budget Code of the Russian Federation № 075-15-2022-1202 dated September 30, 2022, concluded to implement the Order of the Russian Federation Government dated May 11, 2022 No. 1144-r. Velikanova E.A., Matveeva V.G., Senokosova E.A., Khanova M.U., Krivkina E.O., Antonova L.V. Analysis of the effectiveness of various protein coatings for optimizing the endothelialization of polymer matrices. The Siberian Journal of Clinical and Experimental Medicine. 2023;38(1):160– 166.
Сердечно-сосудистые заболевания являются основной причиной смертности в мире; по прогнозам их встречаемость к 2030 г. возрастет до 23,3 млн [1]. При этом ряд широко распространенных заболеваний и патологических состояний связаны с нарушением проходимости кровеносных сосудов. Золотым стандартом хирургического лечения в таких случаях является использование аутологичных вен в качестве шунтов [2]. Однако у значительной части пациентов по разным причинам, таким как сопутствующие заболевания или отсутствие подходящего для шунта сосуда, нет возможности проведения подобной операции с использованием собственного сосуда [3]. Таким образом, актуальным остается вопрос разработки синтетических протезов, в том числе малого диаметра (до 6 мм).
Наиболее перспективным направлением разработки протезов сосудов представляется тканевая инженерия. В основе лежит идея о конструировании каркаса из биосо-вместимого материала, который служит базой для заселения клетками и последующего воссоздания на месте такого протеза аналога нативного сосуда [4].
В рамках подходов к решению этого вопроса рассматриваются различные варианты заселения матриксов клетками: in vitro, с дооперационным культивированием клеточно-заселенных протезов, in vivo и in situ, с идеей привлечения клеток в матрикс непосредственно в живом организме и управления этим процессом с помощью биологически активных молекул [5]. Но независимо от выбранного подхода, в большинстве случаев исследователи встают перед необходимостью модификации внутренней поверхности сосудистого протеза для увеличения адгезии эндотелиальных клеток. Это крайне важный аспект разработки протеза сосуда малого диаметра, поскольку наиболее частыми осложнениями, связанными с имплантацией такого протеза, являются тромбозы и гиперплазия неоинтимы [2]. Предполагается, что быстрая эндотелизация внутренней поверхности позволит предотвратить такие проблемы [6], что возвращает к необходимости разработки покрытия, которое способно максимально поддерживать адгезию, миграцию и пролиферацию эндотелиальных клеток.
В настоящем исследовании для модификаций полимерных матриксов мы использовали белки, которые широко применяются в том числе в культуральной практике для улучшения адгезивных свойств поверхности, а именно коллаген I типа, фиброноген и фибрин. В различных исследованиях были показаны хорошие перспективы использования данных покрытий в тканевой инженерии сосудов. Так, в работах [7] и [8] показано значимое усиление эффективности реэндотелизации децеллюляри-зированных аорты и клапана после покрытия их фибронектином, W. Flameng и соавт. получили аналогичные результаты при использовании фибрина [9]. В нашей работе мы провели сравнительный анализ эффективности этих видов покрытий в отношении улучшения адгезии эндотелиальных клеток на поверхности полимерных матриксов.
Цель работы: определить эффективность модификации поверхности полимерных матриксов фибрином, фибронектином или коллагеном I типа для улучшения адгезии и поддержания жизнеспособности эндотелиальных клеток.
Материал и методы
Изготовление матриксов
Полимерные матриксы изготавливали методом эмульсионного электроспиннинга на установке Nanon-01A (MECC, Япония) из смеси поли(3-гидроксибу-тирата-ко-3-гидроксивалерата) (Sigma-Aldrich) и по-ли(ε-капролактона) (Sigma-Aldrich) в соотношении 1 : 2. В качестве растворителя использовали 1,1,1,3,3,3-гек-сафлуоро-2-пропанол (Sigma-Aldrich). Матриксы изготавливали с использованием иглы калибра 27G, при следующих параметрах электроспиннинга: напряжение на игле составляло 23 kV, скорость подачи раствора полимера – 0,3 мл/ч, скорость вращения коллектора – 200 об/мин, расстояние от иглы до намоточного коллектора – 15 см. Полученные матриксы подвергали стерилизации этиленоксидом.
Из полученного матрикса вырезали образцы, которые помещали на дно лунок 24-луночного культурального планшета, затем проводили процедуру модификации поверхности.
Модификация коллагеном
Изготавливали раствор бычьего коллагена I типа (А10644-01, Invitrogen) в 0,02М уксусной кислоте в концентрации 5 мкг/мл. Полученный раствор заливали в лунки планшета с матриксами, инкубировали при комнатной температуре в течение 1 ч. Затем раствор удаляли, трижды промывали лунки с матриксами фосфатно-солевым буфером и высушивали.
Модификация фибронектином
Изготавливали рабочий раствор фибронектина крыс в фосфатно-солевом буфере в концентрации 10 мкг/мл. Готовый раствор заливали в лунки планшета с матриксами, инкубировали при комнатной температуре в течение 1 ч. Затем раствор удаляли и высушивали матриксы.
Модификация фибрином
Фибрин выделяли из сыворотки крови условно здоровых доноров. Подробно процедура получения фибрина описана в нашем раннем исследовании [10].
Культура клеток
Для проведения эксперимента использовали эндотелиальные клетки пупочной вены человека (HUVEC), выделенные ранее на базе нашей лаборатории. Клетки культивировали в среде MDCB 131 с добавками для эндотелиальных клеток. Пассаж культуры проводили по достижении 70% конфлюэнтности, клетки снимали с поверхности раствором трипсина-ЭДТА (15400054, Thermo Fisher Scientific, Waltham, MA, USA) в концентрации 0,025%. Все манипуляции проводили в стерильных условиях, клетки культивировали в условиях CO2-инкубатора при 37,0 °C 5% CO2.
Для оценки адгезионных свойств модифицированных матриксов HUVEC засевали на образцы матриксов, покрытых коллагеном, фибронектином или фибрином в количестве 50 000 клеток на образец. В качестве контроля использовали клетки, культивированные на немодифи-цированных матриксах, а также в лунках культурального планшета.
Таким образом, в эксперименте использовали следующие группы:
– HUVEC, культивированные в лунке культурального планшета (CONTROL);
– HUVEC, культивированные на образцах полимерного матрикса без модификации поверхности (PHBV/PCL);
– HUVEC, культивированные на образцах полимерного матрикса, модифицированного коллагеном (PHBV/ PCL-COL);
– HUVEC, культивированные на образцах полимерного матрикса, модифицированного фибронектином (PHBV/ PCL-FN);
– HUVEC, культивированные на образцах полимерного матрикса, модифицированного фибрином (PHBV/PCL-FIBRIN).
Клетки на матриксах и пластике культивировали в стандартной культуральной среде в течение 3 сут. После окончания эксперимента проводили оценку жизнеспособности клеток методом флуоресцентной микроскопии, оценку метаболической активности клеток – с помощью МТТ-теста и окрашивание на F-актин для анализа адгезии клеток к поверхности.
Флуоресцентная микроскопия
Клетки на поверхности матрикса окрашивали ядер-ным красителем Hoechst (14533, Sigma Aldrich, USA, St. Louis, МО) в концентрации 10 мкг/мл в течение 10 мин. Затем к клеткам добавляли раствор этидиум бромида (46067, Sigma Aldrich, Sigma Aldrich, USA, St. Louis, MO) в концентрации 30 мкг/мл, окрашивали в течение еще 2 мин и затем анализировали с помощью флуоресцентного микроскопа AxioObserver (Zeiss). Анализировали по 3 образца из каждой группы, по 10 случайно выбранных полей зрения с каждого образца на увеличении ×200. Оценивали количество живых и мертвых клеток, пересчитывали на 1 мм2 площади поверхности.
МТТ-тест
Метаболическую активность клеток изучали с помощью МТТ-теста (Abcam, UK ). Для этого в лунки планшета с культивированными на поверхности матрикса клетками вносили реагент в соответствии с протоколом производителя и инкубировали в течение 4 ч в условиях СО2-инку-батора. Затем культуральную среду с прореагировавшим реагентом переносили в лунки 96-луночного планшета и считывали оптическую плотность (ОП) на анализаторе Multiskan Sky при λ570/605 нм. Из каждой группы анализировали по 3 образца. Контроль измерения проводили по пустой лунке (ОПконтр). ОП каждого образца рассчитывали по формуле:
ОП = ОП570/ОП605-ОПконтр.
Конфокальная микроскопия
Проводили иммунофлуоресцентное окрашивание на VE-кадгерин и F-актин. Для этого клетки фиксировали 4% раствором параформальдегида в течение 10 мин, затем проводили пермеабилизацию 0,1% раствором X-100 в течение 15 мин. Перед окрашиванием внутриклеточных маркеров (vWF, F-actin) проводили пермеаби-лизацию 0,01% раствором Triton X-100. Для блокировки неспецифического связывания использовали 1% раствор бычьего сывороточного альбумина в фосфатно-солевом буфере (BSA/PBS). После этого наносили на образцы первичные антитела кролика к CD144 человека (ab33168, Abcam) и инкубировали в течение ночи при 4 оС. Затем после отмывки в фосфатно-солевом буфере, содержащем 1% Tween-20, на образцы наносили антитела осла к IgG кролика, конъюгированные с AF488 (A11034, Invitrogen) и фаллоидин, конъюгированный с флуоресцентным красителем Alexa Fluor 568 (Alexa Fluor™ 568 Phalloidin, A12380, Thermo Fisher), инкубировали при комнатной температуре в течение 1 ч. Образцы докрашива- ли ядерным красителем DAPI. Готовые стекла заключали в ProLong (Life Technologies, США) под стекло. Препараты анализировали с помощью лазерного сканирующего микроскопа LSM 700 (Zeiss, Германия).
Статистическая обработка результатов
Статистический анализ результатов выполняли в программе GraphPrism 7.0 (Graph Pad Software). Характер распределения данных в выборках оценивали по критерию Колмогорова – Смирнова. Данные представлены в виде медианы и квартилей ( Me ( Q 25; Q 75)). Для оценки статистической значимости отличий между группами использовали критерий Краскела – Уоллиса и апостериорный критерий Данна для парных сравнений. За критический уровень значимости принимали p = 0,05.
Результаты и обсуждение
Оценка жизнеспособности клеток
По результатам анализа плотности клеточных культур на образцах матрикса было показано, что в отношении адгезии клеток к поверхности покрытие коллагеном оказалось наименее эффективным из всех представленных: не было обнаружено значимых различий в количестве HUVEC на матриксах PHBV/PCL и PHBV/PCL-COL (рис. 1А). Покрытие фибронектином способствовало более эффективной адгезии и пролиферации HUVEC на поверхности матрикса, для этой группы наблюдали значимое увеличение количества клеток по сравнению с немодифи-цированным матриксом (268,8 (169,8; 346,1) ед/см2 против 160,4 (88,87; 228,3) ед/см2, p = 0,001). Наилучшие результаты среди выбранных вариантов модификации поверхности продемонстрировало фибриновое покрытие. В этой группе наблюдали выраженное увеличение количества адгезированных клеток (407,5 (352,6; 434,2) ед/см2), значимо отличающееся от всех групп матриксов ( р = 0,001).
Для более углубленного анализа способности представленных образцов матриксов сохранять жизнеспособность клеток на их поверхности изучили соотношение живых и мертвых клеток (рис. 1В).
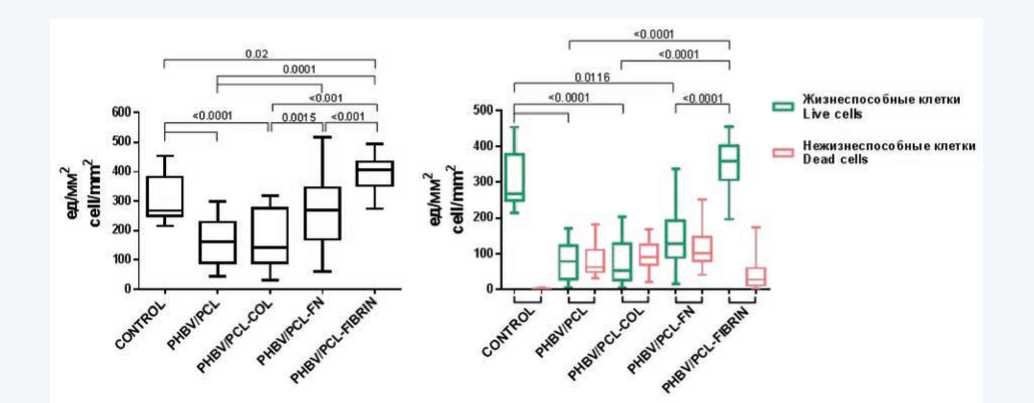
Рис. 1. Оценка плотности клеточной культуры (А) и жизнеспособности HUVEC (B), адгезировавших на поверхности полимерных матриксов и культурального пластика. На диаграмме представлены медианы, 25-й и 75-й процентили, минимальные и максимальные значения показателя. Значения p приведены над скобками
Fig. 1. Evaluation of cell culture density (A) and viability of HUVEC (B) adhering to the surface of polymer matrices and culture plastic. The diagram shows medians, 25th and 75th percentiles, minimum and maximum values. The p values are given above the brackets
В целом полученные результаты соотносились с данными о плотности клеточной культуры на поверхности образцов. Однако при статистически значимом увеличении количества клеток на поверхности PHBV/PCL-FN мы не наблюдали аналогичной разницы в жизнеспособности клеточной культуры. Достаточно высокий уровень погибших клеток в этой группе (101,2 (80,20;147,4) ед/см2) позволяет предположить, что хотя покрытие фибронектином успешно создает условия для эффективного прикрепления клеток к поверхности, подобная модификация не может в полной мере обеспечить нормальное функционирование клеток. Как и в случае с плотностью культуры, наилучшие результаты мы наблюдали в группе PHBV/PCL-FIBRIN. Количество живых клеток на поверхности этих матриксов в несколько раз превышало значения, полученные с остальных матриксов. С учетом достаточно низкого уровня гибели клеток фибриновое покрытие было сравнимо с культуральным пластиком в отношении адгезии и пролиферации клеток на поверхности.
Аналогичные результаты были получены при анализе метаболической активности клеток (рис. 2). Наихудшие значения наблюдали у группы PHBV/PCL; показатели матриксов PHBV/PCL-COL были несколько выше, однако значимо не отличались от немодифицированных матриксов. Метаболическая активность матриксов PHBV/ PCL-FN была значимо выше по сравнению с PHBV/PCL ( р = 0,0013); при модификации матриксов фибрином наблюдали еще большее увеличение показателя ( р < 0,0001 по сравнению с PHBV/PCL). Интересно, что метаболическая активность в группе PHBV/PCL-FIBRIN превышала даже показатели клеток на культуральном пластике.
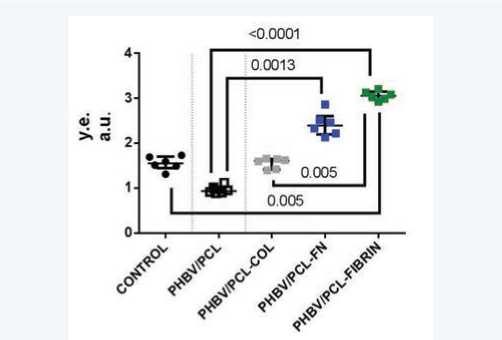
Рис. 2. Метаболическая активность HUVEC на матриксах и культуральном пластике. Точками на диаграмме отмечено каждое отдельное измерение, серединная линия соответствует медиане
Fig. 2. Metabolic activity of HUVEC on matrices and culture plastics. The points on the diagram mark each individual measurement, the median line mark the median
Очевидно, что при увеличении количества клеток будут получены более высокие значения поглощения фор-мазана в этом тесте, поэтому можно было ожидать, что результаты в группе PHBV/PCL-FN будут выше, чем в других экспериментальных группах. Тем не менее полученные результаты позволяют также судить о сохранении высокого уровня функциональной активности клеток, адгезировавших на фибриновом покрытии.
На основе окрашивания клеток на F-актин проводили анализ адгезии HUVEC к поверхности (рис. 3).
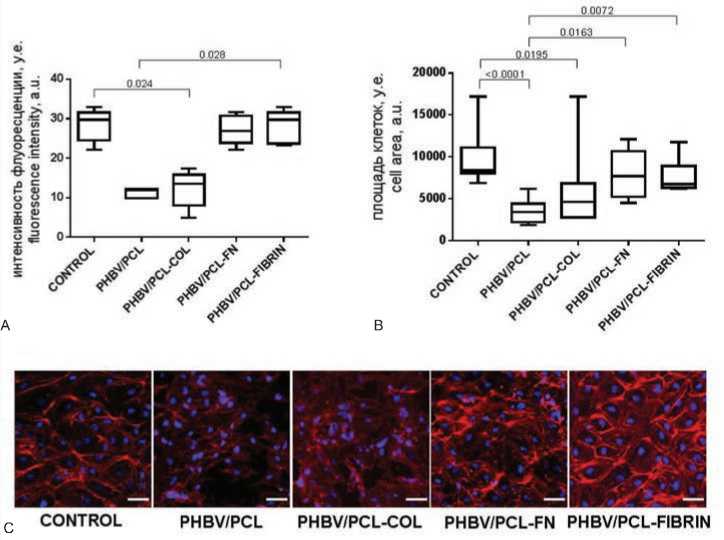
Рис. 3. Адгезия HUVEC на полимерных матриксах и культуральном пластике. А – интенсивность флуоресцентного сигнала F-актина, B – площадь клеток, C – конфокальная микроскопия, репрезентативные микрофотографии; масштабная линейка 50 мкм. На диаграмме представлены медианы, 25-й и 75-й процентили, минимальные и максимальные значения показателя. Значения p приведены над скобками
Fig. 3. Adhesion of HUVEC on polymer matrices and culture plastic. A – fluorescent intensity of F-actin, B – cell area, C – Representative confocal microscopy images; scale bar = 50 µm. The diagram shows medians, 25th and 75th percentiles, minimum and maximum values. The p values are given above the brackets
В качестве исследуемых показателей использовали интенсивность флуоресцентного сигнала, которая характеризовала выраженность в клетках актиновых филаментов, а также площадь клеток на матриксе, поскольку степень распластанности адгезионных клеток напрямую зависит от эффективности прикрепления к субстрату.
Было выявлено, что по количеству F-актина в клетке образцы групп PHBV/PCL-FN и PHBV/PCL-FIBRIN значимо превосходят остальные матриксы; при этом между этими группами отличий не наблюдали (рис. 3А).
По площади HUVEC в группах PHBV/PCL-FN и PHBV/ PCL-FIBRIN также значительно превышали остальные группы, значимо ( р = 0,0001) отличаясь от PHBV/PCL (7700 (5245;10675), 6760 (6315;8898) и 3427 (2198;4392) у.е. соответственно) (рис. 3В). В группе PHBV/PCL отмечали значительную гетерогенность в площади прикрепленных клеток, что в сочетании с общей неравномерностью распределения клеток по поверхности указывало на неэффективность покрытия. Аналогично, неравномерно распределялись клетки на поверхности матриксов PHBV/PCL (рис. 3С).
Коллаген является наиболее ранним и часто используемым биополимером в тканевой инженерии [11]. Столь широкое распространение в этих целях обусловлено его низкой иммуногенностью и хорошей биосовместимостью [12], а также способностью стимулировать клеточную адгезию [13]. Тем не менее в нашем исследовании из коллагена I типа не удалось сформировать эффективное адгезионное покрытие на поверхности полимерного матрикса. С учетом того, что способность коллагена I типа формировать субстрат с высокими адгезионными свойствами не вызывает сомнений, можно предположить, что в нашей работе не достигнуто достаточного связывания коллагеновой пленки с матриксом. Возможно, в этом случае требуется проведение дополнительной обработки для химической сшивки коллагена с полимером матрикса.
Список литературы Анализ эффективности различных белковых покрытий для оптимизации эндотелизации полимерных матриксов
- Mathers C.D., Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3(11):e442. DOI: 10.1371/journal.pmed.0030442.
- Pashneh-Tala S., MacNeil S., Claeyssens F. The tissue-engineered vascular graft – past, present, and future. Tissue Eng. Part. B.: Rev. 2016;22(1):68–100. DOI: 10.1089/ten.teb.2015.0100.
- Elliott M.B., Ginn B., Fukunishi T., Bedja D., Suresh A., Chen T. et al. Regenerative and durable small-diameter graft as an arterial conduit. Proc. Natl. Acad. Sci. USA. 2019;116(26):12710–12719. DOI: 10.1073/pnas.1905966116.
- Shoji T., Shinoka T. Tissue engineered vascular grafts for pediatric cardiac surgery. Transl. Pediatr. 2018;7(2):188–195. DOI: 10.21037/tp.2018.02.01.
- Abdulhannan P., Russell D.A., Homer-Vanniasinkam S. Peripheral arterial disease: a literature review. Br. Med. Bull. 2012;104:21–39. DOI: 10.1093/bmb/lds027.
- Ardila D.C., Liou J.J., Maestas D., Slepian M.J., Badowski M., Wagner W.R. et al. Surface Modification of Electrospun Scaffolds for Endothelialization of Tissue-Engineered Vascular Grafts Using Human Cord Blood-Derived Endothelial Cells. J. Clin. Med. 2019;8(2):185. DOI: 10.3390/jcm8020185.
- Assmann A., Delfs C., Munakata H., Schiffer F., Horstkötter K., Huynh K. et al. Acceleration of autologous in vivo recellularization of decellularized aortic conduits by fibronectin surface coating. Biomaterials. 2013;34:6015–6026. DOI: 10.1016/j.biomaterials.2013.04.037.
- Conklin B.S., Wu H., Lin P.H., Lumsden A.B., Chen C. Basic fibroblast growth factor coating and endothelial cell seeding of a decellularized heparin-coated vascular graft. Artif. Organs. 2004;28:668–675. DOI: 10.1111/j.1525-1594.2004.00062.x.
- Flameng W., De Visscher G., Mesure L., Hermans H., Jashari R., Meuris B. Coating with fibronectin and stromal cell–derived factor-1α of decellularized homografts used for right ventricular outflow tract reconstruction eliminates immune response–related degeneration. J. Thorac. Cardiovasc. Surg. 2014;147(4):1398–1404.e2. DOI: 10.1016/j.jtcvs.2013.06.022.
- Ханова М.Ю., Великанова Е.А., Глушкова Т.В., Матвеева В.Г. Создание персонифицированного клеточнозаселенного сосудистого протеза in vitro. Комплексные проблемы сердечно-сосудистых заболеваний. 2021;10(2):89–93. [Khanova M.Yu., Velikanova E.A., Glushkova T.V., Matveeva V.G. Development of personalized cell-populated vascular graft in vitro. Complex Issues of Cardiovascular Diseases. 2021;10(2):89–93. (In Russ.)]. DOI: 10.17802/2306-1278-2021-10-2S-89-93.
- Copes F., Pien N., Vlierberghe S.V., Boccafoschi F., Mantovani D. Collagen- Based Tissue Engineering Strategies for Vascular Medicine. Front. Bioeng. Biotechnol. 2019;7:166. DOI: 10.3389/fbioe.2019.00166.
- Lynn A.K., Yannas I.V., Bonfield W. Antigenicity and immunogenicity of collagen. J. Biomed. Mater. Res. Part B. Appl. Biomater. 2004; 71:343–354. DOI: 10.1002/jbm.b.30096.
- Smethurst P.A., Onley D J., Jarvis G.E., O’Connor M.N., Knight C.G., Herr A. B. et al. Structural basis for the platelet-collagen interaction: the smallest motif within collagen that recognizes and activates platelet glycoprotein VI contains two glycine-proline-hydroxyproline triplets. J. Biol. Chem. 2007;282(2):1296–1304. DOI: 10.1074/jbc.M606479200.
- Dietrich M., Heselhaus J., Wozniak J., Weinandy S., Mela P., Tschoeke B. et al. Fibrin-based tissue engineering: Comparison of different methods of autologous fibrinogen isolation. Tissue Engineering. Part C: Methods. 2013;19(3):216–226. DOI: 10.1089/ten.tec.2011.0473.
- Park C.H., Woo K.M. Fibrin-Based Biomaterial Applications in Tissue Engineering and Regenerative Medicine. Adv. Exp. Med. Biol. 2018;1064:253–261. DOI: 10.1007/978-981-13-0445-3_16.
- Podolnikova N.P., Yakovlev S., Yakubenko V.P., Wang X., Gorkun O.V., Ugarova T.P. The interaction of integrin αIIbβ3 with fibrin occurs through multiple binding sites in the αIIb β-propeller domain. J. Biol. Chem. 2014;289(4):2371–2383. DOI: 10.1074/jbc. M113.518126.


