Анализ межвидовых различий пяти видов землероек (Lipotyphla: Soricidae): морфометрические и молекулярные данные
Автор: Шадрин Дмитрий Михайлович, Королев Андрей Николаевич, Пылина Яна Игоревна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 5-5 т.16, 2014 года.
Бесплатный доступ
В данной статье дана оценка корреляции морфологической (краниометрической) и генетической (мтДНК) межвидовой изменчивости пяти видов семейства Землеройковые европейского северо-востока России.
Геометрическая морфометрия, молекулярная филогения, мтднк
Короткий адрес: https://sciup.org/148203454
IDR: 148203454 | УДК: 599.36.
Текст научной статьи Анализ межвидовых различий пяти видов землероек (Lipotyphla: Soricidae): морфометрические и молекулярные данные
М ногие представители семейства Землерой-ковые подразделены на ряд форм, отличающихся как по уровню, так и качеству различий, в связи с чем возникают проблемы в определении структурированности вида и его границ. Поэтому как отечественные, так и зарубежные исследователи все чаще обращают внимание на соотношение морфологической и генетической изменчивости, что, по мнению многих авторов, является одной из основных задач современной эволюционной биологии. Этому вопросу посвящено множество исследований, касающихся различных таксономических групп, результаты некоторых выявили значительную связь между уровнем молекулярных и морфологических различий [5, 8]. Другие исследователи не нашли такой зависимости [4].
Цель данной работы – оценка соотношения межвидовых морфологической (краниометрической) и генетической (изменчивость мтДНК) изменчивости пяти видов семейства Землеройко-вые: малой ( Sorex minutus Linnaeus, 1766), средней ( S. caecutiens Laxmann, 1788), равнозубой ( S. isodon Turov, 1924) и обыкновенной ( S. araneus Linnaeus, 1758) бурозубок и обыкновенной куто-ры ( Neomys fodiens (Pennant, 1771)).
МАТЕРИАЛЫ И МЕТОДЫ
Для изучения межвидовых морфологических различий методом геометрической морфометрии проанализировано 46 черепов землероек (рис. 2): №№ образцов S. minutus : 14, 16, 24, 32, 34, 38, 40, 41 (место и год отлова: п. Пырский Котласского района Архангельской области, 2004); №№ образцов S. caecutiens : 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 42
(п. Приозерный Корткеросского района Республики Коми, 1999-2001); №№ образцов S. isodon : 11, 12, 44 (п. Пырский; с. Гам Усть-Вымского района Республики Коми, 2008 г.); №№ образцов S. araneus : 13, 15, 17, 18, 19, 20, 23, 25, 27, 28 (п. Пырский); №№ образцов Neomys fodiens : 21, 22, 26, 29, 30, 31, 33, 35, 36, 37, 39, 43, 45 (п. Пыр-ский). В качестве переменных использовали прокрустовы координаты (PrC), прокрустовы дистанции (PrD) и переменные формы (Relative Warps, RW). Каждую переменную рассчитывали стандартными методами [2, 10] с использованием программы MorphoJ. Анализировали оцифрованные (разрешение 2400 dpi) изображения латеральной стороны правой ветви нижней челюсти, полученные с помощью сканера Epson Perfection 3490 Photo. Форма каждого объекта (нижняя челюсть) была описана декартовыми координатами с использованием 16 меток (рис. 1).
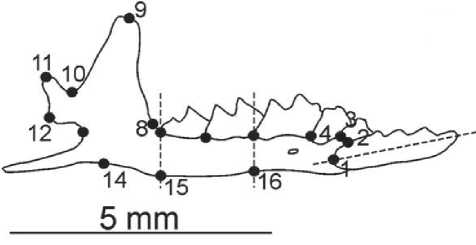
Рис. 1. Метки на латеральной стороне нижней челюсти, используемые в исследовании
Для расстановки меток использовали программу tpsDig ver. 1.40. Кластерный анализ проводили в программном пакете PAST ver. 1.79. Соответствие между матрицей PrD и дендрограммой определяли по коэффициенту кофенетической корреляции.
Для проведения молекулярнофилогенетического анализа использовали последовательности cyt b мтДНК, взятые из базы данных GenBank (NCBI, USA) и полученные на базе ЦКП «Молекулярная биология» Института био- логии Коми НЦ УрО РАН. Выделение ДНК производили с помощью набора «FastDNASpinKit» («QBioGene», Канада) согласно инструкциям производителя. Выделенную ДНК хранили при температуре -20 °С. Амплификацию проводили в реакционной смеси объемом 25 мкл, содержащей 5 мкл ScreenMix («Евроген», Россия), 5 мкл каждого праймера (0.3 мкM), 9.0 мкл воды без нуклеаз («Ambion», США) и 1.0 мкл геномной ДНК (1100 нг). Для амплификации последовательности гена cyt b использовали общепринятые праймеры L14734 и H15985 [7]. Секвенирование проводили с использованием набора реагентов ABI PrismBigDyeTerminator v. 1.1 на приборе ABI PRISM 310 GeneticAnalyzer («Applied Biosystems», США). Выравнивание последовательностей проводили вручную и автоматически с помощью программы ClustalW, филогенетический анализ осуществляли в программном пакете MEGA 4.0 [9]. Оценку корреляции между матрицами генетических и прокрустовых дистанций проводили тестом Мантела [6].
РЕЗУЛЬТАТЫ
В связи с тем, что выборки пяти видов землероек могли быть неоднородны на видовом уровне, т.е. содержать животных, отловленных в разные годы, в нескольких смежных биотопах или локалитетах, мы протестировали каждую выборку на соответствие распределения значений CS модели нормального распределения (Normality test). Тест Шапиро-Уилка выявил для всех пяти выборок, соответствующих разным видам, нормальное распределение (Wmandible = 0.925–0.933, p> 0.05). Тест Левине по размеру (CS) и форме (RW), проведенный для всех выборок, показал их однородность (значимость теста p>0.05). Таким образом, дальнейший анализ проводился по 5 выборкам. Кластерный анализ на основе матрицы PrD без подразделения на выборки позволилразделить образцы на две группы (рис. 2).
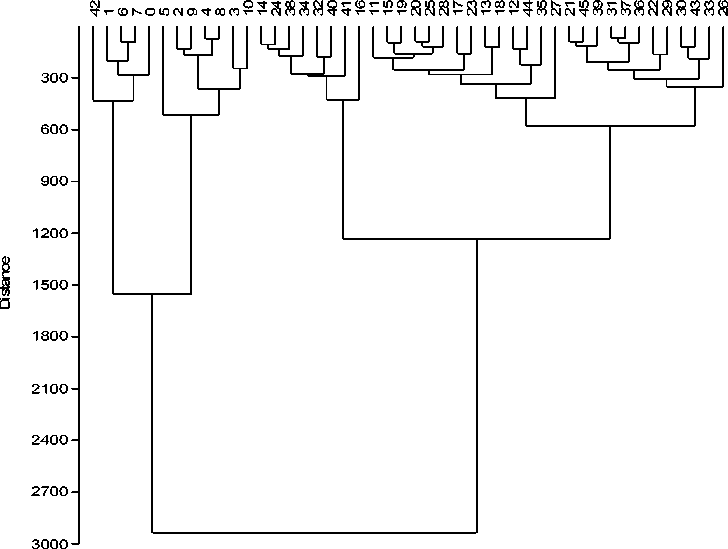
Рис. 2. Результаты кластерного анализа (метод UPGMA) на основе матрицы прокрустовых дистанций нижней челюсти землероек.
В первую вошли образцы S. caecutiens, во вторую – образцы S. minutus, S. isodon, S. araneus, Neomys fodiens. Образцы второй группы по форме нижней челюсти объединились в подгруппы по видовой принадлежности, но абсолютной кластеризации по четырем видам не произошло, за исключением подгруппы в которую вошли образцы S. minutus. Значения коэффициента кофенетиче-ской корреляции для матрицы дистанций по нижней челюсти (r=0.88) удовлетворительно. Дискриминантный анализ пяти групп (видов) Землеройковых по нижней челюсти (PrC) выявил ста- тистически значимые различия между всеми группами (p<0.001).
Полученные данные позволили выявить необычный на первый взгляд статус обыкновенной куторы. А именно то, что кутора являющаяся представителем совсем иной трибы нежели остальные рассмотренные виды, относящиеся к роду Sorex , не образовала отдельный кластер на дендрограмме иллюстрирующей матрицу прокрустовых дистанций, а вошла в один кластер с равнозубой и обыкновенной бурозубками (рис. 2).
AB062732-Sorex caecutiens
AB062735-Sorex caecutiens
60 AB119181-Sorex caecutiens
AB062730-Sorex caecutiens
AB062734-Sorex caecutiens
AB062729-Sorex caecutiens
AB062731-Sorex caecutiens
AB062726-Sorex caecutiens
AB062728-Sorex caecutiens
AB062727-Sorex caecutiens
AB062733-Sorex caecutiens
100 GQ272518-Sorex minutus
GQ272517-Sorex minutus
GQ494308-Sorex minutus
GQ494311-Sorex minutus
GQ494307-Sorex minutus 63
GQ494309-Sorex minutus
GQ494310-Sorex minutus
32 GQ494305-Sorex minutus
67 GQ494306-Sorex minutus
AB028500-Sorex isodon
1 г AJ000438-Sorex isodon
99 AJ000437-Sorex isodon
AJ409867-Sorex araneus
AJ245893-Sorex araneus
AJ409879-Sorex araneus
AJ409880-Sorex araneus
AJ409871-Sorex araneus
2305 J
AJ409870-Sorex araneus
AJ409869-Sorex araneus

36 AJ409881-Sorex araneus
87 AJ409882-Sorex araneus
DQ991062-Neomys fodiens
DQ991063-Neomys fodiens
|
60 58 |
DQ991060-Neomys fodiens DQ991059-Neomys fodiens |
|
42 100 82 |
AJ409868-Sorex araneus DQ991058-Neomys fodiens DQ991056-Neomys fodiens |
|
53 8490 |
AB175096-Neomys fodiens 1— AB175097-Neomys fodiens AB175071-Neomys fodiens |
|
58 |
AB175098-Neomys fodiens DQ991061-Neomys fodiens |
GU981298-Neomys fodiens
GU981295-Neomys fodiens
Анализ молекулярно-филогенетических связей показал, что исследуемые образцы сгруппировались в пять кластеров, согласно их видовой принадлежности (рис. 3).
При этом видно, что образованное древо делится на два кластера соответствующих делению на трибы. В один кластер вошли представители трибы Neomyini – род Neomys , а во второй представители трибы Soricini – род Sorex . При детальном рассмотрении кластера, в который вошли представители рода Sorex можно заметить, что S. araneus является внешней группой по отношению к остальным видам, что опять же соответствует общепринятой классификации, в которой этот вид относиться к подроду Sorex , а остальные три вида относятся к подроду Homalurus , который в эволюционном ряду считается более продвинутым. Следуя выше сказанному, можно отметить, что на примере анализа исследуемых пяти видов представителей семейства Землеройковые, отчасти искусственная классическая система их классификации полностью соответствует системе построенной на основе молекулярных маркеров ( cyt b мтДНК).
Оценка корреляции между матрицами генетических и прокрустовых дистанций на основании теста Мантела, позволяет отметить, что связь между матрицами достоверно низкая (999 повторов; p-value: 0.001; коэффициент корреляции – 0.39). Другими словами, дифференциация рассматриваемых групп по генетическим маркерам (мтДНК) не полностью совпала с морфологической дифференциацией (форма нижней челюсти).
ВЫВОДЫ
Таким образом, исследование данной группы насекомоядных животных показало высокую роль адаптации в формировании краниометрических отличий. Сравнивая полученные данные с общепринятой таксономической классификацией, мы можем проследить их взаимосвязь только с дан- ными молекулярно-генетического анализа. Исходя из этого, для построения схемы филогенетических связей более достоверным будет использование молекулярно-генетических данных.
Коллектив авторов выражает благодарность сотруднику ФГБУН Зоологического института РАН г. Санкт-Петербург Л.Л. Войта за ценные рекомендации и консультацию в ходе выполнения данной работы.
Работа выполнена при финансовой поддержке гранта РФФИ 13-04-98823 и Правительства Республики Коми.
Список литературы Анализ межвидовых различий пяти видов землероек (Lipotyphla: Soricidae): морфометрические и молекулярные данные
- Млекопитающие Печоро-Илычского заповедника. Сыктывкар, 2004. 464 с.
- Павлинов И.Я. Анализ изменчивости верхних промежуточных зубов у землероек-бурозубок (Sorex) методами геометрической морфометрии. Зоологический журнал. 2004.Том. 83. № 7. С. 869-875.
- Строганов С.У. Звери. Насекомоядные. М.: Изд-во АН СССР, 1957. 268 с.
- Bromham L.D., Hendy M.D. Can fast early ratesreconcile molecular dates to the Cambrian explosion? Proc. R.Soc. Lond. 2000. B. 267. Р.1041-1047.
- Castiglia R., Makundi, R. &Corti, M. The origin of an unusual sex chromosome constitution in Acomys sp. (Rodentia, Muridae) from Tanzania. Genetica. 2007. Vol. 131. P. 201-207.
- Mantel N. The Detection of Disease Clustering and a Generalized Regression Approach//Cancer Research, 1967. Vol. 27.№ 2. P. 209-220.
- Ohdachi S.D., Dokuchaev N.E., Hasegawa M., Masuda R. Intraspecific phylogeny and geographical variation of six species of northeastern Asiatic Sorex shrews based on the mitochondrial cytochrome b sequences//Molecular Ecology. 2001. Vol. 10. P. 2199-2213.
- Omland K.E. 1997. Correlated rates of molecular and morphological evolution. Evolution Vol. 51. Р. 1381-1393.
- Tamura K., Dudley J., Nei M. et al. MEGA4: Molecular Evolutionary Genetics Aalisis (MEGA) software version 4.0//Mol. Biol. Evolution. 2007. Vol. 24. P. 1596-1599.
- Zelditch M.L., Swiderski D.L., Sheets H.D. and Fink W.L. Geometric morphometrics for Biologists: A Primer. ElsevierAcademicPress. 2004. 437 p.


