Анализ нарушений связывания кортикостероидов с белками плазмы крови в патогенезе острой лучевой болезни
Бесплатный доступ
Анализ нарушений связывания кортикостероидов с белками плазмы крови при остром лучевом синдроме позволяет уточнить механизмы и закономерности патологических изменений гормонального уровня организма в патогенезе острой лучевой болезни. Актуальность исследования определяется наличием в настоящее время рисков возникновения новых техногенных катастроф и угрозы радиационной безопасности. Полученные результаты позволяют расширить ряд теоретических положений радиобиологии об основных закономерностях связывания кортикостероидов с белками плазмы крови с учётом её различных фракций, позволяющих определить роль свободных кортикоидов в гормональном эффекте при острой лучевой болезни. Целью настоящей работы является исследование основных закономерностей связывания кортикостероидов с белками плазмы крови в патогенезе острой лучевой болезни животных. Опыты проведены на 20 кроликах-самцах и 475 белых беспородных крысах. Предварительно экспериментальные животные были адаптированы к условиям эксперимента. Общее g-облучение животных проводили на электронном гамма-облучателе (ЭГО-2) при средней мощности дозы 5,75 Гр/мин. Кроликов облучали в дозе 8 Гр, крыс - в дозе 8,5 Гр. Общее содержание 11-оксикортикостероидов (11-ОКС), мкг%, определяли флюориметрическим методом в авторской модификации. Количество свободных кортикостероидов определялось по разнице содержания их в цельной плазме и в её белковой фракции после разделения на сефадексе G-25. Получены результаты, демонстрирующие изменения фракционного состава 11-ОКС в плазме крови в патогенезе острой лучевой болезни у животных с моно- и двухфазной кривой адренокортикальной реакции на облучение. Обнаружены нарушения связывания кортикостероидов с белками плазмы крови, следствием чего является увеличение свободных, биологически активных гормонов в разгаре лучевой болезни. Наличие в плазме крови не связанных с белками и более мобильных вследствие этого стероидов может вызвать гиперкортикоидное состояние при нормальном или даже сниженном уровне гормонов в крови. Длительное влияние «скрытого» гиперкортицизма, таким образом, может являться фактором, усугубляющим клиническое течение острой лучевой болезни.
Ионизирующее излучение, острая лучевая болезнь, кора надпочечников, адренокортикальная реакция, кортикостероиды, плазма крови, белково-стероидное взаимодействие, гиперкортицизм, связанные 11-окс, свободный гормон
Короткий адрес: https://sciup.org/170195742
IDR: 170195742 | УДК: 616-001.28-092+616.453 | DOI: 10.21870/0131-3878-2022-31-3-131-138
Текст научной статьи Анализ нарушений связывания кортикостероидов с белками плазмы крови в патогенезе острой лучевой болезни
Воздействие на организм ионизирующей радиации в дозах, вызывающих развитие острой лучевой болезни, неизменно сопровождается изменением гормонального уровня организма. Общие закономерности и механизмы воздействия ионизирующих излучений на реакцию гипофизарно-адренокортикальной системы, а также роль связывания кортикостероидов с белками плазмы крови при действии радиации раскрыты в ряде современных адаптационных теорий [1-7]. Проблеме белково-стероидного взаимодействия при различных патологических процессах, в том числе и при остром лучевом синдроме, в организме животных и человека, начиная с середины прошлого столетия, были посвящены многочисленные работы зарубежных и отечественных учёных. Однако в современных научных работах данная проблематика практически не освещается.
В современных зарубежных работах вопросы белково-стероидного взаимодействия раскрыты в ряде клинических исследований, посвящённых изучению вопросов связывания кортикостероидов с белками плазмы крови в гормональном взаимодействии гипоталамо-гипофизарно-
Омельчук Н.Н. - зав. кафедрой, д.б.н., проф. РУДН.
надпочечниковой системы при различных патологических состояниях организма человека [8-15]. В отечественной науке по проблеме белково-стероидного взаимодействия и специфике нарушений связывания кортикостероидов с белками плазмы крови при остром лучевом синдроме имеются лишь отдельные публикации, в том числе и автора настоящего исследования [16-19].
Таким образом, следует признать, что в настоящее время имеет место недостаточный научно-практический интерес к проблеме белково-стероидного взаимодействия в патогенезе острой лучевой болезни. Отметим теоретическую значимость данной проблемы, решение которой позволяет уточнить ряд положений радиобиологии об основных закономерностях связывания кортикостероидов с белками плазмы крови с учётом её различных фракций, что даёт возможность выявить роль свободных кортикоидов в гормональном эффекте при острой лучевой болезни. Возможность проведения более точного прогноза течения лучевой болезни, а также использования полученных результатов в лечебно-диагностической практике в отношении пациентов с лучевой болезнью и пациентов с нарушением эндокринного статуса отражает практическую значимость исследуемой проблемы.
Материалы и методы
Эксперименты были проведены на 20 кроликах-самцах породы шиншилла, весом 3,0-3,5 кг и на 475 белых крысах-самцах линии Wistar, весом 180-200 г. Для исключения неспецифических воздействий на посттрадиционную реакцию коры надпочечников всех животных предварительно в течение 10-15 дней адаптировали к условиям эксперимента, ежедневно проводя ряд процедур, необходимых для проведения данного опыта, во время которого животных помещали в аппарат, не включая его. Сроки, необходимые для адаптации, устанавливали экспериментально на основании оценки уровня кортикостероидов в крови животных: если в течение 3 ч после воздействия неспецифических факторов содержание кортикостероидов в крови находилось в пределах нормальных величин, животных считали адаптированными к условиям эксперимента.
Общее γ-облучение животных проводили на установке ЭГО-2 при средней мощности дозы 575 Р/мин. Животных облучали в дозе, вызывающей острую лучевую болезнь IV стадии: кроликов облучали в дозе 8 Гр, крыс – в дозе 8,5 Гр. Исследуемые показатели у облучённых животных определяли в динамике лучевой болезни. Сроки наблюдения после облучения в экспериментах на кроликах и крысах были различными. Внимание обращалось на характер изучаемых процессов сразу после облучения (через 1-3 ч) и в разгаре острой лучевой болезни (1-30 сут), поскольку, как известно, реакция коры надпочечников на ионизирующее излучение состоит из двух фаз: ранней (в первые часы после облучения) и поздней (через несколько дней после облучения).
Общее содержание 11-ОКС, мкг%, в плазме периферической крови определяли с помощью флюорометрического метода Guillemin et al. [20] в авторской модификации. Применяемый метод основан на способности 11-ОКС флюоресцировать в спирто-кислотном реагенте. Эта реакция кортикостероидов в этанолсернокислотном реагенте специфична для 11-ОКС. В указанных реагентах после протонизации ∆4- 3-кетогруппы в кислой среде происходит взаимодействие ∆4- 3-кетогруппы с II-гидроксильной группой других молекул кортикостероидов. В результате образуются устойчивые межмолекулярные комплексы, которые дают полосу поглощения с максимумом при 470 ммк и специфичную полосу флюоресценции при 525 ммк. Интенсивность флюоресценции измеряли на спектрофлюорометре ХИТАЧИ МР-2 при длине волны возбуждения 470 ммк, флюоресценции – 525 ммк. Интенсивность флюоресценции исследуемых субстратов в каждом опыте сравнивали с интенсивностью флюоресценции растворов соответствующих кортикостероидов различной концентрации.
Для определения свободной и связанной с белком фракций 11-ОКС использовали метод гельфильтрации De Moor et al. [21] в авторской модификации. Гель-фильтрация наименее трудоёмка, позволяет определить специфическое связывание 11-ОКС с кортикостероидсвязывающим глобулином (КСГ), причём в отличие от других методов, даёт возможность измерить абсолютную величину связывания. Количество свободных кортикостероидов определялось по разнице содержания их в цельной плазме и в её белковой фракции после разделения на сефадексе G-25.
Результаты и их обсуждение
Изменения фракционного состава 11-ОКС в плазме крови кроликов после облучения в дозе 8 Гр представлены на рис. 1.
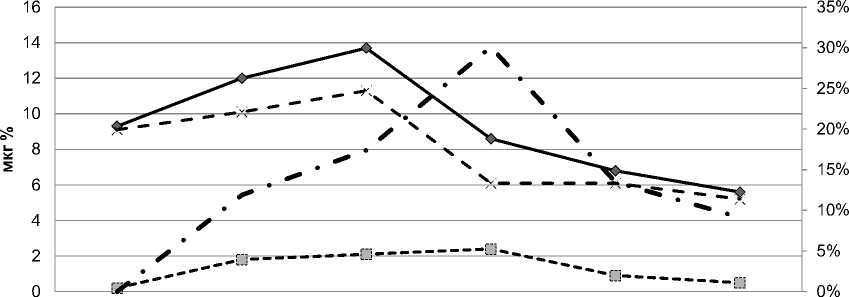
До облучения 30 мин. час после 1,5-2 часа после 4 сутки после 6 сутки после 8 сутки после облучения облучения облучения облучения облучения
—о— Общий уровень 11-ОКС Свободные 11-ОКС
— * —Связанные 11-ОКС Свободные 11-ОКС, %
Рис. 1. Изменение фракционного состава 11-ОКС в плазме крови кроликов после облучения в дозе 8 Гр.
При этом были обнаружены значительные изменения белково-стероидного комплекса. У здоровых кроликов все циркулирующие в крови кортикостероиды практически полностью связаны с белками плазмы крови. Через 30 мин и особенно через 1,5-2 ч после облучения свободные 11-ОКС обнаруживались у всех обследованных животных. Свободная фракция гормона на этот срок достигала в среднем 17,4% от общего количества кортикостероидов. Особенно заметное увеличение содержания свободного гормона в крови кроликов наблюдалось через 4 суток после облучения. Около 30,1% от общего количества гормонов находилось в свободном состоянии. Появление не связанной с белком фракции гормона наблюдалось на фоне нормального или даже сниженного общего уровня стероидов в крови, что, вероятно, может вызвать гиперкортикоидное состояние.
Получены результаты изменения общего содержания 11-ОКС в крови в динамике лучевой болезни у животных с двухфазной кривой. Содержание у крыс в крови 11-ОКС суммарно и по фракциям после облучения в дозе 8,5 Гр показано на рис. 2.
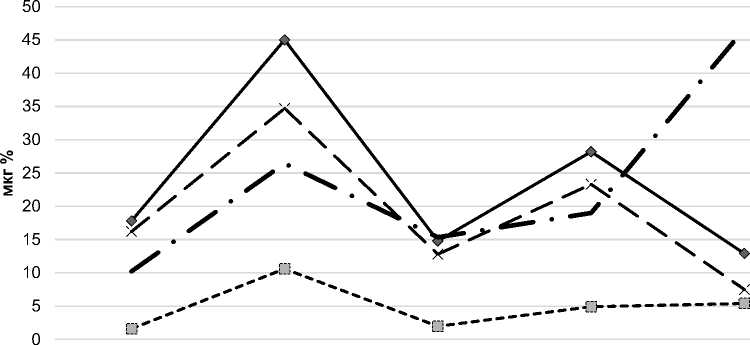
До облучения 1 час после 1 сутки после 3 сутки после 10 сутки после облучения облучения облучения облучения
• Общий уровень 11-ОКС
Свободные 11-ОКС
45%
40%
35%
30%
25%
20%
15%
10%
5%
0%
^■^■^ ^' Связанные 11-ОКС
^^^^™ • Свободные 11-ОКС, %
Рис. 2. Изменение фракционного состава 11-ОКС в плазме крови крыс после облучения в дозе 8,5 Гр.
У здоровых крыс около 9% кортикостероидов находилось в свободном состоянии. Через 1 ч после облучения общий уровень 11-ОКС в крови резко повышался, через сутки возвращался к норме, вновь поднимался на 3-и сутки лучевой болезни и падал на 10-е сутки ниже исходного.
Концентрация свободных 11-ОКС через 1 ч после облучения также повышалась, составляя 23,8% от общего уровня гормона, и нормализовалась через сутки. Затем она вновь увеличивалась, оставаясь повышенной на 3-и и 10-е сутки лучевой болезни. Заслуживает внимания, что у крыс на 3-и сутки лучевой болезни в период вторичной реакции, когда общий уровень 11-ОКС более, чем в 2 раза превышал этот показатель по сравнению с показателем на 10-е сутки, свободные кортикостероиды составляли 17,1% от общего уровня, а на 10-е сутки при общем уровне кортикостероидов даже ниже нормы около 42% кортикостероидов, содержащихся в крови, не были связаны с белками плазмы крови.
Таким образом, как у крыс, так и у кроликов, в динамике острой лучевой болезни наблюдается период скрытого гиперкортицизма, который характеризуется ростом концентрации свободного гормона на фоне даже сниженного общего уровня кортикостероидов в плазме крови. Содержание свободной фракции увеличивается в первые часы и в разгаре лучевой болезни, причём в первые часы это увеличение происходит на фоне повышенного общего содержания кортикостероидов, а в разгаре лучевой болезни на фоне как повышенного, так и сниженного общего уровня.
Заключение
Обобщение полученных результатов в экспериментах на двух видах животных, позволило вывести несколько закономерностей.
-
1. После действия ионизирующей радиации нарушается связывание кортикостероидов с белками плазмы крови, следствием чего является увеличение свободных, биологически активных гормонов в разгаре лучевой болезни.
-
2. Независимо от колебаний общего уровня кортикостероидов, содержание их свободной фракции на всём протяжении лучевой болезни было повышенным. Особенно отчётливо это повышение проявлялось в первые часы после облучения и в разгаре лучевой болезни.
-
3. У крыс адренокортикальная реакция на облучение носит характер двухфазной кривой. В отличие от крыс, у кроликов в пределах времени наблюдения после снижения общего уровня кортикостероидов в крови не отмечалось вторичного гиперкортицизма. Напротив, по мере развития лучевой болезни секреция адренокортикальных гормонов у этих животных продолжала снижаться.
-
4. Наличие в плазме не связанных с белками и более мобильных вследствие этого стероидов, может вызвать гиперкортикоидное состояние при нормальном или даже сниженном общем уровне гормонов в крови. Длительное влияние «скрытого» гиперкортицизма, таким образом, может явиться фактором, усугубляющим клиническое течение острой лучевой болезни.
Список литературы Анализ нарушений связывания кортикостероидов с белками плазмы крови в патогенезе острой лучевой болезни
- Анохин П.К. Очерки физиологии функциональных систем. М.: Книга по Требованию, 2021. 450 с.
- Кузин А.М. Структурно-метаболическая теория в радиобиологии. М.: Наука, 1986. 282 с.
- Кудрицкий Ю.К., Георгиевский А.Б. Адаптационная гипотеза биологической эффективности ионизирующего излучения //Атомная энергия. 1992. Т. 13, № 1. С. 27-32.
- Меерсон Ф.З. Физиология адаптационных процессов. М.: Наука, 1986. 638 с.
- Гребенюк А.Н., Стрелова О.Ю., Легеза В.И., Степанова Е.Н. Основы радиобиологии и радиационной медицины: Учебное пособие. СПб.: ООО Издательство ФОЛИАНТ, 2012. 232 с.
- Докшина Г.А. Эндокринные и метаболические аспекты лучевой болезни. Томск: Издательство Томского ун-та, 1984. 223 с.
- Мороз Б.Б., Кендыш И.Н. Радиобиологический эффект и эндокринные факторы. М.: Атомиздат, 1975. 228 с.
- Fernandez-Real J.M., Pugeat M., Grasa M., Broch M., Vendrell J., Brun J., Ricart W. Serum corticosteroid-binding globulin concentration and insulin resistance syndrome: a population study //J. Clin. Endocrinol. Metab. 2002. V. 87, N 10. P. 4686-4690.
- Gagliardi L., Ho J.T., Torpy D.J. Corticosteroid-binding globulin: the clinical significance of altered levels and heritable mutations //Mol. Cell Endocrinol. 2010. V. 316, N 1. P. 24-34.
- Klieber M.A., Underhill C., Hammond G.L., Muller Y.A. Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release //J. Biol. Chem. 2007. V. 282, N 40. P. 29594-29603.
- Lewis J.G., Borowski K.K., Shand B.I., George P.M., Scott R.S. Plasma sex hormone-binding globulin, corticosteroid-binding globulin, cortisol, and free cortisol levels in outpatients attending a lipid disorders clinic: a cross-sectional study of 1137 subjects //Horm. Metab. Res. 2010. V. 42, N 4. P. 274-279.
- Lewis J.G., Elder P.A. Corticosteroid-binding globulin reactive centre loop antibodies recognise only the intact natured protein: elastase cleaved and uncleaved CBG may coexist in circulation //J. Steroid. Biochem. Mol. Biol. 2011. V. 127, N 3-5. P. 289-294.
- Mihrshahi R., Lewis J.G., Ali S.O. Hormonal effects on the secretion and glycoform profile of corticosteroid-binding globulin //J. Steroid. Biochem. Mol. Biol. 2006. V. 101, N 4-5. P. 275-285.
- Sivukhina E.V., Jirikowski G.F., Bernstein H.G., Lewis J.G., Herbert Z. Expression of corticosteroid-bind-ing protein in the human hypothalamus, co-localization with oxytocin and vasopressin //Horm. Metab. Res. 2006. V. 38, N 4. P. 253-259.
- Zhou A., Wei Z., Stanley P.L., Read P.J., Stein P.E., Carrell R.W. The S-to-R transition of corticosteroid-binding globulin and the mechanism of hormone release //J. Mol. Biol. 2008. V. 380, N 1. P. 244-251.
- Омельчук Н.Н. Актуальные вопросы профилактики острой лучевой болезни //Национальное здоровье. 2018. № 1. С. 70-75.
- Омельчук Н.Н. Метод оценки функциональной активности коры надпочечников с учётом физиологической роли разных фракций кортикостероидов в крови у здоровых и облучённых животных //Национальное здоровье. 2018. № 1. С. 58-64.
- Омельчук Н.Н. Влияние тироксина на общий уровень кортикостероидов и связывающую способность кортикостероидсвязывающего глобулина в плазме крови после облучения //Национальное здоровье. 2018. № 1. С. 65-69.
- Поздеев А.В. Экспериментальное исследование содержания кортизола в крови при радиационном облучении //Вестник Курской государственной сельскохозяйственной академии. 2013. № 7. С. 53-54.
- Guillemin R., Clayton G.W., Lipscomb H.S., Smith J.D. Fluorometric of rat plasma and adrenal, corti-costerone concentration; a note on technical details //J. Lab. Clin. Med. 1959. V. 53, N 3. P. 830-832.
- De Moor P., Hoirwegh K., Heromans G., Declerck-Raskin M.M. Protein binding of corticosteroid studied by gel filtration //J. Clin. Invest. 1962. V. 41, N 4. P. 816-827.


