Анализ непосредственных результатов повторного коронарного шунтирования
Автор: Гордеев М.Л., Гребенник В.К., Исмаил-Заде Имран Курбанович, Ишмухаметов Г.И., Иванов И.Ю., Абуталимова Н.Р., Заварзина Д.Г.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 1 т.25, 2021 года.
Бесплатный доступ
Цель. Сравнить непосредственные результаты лечения пациентов после повторного коронарного шунтирования на работающем сердце и в условиях искусственного кровообращения. Методы. В ретроспективное исследование включены 138 пациентов, которым было проведено повторное изолированное коронарное шунтирование по поводу рецидива стенокардии за 20132019 гг. в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России. В 74 случаях операция проводилась в условиях искусственного кровообращения с применением кровяной изотермической кардиоплегии (группа 1), в 64 случаях - на работающем сердце (группа 2). Первичная конечная точка: основные неблагоприятные сердечно-сосудистые события (инфаркт миокарда, острое нарушение мозгового кровообращения, сердечно-сосудистая смерть) в течение госпитального периода. Вторичные конечные точки: сердечно-сосудистая, дыхательная или почечная недостаточность, нарушение заживления послеоперационной раны в течение госпитального периода. Результаты. Повторное коронарное шунтирование в группе 1, в сравнении с группой 2, чаще осложнялось развитием сердечнососудистой недостаточности (39,2 против 20,3 %, p = 0,043), дыхательной недостаточности (7,8 против 2,7 %, р = 0,047), постперикардиотомным синдромом (13,5 против 0,0 %, р = 0,047). Индекс реваскуляризации оказался выше в группе 1 (2,9 против 2,4 в группах 1 и 2 соответственно). В раннем послеоперационном периоде отмечалось снижение длительности стационарного лечения и нахождения в отделении интенсивной терапии, продолжительности операции, а также меньшая частота развития послеоперационных осложнений в группе 2. Заключение. Результаты повторного коронарного шунтирования удовлетворительные в раннем послеоперационном периоде. Выполнение повторного коронарного шунтирования на работающем сердце имело ряд преимуществ и было ассоциировано со снижением частоты возникновения послеоперационных осложнений.
Искусственное кровообращение, ишемическая болезнь сердца, повторное коронарное шунтирование, реваскуляризация миокарда
Короткий адрес: https://sciup.org/142230779
IDR: 142230779 | DOI: 10.21688/1681-3472-2021-1-85-96
Текст научной статьи Анализ непосредственных результатов повторного коронарного шунтирования
Гордеев М.Л., Гребенник В.К., Исмаил-заде И.К., Ишмухаметов Г.И., Иванов И.Ю., Абуталимова Н.Р., Заварзина Д.Г. Анализ непосредственных результатов повторного коронарного шунтирования. Патология кровообращения и кардиохирургия. 2021;25(1):85-96.
Основные принципы современного лечения больных ишемической болезнью сердца — восстановление адекватного кровотока по коронарным артериям и улучшение перфузии ишемизированного миокарда. Наиболее распространенным вариантом хирургического лечения ишемической болезни сердца по-прежнему является коронарное шунтирование (КШ) [1].
Согласно исследованию M. Czerny и соавт., более 90 % пациентов не отмечали рецидива стенокардии в течение 1 года после КШ, однако через 5 лет этот показатель находился на уровне 70 % [2]. Причинами рецидива стенокардии в послеоперационном периоде могут быть неполная реваскуляризация миокарда, прогрессирование атеросклероза в шунтированных артериях и графтах, а также в нешунтированных при первичной операции на коронарных артериях, технические ошибки при выполнении КШ, интимальная гиперплазия венозных шунтов и другие [3]. В различных исследованиях периоперационная летальность после повторного КШ высокая: от 3,4 до 14,0 %, в сравнении с первичной операцией [2; 4–10].
Основными особенностями повторного КШ являются решение вопроса об объеме реваскуляризации, повторный доступ, потенциальный риск травмы сердца и функционирующего шунта во время кардиолиза, выбор шунтирующего материала и метода коронарного шунтирования [4; 2; 10].
Несмотря на постоянное развитие коронарной хирургии, появление альтернативных методов защиты миокарда, совершенствование анестезиологического обеспечения и протокола ведения в раннем послеоперационном периоде, риски развития послеоперационных осложнений у пациентов, перенесших повторное КШ, остаются высокими, что диктует необходимость дальнейшего изучения обозначенной проблемы.
Цель — сравнить непосредственные результаты лечения пациентов после повторного КШ на работающем сердце и в условиях искусственного кровообращения (ИК).
Методы
В ретроспективное исследование включено 138 пациентов, которым было проведено повторное КШ по поводу рецидива стенокардии с 2013 по 2019 г.
в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России. Основное показание — возврат стенокардии на фоне оптимальной медикаментозной терапии. Всех пациентов рассматривала кардиохирургическая команда с целью выбора оптимальной тактики реваскуляризации при невозможности выполнения и / или предположительно невысокой прогностической эффективности эндоваскулярного лечения (многососудистое поражение коронарных артерий, дистальные формы атеросклеротического поражения, анатомические особенности строения коронарных артерий). Во всех случаях выполнено изолированное повторное КШ. В 74 случаях (53,6 %) операция проводилась в условиях ИК с применением кровяной изотермической кардиоплегии (группа 1), в 64 случаях (46,4 %) — на работающем сердце (группа 2). Средний возраст пациентов в группе 1 составил 62,9 ± 4,2, в группе 2 — 61,3 ± 3,3, р = 0,65.
Критерии включения в исследование: рецидив стенокардии (III–IV функциональный класс по классификации Канадского сердечно-сосудистого общества (англ. Canadian Cardiovascular Society, CCS)) после перенесенного ранее КШ; стенозы в коронарных артериях, требующие реваскуляризации; возраст 18–75 лет.
Критерии невключения: иная кардиальная патология, требующая оперативного лечения; возможность выполнения эндоваскулярной реваскуляризации; ожидаемая плохая приверженность к лечению, алкогольная и / или наркотическая зависимость; тяжелые формы болезни печени, почек, центральной нервной системы; гематологические, гастроэнтерологические, иммунные, эндокринные, метаболические заболевания, которые могут значительно ограничить продолжительность жизни пациента и / или отрицательно повлиять на течение основного заболевания.
Технические особенности
Большинство повторных КШ выполняются через срединную рестернотомию. Доступ осуществляется с помощью осциллирующей пилы для повторной стернотомии. Следует отметить, что этот этап сопряжен с более высоким риском в случае плотного прилегания сердца к задней поверхности грудины. Существует мнение, что для повторного КШ правая подключичная артерия может быть предпочтитель- нее общей бедренной артерии, поскольку реже подвержена атеросклеротическим изменениям [11]. Кардиолиз рекомендуется начинать с диафрагмальной поверхности сердца — ввиду высокой подвижности этой области развитие спаечного процесса здесь выражено в меньшей степени. В случае вмешательства при поддержке аппарата ИК выполняется мобилизация восходящей аорты и правого предсердия для обеспечения артериального и венозного доступов. Мобилизация неработающих венозных графтов не имеет смысла и должна сводиться к минимуму — они просто удаляются из полости перикарда. В свою очередь функционирующая внутренняя грудная артерия должна быть мобилизована практически на всем протяжении, поскольку в случае кардиоплегии она должна быть пережата, в то же время при вмешательстве на работающем сердце это необходимо для оптимального позиционирования сердца.
Техника выполнения операции на работающем сердце
Все операции были выполнены через срединную рестернотомию. В ходе операции использовали стандартные методы интраоперационного мониторинга, включая катетеризацию камер сердца (катетер Свана – Ганца), а также чреспищеводную эхокардиографию при необходимости. Во всех случаях проводили стандартную системную гепаринизацию с введением рассчитанной на основании массы тела дозировки гепарина для поддержания активированного времени свертывания более 350 с. При выполнении КШ на работающем сердце во время формирования дистальных анастомозов использовались интракоронарные шунты и стабилизатор операционного поля фирмы Medtronic Inc. (Дублин, Ирландия).
Техника выполнения операции в условиях искусственного кровообращения
После рестернотомии включали аппарат экстракорпорального кровообращения с канюляцией восходящей аорты и правого предсердия при умеренной системной гипотермии (температура крови 32–34 °C). В условиях ИК выполнялся тотальный кардиолиз. После пережатия аорты проводились интермиттирующая антеградная и ретроградная плегии с интервалами в каждые 15 мин. При ис- пользовании венозных графтов сначала формировались дистальные анастомозы. Формирование проксимальных анастомозов выполнялось после реперфузии и восстановления сердечной деятельности при боковом пережатии аорты.
Методы регистрации исходов
В исследуемых группах регистрировались и анализировались особенности течения послеоперационного периода: острая сердечно-сосудистая недостаточность (определялась как потребность в двух и более препаратах инотропной и / или вазопрессорной поддержки при сердечном индексе менее 2,3 л/мин×м2), дыхательная недостаточность (определялась как потребность в искусственной вентиляции легких на протяжении 8 ч и более), признаки острого повреждения почек (определялись в соответствии со шкалой RIFLE как снижение скорости клубочковой фильтрации более чем на 50 %, рассчитанной по формуле CKD-EPI, или снижение темпа диуреза менее 0,5 мл/кг/ч на протяжении 12 ч и более), нарушение заживления послеоперационной раны (определялось как развитие поверхностной и глубокой стернальной инфекции), длительность пребывания в отделении реанимации, длительность стационарного лечения. Госпитальная летальность была определена как все случаи летального исхода, произошедшие в течение госпитализации, включая период до 30 сут. после операции.
Первичная конечная точка исследования — основные неблагоприятные сердечно-сосудистые события (инфаркт миокарда, острое нарушение мозгового кровообращения, сердечно-сосудистая смерть). Вторичные конечные точки — сердечнососудистая, дыхательная или почечная недостаточность, нарушение заживления послеоперационной раны. Временными конечными точками считались день операции и день выписки из стационара.
Работа выполнена в соответствии с этическими принципами проведения биомедицинских исследований, отраженными в Хельсинкской декларации Всемирной медицинской ассоциации. Пациенты дали добровольное информированное согласие на участие в исследовании и публикацию клинического наблюдения. Исследование одобрено локальным этическим комитетом ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России (протокол № 8 от 27.11.2019 г.).
Табл. 1. Сравнительная характеристика исследуемых групп
|
Показатель |
Группа 1 |
Группа 2 |
р |
|
Пол, мужчины, % |
90,5 |
89,1 |
0,97 |
|
Средний возраст, годы |
62,9 ± 4,2 |
61,3 ± 3,3 |
0,81 |
|
Стенокардия напряжения III–IV функционального класса, n (%) |
65 (87,8) |
47 (74,6) |
0,04 |
|
Инфаркт миокарда в анамнезе, n (%) |
34 (45,9) |
31 (48,4) |
0,67 |
|
Атеросклероз периферических артерий, n (%) |
18 (24,3) |
15 (23,4) |
0,91 |
|
Ожирение, n (%) |
47 (63,5) |
31 (49,1) |
0,74 |
|
Индекс массы тела |
27,6 [21,4–39,1] |
28,3 [19,9–37,1] |
0,68 |
|
Сахарный диабет 2-го типа, n (%) |
14 (18,9) |
23 (36,5) |
0,77 |
|
Гликированный гемоглобин, Ме |
6,1 [5,2–6,8] |
5,8 [5,1–6,6] |
0,85 |
|
Хронические неспецифические заболевания легких, требующие длительной терапии бронходилататорами и / или стероидными препаратами, n (%) |
20 (27) |
9,0 (14,2) |
0,84 |
|
Хроническая болезнь почек, n (%) |
0 (0) |
1 (1,56) |
0,35 |
|
Курение более 5 лет, n (%) |
35 (47,3) |
37 (57,8) |
0,67 |
|
Фракция выброса левого желудочка по Симпсону до операции, % |
53,2 ± 15,2 |
51,2 ± 14,7 |
0,85 |
|
Длительность между операциями, годы |
7,1 ± 5,2 |
7,0 ± 1,4 |
0,06 |
|
Логистический показатель EuroScore II, % |
3,10 ± 2,02 |
3,50 ± 2,08 |
0,69 |
Статистический анализ
Статистическая обработка результатов осуществлялась с помощью программы IBM SPSS Statistics. Version 10 (10.0.1011.00). Выполнена проверка всех количественных переменных на тип распределения с помощью критерия Колмогорова – Смирнова, графически — с помощью квантильных диаграмм, а также показателей асимметрии и эксцесса. Для количественных показателей после проверки на нормальность распределения использовались параметрический критерий Стьюдента и непараметрический критерий Манна – Уитни. Для качественных показателей применялся комплекс непараметрических критериев: χ2, χ2 с поправкой Йетса, критерий Фишера. Результаты представлены как уровень значимости (p). Критический уровень значимости принят p < 0,05.
Результаты
У большей части пациентов выявлены факторы риска, которые способствовали прогрессированию атеросклеротического процесса и рецидиву стенокардии (табл. 1).
Абсолютное большинство пациентов в обеих группах имели высокий функциональный класс стенокардии перед повторной операцией. В сравниваемых группах отмечалась тенденция к наличию нескольких факторов риска рецидива стенокардии: ранее перенесенный инфаркт миокарда в анамнезе, табакокурение, сахарный диабет, избыточная масса тела. Длительность между первичным и повторным вмешательством составила 7,1 ± 5,2 года в группе 1 и 7,0 ± 1,4 года в группе 2. Риск развития неблагоприятных осложнений в послеоперационном периоде, рассчитанный по шкале EuroScore II, был сопоставим в обеих группах.
На этапе планирования повторного КШ проводился анализ коронарошунтографии с оценкой функциональности шунтов и степени поражения коронарного русла с последующим принятием решения об объеме реваскуляризации миокарда. В табл. 2 представлена ангиографическая характеристика поражения коронарного русла и шунтов непосредственно перед повторной операцией.
При первичной операции у пациентов группы 1 суммарное количество шунтов составило 185, ин-
Табл. 2. Ангиографическая характеристика исследуемых групп перед повторной операцией
|
Показатель |
Группа 1 |
Группа 2 |
|
|
Маммарокоронарный шунт, n |
норма |
3 |
21 |
|
дисфункция |
32 |
27 |
|
|
Аутовенозный шунт, n |
норма |
60 |
27 |
|
дисфункция |
69 |
65 |
|
|
Аутоартериальный шунт, n |
норма |
9 |
3 |
|
дисфункция |
12 |
10 |
|
|
Индекс реваскуляризации при первичном коронарном шунтировании |
2,5 |
2,4 |
|
декс реваскуляризации — 2,5. В группе 2 суммарное количество шунтов, сформированных при первичной операции, составило 153 графта, индекс реваскуляризации — 2,39. Ретроспективный анализ ангиографических данных показал, что в группе 2 при первичной операции в 48 случаях (75 %) выполнена реваскуляризация с помощью левой внутренней грудной артерии, что накладывало ограничения при выборе графтов для повторного вмешательства. Также необходимо отметить, что практически у всех исследуемых пациентов наблюдался многососудистый характер поражения коронарного русла, что свидетельствует о прогрессировании атеросклеротического поражения.
В целом в исследуемых группах риск оперативного вмешательства, рассчитанный по шкале
EuroScore II, оказался относительно высоким. Интраоперационная характеристика и структура использованных шунтов представлены в табл. 3.
Общее количество шунтов при повторном КШ в группе 1 составило 177, в группе 2 — 181. В группе 1 в 47 случаях (63,5 %) использованы аутоартериальные графты, в группе 2 — в 17 случаях (26,6 %). Бимаммарное шунтирование не выполнялось у исследуемых пациентов. Артериальное шунтирование в группе 2 было ограничено в отношении использования левой внутренней грудной артерии, так как при первичной операции данный графт был использован у 48 пациентов (75 %) данной группы. Суммарно в обеих исследуемых группах 60 аутовенозных графтов были выделены методом no touch .
Табл. 3. Структура реваскуляризации сердца при повторном вмешательстве
|
Показатель |
Группа 1 |
Группа 2 |
р |
|
Общее количество шунтированных при повторной операции артерий, n |
177 |
181 |
н/д |
|
Использовано 1–2 шунта, n (%) |
42 (56,8) |
20 (31,3) |
0,04 |
|
Использовано 3 и более шунтов, n (%) |
32 (43,2) |
44 (68,7) |
0,01 |
|
Индекс реваскуляризации |
2,39 |
2,82 |
н/д |
|
Левая внутренняя грудная артерия, n (%) |
37 (50) |
8 (12,5) |
0,03 |
|
Правая внутренняя грудная артерия, n (%) |
0 (0) |
6 (9,4) |
0,01 |
|
Лучевая артерия, n (%) |
10 (14,1) |
3 (4,7) |
0,77 |
|
Венозный графт, n (%) |
58 (78,4) |
61 (95,3) |
0,03 |
|
Характеристика шунтированных артериальных бассейнов |
|||
|
Передняя межжелудочковая и / или диагональная артерия, n (%) |
68 (91,8) |
64 (100) |
0,02 |
|
Огибающая артерия, n (%) |
51 (68,9) |
63 (98,4) |
0,03 |
|
Правая коронарная артерия, n (%) |
58 (78,3) |
43 (67,2) |
0,2 |
Примечание . н/д — нет данных
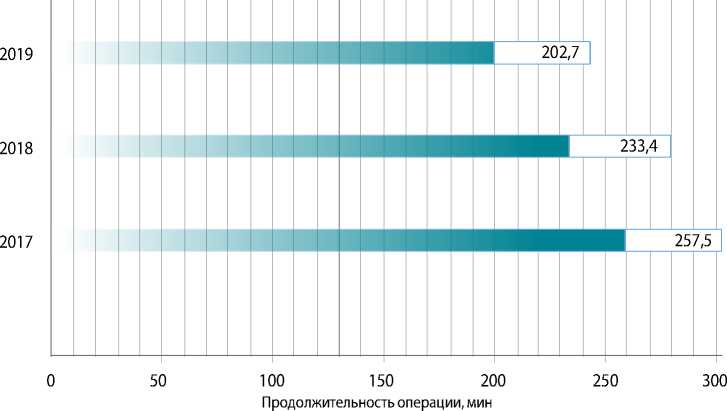
Рис. 1. Динамика продолжительности операций повторного коронарного шунтирования на работающем сердце в ФГБУ «НМИЦ им. В.А. Алмазова» в 2017–2019 гг.
Несмотря на техническую сложность достижения полной реваскуляризации миокарда на работающем сердце, в большей части случаев (68,7 %) именно в группе 2 были шунтированы 3 и более артерии, в то время как в группе 1 многососудистое шунтирование выполнялось менее чем в половине случаев (43,2 %). В 98,4 % случаев в группе 2 выполнялась реваскуляризация бассейна огибающей артерии, при этом индекс реваскуляризации в группе 2 был выше аналогичного показателя группы 1 и чем при первичном вмешательстве (2,82 против 2,39).
Продолжительность оперативного вмешательства в сравниваемых группах отличалась в пользу операций на работающем сердце (219,8 ± 41,5 в группе 2 против 299,7 ± 67,1 мин в группе 1, p = 0,02). При этом в группе 1 средняя продолжительность экстракорпорального кровообращения составила 116,2 мин, среднее время пережатия аорты — 58,7 мин.
Важно отметить, что с накоплением оперативной техники существенно сокращалась продолжительность оперативного вмешательства, что наиболее отчетливо проявлялось в группе 2 (рис. 1). Так, средняя продолжительность повторного КШ на работающем сердце за 2019 г. сократилась на 54,8 мин, в сравнении с аналогичным показателем за 2017 г. (257,5 ± 59,2 против 202,7 ± 36,3 мин в 2017 и 2019 г. соответственно, p = 0,01).
Длительность стационарного лечения также отличалась в пользу группы 2 (17,6 ± 0,8 против 14,5 ± 2,5 дня в группах 1 и 2 соответственно, p = 0,045). В среднем длительность нахождения в отделении реанимации составила 1,9 ± 0,9 дня в группе 1 и 1,3 ± 0,6 дня в группе 2, p = 0,05. В табл. 4 отображены особенности течения послеоперационного периода.
В исследуемых группах случаев интраоперационной летальности, повреждения сердца и функционирующих шунтов во время рестернотомии и кардиолиза не зарегистрировано. В структуре интраоперационных осложнений в группе 1 необходимо выделить один случай интраоперационного инфаркта миокарда с последующей прогрессирующей сер-
Табл. 4. Сравнительная характеристика послеоперационного периода
|
Показатель |
Группа 1 |
Группа 2 |
р |
|
Длительность пребывания в стационаре, дней |
17,6 ± 0,8 |
14,5 ± 2,5 |
0,045 |
|
Длительность пребывания в отделении реанимации, дней |
1,9 ± 0,9 |
1,3 ± 0,6 |
0,05 |
|
Продолжительность искусственной вентиляции легких, ч |
8,5 ± 1,5 |
5,0 ± 4,1 |
0,06 |
Табл. 5. Структура послеоперационных осложнений
|
Показатель |
Группа 1, n (%) |
Группа 2, n (%) |
p |
|
Летальный исход |
3 (4,1) |
0 (0) |
0,1 |
|
Сердечно-сосудистая недостаточность |
29 (39,2) |
13(20,3) |
0,043 |
|
Послеоперационный инфаркт миокарда |
4 (5,4) |
0 (0) |
0,06 |
|
Дыхательная недостаточность |
5(7,8) |
2(2,7) |
0,047 |
|
Послеоперационная пневмония |
1 (1,4) |
1 (1,5) |
0,97 |
|
Постперикардиотомный синдром |
10 (13,5) |
0 (0) |
0,02 |
|
Кровотечение с последующей рестернотомией |
2 (2,7) |
0 (0) |
0,18 |
|
Пароксизм фибрилляции предсердий |
3 (4,1) |
12 (18) |
0,065 |
|
Желудочковые нарушения ритма |
0 (0) |
1 (1,5) |
0,09 |
|
Медиастинит |
0 (0) |
0 (0) |
н/д |
|
Диастаз грудины |
0 (0) |
0 (0) |
н/д |
|
Поверхностная раневая инфекция |
4 (5,4) |
0 (0) |
0,06 |
Примечание. н/д — нет данных дечно-сосудистой недостаточностью и летальным исходом на 1-е сут. после операции.
Анализ течения послеоперационного периода показал (табл. 5), что явления сердечно-сосудистой недостаточности в группе 1 отмечены в 29 случаях (39,2 %), в группе 2 — в 13 случаях (20,3 %), при этом потребность во введении инотропных и вазопрессорных препаратов была обусловлена в большинстве случаев вазоплегией. В 4 случаях (5,4 %) группы 1 был зарегистрирован послеоперационный инфаркт миокарда, потребовавший интенсивной терапии без использования методов механической поддержки. У 10 пациентов (13,5 %) группы 1 отмечен постпери-кардиотомный синдром (в 7 случаях — изолированный гидроперикард, в 2 случаях — гидроперикард с гидротораксом, в 1 случае — изолированный гидроторакс), из которых в 6 случаях потребовалось дренирование из плевральной или перикардиальной полостей. Нарушения заживления послеоперационных ран проявлялись в виде поверхностной раневой инфекции у 4 пациентов (5,4 %) группы 1, данное осложнение отсутствовало в группе 2. Общая госпитальная летальность в группах составила 2,17 % за счет 3 случаев летального исхода в группе 1 (4,1 % из 74 пациентов). Необходимо отметить, что пациенты относились к категории крайне высокого хирургического риска. Двое больных умерли от прогрессирующей полиорганной недостаточности на 8-е и 11-е сут., третий пациент умер от прогрессирующей острой сердечно-сосудистой недостаточности на фоне текущего интраоперационного инфаркта миокарда на 1-е сут. после операции. В послеоперационном периоде ни одному из пациентов не выполнялось повторных коронарных вмешательств. На момент выписки пациенты обеих групп не отмечали клиники стенокардии.
Сравнение результатов лечения пациентов показало некоторые преимущества в пользу повторного КШ на работающем сердце: длительность стационарного лечения и нахождения в отделении интенсивной терапии, продолжительность операции, меньшая частота развития послеоперационных осложнений и низкий показатель госпитальной летальности.
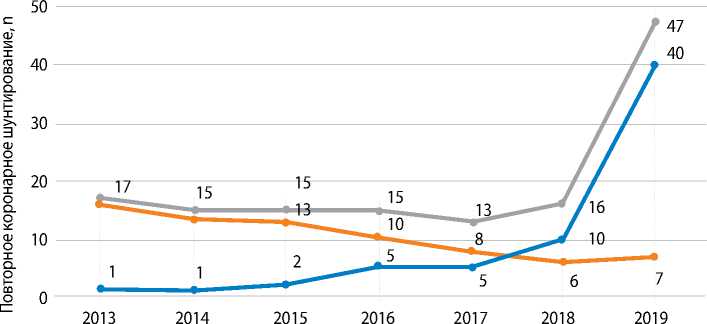
За последние несколько лет отмечается тенденция к увеличению общего количества повторного КШ в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России. Такая динамика была достигнута в большей степени за счет операций на работающем сердце. Так, в 2019 г. количество повторного КШ на работающем сердце возросло в 4 раза, в сравнении с 2018 г., что свидетельствует о совершенствовании тактики ведения подобных пациентов. На рис. 2 приведена диаграмма, отображающая динамику количества повторного КШ за период 2013–2019 гг.
Обсуждение
Несмотря на прогрессивное совершенствование медикаментозной терапии и эндоваскулярных методик, повторное КШ остается одним из методов лечения рецидива стенокардии у пациентов, ранее перенесших реваскуляризацию миокарда. Кроме того, что основной категорией являются пациенты пожилого возраста с отягощающим коморбидным фоном и сниженной сократительной способностью левого
Без искусственного С искусственным кровообращения кровообращением
Общее количество
Рис. 2. Динамика повторного коронарного шунтирования в ФГБУ «НМИЦ им. В. А. Алмазова» в 2013–2019 гг.
желудочка, повторные операции на сердце априори несут дополнительные риски и имеют ряд технических особенностей. На рис. 3 отмечены основные факторы, способствующие возникновению рецидива стенокардии после перенесенного ранее коронарного шунтирования.
В целом эти факторы можно условно разделить на две группы: пациент- и хирург-ассоциированные.
К первой группе относятся анамнестические особенности, факторы риска, низкая комплаентность пациентов. К хирург-ассоциированным факторам относятся тактические ошибки, связанные с неадекватным планированием объема вмешательства, а также технические ошибки. На рис. 4 представлены данные коронарошунтографий пациентов, на которых можно рассмотреть наиболее частые варианты
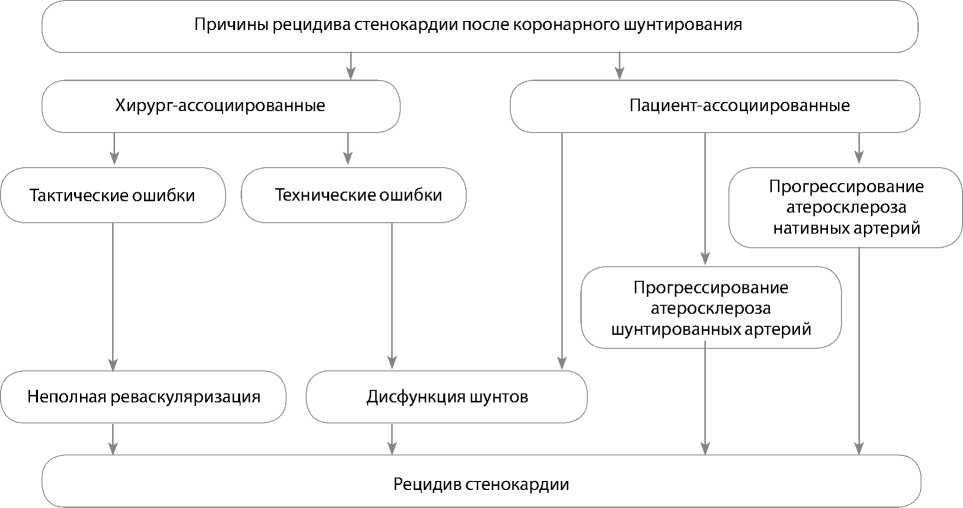
Рис. 3. Основные причины рецидива стенокардии у пациентов после коронарного шунтирования
Рис. 4. Варианты технических ошибок при формировании анастомозов: дефект дистального анастомоза (А); экстравазальная компрессия в области анастомоза, обусловленная наложением клипа (B); дефект проксимального анастомоза (C); недостаточная длина графта (D)
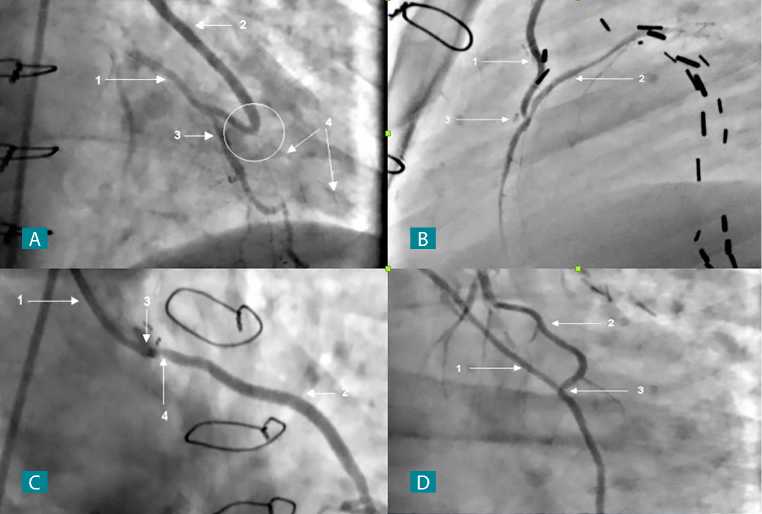
технических ошибок при выполнении коронарного шунтирования.
Конечной целью КШ является полная реваскуляризация независимо от техники выполнения операции. Полная реваскуляризация ассоциирована с более высокой выживаемостью в отдаленном периоде, чем при неполной реваскуляризации. Однако определение полноты реваскуляризации может иметь разное значение. При повторном КШ существует большое разнообразие определений полноты реваскуляризации с учетом конкретных проблем, таких как пожилой возраст пациента, выраженный диффузный атеросклероз коронарных артерий, дегенерация аутовенозного материала. Это приводит к разногласиям об оптимальной реваскуляризации и неоднозначному отношению к полной реваскуляризации [11–16]. По результатам ряда исследований, индекс реваскуляризации после повторного КШ ниже, чем после первичного [2; 17–19]. Имеется несколько сообщений о полноте реваскуляризации при первичных и повторных КШ. M. Di Mauro и соавт. сообщили о более низком уровне полной реваскуляризации при повторном КШ при любой из техник операции (в условиях ИК — 59,8 %, на работающем сердце — 40,2 %), в сравнении с первичным КШ (показатель полноты реваскуляризации — 93,3 против 85,4 % при первичном и повторном КШ соответствен- но). Пациенты с неполной реваскуляризацией в отдаленном периоде характеризовались более высокой частотой развития сердечно-сосудистых событий и смертности [4].
A. Schütz и соавт. сравнивали результаты повторного КШ на работающем сердце и в условиях ИК. Критериями сравнения являлись длительность нахождения в отделении интенсивной терапии, потребность инотропной и вазопрессорной поддержки, а также степень повреждения миокарда по повышению уровня специфических ферментов в крови. В каждую группу сравнения включено 20 пациентов. По результатам исследования, повторные КШ на работающем сердце в меньшей степени оказывают повреждающее действие на миокард (по уровню высвобождения специфических кардиальных ферментов), позволяют снизить потребность в инотропных препаратах и имеют более благоприятное течение раннего послеоперационного периода [7]. N. Trehan и соавт. выявили, что смертность в отдаленном периоде после повторного КШ на работающем сердце составила 4 % [19], хотя в схожих исследованиях показатель смертности после повторного КШ на работающем сердце составил 2,9 %, в сравнении с 3,8 % после повторного КШ в условиях ИК [17; 18; 20]. Y.K. Mishra и соавт. отметили, что смертность в раннем после- операционном периоде составила 3,3 % при операции на работающем сердце против 5,5 % при операции в условиях ИК [21]. H.A. Vohra и соавт. также сообщили о более низком уровне смертности у пациентов, перенесших повторное КШ на работающем сердце, в сравнении с повторным КШ в условиях ИК (2,3 против 6,9 % соответственно) [9].
S.C. Stamou и соавт. выявили значительное снижение показателей смертности в послеоперационном периоде у пациентов, которым выполнялось повторное КШ на работающем сердце (1 против 10 % при КШ на работающем сердце и в условиях ИК соответственно, p = 0,03). Также преимущества операции на работающем сердце проявлялись в более низкой потребности в трансфузиях гемокомпонентов, низкой частоте возникновения эпизодов нарушений ритма, длительности вентиляции легких, сроке стационарного лечения [22]. Аналогичным образом результаты нашего исследования выявили превосходство повторного КШ на работающем сердце в отношении частоты возникновения аритмий в послеоперационном периоде, длительности искусственной вентиляции легких и продолжительности стационарного лечения.
В 2019 г. M.I. Rufa и соавт. опубликовали исследование, в котором выявили ряд преимуществ повторного КШ на работающем сердце, в сравнении с повторным КШ в условиях ИК. У пациентов, которым выполнялось повторное КШ на работающем сердце, не зарегистрирована послеоперационная почечная недостаточность, требующая заместительной почечной терапии (0,0 против 4,6 % при КШ на работающем сердце и в условиях ИК соответственно, p = 0,06). Кроме того, в этой группе был отмечен более короткий период нахождения в палате интенсивной терапии (1,33 ± 1,03 против 4,40 ± 7,98 дня при КШ на работающем сердце и в условиях ИК соответственно, p < 0,001) и длительности стационарного лечения (10,08 ± 5,35 против 14,1 ± 10,6 дня при КШ на работающем сердце и в условиях ИК соответственно, p = 0,001) [23]. Необходимо отметить, что в исследуемых нами группах перечисленные факторы также значимо отличались в пользу повторных операций на работающем сердце.
По мере накопления опыта повторных операций на сердце мы разработали технические принципы выполнения подобных вмешательств. Так, для снижения риска повреждения сердца и функционирующих шунтов при рестернотомии и кардиолизе предпочтительно рутинное выполнение перед повторной операцией мультиспиральной компьютерной томографии сердца с контрастированием коронарных артерий и шунтов: при интимном прилежании сердца к грудине рассматривается возможность проведения ИК с периферическим подключением на этапе предоперационной подготовки. Во избежание нарушений ритма во время кардиолиза предпочтительно использовать низкоэнергетичную контактную монополярную коагуляцию. Вне зависимости от объема оперативного вмешательства мы настоятельно рекомендуем сведение перикарда или мягких тканей переднего средостения над сердцем, так как это поможет избежать плотного прилегания сердца к грудине и снизить риск повреждения сердца при повторных вмешательствах.
Заключение
Результаты повторного КШ как на работающем сердце, так и в условиях ИК удовлетворительные в раннем послеоперационном периоде. Риски повторных вмешательств на сердце сопоставимы с рисками первичных КШ, а функционирующие к моменту повторной операции шунты не являются предикторами развития технических осложнений и не должны рассматриваться как абсолютное противопоказание к повторным вмешательствам.
Выполнение повторного КШ на работающем сердце имеет ряд преимуществ и ассоциировано со снижением частоты возникновения послеоперационных осложнений. Длительность повторных операций напрямую зависит от хирургического опыта и частоты выполнения подобных вмешательств. Повторное КШ не ограничивает полноту реваскуляризации, поэтому должно рассматриваться как метод выбора в стратегии повторной реваскуляризации миокарда.
Список литературы Анализ непосредственных результатов повторного коронарного шунтирования
- Гордеев М.Л., Дьяченко Я.А., Гребенник В.К., Исмаил-заде И.К. Современные тенденции выбора материала для шунтирования при многососудистом поражении коронарных артерий. Грудная и сердечно-сосудистая хирургия. 2018;60(3):194-200. [Gordeev M.L., D'yachenko Ya.A., Grebennik V.K., Ismail-zade I.K. Trends in graft decision making in multiarterial coronary artery bypass grafting surgery. Grudnaya i Serdechno-Sosudistaya Khirurgiya = Russian Journal of Thoracic and Cardiovascular Surgery. 2018;60(3):194-200. (In Russ.)] https://doi.org/10.24022/0236-2791-2018-60-3-194-200
- Czerny M., Zimpfer D., Kilo J., Gottardi R., Dunkler D., Wolner E., Grimm M. Coronary reoperations: recurrence of angina and clinical outcome with and without cardiopulmonary bypass. Ann ThoracSurg. 2003;75(3):847-852. PMID: 12645705. https:// doi.org/10.1016/s0003-4975(02)04652-0
- Гребенник В.К., Кучеренко В.С., Фань Х., Гордеев М.Л. Повторное аорто-коронарное шунтирование. Риски и результаты. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2018;13(3)20-24. [Grebennik V.K., Kucherenko V.S., Fany H., Gordeev M.L. Redo coronary artery bypass graft. Risk and results. Bulletin of Pirogov National Medical & Surgical Center. 2018;13(3)20-24. (In Russ.)] https:// doi.org/10.25881/BPNMSC.2018.85.15.004
- Di Mauro M., Iaco A.L., Contini M., Teodori G., Vitolla G., Pano M., Di Giammarco G., Calafiore A.M. Reoperative coronary artery bypass grafting: analysis of early and late outcomes. Ann Thorac Surg. 2005;79(1):81-87. PMID: 15620920. https://doi. org/10.1016/i.athoracsur.2004.06.058
- Masroor S., Katariya K., Yassin S., Tehrani H., Salerno T. Redo-OPCAB via left thoracotomy using symmetry aortic connector system: a report of two cases. J Card Surg. 2004;19(1):51-53. PMID: 15108791. https://doi.org/10.11117i.0886-0440.2004.04011.x
- Mack M.J. Off-pump surgery and alternatives to standard operation in redo coronary surgery. J Card Surg. 2004;19(4):313-319. PMID: 15245460. https://doi.org/10.1111/ i.0886-0440.2004.4056 11.x
- Schütz A., Mair H., Wildhirt S.M., Gillrath G., Lamm P., Kilger E., Reichart B. Re-OPCAB vs. Re-CABG for myocardial revascularization. Thorac Cardiovasc Surg. 2001;49(3):144-148. PMID: 11432471. https://doi.org/10.1055/s-2001-14290
- Sisillo E., Marino M.R., Juliano G., Beverini C., Salvi L., Alamanni F. Comparison of on pump and off pump coronary surgery: risk factors for neurological outcome. Eur J Cardiothorac Surg. 2007;31(6):1076-1080. PMID: 17408960. https://doi. org/10.1016/i.eicts.2007.02.015
- Vohra H.A., Bahrami T., Farid S., Mafi A., Dreyfus G., Amrani M., Gaer J.A.R. Propensity score analysis of early and late outcome after redo off-pump and on-pump coronary artery bypass grafting. Eur J Cardiothorac Surg. 2008;33(2):209-214. PMID: 18180164. https://doi.org/10.1016/_i.ejcts.2007.11.011
- Cosgrove D.M. 3rd. Is coronary reoperation without the pump an advantage? Ann Thorac Surg. 1993;55(2):329. PMID: 8431034. https://doi.org/10.1016/0003-4975(93)90990-y
- Yaku H., Doi K. Redo coronary artery bypass grafting. Gen Thorac Cardiovasc Surg. 2014;62(8):453-460. PMID: 24906816. https://doi.org/10.1007/s11748-014-0426-6
- Valgimigli M., Agostoni P., Biondi Zoccai G.G.L. Complete myocardial revascularization: between myth and reality. Eur Heart J. 2005;26(17):1809-1810. PMID: 15987705. https://doi. org/10.1093/eurhearti/ehi403
- BARI Investigators. The final 10-year follow-up results from the BARI randomized trial. J Am Coll Cardiol. 2007;49(15):1600-1606. PMID: 17433949. https://doi.org/10.1016/i.iacc.2006.11.048
- Vander Salm TJ., Kip K.E., Jones R.H., Schaff H.V., Shemin R.J., Aldea G.S., Detre K.M. What constitutes optimal surgical revascularization? Answers from the Bypass Angioplasty Revascularization Investigation (BARI). J Am Coll Cardiol. 2002;39(4):565-572. PMID: 11849852. https://doi.org/10.1016/ s0735-1097(01)01806-x
- Deppe A.-C., Arbash W., Kuhn E.W., Slottosch I., Scherner M., Liakopoulos O.J., Choi Y.-H., Wahlers T. Current evidence of coronary artery bypass grafting off-pump versus on-pump: a systematic review with meta-analysis of over 16,900 patients investigated in randomized controlled trials. Eur J Cardiothorac Surg. 2016;49(4):1031-1041. PMID: 26276839. https://doi. org/10.1093/ejcts/ezv268
- Dieberg G., Smart N.A., King N. On-vs. off-pump coronary artery bypass grafting: A systematic review and meta-analysis. Int J Cardiol. 2016;223:201-211. PMID: 27541655. https://doi. org/10.1016/j.ijcard.2016.08.250
- Yau T.M., Borger M.A., Weisel R.D., Ivanov J. The changing pattern of reoperative coronary surgery: trends in 1230 consecutive reoperations. J Thorac Cardiovasc Surg. 2000;120(1 ):156-163. PMID: 10884669. https://doi.org/10.1067/mtc.2000.106983
- Tugtekin S.M., Alexiou K., Kappert U., Esche H., Joskowiak D., Knaut M., Matschke K. Coronary reoperation with and without cardiopulmonary bypass. Clin Res Cardiol. 2006;95(2):93-98. PMID: 16598517. https://doi.org/10.1007/s00392-006-0335-5
- Trehan N., Mishra Y.K., Malhotra R., Sharma K.K., Mehta Y., Shrivastava S. Off-pump redo coronary artery bypass grafting. Ann Thorac Surg. 2000;70(3):1026-1029. PMID: 11016368. https://doi.org/10.1016/s0003-4975(00)01775-6
- Lamy A., Devereaux P.J., Prabhakaran D., Taggart D.P., Hu S., Straka Z., Piegas L.S., Avezum A., Akar A.R., Lanas Zanetti F., Jain A.R., Noiseux N., Padmanabhan C., Bahamondes J.-C., Novick R.J., Tao L., Olavegogeascoechea P.A., Airan B., Sulling T.-A., Whitlock R.P., Ou Y., Gao P., Pettit S., Yusuf S., CORONARY Investigators. Five-year outcomes after offpump or on-pump coronary artery bypass grafting. N Engl J Med. 2015;375(24):2359-2368. PMID: 27771985. https://doi. org/10.1056/nejmoa1601564
- Mishra Y.K., Collison S.P., Malhotra R., Kohli V., Mehta Y., Trehan N. Ten-year experience with single-vessel and multivessel reoperative off-pump coronary artery bypass grafting. J Thorac Cardiovasc Surg. 2008;135(3):527-532. PMID: 18329464. https://doi.org/10.1016/Mtcvs.2007.10.019
- Stamou S.C., Pfister A.J., Dangas G., Dullum M.K., Boyce S.W., Bafi A.S., Garcia J.M., Corso P.J. Beating heart versus conventional single-vessel reoperative coronary artery bypass. Ann Thorac Surg. 2000;69(5):1383-1387. PMID: 10881809. https://doi.org/10.1016/s0003-4975(00)01177-2
- Rufa M.I., Ursulescu A., Nagib R., Shanmuganathan S., Albert M., Reichert S., Franke U.F.W. Off-pump versus on-pump redo coronary artery bypass grafting: A propensity score analysis of long-term follow-up. J Thorac Cardiovasc Surg. 2020;159(2):447-456.e2. PMID: 31229294. https://doi. org/10.1016/j.jtcvs.2019.03.122


