Анализ осложнений лечения рака предстательной железы высокоинтенсивным фокусированным ультразвуком (HIFU)
Автор: Чернышев Игорь Владиславович, Низамова Румия Сахабовна, Губанов Евгений Сергеевич, Зимичев Александр Анатольевич, Пряничникова М.Б., Боряев Е.А.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142211673
IDR: 142211673
Текст статьи Анализ осложнений лечения рака предстательной железы высокоинтенсивным фокусированным ультразвуком (HIFU)
Актуальность
Рак предстательной железы – является один из самых распространенных видов онкологического заболевания в Европе. В Великобритании он составляет примерно 24% всех новых онкологических диагнозов у мужчин. В странах северной и западной Европы на 100 000 населения приходится более 200 случаев рака предстательной [1-3]. Кроме того, в 2012 г. в развитых странах РПЖ занимал третье место среди причин смерти от рака у мужчин (142 тыс. случаев) [4].
В настоящее время существует несколько методов лечения РПЖ. К радикальным относятся: радикальная простатэктомия и лучевая терапия (ДЛТ и брахитерапия). Наряду с ними, существуют и альтернативные (малоинвазивные) – HIFU терапия, криоабляция предстательной железы, фотодинамическая терапия. Но выбор метода лечения зависит от стадии заболевания и общего состояния пациента.
На сегодняшний день оценка результатов лечения складывается из двух параметров – продолжительность жизни паци- ента и ее качество. При этом Американское общество клинической онкологии и Национальный институт рака считают, что именно качество жизни является основным параметром.
Как известно, основное влияние на качество жизни оказывают осложнения, возникшие после лечения, которые связаны с нарушением удержания мочи, опорожнения мочевого пузыря и эректильной функции. В связи с этим постоянно идет поиск метода лечения РПЖ, который увеличивал бы продолжительность жизни и имел наименьшее количество осложнений.
Согласно принципам доказательной медицины, преимущество любого нового метода лечения должно быть изучено и проанализировано.
Одним из основных показателей критической оценки качества оказания хирургической помощи является частота осложнений. Объективная регистрация интраоперационных, ранних и поздних послеоперационных осложнений имеет большое значение для правильной интерпретации результатов хирургического лечения, их сравнения между учреждениями и отдельными хирургами [6, 7, 8]. Безопасная хирургия требует постоянного контроля качества. По оценкам Всемирной организации здравоохранения, в 2002 году население трудоспособного возраста в 11% признавалось временно нетрудоспособным из-за осложнений хирургического лечения [9]. Следует отметить, что сохраняются разногласия в трактовке термина «осложнение», правил его регистрации и классификации [10, 11, 12]. Наиболее универсальной, простой и объективной признана модифицированная классификация Clavien (2004). Одновременно с созданием классификации послеоперационных осложнений, введением определения послеоперационно- го осложнения оставалась неоднознаность с критериями их регистрации, необходимыми для формирования единых требований к отчетности [13, 14]. Эту задачу успешно решили в 2002 году Martin и соавторы. Ученые предложили 10 критериев для регистрации осложнений после хирургического лечения. Каждое исследование, в котором выполнялся анализ количества послеоперационных осложнений, должно включать следующие данные: способ планирования; продолжительность наблюдения; данные, полученные после выписки пациента из стационара; определение каждого выявленного осложнения; уровень смертности и причины каждого случая смерти; количество случаев с осложнением и общее число осложнений; причины каждого осложнения; название классификации осложнений; продолжительность пребывания пациентов в стационаре; факторы риска, выявленных осложнений [13, 14].
Таким образом, использование универсального комплексного подхода в отчетности хирургических осложнений ведет к улучшению качества оказания урологической помощи, позволяет создавать профиль осложнения каждого метода лечения, сравнивать результаты отдельных врачей и коллективов. Эти принципы позволяют выполнять статистический анализ серий операций в больших группах, прогнозировать возможные осложнения у конкретного пациента, выявляя факторы риска их возникновения [15, 16] .
Цель исследования
Анализ осложнений HIFU терапии рака предстательной железы.
Материалы и методы
В исследование включен 151 пациент, с морфологически доказанным при биопсии раком предстательной железы, прошедшие лечение методом HIFU. Срок наблюдения 60 месяцев. Из исследуемой группы 7 человек имели местный рецидив после дистанционно лучевой терапии, 2 - после радикальной простатэктомии и 3 после HIFU-терапии.
Всем больным были проведены сеансы HIFU терапии на аппарате «Аблатерм» (EDAP, Франция). При этом в целях профилактики недержания мочи у пациентов, апикальный отдел предстательной железы оставался без воздействия HIFU на протяжении 5-6 мм.
Возраст пациентов составлял от 51 до 85 лет, в среднем – 68,2 года.
Характеристика больных РПЖ прошедших HIFU-терапию в зависимости от стадии заболевания представлена в таблице 1.
Локализованная форма опухолевого процесса встретилась у 102 (67,6%) пациентов, местнораспространенная и генерализованная – у 37 (24,5%) и 12 (7,9%) соответственно. Следует отметить, что у 6 пациентов выявлена ПИН по данным биопсии. У пациентов с генерализованной формой процесса HIFU- терапия носила паллиативный характер.
Неоадьювантную гормонотерапию в группе с локализованной формой получали 72 пациента, причем на фоне ее применения у 60 пациентов имелась положительная динамика, у 12 пациентов диагностирован гормонорезистентный рак предстательной железы.
В группе с местнораспространенной формой, неоадьювант-ная гормонотерапия проводилась 32 пациентам. Гормонорезистентный рак выявлен у 8 пациентов, у 24 – гормоночувствительная форма. Гормональную терапию не получали 4 пациента.
При генерализованной форме процесса 13 пациентам проводилась неоадьювантная гормонотерапия. Гормонорезистентный рак – 2 случая, гормоночувствительный – 11 случаев.
Значение ПСА до лечения составило от 0,07 до 295 нг/мл, в среднем 23,91 нг/мл. В группе с локализованной формой -14,23 нг/мл, местнораспространенной - 25,9 нг/мл и генерализованной - 31,6 нг/мл. В первых двух группах, несмотря на проведение гормонотерапии, уровень ПСА достаточно высокий, это вероятно связано с наличием гормонрезистентного рака предстательной железы. В группе же с генерализованным процессом уровень ПСА обусловлен распространенностью заболевания.
К показателям, характеризующим состояние мочевыделительной системы, отнесены: сумма балов по шкале IPSS и МИЭФ – 5, предшествующие оперативные вмешательства на органах мочевыводящей системы, предстательной железе, объем железы, максимальная скорость потока струи мочи, объем остаточной мочи, объем железы подвергшийся воздействию HIFU, сопутствующие урологические заболевания, выявленные при комплексном обследовании.
Медиана значений сумм баллов по шкале IPSS составила -18, а МИЭФ5 – 12.
Предшествующие оперативные вмешательства на предстательной железе выполнялись по поводу гиперплазии последней и носили как, паллиативный так и радикальный характер. Так по поводу острой задержки мочи 25 пациентам наложена эпицистостома, аденомэктомия выполнена – 9 и ТУР – 32 пациентам, причем у 16 из них как подготовительный этап перед проведением HIFU- терапии.
Таблица 1
Характеристика больных РПЖ прошедших HIFU-терапии
|
Степень дифференцировки опухоли |
Формы распространенности процесса |
|||
|
Локализованная |
Местно-распространенная |
Генерализованная |
Всего (n-151) |
|
|
Высокодифференцированная |
72 |
19 |
5 |
96 (63,6%) |
|
Умереннодифференцированная |
23 |
9 |
3 |
35 (23,2%) |
|
Низкодифференцированная |
7 |
8 |
5 |
20 (13,2%) |
При обследовании перед HIFU терапией у 11 больных диагностирована хроническая почечная недостаточность 1-2 степени, у 2 пациентов последняя обусловлена наличием двустороннего уретерогидронефроза, у остальных пациентов - не-фросклерозом.
Мочекаменная болезнь диагностирована в 5 случая, у 1 пациента – камни почек, которые не имели клинического проявления и у 4 камни мочевого пузыря, которые были удалены в ходе выполнения операции.
Состояние нижних мочевых путей оценены по объему предстательной железы, наличию остаточной мочи и максимальной скорости потока струи мочи (Таблица 2).
Как видно из таблицы, несмотря на незначительное увеличение объема железы, во всех группах имелись признаки ин-фравезикальной обструкции, о чем свидетельствуют данные урофлоуметрии и наличие остаточной мочи.
Сочетание рака простаты и аденомы встречается крайне часто. Так, у наших пациентов, которым произведена HIFU терапия по поводу рака простаты объем предстательной железы до ТУР более 30 куб. см. встречался у 87 (57.%) пациентов. Передне-задний размер простаты, превышающий 24 мм наблюдался у 148 (98.1%) больных.
Для уменьшение объема (передне-заднего размера) железы и устранения инфравезикальной обструкции 122 (80.8%) пациентам выполнена ТУР простаты. ТУР не применялась у 29 пациентов первичного лечения рака предстательной железы и с отсутствием инфравезикальной обструкции.
Процедура HIFU проводилась по общепринятой методике. Результат лечения осуществлялся по следующим критериям: терапии злокачественности, функции опорожнения и удержания мочи и сохранение эректильной функции.
Определение ПСА осуществлялось через 3, 6, 9, 12 месяцев после лечения. Динамика ПСА после HIFU терапии локализованного и местнораспространенного рака предстательной железы представлена на графике 1.
Как видно на диаграмме отмечается значительный рост ПСА к 12 месяцам в группе с локализованной формой, что требует продолжение лечения. В группе с местнораспространенной формой рост ПСА отмечен к 6 месяцам, что потребовало продолжения лечения. Снижение уровня ПСА наблюдалось к 9 месяцу и его стабилизация к 12 месяцу.
В группе пациентов с локализованной формой среднее значение ПСА составило 5.6 нг/мл, с местнораспространненой и генерализованной - 8.1 нг/мл и 5.7 нг/мл соответственно.
Следует отметить, что в группе с локализованной формой процесса адьювантная гормонотерапия проводилась у 6 пациентов и у 7 в группе с местнораспространенной, при, чем 1 пациенту проведена дистанционная лучевая терапия на регионарные лимфатические узлы. В группе с диссеминированой формой все пациенты в послеоперационном периоде получали адьювантную гормонотерапию. Незначительная разница в значениях ПСА в приведенных группах, вероятнее все обусловлено применением адьювантной гормонотерапии в большем количестве у пациентов в группах с местнораспространенной и диссеминированой формой, чем локализованной. Изменения со стороны нижних мочевых путей отражено в таблице 3.
Как видно из таблицы, во всех группах наряду с уменьшением объема железы улучшается и качество мочеиспускания. Обструктивный характер мочеиспускания отмечен у 26 пациентов в группе с локализованной формой, в группе с местнораспространенной и генерализованной формой 9 и 2 пациента соответственной.
В раннем послеоперационном периоде осложнений не наблюдалось.
В позднем послеоперационном периоде наблюдались следующие осложнения, которые представлены в таблице 4.
Как видно из таблицы в основном преобладали осложнения связанные с функцией удержания и опорожнения мочевого пузыря. Так недержания мочи в течение года констатировано у 89 пациентов(58.3%). По поводу чего всем пациентам про-
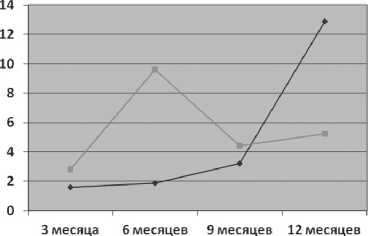
—■—Местнораспространенный
—♦—Локализован н ый
График 1. Динамика ПСА после HIFU терапии локализованного и местнораспространенного рака предстательной железы
Таблица 2
Показатели состояния нижних мочевых путей перед HIFU-терапией
|
Средние показатели |
Форма рака предстательной железы |
||
|
Локализованная |
Местнораспространенная |
Диссеминированная |
|
|
Объем предстательной железы, см3 |
22,4 |
18,5 |
20,56 |
|
Максимальная скорость потока струи мочи, мл/сек. (при объеме мочеиспускания от 150 до 450 мл.) |
11,9 |
10,1 |
12,2 |
|
Объем остаточной мочи, мл |
53.8 |
53.9 |
32.1 |
Таблица 3
Сравнение средних показателей состояния нижних мочевых путей у пациентов перед и после HIFU терапии
|
Показатели |
Форма рака предстательной железы |
|||||
|
Локализованная |
Местнораспространенная |
Диссеминированная |
||||
|
До HIFU терапии |
После HIFU терапии |
До HIFU терапии |
После HIFU терапии |
До HIFU терапии |
После HIFU терапии |
|
|
Объем предстательной железы перед HIFU, см3 |
22,4 |
7,4 |
18,5 |
6,0 |
20,6 |
5,9 |
|
Максимальная скорость потока струи мочи, мл/сек. |
11,9 |
14,7 |
10,1 |
12,1 |
12,2 |
14,9 |
|
Объем остаточной мочи, мл |
53,8 |
38,7 |
53,9 |
43,4 |
32,1 |
39,0 |
Таблица 4
Классификация хирургических осложнений по системе Клавьена
Стриктура уретры диагностирована у 43 (28.5 %) пациентов. На фоне чего у 4 пациентов отмечено образование камней мочевого, у 18 возникла острая задержка мочи. По поводу стриктуры уретры все пациенты проходили периодическое бужирование. Однако у 25 (17 %) пациентов данный вид лечения оказался неэффективным, что в свою очередь потребовало проведения оптической уретротомии и бужирования уретры.
Несмотря на то, что процент данного осложнения не отличается от мировых данных (17%) прослеживается связь с применением ТУР перед процедурой. Так 37 пациентам перед HIFU выполнена ТУР простаты, а у 6 которым проведена HIFU без применения ТУР, в анамнезе имели перенесенные операции на простате (ТУР, аденомэктомия).
Острая задержка мочи, как проявление стриктуры уретры, наблюдалась у 17 пациентов и у 1 пациента была обусловлена отхождение некротических масс предстательной железы. После катетеризации мочевого пузыря у 3 пациентов О.З.М. разрешилась на фоне приема альф-адреноблокаторов, 6 пациентам проведено бужирование уретры и 9 выполнена оптическая уретротомия. Эпицистостома была наложена 4 пациентам и у 3 была закрыта после проведения оптической уретротомии.
Мочекаменная болезнь имела место у 6 пациентов. Камни мочевого пузыря диагностированы у 4 больных, на фоне стриктуры уретры, и у 2 – камни мочеточников. Все пациенты подверглись оперативному лечению. По поводу камней в мочеточнике выполнена одна контактная литотрипсия, в другом случае конкремент отошел самостоятельно. По поводу камней в мочевом пузыре выполнялись следующие оперативные пособия: цистолитотомия в 1 случае, контактная литотрипсия - 3. Следует отметить, что все операции по поводу камней в мочевом пузыре сочетались с операциями на уретре, которые были направленны на устранение причины инфравезикальной обструкции.
Дизурические явления, которые наблюдались в 6 случаях, купировались на фоне проведения консервативной терапии (М-холинолитики, альфа-адреноблокаторы, нестероидные противовоспалительные препараты).
Воспалительные заболевания мочеполовой системы в виде орхита и орхоэпидидимита развились у 6 пациентов. В основном были обусловлены манипуляциями на уретре (бужирование, наличие уретрального катетера, проведение оптической уретротомии). По поводу чего 2 пациента были прооперированы. В одном случае проведена эпидидимэктомия, в другом орхэтомия. В остальных случаях воспалительные явления купированы на фоне проведения консервативной терапии.
Двухсторонний уретерогидронефроз диагностирован у 2 пациентов и связан с местным рецидивом основного заболевания. На фоне этого развилась постренальная хроническая почечная недостаточность, в связи с чем были наложены разгрузочные пункционные нефростомы.
Образование пузырно-прямокишечного свища произошло в одном случае, при повторной HIFU-терапии. После диагностики этого осложнения, пациенту наложена колостома и эпи-цистостома - свищ закрылся.
Ремиссия заболевания после лечения была достигнута у 124 (82.1%) пациентов. Прогрессия заболевания отмечена у 27 пациентов (Таблица 5).
По поводу прогрессии заболевания всем пациентам назначалась гормональная терапия, также 1 пациенту повторно проведена HIFU терапия и 1 - ДЛТ.
Для выявления факторов влияющих на развитие недержания мочи и стриктуры уретры проведен кореляционно-регрессионный анализ.
Проведенные расчеты показали, что коэффициенты множественной корреляции для развития стриктуры уретры и недержания мочи составили 0.57 и 0.52 соответственно, что является статистически достоверным. При проверке статистических гипотез оказалось, что F наблюдаемое для стриктуры уретры -4.9, недержания мочи – 4.2. Так же определены коэффициенты детерминации, которые показали, что развитие стриктуры уретры в 32.77 % , а недержание мочи в 27 % обусловлены факторами включенные в регрессионную модель.
Стоит также отметить, что при проведении статистического анализа обращает на себя тесная связь между развитием осложнений и применением ТУР простаты перед HIFU терапией. Коэффициенты корреляции данного фактора составляет – 0.47 соответственно для недержания мочи, а при стриктуре уретры – 0.49.
Выводы
-
1. HIFU- терапия, несмотря на малоинвазивность метода, имеет достаточно высокий процент осложнений в виде недержания мочи 45(30%) и стриктуры уретры 43(28.5%).
-
2. Выявлена связь между развитием осложнений и применением ТУР простаты перед HIFU-терапии. Вероятнее всего применение данной процедуры, как подготовки пациента к основному методу лечения, и является основной причиной возникновения осложнений в послеоперационном периоде.
-
3. Поскольку проведение ТУР перед HIFU зависит от объема железы, то предпочтительнее на этот малоинвазивный метод отбирать пациентов с объемом не превышающий 30 см3, что позволяет избежать ТУР перед лечением. При данном объеме отмечено наименьшее количество осложнений в виде недержания мочи – 38.1% и стриктуры уретры 19.0%.
Список литературы Анализ осложнений лечения рака предстательной железы высокоинтенсивным фокусированным ультразвуком (HIFU)
- EAUGuidelines. Guidelines on Prostate cancer . -Vers 2014. -URL: http://uroweb.org/guideline/prostate-cancer/.
- Haynes A. B., Weiser T. G. A Surgical Safety Checklist to Reduce Morbidity and Mortality in a Global Population//The New England journal medicine. -2009. -Vol. 360, №5.
- Mottet, N. Prostate cancer: guidelines/N. Mottet, PJ. Bastian, J. Bellmunt, R.C.N. van den Bergh, M. Bolla, N.J. van Casteren, P Cornford, S. Joniau, M.D. Mason, V Matveev, T.H. van der Kwast, H. van der Poel, O. Rouviere, T. Wiegel. -Netherlands: European Association of Urology, 2016. -128 рp.
- Torre, L.A. Global cancer statistics, 2012/A.L. Torre, F. Bray, R.L. Siegel, J. Ferlay, J. Lortet-Tieulent, A. Jemal//CA. Cancer J. Clin. -2015. -Vol. 65. -№ 2. -P 87-108.
- Каприн, А.Д. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность)/А.Д. Каприн, В.В. Старинский, Г.В. Петрова. -Москва: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2016. -250 с.
- Галимов О. В. Профилактика вентральных грыж после лапароскопических операций/О. В. Галимов, В. О. Ханов, Р А. Зиангиров//Эндоскопическая хирургия. -2010. -№ 3. -С. 9-10.
- Trotti A., Colevas A. D., Setser A. et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment//Semin Radiat Oncol. -2003. -Vol. 13. -P 176-181.
- Veen M. R., Lardenoye J. W., Kastelein G. W. et al. Recording and classification of complications in a surgical practice//Eur J Surg. -1999. -Vol. 165. -P 421-424.
- Veillard J., Champagne F., Klazinga N. et al. A performance assessment framework for hospitals: the WHO regional office for Europe PATH project//International J for Quality in Health Care. -2005. -Vol. 17, № 6. -P 487-496.
- Dindo D., Clavien P A. What is a surgical complication?//World J Surg. 2008. -Vol. 32. -P. 939-941.
- Sivaraman A., Coelho R. F., Patel V.R. et al. A new concept in reporting outcomes of robot assisted laparoscopic radical prostatectomy the octafecta//European Urology Supplements. Eur Urol. -2011. -Vol. 10. -P. 551.
- Soko D.K., Wilson J. What is a surgical complication?//World J Surg. -2008. -Vol. 32. -P. 942-944.
- Donat S. M. Standards for Surgical Complication Reporting in Urologic Oncology: Time for a Change//Urol. -2007. -Vol. 69, № 2.
- Martin R. C., Brennan M. F., Jaques D. P. Quality of complication reporting in the surgical literature//Ann Surg. -2002. -Vol. 235. -P. 803-813.
- Haylen B. T., Freeman R. M., Lee J. et al. International Urogynecological Association (IUGA)/International Continence Society (ICS) Joint Terminology and Classification of the Complications Related to Native Tissue Female Pelvic Floor Surgery//Neurourology and Urodynamics. -2012. -Vol. 31. -P. 406-414.
- Strasberg S. M., Linehan D. C., Hawkins W. G. The Accordion Severity Grading System of surgical complications//Ann Surg. -2009. -Vol. 250. -P. 177-186.


