Анализ показателей выживаемости и оценка факторов прогноза у больных с метастазами рака почки в легкие
Автор: Семенов Д.В., Орлова Р.В., Широкорад В.И., Кострицкий С.В., Карлова Н.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
У пациентов с метастазами в легкие почечно-клеточного рака (ПКР) необходим поиск новых прогностических факторов, влияющих на показатели выживаемости. Цель исследования - проанализировать показатели общей выживаемости и выявить прогностические факторы у больных с метастазами рака почки в легкие. Материал и методы. Проведен ретроспективный анализ данных 655 пациентов с легочными метастазами ПКР, получавших лечение в Московской городской онкологической больнице№ 62 г. Москвы и Городском клиническом онкологическом диспансере (г. Санкт-Петербург) с 2006 по 2022 г., из них 241 (36,8 %) больной был отнесен к группе промежуточного прогноза, а 278 (42,2 %) - к группе неблагоприятного прогноза. Изучены клинико-морфологические факторы прогноза, влияющие на показатели выживаемости у больных с метастазами в легкие ПКР. Статистический анализ проводился с использованием пакетов программного обеспечения Statistica 10.0 (StatSoft, США) посредством построения кривых Каплана-Мейера и таблиц дожития, построения математической модели дожития.
Почечно-клеточный рак, метастазы в легкие, общая выживаемость, прогностические факторы
Короткий адрес: https://sciup.org/140305907
IDR: 140305907 | УДК: 616.61-006.6-033.2:616.24]-037 | DOI: 10.21294/1814-4861-2024-23-2-37-46
Текст научной статьи Анализ показателей выживаемости и оценка факторов прогноза у больных с метастазами рака почки в легкие
Рак почки, составляющий 5 % всех злокачественных новообразований, возникает из эпителиальной системы почечных канальцев и собирательных трубочек [1]. В последние годы наблюдается тенденция к постепенному росту заболеваемости, причем у мужчин она примерно в два раза выше, чем у женщин [1]. Почечно-клеточный рак (ПКР) составляет до 90 % рака почки, являлся 6-м и 8-м наиболее распространенным раком среди американских мужчин и женщин в 2021 г. [2]. В основном ПКР представлен светлоклеточным, папиллярным и хромофобным подтипами [3, 4]. Показатели выживаемости при светлоклеточном ПКР составляют от 3 мес до 5 лет, 60 % этих пациентов умирают в
течение 1–2 лет после постановки диагноза [2, 5, 6]. Высокая васкуляризация опухоли почки может привести к местному прогрессированию и увеличить вероятность отдаленных метастазов [3]. J. Nishida et al. доказали, что усиление воспаления может вызвать нейтрофил-зависимое метастазирование в легкие у больных ПКР [5]. Легкие и кости являются наиболее частыми зонами метастазирования рака почки [7]. На момент постановки первичного диагноза у 18–40 % пациентов с ПКР уже развиваются метастазы в легкие [8], которые представляют собой множественные очаги с двусторонним поражением или одиночные очаги, которые чаще всего локализуются в нижних долях легкого. В качестве системной терапии метастатического ПКР
Таблица 1/table 1
|
Характеристика/Characteristics |
Количество больных/Number of patients |
|
Пол/Gender |
|
|
Мужской/Male |
485 (74 %) |
|
Женский/Female |
170 (26 %) |
|
Возраст, лет/Age, years |
|
|
18–44 |
31 (4,7 %) |
|
45–59 |
277 (42,3 %) |
|
60–74 |
299 (45,6 %) |
|
≥75 |
48 (7,4 %) |
|
Статус по шкале ECOG/ECOG status |
|
|
0 |
35 (5,3 %) |
|
1 |
266 (40,6 %) |
|
2 |
232 (35,5 %) |
|
3 |
122 (18,6 %) |
|
Локализация первичной опухоли/Localization of the primary tumor |
|
|
Справа/Right |
322 (49,2 %) |
|
Слева/Left |
319 (48,7 %) |
|
Двустороннее/Bilateral |
14 (2,1 %) |
|
Гистологический вариант/Histological type |
|
|
Светлоклеточный рак/Clear-cell carcinoma |
589 (89,9 %) |
|
Несветлоклеточный рак/Non-clear-carcinoma |
66 (10,1 %) |
|
Степень дифференцировки/Differentiation grade |
|
|
G1 |
115 (17,6 %) |
|
G2 |
241 (36,8 %) |
|
G3 |
299 (45,6 %) |
|
Тип метастазов/Metastasis type |
|
|
Метахронные/Metachronous |
273 (41,7 %) |
|
Синхронные/Synchronous |
382 (58,3 %) |
|
Количество метастазов/Number of metastases |
|
|
Солитарные/Solitary |
7 (1,1 %) |
|
Единичные/Single |
137 (20,9 %) |
|
Множественные/Multiple |
511 (78 %) |
|
Прогноз по IMDC/IMDC prognosis |
|
|
Благоприятный/Favorable |
136 (20,8 %) |
|
Промежуточный/Intermediate |
241 (36,8 %) |
|
Неблагоприятный/Poor |
278 (42,4 %) |
|
Метастазы/Metastases |
|
|
Кости/Bones |
197 (30,1 %) |
|
Печень/Liver |
92 (14,0 %) |
|
Лимфатические узлы/Lymph nodes |
236 (36,0 %) |
|
Головной мозг/Brain |
35 (5,3 %) |
|
Предыдущая нефрэктомия/Prior nephrectomy |
602 (91,9 %) |
|
Лучевая терапия/Radiation therapy |
70 (10,7 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Характеристика больных (n=655)
patient characteristics (n=655)
применяются различные препараты [9], однако показатели выживаемости при метастатическом ПКР (мПКР) составляли всего около 20 % [3].
Ранее были созданы клинические модели рака почки, примером которой является модель риска Международного консорциума базы данных по метастатическому раку почки (IMDC) [10], но в эру иммуноонкологических препаратов данная модель несколько устарела. В нашей работе проанализированы прогностические факторы и их влияние на показатели выживаемости у больных с метастазами рака почки в легкие.
Цель исследования – анализ влияния прогностических факторов на показатели общей выживаемости у больных с метастазами рака почки в легкие.
Материал и методы
Проведен ретроспективный анализ данных 655 пациентов с метастазами в легкие ПКР, которым проведено комбинированное лечение на базе Городской онкологической больницы № 62 г. Москвы и Городского онкологического диспансера г. Санкт-Петербурга с 2006 по 2022 г. Из 655 больных 241 (36,8 %) пациент отнесен к группе промежуточного прогноза, 278 (42,4 %) – к группе неблагоприятного прогноза. Средний возраст больных составил 60,5 года (28–95 лет). Изучены клиникоморфологические факторы прогноза, влияющие на показатели выживаемости у больных с метастазами ПКР в легкие (табл. 1). Все пациенты получали системную противоопухолевую терапию.
Данные пациентов были консолидированы в виде электронных таблиц и анализировались с помощью программы Statistica 12 for Windows. Продолжительность жизни рассчитывали от даты диагноза до даты последнего наблюдения или смерти. Общую выживаемость (ОВ) оценивали по методу Каплана– Майера, различия выживаемости определяли с помощью log-rank теста; для исключения факторов, не имеющих самостоятельной прогностической значимости, использовали регрессионный анализ Cox. Проводился анализ показателей ОВ у больных с метастазами ПКР в легкие в зависимости от пола, возраста, ECOG-статуса, локализации первичной опухоли и гистологического варианта, степени градации по Fuhrman, группы прогноза по IMDC, типа, количества и локализации метастазов, проведения нефрэктомии и метастазэктомии.
Результаты
Светлоклеточный почечно-клеточный рак выявлен у 589 (89 %) больных. Благоприятный, промежуточный и неблагоприятный прогноз имели 136 (20,8 %), 241 (36,8 %) и 278 (42,4 %) пациентов соответственно. Синхронные метастазы установлены у 273 (41,7 %) пациентов; солитарные, единичные и множественные метастазы выявлены у 7 (1,1 %), 137 (20,9 %) и 511 (78 %) больных соответственно.
Показатели 3- и 5-летней ОВ у больных с метастазами ПКР в легкие (n=655) составили 48 % [95 % ДИ 45–53 %] и 27 % [95 % ДИ 23–31 %] соответственно, при этом медиана ОВ составила 34,9 мес [95 % ДИ 30,4–37,4,] (рис. 1). При однофакторном анализе у больных с метастазами рака почки в легкие выявлено, что отрицательное влияние на показатели общей выживаемости оказывали статус по ECOG (p<0,001), гистологический подтип (p<0,001), степень дифференцировки опухоли по Fuhrman (p<0,001), тип и количество метастазов (p<0,001), метастазы в кости и печень (p<0,001), лимфатические узлы (p=0,001), прогноз по IMDC (p<0,001), проведение нефрэктомии и метастазэк-томии (p<0,001) (табл. 2, рис. 2–7).
Медиана ОВ при светлоклеточном и несветлоклеточном мПКР составила 36,8 [33–40,8, 95 %
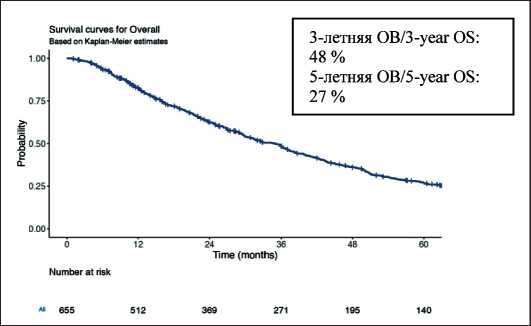
Рис. 1. Общая выживаемость (ОВ) больных с метастазами ПКР в легких (n=655).
Примечание: рисунок выполнен авторами
Fig. 1. Overall survival (OS) of patients with pulmonary metastases from RCC (n=655). Note: created by the authors
ДИ] и 16,3 [95 % ДИ 12–22,7] мес соответственно, а при G1, G2 и G3 – 71,2 [95 % ДИ 63,5–78,2], 38,6 [9 % ДИ 35,9–43,7] и 21,7 [95 % ДИ 18,6–26,3] мес соответственно.
Медиана ОВ при метахронных и синхронных метастазах ПКР составила 41,2 [95 % ДИ 36,3–47,4] и 26,9 [95 % ДИ 23,6–31,3] мес, при солитарных, единичных и множественных метастазах – 109,6 [95 % ДИ 77,6–NA], 61,8 [95 % ДИ 52,3–71,2] и 26,9 [95 % ДИ 23,7–29,8] мес соответственно. Медиана ОВ при ECOG 0, 1, 2, 3 составила 71,2 [95 % ДИ 56,8–109,1], 53 [95 % ДИ 46,3–60,7], 31.9 [95 % ДИ 28–36,4] и 9,7 [95 % ДИ 8,2–12] мес соответственно, при метастазах в кости и без них – 38,6 [95 % ДИ 36–43,5] и 23,4 [95 % ДИ 20,9–29,5] мес соответственно. Медиана ОВ при метастазах ПКР в печень и без них составила 36,3 [95 % ДИ 32,6–40,3] и 20,4 [95 % ДИ 13,1–30,9] мес, а при метастазах в лимфатические узлы и без них – 38,1 [95 % ДИ 34,3–43,2] и 26,9 [95 % ДИ 22,3–31,9] мес соответственно. Медиана ОВ при благоприятном, промежуточном и неблагоприятном прогнозе составила 69,8 [95 % ДИ 62,7–81,4, 95 % ДИ], 40,1 [95 % ДИ 36,8–46,3, 95 % CI] и 18,6 [95 % ДИ 15,9–22,3] мес. Медиана ОВ при выполнении нефрэктомии и без нее составила 36,7 [95 % ДИ 32,9–40,8] и 11 [95 % ДИ 8,2–22,7] мес соответственно, при проведении или отсутствии метастазэктомии – 43 [95 % ДИ 35,7–63,7] и 31,9 [95 % ДИ 28,3–36,4] мес соответственно.
При многофакторном анализе ECOG-статус [HR=3,66 (95 % ДИ 2,10–6,39], гистологический подтип [HR=1,49 (95 % ДИ 1,10–2,01], степень дифференцировки опухоли по Fuhrman [HR=1,54 (95 % ДИ 1,13–2,09], количество метастазов [HR=3,63 (95 % ДИ 1,44–9,16], прогноз по IMDC [HR=2,27 (95 % ДИ 1,63–3,17], а также проведение нефрэктомии [HR=1,87 (95 % ДИ 1,29–2,70] и метастазэктомии [HR=0,69 (95 % ДИ 0,53–0,88] были дополнительными факторами, оказывающими независимое отрицательное влияние на
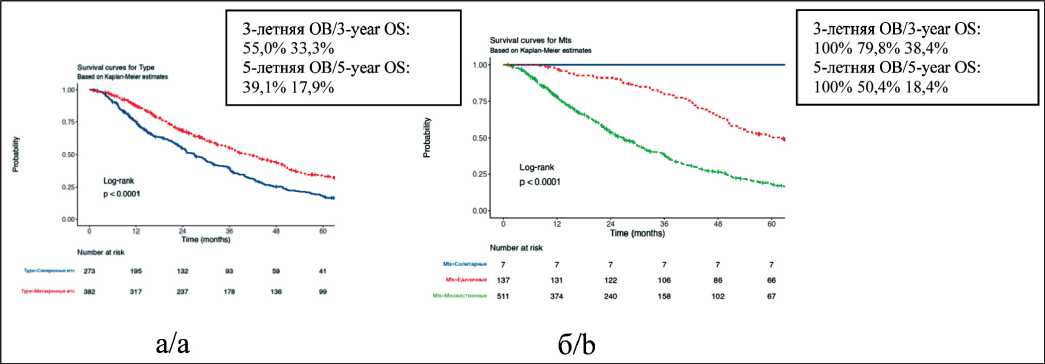
Рис. 2. Общая выживаемость у пациентов с метастазами ПКР в легких в зависимости от гистологического подтипа (а) и дифференцировки опухоли по Fuhrman (б) (n=655). Примечание: рисунок выполнен авторами
Fig. 2. Overall survival in patients with pulmonary metastases from RCC depending on histologic subtype (a) and Fuhrman tumor differentiation (b) (n=655). Note: created by the authors
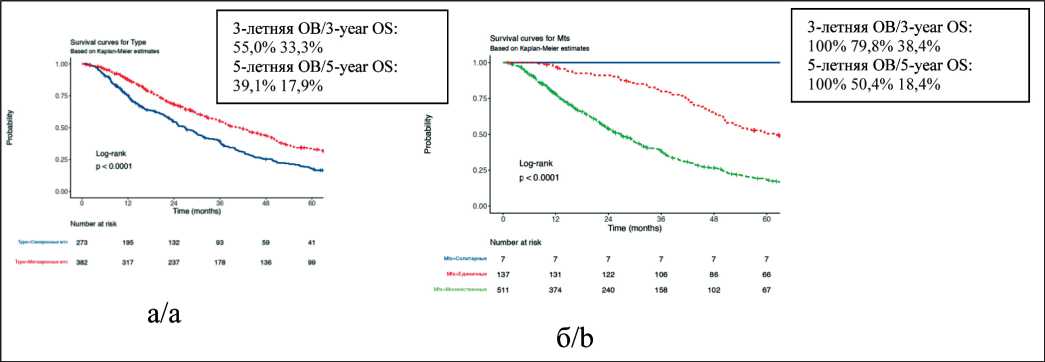
Рис. 3. Общая выживаемость больных с легочными метастазами ПКР (n=655) в зависимости от типа (а) и количества метастазов (б). Примечание: рисунок выполнен авторами
Fig. 3. Overall survival of patients with pulmonary metastases from RCC (n=655) according to type (a) number of metastases (b). Note: created by the authors
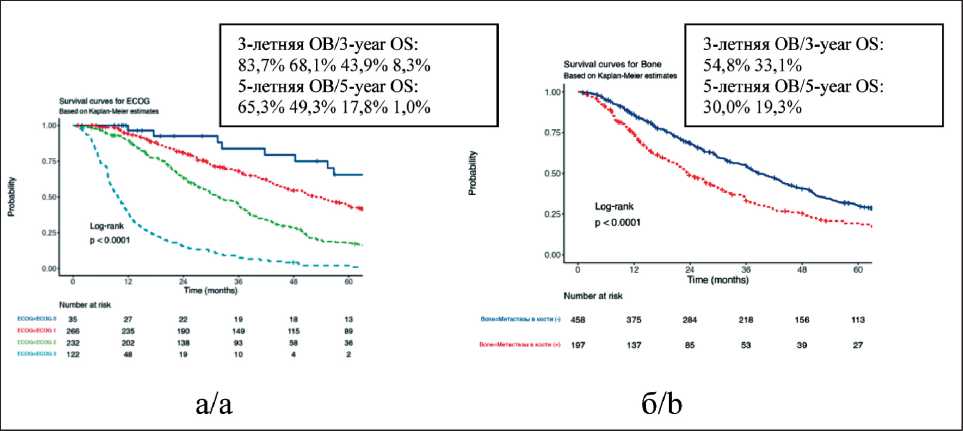
Рис. 4. Общая выживаемость больных с легочными метастазами ПКР (n=655) в зависимости от ECOG-статуса (а), с метастазами в кости и без них (б). Примечание: рисунок выполнен авторами
Fig. 4. Overall survival of patients with pulmonary metastases from RCC (n=655) depending on ECOG status (a), with and without bone metastases (b). Note: created by the authors
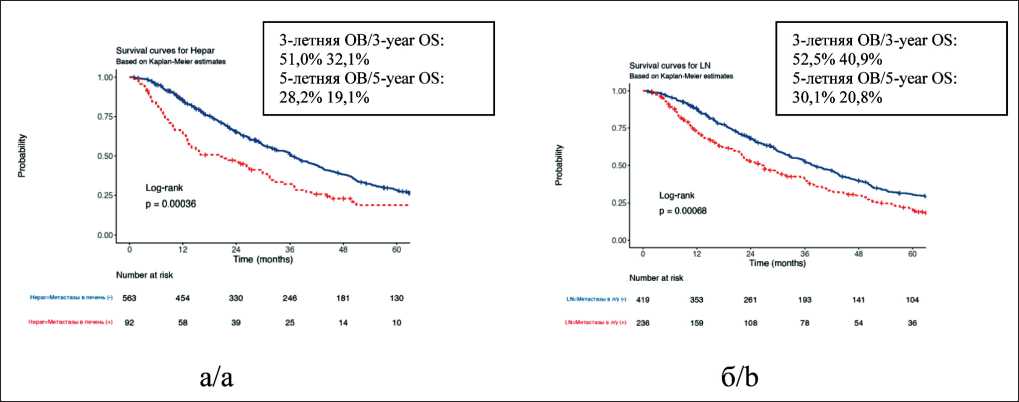
Рис. 5. Общая выживаемость больных с легочными метастазами ПКР (n=655) c метастазами в печень и без них (а), с метастазами в лимфатические узлы и без них (б). Примечание: рисунок выполнен авторами
Fig. 5. Overall survival of patients with pulmonary metastases from RCC (n=655) with and without liver metastases (a), with and without lymph node metastases (b). Note: created by the authors
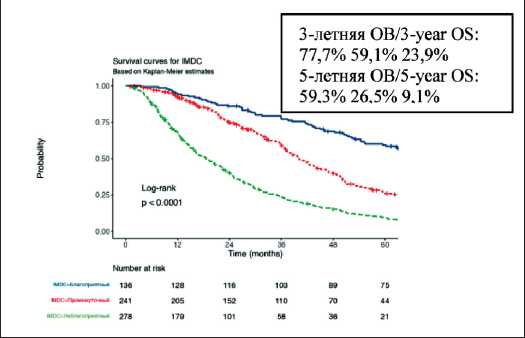
Рис. 6. Общая выживаемость больных с легочными метастазами ПКР (n=655)
в зависимости от прогноза по IMDC.
Примечание: рисунок выполнен авторами Fig. 6. Overall survival of patients with pulmonary metastases from RCC (n=655) according to IMDC prognosis. Note: created by the authors
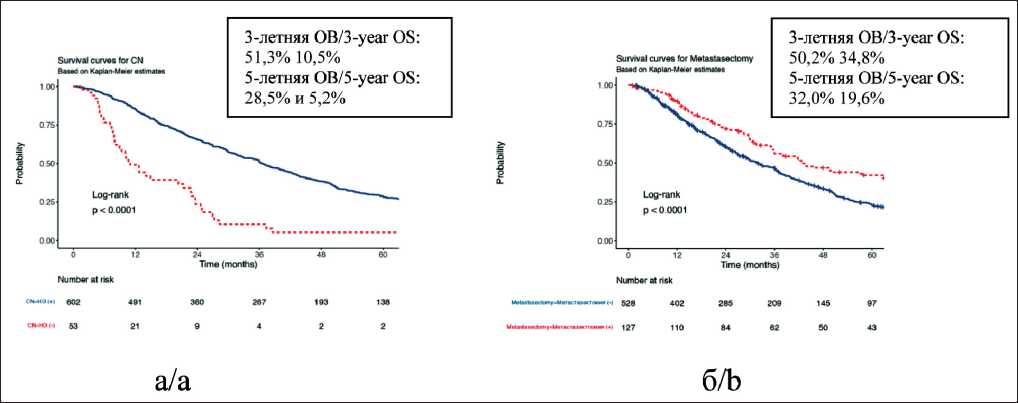
Рис. 7. Общая выживаемость больных с легочными метастазами ПКР (n=655) при нефрэктомии и без нее (а) и метастазэктомии и без нее (б). Примечание: рисунок выполнен авторами
Fig. 7. Overall survival of patients with pulmonary metastases from RCC (n=655) with and without nephrectomy (a) and with and without metastasectomy (b). Note: created by the authors
Таблица 2/table 2
Факторы прогноза общей выживаемости больных с метастазами ПКР в легких (n=655) (однофакторный и многофакторный анализ)*
prognostic factors for overall survival in patients with lungs metastases of Rcc (n=655) (univariative and multivariative tests)*
|
Фактор/Factor |
Количество больных/ Number of patients |
Отношение рисков (95 % ДИ)/ Hazard rario (95 % CI) Однофакторный анализ/ Многофакторный анализ/ Univariate test Multivariate test |
|
|
Статус по шкале ECOG/ECOG status |
|||
|
0 |
35 (5,3 %) |
– |
– |
|
1 |
266 (40,6 %) |
1,38 (0,86–2,22, p=0,181) |
1,14 (0,69–1,87, p=0,610) |
|
2 |
232 (35,5 %) |
2,67 (1,66–4,30, p<0,001) |
1,67 (1,01–2,78, p=0,045) |
|
3 |
122 (18,6 %) |
10,23 (6,22–16,81, p<0,001) |
3,66 (2,10–6,39, p<0,001) |
|
Гистологический вариант/Histological type |
|||
|
Светлоклеточный рак/Clear-cell carcinoma |
589 (89,9 %) |
– |
– |
|
Несветлоклеточный рак/ Non-clear–carcinoma |
66 (10,1 %) |
2,27 (1,73–2,98, p<0,001) |
1,49 (1,10–2,01, p=0,009) |
|
Степень дифференцировки/Differentiation grade |
|||
|
G1 |
115 (17,6 %) |
– |
– |
|
G2 |
241 (36,8 %) |
1,88 (1,45–2,43, p<0,001) |
1,42 (1,06–1,90, p=0,020) |
|
G3 |
299 (45,6 %) |
3,19 (2,48 – 4,10, p<0,001) |
1,54 (1,13 – 2,09, p=0,006) |
|
Тип метастазов/Metastasis type |
|||
|
Метахронные/Metachronous |
273 (41,7 %) |
– |
– |
|
Синхронные/Synchronous |
382 (58,3 %) |
0,65 (0,54 – 0,77, p<0,001 ) |
1,24 (0,99–1,55, p=0,057) |
|
Количество метастазов/Number of metastases |
|||
|
Солитарные/Solitary |
7 (1,1 %) |
– |
– |
|
Единичные/Single |
137 (20,9 %) |
2,21 (0,90–5,43, p=0,084) |
2,45 (0,98–6,13, p=0,055) |
|
Множественные/Multiple |
511 (78 %) |
5,21 (2,14 – 12,70, p<0,001) |
3,63 (1,44 – 9,16, p=0,006) |
|
Метастазы в кости/Bones metastases |
|||
|
Нет/Absent |
458 (69,9 %) |
– |
– |
|
Есть/Present |
197 (30,1 %) |
1,53 (1,27 – 1,85, p<0,001) |
1,00 (0,78–1,28, p=0,975) |
|
Метастазы в печень/Liver metastases |
|||
|
Нет/Absent |
563 (86,0 %) |
– |
– |
|
Есть/Present |
92 (14,0 %) |
1,57 (1,22 – 2,01, p<0,001) |
0,88 (0,64–1,23, p=0,459) |
|
Метастазы в лимфатические узлы/Lymph nodes metastases |
|||
|
Нет/Absent |
419 (64,0 %) |
– |
– |
|
Есть/Present |
236 (36,0 %) |
1,37 (1,14 – 1,64, p=0,001) |
1,02 (0,83–1,25, p=0,833) |
|
Прогноз по IMDC/IMDC prognosis |
|||
|
Благоприятный/Favorable |
136 (20,8 %) |
– |
– |
|
Промежуточный/Intermediate |
241 (36,8 %) |
1,93 (1,50–2,49, p<0,001) |
1,40 (1,05–1,87, p=0,023) |
|
Неблагоприятный/Poor |
278 (42,4 %) |
4,65 (3,62 – 5,97, p<0,001) |
2,27 (1,63 – 3,17, p<0,001) |
|
Нефрэктомия/Prior nephrectomy |
|||
|
Да/Yes |
602 (91,9 %) |
– |
– |
|
Нет/No |
53 (8,1 %) |
2,89 (2,10 – 3,98, p<0,001) |
1,87 (1,29 – 2,70, p=0,001) |
|
Метастазэктомия/ Metastasectomy |
|||
|
Да/Yes |
528 (80,6 %) |
– |
– |
|
Нет/No |
127 (19,4 %) |
2,89 (2,10 – 3,98, p<0,001) |
1,87 (1,29 – 2,70, p=0,001) |
Примечания: * – в таблице приведены только факторы, демонстрирующие прогностическую значимость; таблица составлена авторами.
Notes: * – the table only presents factors with prognostic significance; created by the authors.
показатели ОВ у пациентов с метастазами ПКР в легких (табл. 2).
Обсуждение
Легкие являются наиболее распространенной локализацией метастатического поражения у больных ПКР [4]. Ранняя диагностика метастазов может улучшить эффективность системной терапии и увеличить показатели выживаемости. Наше исследование продемонстрировало, что органные метастазы являются важными факторами, влияющими на ОВ, у 511 (78,0 %) пациентов имелись множественные метастазы. По данным W. Xi et al., метастазы ПКР в двух и более органах наблюдались в 33 % случаев [11]. J. Xue et al. также показали, что 8,76 % пациентов со светлоклеточным ПКР имели отдаленные метастазы на момент постановки диагноза, а у 35 % больных с мПКР были множественные метастазы [4]. По нашим данным, у 273 (41,7 %) больных выявлены синхронные метастазы ПКР. Кроме того, в предыдущих исследованиях также сообщалось об органных метастазах как о предрасполагающих факторах прогноза у пациентов с мПКР. В работе C. Xu et al. [12] костные метастазы, метастазы в печень и головной мозг были важными прогностическими предикторами метастазов в легких при раке почки, что подтверждается данными нашего исследования. В нашей работе только при однофакторном анализе выявлено влияние метастазов в кости, печень и лимфатические узлы на показатели ОВ у больных с ПКР (p<0,001). Также, по нашим данным, степень дифференцировки опухоли по Fuhrman оказывала значимое влияние при одно- и многофакторном анализе на показатели выживаемости у больных мПКР (p<0,001 и р=0,006). Эти прогностические факторы были важными предикторами и при других локализациях метастазов рака почки [1, 4]. Размер первичной опухоли [13], а также псевдокапсула были независимыми предикторами показателей ОВ при мПКР [14]. В нашей работе мы не изучали данные характеристики опухолевого процесса. Важное значение для инвазии и метастазирования имеет также васкуляризация опухоли [15]. Многофакторный анализ, проведенный Z. Lu et al., показал, что гистологический вариант, стадия T и N, раса, наличие нефрэктомии, локализация метастазов и размер опухоли были независимыми факторами риска развития метастазов в легких [16]. В нашей работе при многофакторном анализе гистотип опухоли (p=0,009), количество
Список литературы Анализ показателей выживаемости и оценка факторов прогноза у больных с метастазами рака почки в легкие
- Hua K.C., Hu Y.C. Establishment of predictive model for patients with kidney cancer bone metastasis: a study based on SEER database. Transl Androl Urol. 2020; 9(2): 523-43. https://doi.org/10.21037/tau.2020.01.24.
- Ged Y., Voss M.H. Novel emerging biomarkers to immunotherapy in kidney cancer. Ther Adv Med Oncol. 2021; 13. https://doi.org/10.1177/17588359211059367.
- Chung C. From oxygen sensing to angiogenesis: Targeting the hypoxia signaling pathway in metastatic kidney cancer. Am J Health Syst Pharm. 2020; 77(24): 2064-73. https://doi.org/10.1093/ajhp/zxaa308.
- Xue J., Chen W., Xu W., Xu Z., Li X., Qi F., Wang Z. Patterns of distant metastases in patients with clear cell renal cell carcinoma A population-based analysis. Cancer Med. 2021; 10(1): 173-87. https://doi.org/10.1002/cam4.3596.
- Nishida J., Momoi Y., Miyakuni K., Tamura Y., Takahashi K., Koinuma D., Miyazono K., Ehata S. Epigenetic remodelling shapes inflammatory renal cancer and neutrophil-dependent metastasis. Nat Cell Biol. 2020; 22(4): 465-75. https://doi.org/10.1038/s41556-020-0491-2.
- Zhang G., Zhang L., Sun S., Chen M. Identification of a Novel Defined Immune-Autophagy-Related Gene Signature Associated With Clinical and Prognostic Features of Kidney Renal Clear Cell Carcinoma. Front Mol Biosci. 2021; 8. https://doi.org/10.3389/fmolb.2021.790804.
- Abdel-Rahman O. Clinical correlates and prognostic value of different metastatic sites in metastatic renal cell carcinoma. Future Oncol. 2017; 13(22): 1967-80. https://doi.org/10.2217/fon-2017-0175.
- Lin S., Zheng Y., Qin Z., Hu X., Qi F., Yin R., Xu L., Li X. Surgical intervention in renal cell carcinoma patients with lung and bronchus metastasis is associated with longer survival time: a population-based analysis. Ann Transl Med. 2019; 7(14): 323. https://doi.org/10.21037/atm.2019.06.02.
- Danno T., Iwata S., Niimi F., Honda S., Okada H., Azuma T. Nivolumab and Ipilimumab Combination Immunotherapy for Patients with Metastatic Collecting Duct Carcinoma. Case Rep Urol. 2021. https://doi.org/10.1155/2021/9936330.
- Schulz S., Woerl A.C., Jungmann F., Glasner C., Stenzel P., Strobl S., Fernandez A., Wagner D.C., Haferkamp A., Mildenberger P., Roth W., Foersch S. Multimodal Deep Learning for Prognosis Prediction in Renal Cancer. Front Oncol. 2021; 11. https://doi.org/10.3389/fonc.2021.788740.
- Xi W., Hou Y., Hu X., Xia Y., Jiang S., Wang H., Bai Q., Hou J., Guo J. Prognostic significance of pseudocapsule status in patients with metastatic renal cell carcinoma treated with tyrosine kinase inhibitors. Transl Androl Urol. 2021; 10(11): 4132-41. https://doi.org/10.21037/tau-21-429.
- Xu C., Zhou Q., Liu W., Li W., Dong S., Li W., Xu X., Qiao X., Jiang Y., Chen J., Yin C. Dynamic Predictive Models with Visualized Machine Learning for Assessing the Risk of Lung Metastasis in Kidney Cancer Patients. J Oncol. 2022. https://doi.org/10.1155/2022/5798602.
- Xiao R., Liu C., He W., Ma L. Prognostic Factors and a Nomogram Predicting Overall Survival and Cancer-Specific Survival for Patients with Collecting Duct Renal Cell Carcinoma. Biomed Res Int. 2021. https://doi.org/10.1155/2021/6736008.
- Volpe A., Bollito E., Bozzola C., Di Domenico A., Bertolo R., Zegna L., Duregon E., Boldorini R., Porpiglia F., Terrone C. Classification of Histologic Patterns of Pseudocapsular Invasion in Organ-Confined Renal Cell Carcinoma. Clin Genitourin Cancer. 2016; 14(1): 69-75. https://doi.org/10.1016/j.clgc.2015.07.020.
- Bridgeman V.L., Vermeulen P.B., Foo S., Bilecz A., Daley F., Kostaras E., Nathan M.R., Wan E., Frentzas S., Schweiger T., Hegedus B., Hoetzenecker K., Renyi-Vamos F., Kuczynski E.A., Vasudev N.S., Larkin J., Gore M., Dvorak H.F., Paku S., Kerbel R.S., Dome B., Reynolds A.R. Vessel co-option is common in human lung metastases and mediates resistance to anti-angiogenic therapy in preclinical lung metastasis models. J Pathol. 2017; 241(3): 362-74. https://doi.org/10.1002/path.4845.
- Lu Z., Yang C., He W., Zhou J., Xiang R. Nomogram to predict risk and prognosis of synchronous lung metastasis in renal cell carcinoma: A large cohort analysis. Medicine (Baltimore). 2022; 101(27). https://doi.org/10.1097/MD.0000000000029764.
- Petrozza V., Costantini M., Tito C., Giammusso L.M., Sorrentino V., Cacciotti J., Porta N., Iaiza A., Pastore A.L., Di Carlo A., Simone G., Carbone A., Gallucci M., Fazi F. Emerging role of secreted miR-210-3p as potential biomarker for clear cell Renal Cell Carcinoma metastasis. Cancer Biomark. 2020; 27(2): 181-8. https://doi.org/10.3233/CBM-190242.


