Анализ применения различных видов имплантов при интраокулярном протезировании у собак
Автор: Вахрушева Т.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 5, 2018 года.
Бесплатный доступ
Цель исследования: проведение сравнительной характеристики реакций тканей глаза на различ-ные виды имплантов при интраокулярном проте-зировании у собак, для чего была проведена серия опытов на собаках и белых мышах. Основными задачами исследования являлось изучение реакций мягких тканей брюшной стенки белых мышей на различные виды интраокулярных имплантов с по-следующим их гистологическим исследованием, а также изучение реакций тканей глазного яблока на различные виды интраокулярных имлантов у собак с помощью анализа клинических показате-лей. Для изучения реакции тканей белых мышей на различные виды интраокулярных имплантов был проведен опыт № 1: объектом исследования по-служили белые лабораторные мыши в количестве 12 голов, в возрасте семи месяцев. Для изучения реакций тканей глазного яблока на различные ви-ды интраокулярных имплантов у собак был прове-ден опыт № 2, объектами исследования являлись собаки (6 голов), в возрасте 6 лет, живая масса животных в среднем составляла 8 кг...
Интраокулярное протезиро-вание, интраокулярный имплант, собака, эвисцерация глазного яблока, болезни глаз
Короткий адрес: https://sciup.org/140238076
IDR: 140238076 | УДК: 619:
Текст научной статьи Анализ применения различных видов имплантов при интраокулярном протезировании у собак
Введение. Болезни глаз у мелких домашних животных, в частности собак, являются достаточно распространенной патологией. В 60 % случаев лечение патологий глаз требует оперативного лечения, которое включает удаление пораженного глаз- ного яблока [1–3]. Существует три вида хирургического удаления глаза: энуклеация – операция, при которой полностью удаляется глазное яблоко совместно с третьим веком и большей частью конъюнктивы, также иссекаются края век, глазная щель ушивается; экзентерация – включает энуклеацию в сочетании с удалением экстраокулярных мышц, век, жировой ткани орбиты, третьего века, слёзной железы и всех конъюнктивных тканей, обрезанные края век сшивают; эвисцерация – удаление содержимого глазного яблока с сохранением целостности склеры, которая вместе с прикрепляющимися к ней наружными мышцами глаза используется в дальнейшем в качестве подвижной плотной основы для глазного протеза [4–7]. После проведения эвисцерации глазного яблока у домашних животных, с целью минимизирования эстетических недостатков, ветеринарными специалистами был разработан и успешно внедрен на практике метод косметического восстановления внешнего вида глаза с помощью протезирования. Сущность метода интраокулярного протезирования заключается в имплантировании внутрь глазного яблока, на место удаленных его структур, протеза сферической формы, который после полного заживления операционной раны выполняет функции сохранения нормальной анатомической формы и размеров утраченного глазного яблока; топографически правильное его расположение в орбите и прилегание век, в том числе третьего века, к самому протезу, способствует нормальной работе экстраокуляр-ных мышц и обеспечивает косметический эффект. В результате того, что эвисцерация глазного яблока с последующим интраокулярным протезированием имеет ряд преимуществ перед другими методами, этот метод хирургической операции является одним из самых востребованных в ветеринарной офтальмологии [5, 7].
Для осуществления интраокулярного протезирования применяются разнообразные виды интраокулярных имплантов, отличающиеся различной структурой и свойствами материала, в связи с чем выбор интраокулярного импланта в каждом конкретном случае имеет большое значение. Для протезирования глазного яблока у собак наиболее часто применяются следующие виды имплантов: иинтраокуляр-ный силиконовый протез Dioptrix – из твердого медицинского нетоксичного силикона, изготавливаемый во Франции; интраокулярный силиконовый протез Acrivet – из твердого медицинского нетоксичного силикона, производимый в Германии; тефлоновый интраокулярный имплант, производимый в Российской Федерации, материал которого имеет порозную структуру, что повышает риск развития инфекционного процесса в послеоперационный период [7].
Цель исследования : проведение сравнительной характеристики реакций тканей глаза на различные виды имплантов при интраокулярном протезировании у собак.
Задачи исследования . Для достижения поставленной цели были определены задачи: 1) изучение реакции тканей белых мышей на различные виды интраокулярных имплантов; 2) изучение и проведение сравнительного анализа реакции тканей глазного яблока у собак на различные виды интраокулярных имлантов.
Материалы, объекты и методы исследования . Для изучения реакции тканей белых мышей на различные виды интраокулярных имплантов был проведен опыт № 1: объектом исследования послужили белые лабораторные мыши в количестве 12 голов, в возрасте семи месяцев. Лабораторным животным подкожно, в область левой двуглавой мышцы бедра, с помощью инъекционной иглы были введены фрагменты трех различных видов интраокулярных имплантов, схема опыта представлена в таблице 1.
Схема опыта № 1
Таблица 1
|
Номер опытной группы |
Количество опытных животных, гол. |
Вид интраокулярного импланта |
|
1 |
3 |
Силиконовый интраокулярный имплант Acrivet |
|
2 |
Силиконовый интраокулярный имплант Dioptrix |
|
|
3 |
Тефлоновый интраокулярный имплант |
|
|
4 |
Контроль – без интраокулярных имплантов |
Клинические наблюдения за мышами велись в течение 14 суток. Ежедневно проводилась оценка общего клинического состояния животных и оценка реакции тканей в месте введения фрагмента интраокулярного импланта по следующим параметрам: изменение местной температуры, наличие воспалительной гиперемии, отека и болезненности. Через 14 суток животных подвергли эутанизии с помощью этилового эфира, проводился отбор материалов для гистологического исследования: фрагменты кожи с подкожной клетчаткой и кусочком интраокулярного импланта. Гистологические срезы окрашивали гематоксилином и эозином, микроскопическое исследование проводили на световом микроскопе.
Для изучения реакций тканей глазного яблока на различные виды интраокулярных имплантов у собак был проведен опыт № 2, объектами исследования являлись собаки (6 голов), в возрасте 6 лет, живая масса животных в среднем составляла 8 килограммов. При исследовании показателей биохимического и общего анализа крови отклонений от физиологической нормы выявлено не было. В течение опытного периода животным были проведены хирургические операции методом эвисцерации глазного яблока с последующим интраокулярным протезированием.
Перед хирургической операцией у животных было проведено офтальмологическое обследование здоровых и пораженных глаз, которое включало следующие этапы: биомикроскопия глазного яблока щелевой лампой Heine; прямая офтальмоскопия для исследования глазного дна с помощью офтальмоскопа Welch Allyn; ультразвуковое исследование глазного яблока аппаратом ультразвуковой диагностики Esaiote; измерение внутриглазного давления тонометром Shiots. Для определения количества слезной жидкости проведены тесты Ширмера. Для диагностики целостности эпителия роговицы и конъюнктивы проведена диагностическая окраска 1 % раствором флуоресцеина натрия. Для диагностики остаточной чувствительности сетчатки исследовался Даззл рефлекс с помощью осветителя для эндоскопического оборудования с ксеноновой лампой. В качестве протезов использовались: силиконовые интраокулярные импланты Acrivet и Dioptrix, а также модифицированный имплант из медицинского тефлона (схема опыта представлена в таблице 2).
Таблица 2
|
Номер опытной группы |
Количество животных, гол. |
Вид интраокулярного импланта |
|
1 |
2 |
Силиконовый интраокулярный имплант Acrivet |
|
2 |
Силиконовый интраокулярный имплант Dioptrix |
|
|
3 |
Тефлоновый интраокулярный имплант |
Схема опыта № 2
Исследование реакции тканей на введение интраокулярного импланта осуществлялось следующим образом: первичный клинический осмотр про- водился через 7 суток после хирургической операции, контрольный клинический осмотр проводился на 30-е сутки после операции. Клинический после- операционный осмотр включал следующие этапы: осмотр глазного яблока на наличие выделений; пальпация для выявления воспалительного отека и болевой реакции; осмотр слизистых оболочек глазного яблока на наличие местной воспалительной гиперемии и воспалительного экссудата. Для диагностики заживления роговицы и конъюнктивы проводилась диагностическая окраска 1 % раствором флюоресцина натрия с последующим исследованием в ультрафиолетовых лучах.
Результаты исследования. Анализ результатов опыта № 1 показал следующее: у мышей опытных групп № 1 и 2 на первый день после имплантации фрагментов отмечалось незначительное повышение местной температуры, умеренный воспалительный отек тканей в месте введения и умеренная болезненная реакция, на вторые сутки – развитие воспалительной гиперемии. Через трое суток после операции отмечалась нормализация местной температуры, исчезновение отечности, воспалительной гиперемии и болевой реакции в месте локализации фрагмента импланта.
-
У животных опытной группы № 3, которым был введен фрагмент тефлонового интраокулярного им-
Вестник КрасГАУ. 2018. № 5 планта, при клиническом осмотре были выявлены следующие изменения: после проведения операции отмечалась общая апатия, вялость, сонливость, повышение местной температуры, выраженная воспалительная гиперемия и отек в участке имплантации в радиусе 0,5 см, данные клинические изменения наблюдались в течение 5 суток, болевая реакция при пальпации в месте введения импланта наблюдалась в течение 10 суток.
-
У животных контрольной группы отклонений от физиологической нормы клинических показателей не наблюдалось.
Гистологическое исследование тканей в области введения имплантов у животных опытных групп показало следующее: в месте локализации фрагментов интраокулярных имплантов у мышей опытных групп № 1 и 2 на 14-е сутки после проведения операции отмечался незначительный серозно-воспалительный отек и воспалительная гиперемия, характеризующиеся умеренным скоплением между тканевыми элементами серозного экссудата и инъекцией кровеносных сосудов. Признаков лейкоцитарной инфильтрации, указывающей на развитие выраженного воспаления, не наблюдалось (рис. 1–4).
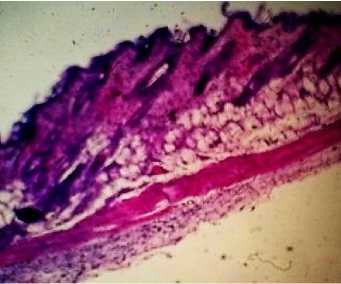
Рис. 1. Кожа и подкожная клетчатка мыши опытной группы № 1: умеренная воспалительная гиперемия (окраска гематоксилином и эозином; ×100)
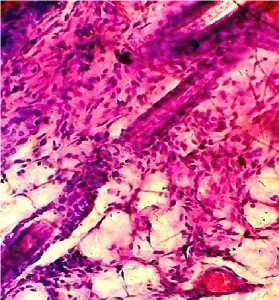
Рис. 2. Кожа и подкожная клетчатка мыши опытной группы № 1: отсутствие лейкоцитарной инфильтрации (окраска гематоксилином и эозином; ×400)
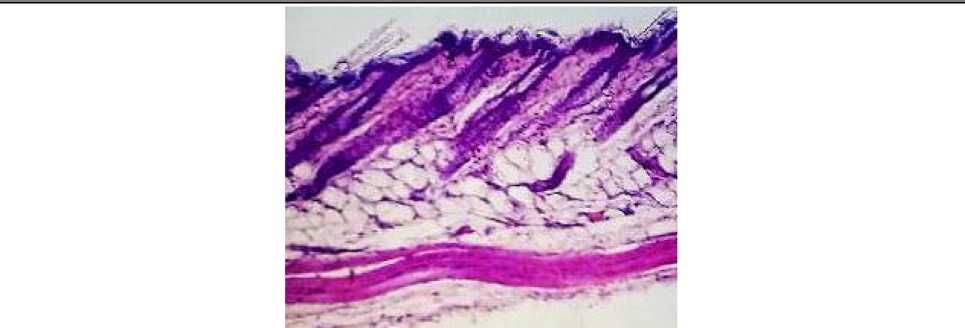
Рис. 3. Кожа и подкожная клетчатка мыши опытной группы № 2: отсутствие воспалительной гиперемии (окраска гематоксилином и эозином; *100)
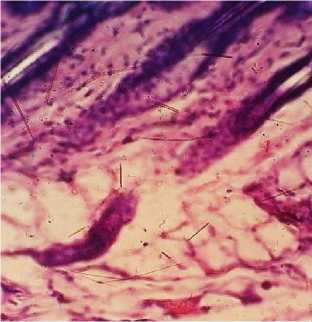
Рис. 4. Кожа и подкожная клетчатка мыши опытной группы № 2: умеренно выраженный серозно-воспалительный отек (окраска гематоксилином и эозином; *400)
При проведении гистологического исследования мягких тканей в области имплантации у животных опытной группы № 3 наблюдалась картина значительно выраженной воспалительной гиперемии, характеризующаяся повышенной инъекцией кровеносных сосудов, а также серозно-воспалительным отеком, проявляющимся в виде скопления серозного экссудата преимущественно в периваскулярных пространствах. Вокруг фрагмента интраокулярного импланта обнаруживалась лейкоцитарная инфильтрация тканей с наличием нейтрофильных и эозинофильных лейкоцитов (рис. 5, 6).
Гистологическое исследование мягких тканей животных контрольной группы показало отсутствие признаков развития патологических процессов, морфология всех структур кожи и подкожной клетчатки соответствовала анатомо-физиологической норме (рис. 7, 8).
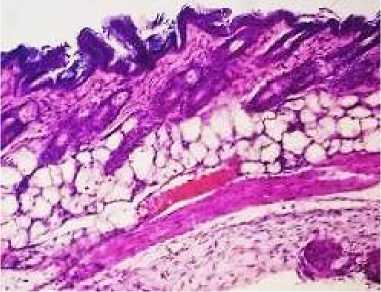
Рис. 5. Кожа и подкожная клетчатка мыши опытной группы № 3: выраженная воспалительная гиперемия (окраска гематоксилином и эозином; *100)
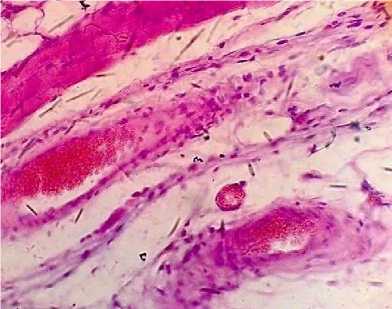
Рис. 6. Кожа и подкожная клетчатка мыши опытной группы № 3: выраженный серозно-воспалительный отек (окраска гематоксилином и эозином; *400)
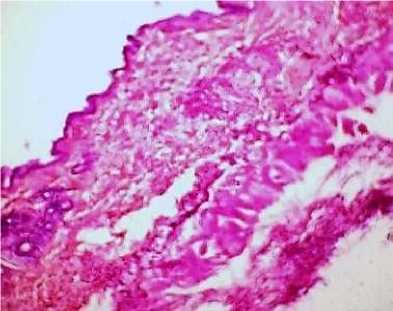
Рис. 7. Кожа и подкожная клетчатка мыши контрольной группы: отсутствие патоморфологических изменений (окраска гематоксилином и эозином; *100)
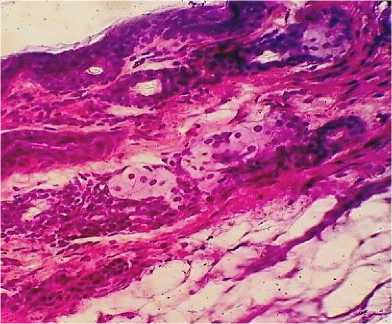
Рис. 8. Кожа и подкожная клетчатка мыши контрольной группы: морфология тканей соответствует анатомо-физиологической норме (окраска гематоксилином и эозином; *400)
Анализ результатов опыта № 2 показал следующее: при проведении клинического обследования у животных были выявлены признаки следующих патологических процессов: терминальная стадия глаукомы – у двух животных, люксация хрусталика в заднюю камеру глаза – у двух животных, отслоение сетчатки – у двух животных. Биохимический, общий анализ крови и определение гемостаза у всех животных, подвергнутых оперативному вмешательству методом эвисцерации с интраокулярным протезированием, находились в пределах физиологической нормы, в результате чего противопоказания к проведению хирургической операции отсутствовали (табл. 3).
Результаты общего и биохимического анализа крови собак
Таблица 3
|
Показатель |
Среднее значение |
Данные исследования |
||
|
Группа 1 |
Группа 2 |
Группа 3 |
||
|
Общий анализ крови |
||||
|
Гематокрит, % |
37–55 |
45–51 |
46–52 |
43–39 |
|
Гемоглобин, г/л |
120–180 |
135–152 |
148–162 |
129–145 |
|
Эритроциты, ×1012/л |
5,6–8,0 |
6,1–7,2 |
6,1–7,6 |
5,8–5,7 |
|
СОЭ, мм/ч |
1–6 |
4 |
3 |
2 |
|
Лейкоциты, ×109/л |
6,0–16,0 |
8,2–11,2 |
7,8–2,1 |
7,1–7,7 |
|
Палочкоядерные нейтрофилы, % |
0–3 |
0 |
0 |
0-2 |
|
Сегментоядерные нейтрофилы, % |
60–70 |
63 |
67 |
63 |
|
Эозинофилы, % |
0–5 |
3 |
1–3 |
1-4 |
|
Моноциты, % |
1–7 |
4 |
3–5 |
3 |
|
Базофилы, % |
Единичные |
– |
– |
– |
|
Лимфоциты, % |
12–30 |
19–21 |
23–25 |
17–18 |
|
Тромбоциты, % |
190–550 |
220–235 |
264–311 |
212 |
|
Биохимический анализ крови |
||||
|
Билирубин, Мкмоль/л |
3,0–13,5 |
12,3–10,7 |
10,6–12,7 |
7,4–10,7 |
|
АСТ, ед/л |
0–42 |
7 |
18 |
7–31 |
|
АЛТ, ед/л |
0–52 |
10–27 |
32–40 |
22 |
|
Общий белок, г/л |
55,1–75,2 |
61,7–64,6 |
64,3–66,1 |
67,3–64,6 |
|
Глюкоза, моль/л |
4,3–7,3 |
6,1–5,1 |
5,6–6,8 |
4,9–5,1 |
|
Исследование гемостаза |
||||
|
Норма |
||||
|
Протромбиновое время, с |
9–18 |
10 |
14 |
10 |
|
Активированное частичное тромбопластиновое время (АЧТВ), с |
10–18 |
14 |
14 |
12 |
Хирургическая операция проводилась под общим наркозом, для местной анестезии глазного яблока были применены следующие новокаиновые блокады: ретробульбарная блокада, блокада подглазничного нерва, проводниковая анестезия субтенонового пространства. Хирургическая операция проводилась в следующей последовательности: 1) рассечение конъюнктивы по экватору глазного яблока – длина разреза 1,5 см; 2) рассечение склеры вдоль экватора глазного яблока – длина разреза 1 см (рис. 9); 3) эвакуация содержимого глазного яблока (стекловидного тела и хрусталика); 4) отделение увеальной оболочки, в том числе радужной оболочки и сетчатки, на протяжении всей внутренней поверхности глазного яблока; промывание полости глазного яблока 0,01 % раствором мирамистина (Miramistin); 5) введение импланта в полость глазного яблока при помощи инжектора TitanSurgica (рис. 10); 6) ушивание склеры скорняжным непрерывным швом нитью моносорб (Monosorb) 5,0; 7) ушивание конъюнктивы узловым швом, кетгут (Catgut) 5,0; формирование тарзорофии на срок до 7 суток для защиты швов от воздействия факторов внешней среды.
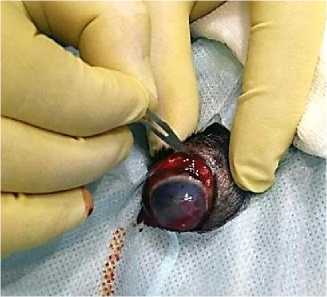
Рис. 9. Рассечение конъюнктивы
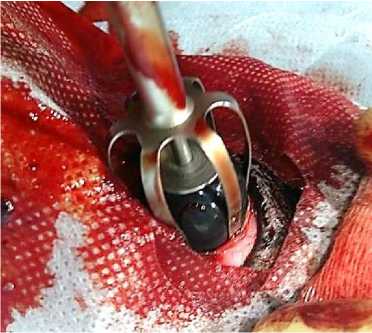
Рис. 10. Введение импланта с помощью инжектора TitanSurgica
В качестве послеоперационного лечения всем животным были назначены следующие терапевтические препараты: в качестве обезболивающего – Амелотекс (Amelotex) (0,1 мл на килограмм живой массы, внутримышечно 1 раз в сутки в течение 5 дней); для местной обработки – 0,05 % раствор хлоргексидина (Chlorhexidinum); антибиотикотерапия – Амоксициллин (Amoxycillinum) (15 % суспензия в дозе 0,1 мл на килограмм живой массы, или подкожно 1 раз в 2 суток, трехкратно). Ношение елизаветинского воротника до момента снятия тарзорафии.
Результаты клинического обследования собак в послеоперационный период показали, что на 7-е сутки после проведения хирургической операции у собак опытных групп № 1 и 2 в области наложения швов в тканях век отмечалась незначительная отечность; на слизистых оболочках – умеренная гиперемия; при пальпации болевая реакция отсутствовала. При диагностике 1 % раствором флуоресцина натрия с последующим исследованием в ультрафиолетовых лучах окрашивание отсутствовало, что являлось показателем физиологической нормы. У животных опытной группы № 3 в области век наблюдались значительно выраженный воспалительный отек и гиперемия, при пальпации отмечалась болевая реакция. При диагностике 1 % раствором флуорес-цина натрия с последующим исследованием в ультрафиолетовых лучах у одной собаки было выявлено отторжение фиброзной оболочки на месте наложенного шва, что характеризовалось наличием характерного зеленого свечения, вследствие чего животному был назначен повторный курс терапии антибиотиками и нестероидными противовоспалительными средствами.
Проведение клинического осмотра животных на 30-е сутки после хирургической операции показало: у животных опытных групп № 1 и 2 веки имели правильную анатомическую форму, состояние мягких тканей соответствовало анатомо-физиологичес кой норме, при пальпации болевая реакция отсутствовала; наблюдалось полное заживление швов. У собак опытной группы № 3 после повторного курса лечения отмечалось общее уменьшение отечности век, воспалительной гиперемии и болевой реакции, а также заживление фиброзной оболочки на месте наложения швов.
Выводы . Результаты проведенного исследования показали, что при введении фрагмента интраокулярных имплантов мышам опытных групп реакция тканей на силиконовые импланты Acrivet и Dioptrix характеризовалась развитием незначительной воспалительной гиперемии и отсутствием лейкоцитарной инфильтрации тканей брюшной стенки. Реакция тканей на фрагмент интраокулярного импланта из тефлона сопровождалась выраженными признаками воспаления – воспалительной гиперемией и лейкоцитарной инфильтрацией. При имплантации силиконовых интраокулярных имплантов Dioptrix и Acrivet собакам реакция тканей глаза характеризовалась наличием незначительной воспалительной реакции, отсутствием отторжения фиброзной оболочки и быстрыми темпами заживления в течение 7 суток. При применении модифицированного интраокулярного импланта из медицинского тефлона отмечалось развитие серозно-воспалительной реакции тканей, признаков отторжения фиброзной оболочки и медленное заживление в течение 30 суток после назначения курса дополнительного лечения.
На основе проведенного сравнительного анализа можно сделать следующее заключение: наиболее эффективным и безопасным для интраокулярного протезирования у собак является применение имплантов из медицинского силикона. Применение модифицированного импланта из медицинского тефлона является нецелесообразным, вследствие значительного количества послеоперационных осложнений и длительных сроков реабилитации.
Список литературы Анализ применения различных видов имплантов при интраокулярном протезировании у собак
- Риис Р. Офтальмология мелких домашних животных. -М.: Аквариум-Принт, 2006. -280 с.
- Практикум по частной хирургии: учеб. пособие/под общ. ред. Б.С. Семёнова, А.А. Стекольникова. -СПб.: Лань, 2013 -536 с.
- Кирк Р., Бонагура Д. Современный курс ветеренарной медицины. -М.: Аквариум, 2014. -Т. 2. -С. 1128-1190.
- Петер Ф., Кон Б. Болезни собак. -М.: Аквариум-Принт, 2001. -1360 с.
- Семёнов Б.С., Стекольников А.А., Высоцкий Д.И. Ветеринарная хирургия, ортопедия и офтальмология. -М.: Колос, 2003. -376 с.
- Petersen-Jones S., Crispin S. BSAVA Manual of Small Animal Ophthalmology second edition. -2002. -305 р.
- Базанова Е.Ю. Сравнительная оценка применения интраокулярных имплантов при интраокулярном протезировании у собак//Студенче-ская наука -взгляд в будущее: мат-лы ХII Все-рос. студ. науч. конф./Краснояр. гос. аграр. ун-т. -Красноярск, 2017. -С. 20-22.


