Анализ процессов взаимодействия между медным расплавом и сопряженными неметаллическими фазами в системах Cu-Fe-O, Cu-Fe-Si-0
Автор: Трофимов Е.А., Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (65), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156532
IDR: 147156532 | УДК: 669.33+
Текст обзорной статьи Анализ процессов взаимодействия между медным расплавом и сопряженными неметаллическими фазами в системах Cu-Fe-O, Cu-Fe-Si-0
Оксидные соединения системы Cu-Fe-О образуются в процессе пирометаллургического производства меди из высокожелезистого сырья. В ряде случаев они осложняют технологию процесса, являются причиной химических потерь извлекаемого металла. Термодинамический анализ равновесия медный расплав - шлак в системе Cu-Fe-0 интересен как для изучения процесса пирометаллургического рафинирования, так и для оптимизации раскисления меди железом и комплексными раскислителями, содержащими железо [1-7].
Данные о составе шлака, находящегося в равновесии с медным расплавом, показывают, что в шлаке могут присутствовать ионы Fe3+ и Fe2+ [3-5]. В то же время исключается возможность нахождения медного расплава в равновесии с твердым гематитом (Fe2O3). При низких концентрациях железа возможно образование делафоссита (CuFeO2). Согласно расчетам И.С. Куликова [8], образование окиси железа менее вероятно, чем CuFeO2. Отмечается, что образование этого химического соединения возможно лишь в случае разбавленных его растворов в закиси меди при следовых (порядка 10^ %) концентрациях железа в меди.
В соответствии с этим, в системе Cu-Fe-О процессы взаимодействия железа с кислородом в жидкой меди могут быть описаны следующими химическими реакциями, температурные зависимости констант равновесия для которых приводятся в табл. 1:
/Си2О/ =2Си+[О];
(Cu2O) = 2Си + [О];
/CuFeO2/ = Си + [Fe] + 2[О];
/Ре3О4/= 3[Fe] + 4[О];
(Fe2O3) = 2[Fe] + 3[О];
/FeO/ = [Fe] + [О];
(FeO)= [Fe] + [О].
Для описания системы Cu-Fe-Si-O необходимо учитывать и реакции:
/SiO2/=[Si]+2[O] и
(SiO2)=[Si]+2[O], используемые для описания равновесий в системе Cu-Si-O.
Наконец, в системе Cu-Fe-Si-O помимо соединений характерных для тройных систем Cu-Fe-O и Cu-Si-O может присутствовать фаялит (Fe2SiO4), равновесие которого с медным расплавом можно описать следующим уравнением реакции:
/Fe2SiO4/ = 2 [Fe] + [Si] + 4 [О],
Таблица 1
Температурные зависимости констант равновесия реакций взаимодействия компонентов медного расплава
|
№ |
Процесс |
Константа равновесия, К; a - активность, мае. % |
Температурная зависимость, 1g К |
|
1 |
(Cu2O)=2Cu+[O] |
~ а1°] ^(Си2О) |
-3140/7+2,250 |
|
2 |
/Cu2O/=2Cu+[O] |
К = °[о] |
-6500/7+4,468 |
|
3 |
/CuFeO2/ = = Cu+[Fe]+2[O] |
К ~ ^[Oj^Fe] |
-22562/7+10,208 |
|
4 |
/Fe3OV = 3[Fe] + 4[O] |
4 3 А - |
-50048/7+20,984 |
|
5 |
(Fe2O3)= 2[Fe] + 3[O] |
= ^Fe^o/ a(Fe,O3) |
-33258/7+13,915 |
|
6 |
/FeO/= [Fe] + [0] |
-12389/7+5,084 |
|
|
7 |
(FeO) = [Fe] + [0] |
^ ~ “[Oj^fFe] ^ a(FeO) |
-10706/7+4,054 |
|
8 |
(SiO2)=[Si]+2[O] |
^ = <3[o]^si] ^(SiO,) |
-37780/7+10,524 |
|
9 |
/SiO2/=[Si]+2[O] |
K = "[Oj^Si] |
-38183/7+10,726 |
|
10 |
/Fe2SiO4/ = 2[Fe]+[Si]+4[O] |
r^- 4 2 A - ^oj^siJ^Fe] |
-64854/7+21,996 |
* Работа выполнена при финансовой поддержке гранта МК-4255.2006.3.
выражение для константы равновесия которой, приведенное в табл. 1, получено на основе данных, приведенных в работе [9] об образовании этого силиката из соответствующих оксидов, и зависимостей констант равновесия реакций образования оксидов железа и кремния из компонентов медного расплава.
Для расчета активностей компонентов неметаллического расплава в настоящей работе использовалось приближение теории совершенных ионных расплавов. При этом принималось, что в составе неметаллического расплава системы Cu-Fe-0 присутствуют ионы Cu+, Fe2+, Fe3+, О2" , а в расплаве системы Cu-Fe-Si-0 - Cu+, Fe2+, Fe3+, О2' и SiO42”.
Для расчета активностей компонентов медного расплава применялись параметры взаимодействия первого порядка, температурные зависимости которых приведены в табл. 2.
Результаты расчета координат ПРКМ для системы Cu-Fe-0 представлены на рис. 1.
В области I заданы составы металла, равновесного с оксидным расплавом, в области II медь находится в равновесии с Си2О, в области Ш - с CuFeO2, в области IV - с Ре3О4, в области V - с FeO.
Также на рис. 1 отражены результаты наших экспериментов. С целью проверки адекватности приведенного расчета медно-железный сплав (2 %) расплавляли в алундовом тигле. Насыщение расплава кислородом проводили путем добавления Си2О (х.ч.) и продувкой воздухом до появления окисной пленки. Затем тигель закрывался и выдерживался при постоянной температуре, в атмосфере аргона в течение 2 часов.
После этого образец закаливали в воде, окисную пленку растворяли в соляной кислоте и гравиметрически анализировали на содержание железа, меди и кислорода [10]. Содержание железа в металле определяли фотометрически [11], а кислорода - металлографически, изучением нетравленого шлифа в поляризованном свете [12]. Три опыта проводились при температуре 1100 °C, а один при Т= 1225 °C.
Составы оксидных фаз практически соответствуют расчетным. Так, в составе оксидной пленки первой плавки (точка 1) отношение числа атомов железа к числу атомов кислорода составило 0,98; содержание меди в оксидной фазе менее 0,3 %. Таким образом, можно считать, что в равновесии с ме-
Таблица2
Температурные зависимости параметров взаимодействия
|
Температурная зависимость |
Температурная зависимость |
Температурная зависимость |
|||
|
^0° |
-630/7+0,327 |
esi еО |
-4870/7+2,654 |
-8523 / 7 + 4,644 |
|
|
159/7 |
е0 |
-500/7 |
-170/7 |
||
|
4= |
-209/Г+0,138 |
< |
0 |
< |
0 |
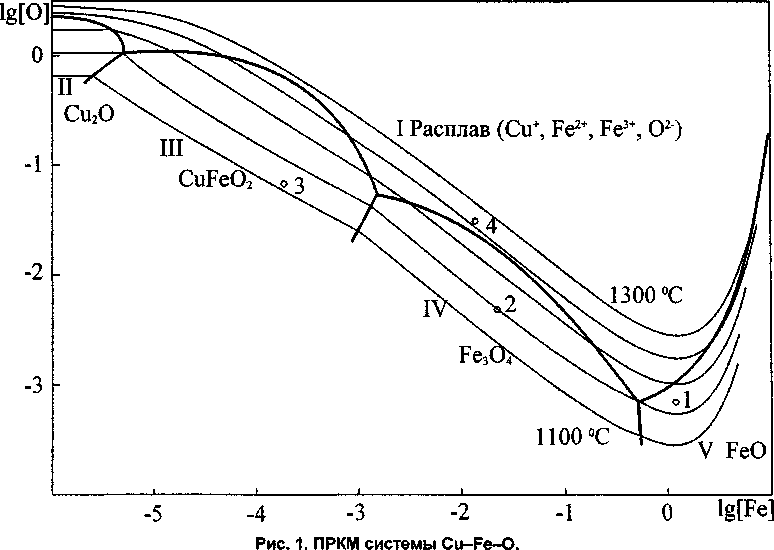
Экспериментальные данные настоящей работы: 1, 2, 3 -1100 °C; 4 -1225 °C
таллом, состав которого соответствует точке 1, находится вюстит. Во втором опыте (точка 2) в равновесии с металлом находится магнетит (меди менее 1 %). В третьем - делафоссит (Си - 26,6 ат. %, Fe -25 ат. %, О - 48,4 ат. %). В четвертом опыте состав равновесной оксидной фазы соответствует составу шлака, представляющего собой расплав Си2О, Fe2O3 и FeO (Си - 9,1 ат. %, Fe - 44,3 ат. %, О - 46,6 ат. %).
Рис. 2 отражает результаты расчета координат ПРКМ для системы Cu-Fe-Si-O при 1250 °C. На этом рисунке можно видеть, что в равновесии с металлом могут находиться четыре различные оксидные фазы. В области I - заданы составы металла равновесного с оксидным расплавом, включающим ионы, Cu+, Fe2+, Fe3+, О2" и SiO42; в области II металл сосуществует с твердым SiO2; в области III металл сосуществует с делафосситом, и в области IV металл сосуществует с вюститом.
относящиеся к ней, составляют основу шлаков медеплавильного производства, которые в значительной степени определяют состав полученной анодной меди.
Известно, что в реальных шлаках железо содержится, главным образом, в двухвалентной форме [2-5]. Результаты исследований показывают, что двухвалентное железо преобладает в шлаке при относительно высоком его содержании в металле и низкой концентрации кислорода (результаты наших работ в этом совпадают с оценкой И.С. Куликова, приведенной в работе [8]).
В расчетах фазовых равновесий зачастую пренебрегают возможностью существования в шлаке трехвалентного железа [13]. Считают, что железо находится только в виде Fe2+. В результате расчет равновесного содержания железа в металле проводят с использованием константы равновесия реак-
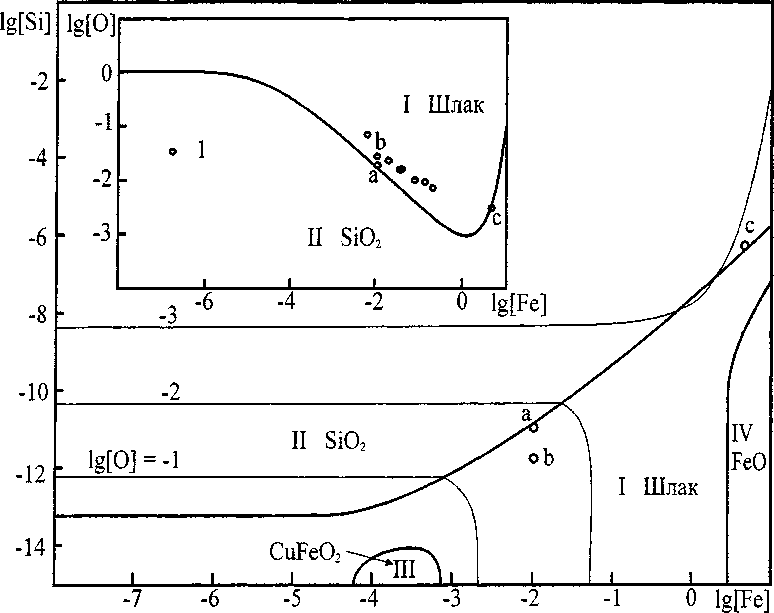
Рис. 2. ПРКМ системы Cu-Si-Fe-О при Т = 1250 °C.
1 - экспериментальные данные Т.А. Багровой и др. [3]
На этом же рисунке отражены экспериментальные данные работы Багровой и др. [3], в которой исследовался шлаковый расплав, находящийся в равновесии с твердым оксидом кремния при данной температуре. Видно, что данные этой работы в целом соответствуют границе между областями I и II.
Диаграммы системы Cu-Fe-Si-O и, в частности, ПРКМ этой системы представляют значительный интерес для практики, поскольку вещества, ции образования только оксида двухвалентного железа, что не вполне корректно.
На рис. 3 представлены результаты расчета изменения катионного состава в шлаке равновесном с медным расплавом и твердым SiO2, в зависимости от содержания железа в меди, для системы Cu-Si-Fe-O при Т = 1250 °C. Такой вид кривых (для концентраций железа в металле свыше 0,01 мае. %), качественно подтверждается данными работы [3].
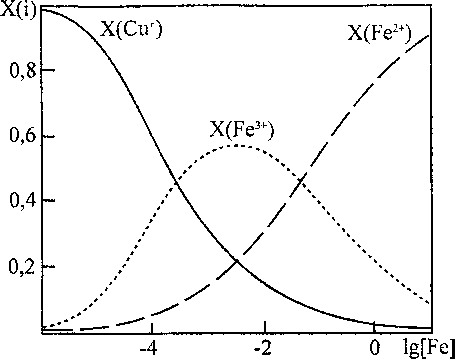
Рис. 3. Изменения катионного состава в шлаке равновесном с медным расплавом и твердым SiO2, в зависимости от содержания железа в меди, для системы Cu-Si-Fe-О при Т = 1250 °C
Выводы
Посредством термодинамических расчетов построены поверхности растворимости компонентов в металле (ПРКМ) для систем Cu-Fe-O и Cu-Fe-Si-O. Результаты расчета сопоставлены с экспериментальными данными. Разработанные ПРКМ могут быть использованы для анализа технологических процессов, связанных с взаимодействием кислорода, железа и кремния в медном расплаве.
Список литературы Анализ процессов взаимодействия между медным расплавом и сопряженными неметаллическими фазами в системах Cu-Fe-O, Cu-Fe-Si-0
- Reddy R.G., Acholonu C.C. Activity coefficient of CuO0.5 in alumina saturated iron silicate slags//Met. Trans. -1984. -V. B.15. -№ 6.-P. 345.
- Исследование растворимости меди и никеля в насыщенных SiO2 окелезосиликатных шлаках/Л.И. Дитятковский, А.Д. Васкевич, А.В. Ванюков и др.//Изв. вузов. Цв. мет. -1983. -№ 5.-С. 16.
- Активности компонентов в системе медь-шлак-газовая фаза/Т.А. Багрова, В.В. Галущенко, В.А. Каплан, А.В. Тарасов//Цветные металлы. -1991. -№3.-С. 10.
- Термодинамическое исследование системы Fe-Cu-S-O-Si/В.Я. Зайцев, B.C. Цесарский, Б.М. Сагимбеков, А.С. Сафронов//Научные труды МИСиС. -1978.-№111.-С.34.
- Растворимость меди в железосиликатных расплавах: Исследования процессов получения тяжелых цветных и благородных металлов/В.Я. Зайцев, B.C. Цесарский, А.Д. Васкевич и др.//Научные труды МИСиС. -1976. -№ 91. -С. 17.
- Takeda Y., Yazawa A. Activity of FeO and solubility of copper in NaO0.5-SiO2-FeO slag saturated with solid iron//Trans. Jap. Inst. Metals. -1988. -29. -№3.-P. 244-235.
- Sanchez M., Acuna J., Luraschi A.A. Experimental study of slag-metal equilibria in the system Cu-Fe-0//2nd Int. Symp. met. slags and fluxes, fall extract. and process met. meet., lake tahoe, nev„ nov. 11-14, 1984'. Warrendale, Pa, 1984, 755-775.
- Куликов И.С. Раскисление металлов. -M.: Металлургия, 1975. -504 с.
- Туркдоган Е.Т. Физическая химия высокотемпературных процессов. -М.: Металлургия, 1985. -344 с.
- Филиппова Н.А. Фазовый анализ руд и продуктов их переработки. -М.: Химия, 1975. -280 с.
- Медь. Методы анализа. -М.: Издательство стандартов, 1986. -80 с.
- Беккерт М., Клемм X. -Справочник по металлографическому травлению. -М.: Металлургия, 1979. -336 с.
- Расчет равновесного распределения кислорода и железа между медью и шлаковым расплавом/О.Б. Ранский, И.Ф. Худяков, В.И. Антоненко и др.//Цветная металлургия. -1989. -№ 6. -С. 33-37.


