Анализ результатов хирургического лечения рака почки с опухолевым тромбозом нижней полой вены: опыт одного центра
Автор: Гамаюнов С.В., Ашимов Э.А., Киселев Н.М., Каров В.А., Спиридонов М.А., Заречнова Н.В., Загайнов В.Е.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Цель исследования - анализ непосредственных результатов хирургического лечения рака почки (РП) с опухолевым тромбозом нижней полой вены (ОТНПВ) на базе одного онкологического центра. материал и методы. Ретроспективный анализ данных 25 пациентов, получивших хирургическое лечение по поводу локального и распространенного РП с ОТНПВ с 01.2021 по 12.2022 г. Медиана наблюдения за пациентами составила 21 мес (ДИ 95 % 14,3-33 мес). Больные распределены на группы согласно классификации Mayo по ОТНПВ: I тип - 8, II тип - 8, III тип - 9 пациентов.
Рак почки, тромбоз нижней полой вены, резекция нижней полой вены, хирургическое лечение
Короткий адрес: https://sciup.org/140307926
IDR: 140307926 | УДК: 616.61-006.6-089:616.146-005.6 | DOI: 10.21294/1814-4861-2024-23-5-93-102
Текст научной статьи Анализ результатов хирургического лечения рака почки с опухолевым тромбозом нижней полой вены: опыт одного центра
Актуальность
Заболеваемость раком почки (РП) ежегодно растет, за последнее десятилетие прирост во всем мире составил почти 10 %. За 2020 г., согласно данным GLOBOCAN, впервые диагностировано 431 288 случаев РП, при этом смертность от заболевания составила 179 368 случаев [1]. Хотя рак почки составляет 2 % от всех злокачественных новообразований, в развитых странах этот показатель вдвое больше [2].
Одним из осложнений РП является образование опухолевых тромбов в просвете почечных вен и нижней полой вены (НПВ). Приблизительно у 4–10 % пациентов с РП на момент постановки диагноза диагностируется опухолевый тромбоз НПВ, у 1–3 % пациентов апикальная часть тромба локализуется в правом предсердии [3]. Нефрэктомия с тромбэктомией из НПВ является оптимальной опцией лечения пациентов с локализованной формой РП и может рассматриваться при наличии отдаленных метастатических очагов [4–7].
Пятилетняя общая выживаемость у пациентов после радикальной операции составляет 40–65 %, тогда как у пациентов без хирургического лечения, получавших только лекарственную терапию, одногодичная общая выживаемость не превышает 29 % [8]. Как правило, лекарственная терапия у пациентов с опухолевым тромбозом нижней полой вены (ОТНПВ) лимитирована риском развития жизнеугрожающих осложнений [9]. В настоящее время опция хирургического лечения ОТНПВ сопряжена с высокой частотой послеоперационных осложнений и летальности [10]. Согласно статистическим данным крупных онкологических клиник, послеоперационная летальность в среднем варьируется от 2 до 10 %, а в некоторых клиниках она достигала 40 % [11–14]. В связи с этим хирургическое лечение РП с ОТНПВ является прерогативой крупных высокопотоковых онкологических центров.
Целью исследования явился анализ непосредственных результатов хирургического лечения рака почки (РП) с опухолевым тромбозом нижней полой вены (ОТНПВ) на базе одного онкологического центра.
Материал и методы
Ретроспективный анализ 25 медицинских карт стационарных пациентов с диагнозом РП с ОТНПВ за период с января 2021 г. по декабрь 2022 г., получивших хирургическое лечение в условиях ГАУЗ НО НИИКО НОКОД, г. Нижний Новгород, Россия. Критерии включения: возраст пациентов 18–85 лет включительно, гистологический тип опухоли (светлоклеточный, хромофобный, папиллярный), наличие ОТНПВ.
Клинико-морфологическая характеристика пациентов отражена в таблице. Медиана возраста составила 66 лет – в диапазоне от 34 до 82 лет. В группе превалировали женщины – 64 %. Медиана индекса массы тела – 27,1 кг/м2 (в диапазоне от 15,7 до 41,3 кг/м2). Индекс коморбидности по Charlson 4,9 ± 1,9. В основной группе пациентов выявлена артериальная гипертензия различной степени – 20 (80 %) и сахарный диабет 2-го типа – 5 (20 %), а у 10 (40 %) пациентов диагностировано варикозное
Таблица/table
Клинико-морфологическая характеристика пациентов, результаты хирургического лечения Clinical and morphological characteristics of patients, results of surgical treatment
|
Всего/ Total |
Уровень тромба по |
Mayo/Blood clot level by Mayo |
|||
|
Параметры/Parameters |
I |
II |
III |
p-value |
|
|
Количество пациентов/Number of patients |
25 |
8 |
8 |
9 |
|
|
Мужской/Male Пол/Gender |
9 (36 %) |
2 (22,2 %) |
2 (22,2 %) |
5 (55,6 %) |
0,311 |
|
Женский/Female |
16 (64 %) |
6 (37,5 %) |
6 (37,5 %) |
4 (25 %) |
|
|
Возраст, лет/Age, years |
66 (34–82) |
68,5 (57–82) |
63 (54–72) |
63 (34–77) |
0,172 |
|
ИМТ, кг/м2/BMI (body mass index), kg/m2 |
27,1 (15,7–41,5) |
25,5 (19,8–34,4) |
29,4 (26,0– 41,5) |
22,4 (15,7–36,7) |
0,084 |
|
Размер опухоли, см/Tumor size,cm |
10 (4–20) |
8 (4–11) |
11,5 (7–20) |
13 (5–18) |
0,0311 |
|
Локализация опухоли/ Справа/Right |
17 (68 %) |
5 (29,4 %) |
5 (29,4 %) |
7 (41,2 %) |
0,734 |
|
Localization of the tumor Слева/Left |
8 (32 %) |
3 (37,5 %) |
3 (37,5 %) |
2 (25,0 %) |
|
|
Послеоперационный койко-день/ Postoperative days |
6 (4–23) |
6,5 (4–13) |
6,5 (4 –18) |
6 (5–23) |
0,978 |
|
Кровопотеря, мл/Volume of blood lost, ml |
600 (250–1700) |
350 (250–600) |
600 (400–800) |
800 (300–1700) |
0,0031 |
|
Кол-во гемотрансфузий эр. массы, пакет/ Number of hemotransfusion RBC, units of blood |
16 |
0 |
4 (25 %) |
12 (75 %) |
0,0061 |
|
Время операции, мин/Surgery times, min |
205 (75–360) |
162 (75–230) |
210 (170–360) |
230 (170–300) |
0,0141 |
|
Светлоклеточный/ Clear cell |
20 (80 %) |
6 (30 %) |
8 (40 %) |
6 (30 %) |
|
|
Гистотип опухоли/ Папиллярный/ Histological type of tumor Papillary |
3 (12 %) |
1 (33,3 %) |
0 |
3 (66,7 %) |
0,505 |
|
Хромофобный/ Chromophobe |
2 (8 %) |
1 (50 %) |
0 |
1 (50 %) |
|
|
I |
2 (8 %) |
1 (50 %) |
0 |
1 (50 %) |
|
|
Степень дифференцировки/ II |
14 (56 %) |
6 (42,8 %) |
4 (28,6 %) |
4 (28,6 %) |
0,679 |
|
Fuhrman grade by Fuhrman III |
4 (16 %) |
0 |
2 (50 %) |
2 (50 %) |
|
|
IV |
5 (20 %) |
1 (20 %) |
2 (40 %) |
2 (40 %) |
|
|
Позитивный край резекции R1/ Positive surgical margin R1 |
3 (12 %) |
0 |
1 (33,4 %) |
2 (66,6 %) |
0,331 |
|
Инвазия в стенку НПВ/ Inferior vena сava invasion |
4 (16 %) |
0 |
1 (25 %) |
3 (75 %) |
0,0431 |
|
pN1 |
9 (36 %) |
2 (22,2 %) |
5 (55,6 %) |
2 (22,2 %) |
0,150 |
|
Отдаленные метастазы/Distant metastases |
7 (28 %) |
1 (14,3 %) |
3 (42,9 %) |
3 (42,9 %) |
0,487 |
|
Послеоперационные Всего/Total |
7 (28 %) |
||||
|
осложнения IIIa–IIIb |
4 |
0 |
1 (25 %) |
3 (75 %) |
|
|
по Clavien–Dindo/ IV Postoperative complications by Clavien–Dindo V |
2 1 |
0 0 |
1 (50 %) 0 |
1 (50 %) 1 (100 %) |
0,153 |
Примечания: 1 – различия статистически значимы (p<0,05); таблица составлена авторами.
Notes: 1 – statistically significant (p<0.05); created by the authors.
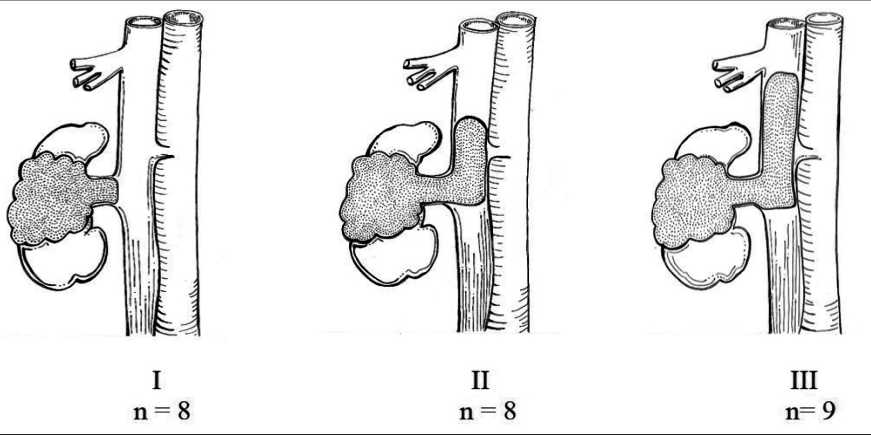
Рис. 1. Уровень опухолевого тромбоза нижней полой вены по классификации Мауо. Примечание: рисунок выполнен авторами Fig. 1. Inferior vena cave thrombus extension classified by Mayo. Note: created by the authors
расширение вен нижних конечной без признаков воспаления и тромбоза.
Всем пациентам в рамках предоперационного обследования выполнена мультиспиральная компьютерная томография органов грудной клетки, брюшной полости и забрюшинного пространства с внутривенным контрастированием, по данным которой был определен уровень ОТНПВ согласно классификации Mayo [15]. Распределение пациентов по классификации Mayo представлено на рис. 1. Патологоанатомическое стадирование pTNM проводилось в соответствии с системой UICC TNM classification (8th edition) [16]. У 7 (28 %) пациентов выявлены отдаленные метастазы РП: у 3 – в отдаленные лимфатические узлы (забрюшинные, внутригрудные), у 3 – в легкие (в количестве не более 5), у 1 – в надпочечник. Пациенты с синхронным метастатическим процессом РП с ОТНПВ в один из органов-мишеней включались в исследование при функционально сохранном состоянии ECOG 0–1 и с хорошим прогнозом по модели IMDC – в послеоперационном периоде они имели перспективу быть кандидатами на лекарственную противоопухолевую терапию.
Операция выполнялась в одних руках без смены оперирующего хирурга. Хирургическое вмешательство проводилось в зависимости от уровня ОТНПВ. Предоперационная эмболизация почечной артерии не выполнялась. Перед проведением резекционного вмешательства выполнялась мобилизация по Cattell–Braasch, дополненная мобилизацией печени по Langenbuch в группе Mayo II–III, с полным контролем супрагепатического сегмента НПВ трасдиафрагмальным доступом, инфрагепатического и инфраренального отдела НПВ. Резекция, тромбэктомия из НПВ и реконструкция выполнялись в условиях тотальной сосудистой изоляции, без применения кава-кавального шунтирования, аутогемотрасфузии системой Cellsaver и без использования аппарата искусственного кровообращения. После этапа реконструкции удалялся препарат, единым комплексом (en-bloc). С целью оценки гемодинамических показателей всем пациентам интараоперационно выполнялось ультразвуковое триплексное исследование НПВ и почечных сосудов.
Все операции выполнялись в условиях ингаляционной анестезии. Во время операции и в течение не менее 12 ч после нее контроль гемодинамики осуществлялся с использованием инвазивного мониторинга АД посредствам катетеризации а. radialis. Инфузионная программа формировалась индивидуально для каждого пациента и имела задачей поддержание следующих целевых параметров: АДср более 65 мм рт. ст., вариабельность пульсового давления 10 %, диурез не менее 0,5 мл/кг×ч, а-v pCO2 не более 6 мм рт. ст., гемоглобин не менее 80 г/л, гематокрит не менее 30 %, Sc-vO2 65–75 %. В послеоперационном периоде всем пациентам каждые 12 ч с целью оценки волемии проводился PLR тест. В структуре инфузионной программы основное место занимали полиионные сбалансированные кристаллоиды, эритроцитная масса – для коррекции анемии, синтетические коллоидные препараты не использовались, при необходимости поддержания онкотического давления использовался 10 % раствор альбумина.
Анализ данных, систематизация полученной информации и визуализация осуществлялись в электронных таблицах Microsoft Office Excel 2019. Статистический анализ проводился с использованием программного обеспечения IBM® SPSS Statistics v.26. Для оценки соответствия нормальному распределению количественных показателей использовался критерий Шапиро–Уилка, а также показатели асимметрии и эксцесса. Количественные показатели описывались при помощи значений медианы (Me) с указанием минимальных и максимальных значений (min-max) вместо квартилей Q1-Q3. Номинальные данные описывались с указанием абсолютных значений и процентных долей. При сравнении нескольких выборок ко-
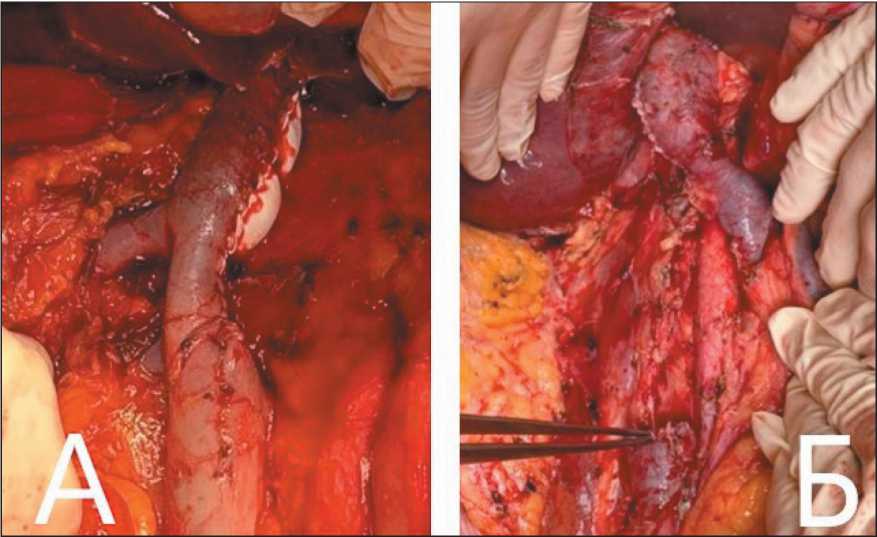
Рис. 2. Интраоперационный вид резецированной нижней полой вены: А – левосторонняя нефрэктомия с тромбэктомией, тангециальной резекцией нижней полой вены и реконструкцией PTFE-графтом; Б – правосторонняя нефрэктомия с экстирпацией и тромбэктомией из нижней полой вены. Примечание: фотографии выполнены авторами
Fig. 2. Intraoperative view of the resected inferior vena cava: А – left nephrectomy with thrombectomy, tangential resection of the inferior vena cava and reconstruction with a PTFE graft; Б – right nephrectomy with extirpation and thrombectomy from the inferior vena cava. Note: created by the authors личественных данных использовался критерий Краскела–Уоллиса. При обнаружении статистически значимых различий между группами дополнительно проводился парный анализ при помощи критерия Данна. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона. Достоверными различия считались при p<0,05. Выживаемость пациентов оценивалась путем построения кривой по методу Каплана–Майера.
Результаты
После предоперационной подготовки всем пациентам выполнено оперативное вмешательство, в основном в объеме нефрэктомии справа – в 17 (68 %) случаях. Медиана размера опухоли была 10 см – в диапазоне от 4 до 20 см, значимо отличался размер опухоли в зависимости от уровня тромба и превалировала в группе Mayo III (p=0,031). Резекция НПВ: тангенциальная выполнена 20 (80 %), циркулярная – 3 (12 %) и экстирпация НПВ – 2 (8 %) пациентам. В 3 случаях использован политетрафторэтиленовый протез (PTFE): в 1 случае – при тангенциальной резекции полуокружности НПВ (1800) в виде заплаты, в 2 случаях – при циркулярной резекции с диастазом более 3 см в виде сосудистого протеза PTFE с кольцами (рис. 2).
Медиана продолжительности операции составила 205 мин – в диапазоне от 100 до 360 мин. Медиана интраоперационной кровопотери – 600 мл (от 250 до 1700 мл). Гемотрансфузия эритроцитарной взвесью в послеоперационном периоде выполнялась в 8 (32 %) случаях. Суммарно использовано 16 пакетов эритроцитарной массы: Mayo II – 4, Mayo III – 12. Значимые различия получены при оценке показателей кровопотери (p=0,003), количества гемотрансфузий эритроцитарной взвеси (p=0,006), времени оперативного вмешательства (p=0,014) и превалировали в группе Mayo III. Медиана продолжительности пребывания в стационаре не отличались в подгруппах (p=0,978) и составила 6 койко-дней – в диапазоне от 4 до 20 дней в общей группе. Частота значимых послеоперационных осложнений составила 28 %, распределение по классам Clavien–Dindo: III – 4, IV – 2, V – 1. При групповом анализе выявлено увеличение частоты осложнений III–V класса у пациентов с Mayo III, однако значимых различий не получено (p=0,153). Наиболее частым осложнением было острое повреждение почек. Двум (8 %) пациентам потребовалась повторная операция. Один пациент умер от сепсиса, что составило 4 % 30-дневной послеоперационной летальности.
Преимущественной гистологической формой РП был светлоклеточный почечно-клеточный рак – 20 (80 %) случаев. Оценена степень дифференцировки РП по Fuhrman: G1 – 2 (8 %), G2 – 14 (56 %), G3 – 4 (16 %), G4 – 5 (20 %). У 9 (36 %) пациентов при гистологическом исследовании послеоперационного материала выявлены метастазы в регионарных лимфатических узлах. Истинная инвазия в стенку НПВ подтверждена у 4 (16 %) пациентов, значимо превалировала в группе Mayo III (p= 0,043). R1-резекции выполнены в 3 (12 %) случаях по краю роста опухоли в забрюшинную клетчатку. Противоопухолевую лекарственную терапию после хирургического вмешательства получили 6 из 7 пациентов с отдаленными метастазами, одному больному с метастатическим поражением ипсилатерального надпочечника, который был удален во время хирургического вмешательства, адъювантная терапия не назначалась.
Медиана наблюдения за пациентами составила 21 мес (ДИ 95 % 14,3–33 мес). Одногодичная общая выживаемость составила 92 %. Медиана общей выживаемости при построении кривой Kaplan–Meier не достигнута (рис. 3).
Обсуждение
Наличие опухолевого тромба в венах, поражение регионарных лимфатических узлов и отдаленные метастазы являются ключевыми факторами для определения стадии РП по классификации TNM 8-й редакции [16]. В соответствии с действующими клиническими рекомендация-
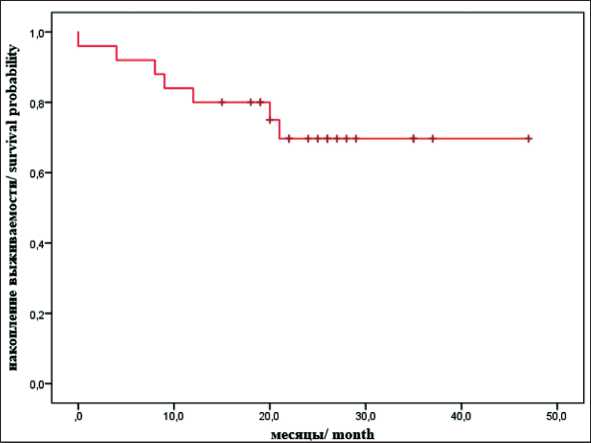
Рис. 3. Кривая общей выживаемости по Каплану–Майеру. Примечание: рисунок выполнен авторами Fig. 3. Kaplan–Meier overall survival curve. Note: created by the authors
ми Министерства здравоохранения Российской Федерации ранние формы ПКР (Т1–2N0M0) являются показанием для хирургического лечения при условии функциональной операбельности пациента. Местнораспространенные опухоли (Т3–4N1M0) являются показанием к расширенному хирургическому лечению при необходимости с резекцией соседних структур, тромбэктомией и аорто-кавальной лимфодиссекцией. Наибольший интерес и дискуссии в плане тактики лечения вызывают случаи РП с опухолевым тромбом в НПВ и наличием отдаленных метастазов. Актуальность исследований в данном направлении определяется значительным увеличением эффективности современной лекарственной терапии, что позволило рассматривать данную когорту пациентов на хирургическое лечение [17]. Первая успешная нефрэктомия с тромбэктомией из НПВ выполнена в 1913 г. [18]. Спустя годы данная хирургическая манипуляция стала безопасным и эффективным методом лечения РП ОТНПВ, однако технические сложности и частота послеоперационных осложнений остаются актуальной темой обсуждений.
В нашем исследовании мы провели анализ данных 25 пациентов с 2021 по 2022 г. с диагнозом РП с ОТНПВ, ниже уровня диафрагмы (по классификации Mayo I–III). При этом каждая группа была практически равной. Тип 0 и IV по Mayo не включены в исследование ввиду того, что уровень тромбоза Mayo 0 не отличается по хирургической технике от стандартной нефрэктомии и не требует манипуляций с НПВ, а уровень IV Mayo требует вмешательства не только на НПВ, но и на сердце с применением искусственного кровообращения.
Нефрэктомия с тромбэктомией из НПВ представляет собой сложную хирургическую операцию с элементами сосудистых реконструкций, особенно при большом объеме опухолевой массы и высоком уровне опухолевого тромба. Техника хирургического вмешательства зависит от краниальной распространенности тромба НПВ [12, 14, 15]. Подпеченочный тромб НПВ (тип I–II) можно безопасно удалить путем сосудистой изоляции ретропеченочного сегмента НПВ. С другой стороны, тромб, распространяющийся на правое предсердие, требует обязательного широкого торакоабдоминального доступа с искусственным кровообращением.
Предыдущее многоцентровое исследование с участием 2 147 пациентов из 22 учреждений США и Европы продемонстрировало 34 % послеоперационных осложнений: 13 % были отнесены к III–V классу по Clavien–Dindo. Смертность составила 2 % в течение 30 дней, а высокий уровень опухолевого тромба был связан с увеличением частоты осложнений (p=0,03) [19]. В нашей серии пациентов размер опухолевой массы, интраоперационная кровопотеря, количество гемотрансфузий, время оперативного вмешательства и частота истинной инвазии в стенку НПВ возрастали в зависимости от уровня тромбоза и были статистически значимо выше у пациентов в группе Mayo III (p<0,01). При этом прямо пропорционально увеличивалась частота осложнений класса III–V по Clavien–Dindo. В группе Mayo III – 57,1 % от общего числа тяжелых осложнений, однако статистической достоверности не получено.
По данным различных авторов, 30-дневная летальность при подобых операциях варьирует от 1,5 % до 10 %. Послеоперационная летальность в зависимости от уровня опухолевого тромба составляет 18, 20, 26 и 47 % для I, II, III, и IV типа по Mayo соответственно [20–22]. В нашей когорте пациентов 30-дневная летальность составила 4 %, что сопоставимо с литературными данными.
Предложены различные методы уменьшения интраоперационной кровопотери и периоперационных осложнений, и самый большой интерес и дискуссию вызывает вопрос предоперационной эмболизации почечных артерий (ЭПА) [20, 23]. ЭПА обычно выполняется в день либо накануне операции, и зачастую перекрытием притока крови к почке, уменьшается интраоперационная кровопотеря, объем опухолевой массы [24]. Исследование Кливлендской клиники продемонстрировало значительный риск осложнений и послеоперационной летальности у пациентов после ЭПА (HR 5,5, р=0,03), что было также показано в метаанализе авторов из Нью-Джерси [25, 26]. Однако недавнее исследование G. Tang et al. подтвердило снижение интраоперационной кровопотери и трансфузий у пациентов с ЭПА (p<0,03) [27]. Примечательно, что пациенты из исследования клиники Кливленда имели высокий уровень опухолевых тромбов (Mayo III–IV) по сравнению с исследованием G. Tang et al. В нашей серии предоперационная ЭПА не проводилась.
Литературные данные и наши результаты подтверждают, что радикальная нефрэктомия с тромбэктомией из НПВ является эффективной хирургической операцией. Отмечена достоверно лучшая выживаемость у пациентов с РП ОТНПВ после хирургического лечения по сравнению с нелечеными. В исследовании клиники Балтимор медиана общей выживаемости была 21,5 мес и 1-годичная общая выживаемость составила 75,5 % [21]. В нашем исследовании 1-годичная общая выживаемость составила 92 % после нефрэктомии с тромбэктомией, что несколько выше данных литературы (29–75,5 %), возможно, это связано с более тщательной селекцией пациентов и невключением пациентов с уровнем тромбоза НПВ Mayo IV.
Интересным представляется вопрос последовательности хирургического и лекарственного этапов лечения. В исследовании EORTC SURTIME показано, что отсроченная циторедуктивная нефрэктомия после индукционной терапии Сунити-нибом у больных группы промежуточного риска приводит к увеличению ОВ (32,4 vs 15,0 мес) [28]. С ингибиторами контрольных точек подобных исследований не было. Но при анализе ответа опухоли при ПКР даже на наиболее эффективных схемах комбинированной терапии (Ипилимумаб + + Ниволумаб) только 34 % пациентов характе- ризуются частичным ответом таргетных очагов [29]. Исследование NAXIVA показало редукцию протяженности тромба у 7/21 пациентов (35 %) после приема Акситиниба в течение 8 нед. Однако все пациенты в данном исследовании характеризовались хорошим статусом ECOG (ECOG-0 – 13, ECOG-1 – 8 пациентов) и преимущественно тромбами низкого уровня: почечная вена Mayo 0 – 4, I уровень по Mayo – 3, II уровень – 9, III уровень – 2 и IV уровень – 2 пациента [30]. Частота объективного ответа у 1/3 пациентов, сложность проведения лекарственной терапии на фоне некупированных осложнений и высокий риск фатальных исходов при некупированной гематурии и флотирующем тромбозе НПВ предполагают на первом этапе выбор в пользу хирургического лечения.
Список литературы Анализ результатов хирургического лечения рака почки с опухолевым тромбозом нижней полой вены: опыт одного центра
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Padala S.A., Barsouk A., Thandra K.C., Saginala K., Mohammed A., Vakiti A., Rawla P., Barsouk A. Epidemiology of Renal Cell Carcinoma. World J Oncol. 2020; 11(3): 79-87. https://doi.org/10.14740/wjon1279.
- Tohi Y., Makita N., Suzuki I., Suzuki R., Kubota M., Sugino Y., Inoue K., Kawakita M. En bloc laparoscopic radical nephrectomy with inferior vena cava thrombectomy: A single-institution experi- ence. Int J Urol. 2019; 26(3): 363-8. https://doi.org/10.1111/iju.13873.
- Powles T., Albiges L., Bex A., Grünwald V., Porta C., Procopio G., Schmidinger M., Suárez C., de Velasco G.; ESMO Guidelines Committee. ESMO Clinical Practice Guideline update on the use of immunotherapy in early stage and advanced renal cell carcinoma. Ann Oncol. 2021; 32(12): 1511-9. https://doi.org/10.1016/j.annonc.2021.09.014.
- Motzer R.J., Jonasch E., Agarwal N., Alva A., Baine M., Beckermann K., Carlo M.I., Choueiri T.K., Costello B.A., Derweesh I.H., Desai A., Ged Y., George S., Gore J.L., Haas N., Hancock S.L., Kapur P., Kyriakopoulos C., Lam E.T., Lara P.N., Lau C., Lewis B., Madoff D.C., Manley B., Michaelson M.D., Mor- tazavi A., Nandagopal L., Plimack E.R., Ponsky L., Ramalingam S., Shuch B., Smith Z.L., Sosman J., Dwyer M.A., Gurski L.A., Motter A. Kidney Cancer, Version 3.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022; 20(1): 71-90. https://doi.org/10.6004/jnccn.2022.0001.
- Singer E.A., Rumble R.B., van Veldhuizen P.J. Management of Metastatic Clear Cell Renal Cell Carcinoma: ASCO Guideline Q&A. JCO Oncol Pract. 2023; 19(3): 127-31. https://doi.org/10.1200/OP.22.00660.
- Mason N.T., Joshi V.B., Adashek J.J., Kim Y., Shah S.S., Schneider A.M., Chadha J., Jim H.S.L., Byrne M.M., Gilbert S.M., Manley B.J., Spiess P.E., Chahoud J. Cost Efectiveness of Treatment Sequences in Advanced Renal Cell Carcinoma. Eur Urol Oncol. 2023; 6(3): 331-8. https://doi.org/10.1016/j.euo.2023.01.011.
- Wang B.S., Li Y.Z., Fang Y.Y., Zhang S.D., Ma L.L. Imaging predictors for assessment of inferior vena cava wall invasion in patients with renal cell carcinoma and inferior vena cava tumor thrombus: a retrospective study. Chin Med J (Engl). 2020; 133(17): 2078-83. https://doi.org/10.1097/CM9.0000000000000828.
- Liu Z., Li L., Hong P., Zhu G., Tang S., Zhao X., Zhang Q., Wang G., He W., Zhang H., Xue H., Cui L., Ge H., Jiang J., Zhang S., Cao F., Yan J., Ma F., Liu C., Ma L., Wang S. A Predictive Model for Tumor Invasion of the Inferior Vena Cava Wall Using Multimodal Imaging in Patients with Renal Cell Carcinoma and Inferior Vena Cava Tumor Thrombus. Biomed Res Int. 2020. https://doi.org/10.1155/2020/9530618.
- Yuan S.M. Surgical treatment of renal cell carcinoma with inferior vena cava tumor thrombus. Surg Today. 2022; 52(8): 1125-33. https://doi.org/10.1007/s00595-021-02429-9.
- Garg H., Psutka S.P., Hakimi A.A., Kim H.L., Mansour A.M., Pruthi D.K., Liss M.A., Wang H., Gaspard C.S., Ramamurthy C., Svatek R.S., Kaushik D. A Decade of Robotic-Assisted Radical Nephrectomy with Inferior Vena Cava Thrombectomy: A System- atic Review and Meta-Analysis of Perioperative Outcomes. J Urol. 2022; 208(3): 542-60. https://doi.org/10.1097/JU.0000000000002829.
- Tabbara M.M., Ciancio G. Surgical treatment of renal cell carcinoma with inferior vena cava tumor thrombus. Surg Today. 2023; 53(7): 855-6. https://doi.org/10.1007/s00595-022-02514-7.
- Berczi A., Flasko T., Szerafn T., Thomas B., Bacso Z., Berczi C. Surgical Management and Outcome of Renal Cell Carcinoma with Inferior Vena Cava Tumor Thrombus. Urol Int. 2017; 99(3): 267-71. https://doi.org/10.1159/000464108.
- Liu Z., Zhang Q., Zhao X., Zhu G., Tang S., Hong P., Ge L., Zhang S., Wang G., Tian X., Zhang H., Liu C., Ma L. Inferior vena cava interruption in renal cell carcinoma with tumor thrombus: surgical strategy and perioperative results. BMC Surg. 2021; 21(1): 402. https://doi.org/10.1186/s12893-021-01400-2.
- Blute M.L., Leibovich B.C., Lohse C.M., Cheville J.C., Zincke H. The Mayo Clinic experience with surgical management, complications and outcome for patients with renal cell carcinoma and venous tumour thrombus. BJU Int. 2004; 94(1): 33-41. https://doi.org/10.1111/j.1464-410X.2004.04897.x.
- Kandori S., Kojima T., Nishiyama H. The updated points of TNM classifcation of urological cancers in the 8th edition of AJCC and UICC. Jpn J Clin Oncol. 2019; 49(5): 421-25. https://doi.org/10.1093/jjco/hyz017.
- Aldin A., Besiroglu B., Adams A., Monsef I., Piechotta V., Tomlinson E., Hornbach C., Dressen N., Goldkuhle M., Maisch P., Dahm P., Heidenreich A., Skoetz N. First-line therapy for adults with advanced renal cell carcinoma: a systematic review and network meta-analysis. Cochrane Database Syst Rev. 2023; 5(5). https://doi.org/10.1002/14651858.CD013798.pub2.
- Berg A.A. Malignant hypernephroma of the kidney, its clinical course and diagnosis, with a description of the author’s method of radical operative cure. Surg Gynecol Obstet. 1913; 17: 463-71.
- Martínez-Salamanca J.I., Linares E., González J., Bertini R., Carballido J.A., Chromecki T., Ciancio G., Daneshmand S., Evans C.P., Gontero P., Haferkamp A., Hohenfellner M., Huang W.C., Koppie T.M., Master V.A., Matloob R., McKiernan J.M., Mlynarczyk C.M., Montorsi F., Nguyen H.G., Novara G., Pahernik S., Palou J., Pruthi R.S., Ramaswamy K., Faba O.R., Russo P., Shariat S.F., Spahn M., Terrone C., Tilki D., Vergho D., Wallen E.M., Xylinas E., Zigeuner R., Libertino J.A. Lessons learned from the International Renal Cell Carcinoma-Venous Thrombus Consortium (IRCC-VTC). Curr Urol Rep. 2014; 15(5): 404. https://doi.org/10.1007/s11934-014-0404-7.
- Haidar G.M., Hicks T.D., El-Sayed H.F., Davies M.G. Treatment options and outcomes for caval thrombectomy and resection for renal cell carcinoma. J Vasc Surg Venous Lymphat Disord. 2017; 5(3): 430-6. https://doi.org/10.1016/j.jvsv.2016.12.011.
- Horynecka Z., Jabłońska B., Kurek A., Lekstan A., Piaszczyński M., Mrowiec S., Oczkowicz G., Król R. Analysis of surgical outcomes in 102 patients with renal cell carcinoma with venous tumor thrombus: A retrospective observational singlecenter study. Medicine (Baltimore). 2022; 101(40). https://doi.org/10.1097/MD.0000000000030808.
- Rehman Z.U., Ather M.H., Aziz W. Surgical Interventions for Renal Cell Carcinoma with Thrombus Extending into the Inferior Vena Cava: A Multidisciplinary Approach. Ann Vasc Dis. 2019; 12(1): 55-59. https://doi.org/10.3400/avd.oa.18-00150.
- Agochukwu N., Shuch B. Clinical management of renal cell carcinoma with venous tumor thrombus. World J Urol. 2014; 32(3): 581-9. https://doi.org/10.1007/s00345-014-1276-7.
- Rooseno G., Hakim L., Djojodimedjo T. A systematic review and meta-analysis on the efcacy of preoperative renal artery embolization prior to radical nephrectomy for renal cell carcinoma: Is it necessary? Arch Ital Urol Androl. 2023; 95(4). https://doi.org/10.4081/aiua.2023.12018.
- Subramanian V.S., Stephenson A.J., Goldfarb D.A., Fergany A.F., Novick A.C., Krishnamurthi V. Utility of preoperative renal artery embolization for management of renal tumors with inferior vena caval thrombi. Urology. 2009; 74(1): 154-9. https://doi.org/10.1016/j.urology.2008.12.084.
- Shanmugasundaram S., Cieslak J.A., Sare A., Chandra V., Shukla P.A., Kumar A. Preoperative embolization of renal cell carcinoma prior to partial nephrectomy: A systematic review and meta-analysis. Clin Imaging. 2021; 76: 205-12. https://doi.org/10.1016/j.clinimag.2021.04.021.
- Tang G., Chen X., Wang J., He W., Niu Z. Adjuvant instant preoperative renal artery embolization facilitates the radical neph- rectomy and thrombectomy in locally advanced renal cancer with venous thrombus: a retrospective study of 54 cases. World J Surg Oncol. 2020; 18(1): 206. https://doi.org/10.1186/s12957-020-01985-7.
- Bex A., Mulders P., Jewett M., Wagstaff J., van Thienen J.V., Blank C.U., van Velthoven R., Del Pilar Laguna M., Wood L., van Melick H.H.E., Aarts M.J., Lattouf J.B., Powles T., de Jong I.J., Rottey S., Tombal B., Marreaud S., Collette S., Collette L., Haanen J. Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncol. 2019; 5(2): 164-70. https://doi.org/10.1001/jamaoncol.2018.5543. Erratum in: JAMA Oncol. 2019; 5(2): 271. https://doi.org/10.1001/jamaoncol.2019.0117.
- Tannir N.M., Albigès L., McDermott D.F., Burotto M., Choueiri T.K., Hammers H.J., Barthélémy P., Plimack E.R., Porta C., George S., Donskov F., Atkins M.B., Gurney H., Kollmannsberger C.K., Grimm M.O., Barrios C., Tomita Y., Castellano D., Grünwald V., Rini B.I., Jiang R., Desilva H., Fedorov V., Lee C.W., Motzer R.J. Nivolumab plus ipilimumab versus sunitinib for frst-line treatment of advanced renal cell carcinoma: extended 8-year follow-up results of efcacy and safety from the phase III CheckMate 214 trial. Ann Oncol. 2024. https://doi.org/10.1016/j.annonc.2024.07.727.
- Stewart G.D., Welsh S.J., Ursprung S., Gallagher F.A., Jones J.O., Shields J., Smith C.G., Mitchell T.J., Warren A.Y., Bex A., Boleti E., Carruthers J., Eisen T., Fife K., Hamid A., Laird A., Leung S., Malik J., Mendichovszky I.A., Mumtaz F., Oades G., Priest A.N., Riddick A.C.P., Venugopal B., Welsh M., Riddle K., Hopcroft L.E.M.; NAXIVA Trial Group; Jones R.J. A Phase II study of neoadjuvant axitinib for reducing the extent of venous tumour thrombus in clear cell renal cell cancer with venous invasion (NAXIVA). Br J Cancer. 2022; 127(6): 1051-60. https://doi.org/10.1038/s41416-022-01883-7.
- Abel E.J., Spiess P.E., Margulis V., Master V.A., Mann M., Zargar-Shoshtari K., Borregales L.D., Sexton W.J., Patil D., Matin S.F., Wood C.G., Karam J.A. Cytoreductive Nephrectomy for Renal Cell Carcinoma with Venous Tumor Thrombus. J Urol. 2017; 198(2): 281-8. https://doi.org/10.1016/j.juro.2017.03.011.
- Manso M., Pacheco-Figueiredo L., Santos-Silva A., Silva J., Silva C., Cruz F. Renal Cell Carcinoma with Venous Thrombus: Should Surgery Be Ofered When Metastasis Is Present at Diagno- sis? Urol Int. 2018; 101(4): 387-90. https://doi.org/10.1159/000493510.
- Kirkali Z., V. Poppel H. A critical analysis of surgery for kidney cancer with vena cava invasion. Eur Urol. 2007; 52(3): 658-62. https://doi.org/10.1016/j.eururo.2007.05.009.


