Анализ результатов эндоскопического билиарного стентирования у пациентов с механической желтухой опухолевого генеза
Автор: Самсонян Э.Х., Емельянов С.И., Луцевич О.Э., Баширов Р.А., Курганов И.А., Светашов В.С., Галахов В.П., Пархоменко К.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 2 (92), 2025 года.
Бесплатный доступ
Цель исследования – проанализировать результаты выполнения эндоскопического ретроградного стентирования желчных протоков у пациентов с механической желтухой опухолевого генеза. Материалы и методы. В период с 2016 по 2022 год проанализированы результаты эндоскопического билиарного стентирования у 64 пациентов с явлениями механической желтухи опухолевого генеза в качестве оказания паллиативной помощи. Результаты. У 17 пациентов (26,6 %) отмечались явления умеренного болевого синдрома. Постманипуляционный острый панкреатит развился у 2 пациентов (3,1 %). Технический успех был достигнут у 58 пациентов (90,6 %). Клинический успех достигнут в 89,1 % случаев. 6 пациентам (9,3 %) было выполнено антеградное чрескожное чреспеченочное дренирование желчных протоков. Частота миграции составила 1,6 % случаев (1 пациент). Через 3 месяца после операции повторное эндоскопическое стентирование желчных протоков выполнено 14 пациентам (21,9 %). У 8 пациентов (12,5 %) была выявлена инкрустация пластикового стента. 4 пациентам (6,2 %) на фоне повторной опухолевой обструкции металлического стента было выполнено эндоскопическое рестентирование желчных протоков металлическим стентом по типу «стент-в-стент». Трехмесячный показатель летальности в исследуемой группе пациентов составил 20,3 %. Заключение. Применение металлических саморасширяющихся стентов позволяет проводить более качественную и длительную декомпрессию желчных протоков. Выполнение эндоскопического ретроградного стентирования желчных протоков целесообразно при наличии дистального опухолевого блока желчных протоков, а при наличии проксимального опухолевого блока более предпочтительно применение методики антеградного чрескожного чреспеченочного дренирования желчных протоков.
Эндоскопическое стентирование желчных протоков, механическая желтуха, металлический билиарный стент, пластиковый билиарный стент, опухолевый билиарный блок
Короткий адрес: https://sciup.org/142244467
IDR: 142244467 | УДК: 616.361-089.819.5 | DOI: 10.17238/2072-3180-2025-2-34-46
Текст научной статьи Анализ результатов эндоскопического билиарного стентирования у пациентов с механической желтухой опухолевого генеза
На сегодняшний день одним из эффективных минимально инвазивных методов декомпрессии желчных протоков при злокачественной опухолевой обструкции, применяемых с паллиативной целью, является дренирование и стентирование желчных протоков, выполняемое либо эндоскопическим ретроградным, либо антеградным чрескожным чреспеченочным способом, способствующее купированию клинических симптомов механической желтухи, восстановлению нормального оттока желчи и улучшению качества жизни паллиативных больных
-
[3 ] . В исследовании Будзинского С.А. и соавторов [4], включающем 272 пациента, которым было проведено эндоскопическое стентирование желчных протоков на фоне злокачественного опухолевого поражения органов панкреатобилиарной зоны, в 85,7 % наблюдений удалось купировать клинические симптомы механической желтухи. Авторами был сделан вывод, что эндоскопическое ретроградное стентирование желчных протоков может являться либо окончательным методом лечения при нерезектабельных опухолях, либо позволяет подготовить пациентов к радикальным оперативным вмешательствам.
В настоящее время с целью декомпрессии желчных протоков применяется два вида стентов: пластиковые стенты и саморасширяющиеся металлические стенты. Пластиковые стенты состоят из полиэтилена или политетрафторэтилена и их стандартные размеры варьируют от 7,0 Fr (2,3 мм) до 11,5 Fr (3,8 мм) [5]. Выбор необходимого диаметра стента соответствует протяжённости и диаметру обструкции, который определяется либо в предоперационном периоде, посредством выполнения ультразвукового исследования (УЗИ), компьютерной томографии (КТ) или магнитно-резонансной холангиопанкреатографии (МРХПГ), либо в интраоперационном периоде с помощью холангиографии.
Одним из осложнений эндоскопического билиарного стентирования с использованием пластикового стента является их частая миграция в проксимальном направлении, которая, согласно данным мировой литературы, ассоциирована с размером стента 7 Fr (2,3 мм) и установкой на срок более трех месяцев. Aditya Kale и соавторы [6] проанализировали частоту возникновения этого осложнения у 1137 пациентов, которым проводилось удаление пластикового стента или повторная эндоскопическая ретроградная холангиопанкреатография. По полученным данным, проксимальная миграция стента была зафиксирована в 6,5 % случаев. В связи с этим, авторы сделали вывод о том, что с целью профилактики этого осложнения, стент необходимо устанавливать таким образом, чтобы размер обструкции соответствовал расстоянию между проксимальными и дистальными «лепестками» стента, причём дистальный край стента устанавливается транспапиллярно.
Наиболее частым осложнением эндоскопического стентирования желчных протоков пластиковым стентом является более быстрая окклюзия его просвета, вследствие малого диаметра стента, образования бактериальной биоплёнки и осаждения билирубината и пальмитатных солей, что приводит к рецидивирующим симптомам обструкции и требует замены стента. Mohamed A. Elsebaey и соавторы [7] проанализировали частоту осложнений, связанных с установкой пластикового стента более чем на 3 месяца. Исследование включало в себя 577 пациентов, которые были разделены на две группы следующим образом: первая группа включала 527 пациентов, которым стенты были удалены в течение 3 месяцев, и вторая группа, включающая 50 пациентов со стентами, извлеченными через один год после их установки. Наиболее частым осложнением у пациентов второй группы была отмечена окклюзия просвета пластикового стента – в 88 % случаев, а у пациентов первой группы – в 3,98 % случаев.
Более длительную проходимость по сравнению с пластиковыми стентами обеспечивают металлические саморасширяю-щиеся стенты, так как они способны расширяться до размера, превышающего размер рабочего канала эндоскопа. Ryo Sugiura и соавторы [8] в многоцентровом исследовании 107 пациентов с нерезектабельным ампулярным раком зоны большого дуоденального сосочка оценили частоту обструкции пластиковых и саморасширяющихся металлических стентов. По данным проведенного анализа результатов, обструкция желчных протоков при применении пластиковых стентов возникала в 88,7 % случаев, а при установке саморасширяющихся металлических стентов — в 27,8 % случаев. Таким образом, авторы сделали вывод о том, что использование пластиковых стентов связано с более высоким риском рецидива обструкции по сравнению с саморасширяющимися металлическими стентами.
При эндоскопическом стентировании опухолевой стриктуры желчных протоков применяются различные по своей структуре покрытия металлические саморасширяющиеся стенты: полностью покрытые (полиуретановое покрытие металла), частично-покрытые (цельноплетенные), непокрытые стенты («голый» металл). В настоящее время в отношении выбора металлического стента при эндоскопическом стентировании остаётся некоторая неопределённость: частота рецидива обструкции, длительность клинического эффекта, частота миграции стента, и возникающие осложнения (острый панкреатит, холецистит и кровотечение). Saleem A. и соавторы [9] провели метаанализ, сравнивающий проходимость покрытых и непокрытых саморасширяющихся металлических стентов, применяемых с целью оказания паллиативной помощи у па- циентов с дистальной злокачественной обструкцией желчных протоков, и включающий в себя исследования с участием 781 пациента и продолжительностью наблюдения 212 дней. По результатам проведенного анализа было выявлено, что покрытые саморасширяющиеся металлические стенты имеют значительные преимущества по сравнению с непокрытыми стентами, а именно: покрытые саморасширяющиеся металлические стенты обеспечивают более длительную проходимость по сравнению с непокрытыми стентами (на 60,56 дней). Однако, авторами было отмечено также, что при установке покрытых металлических стентов риск миграции был в 8,11 раз выше, чем при установке непокрытых металлических стентов.
Несмотря на значительные достижения минимально инвазивных методов декомпрессии желчных протоков при злокачественной обструкции у пациентов, нуждающихся в паллиативной медицинской помощи, ряд вопросов требует дальнейшего исследования и анализа. Несмотря на многолетние дискуссии в мировом сообществе, на сегодняшний день остается спорным вопрос выбора метода дренирования (антеградного чрескожного чреспеченочного или эндоскопического ретроградного) при проксимальном опухолевом блоке. По данным некоторых авторов, эндоскопическое ретроградное стентирование желчных протоков целесообразнее применить при лечении дистального билиарного блока, а чрескожное чреспеченочное дренирование наиболее часто показано при декомпрессии проксимального уровня билиарного блока, в связи с тем, что по сравнению с эндоскопическим ретроградным стентированием, при чреспеченочном доступе место обструкции достигается более прямым и коротким путем, тем самым повышая частоту технического успеха операции и снижая риски развития холангита [10, 11]. Также остается дискутабельным вопрос выбора типа используемого стента в различных клинических ситуациях, с целью улучшения результатов хирургического лечения пациентов с механической желтухой опухолевого генеза и, соответственно, показателей их качества жизни.
Цель исследования. Проанализировать результаты выполнения эндоскопического ретроградного стентирования желчных протоков у пациентов с механической желтухой опухолевого генеза, а также определить оптимальную методику декомпрессии желчных протоков при различных типах опухолевого блока.
Материал и методы
В период с 2016 по 2022 год нами были проанализированы результаты эндоскопического билиарного стентирования у 64 пациентов с клинической картиной механической желтухи опухолевого генеза в качестве оказания паллиативной помощи.
Критериями включения пациентов были следующие: наличие нерезектабельного образования органов гепатоби- лиарной зоны, осложненным клиническими проявлениями механической желтухи; отсутствие противопоказаний к проведению операции; информированное добровольное согласие пациента на проведение операции.
Критерии невключения пациентов были установлены следующие: обнаружение в ходе предоперационного обследования состояний, препятствующих проведению эндоскопического вмешательства (массивное прорастание опухоли головки поджелудочной железы в просвет луковицы двенадцатиперстной кишки с переходом в постбульбарный отдел; различные состояния, препятствующие ретроградному доступу в желчные протоки, IV тип опухолевого поражения по Bismuth-Corlette); наличие противопоказаний к проведению общей анестезии; терминальное состояние пациента.
Критериями исключения из нашего исследования пациентов были приняты следующие: несоблюдение рекомендаций лечащего врача в послеоперационном периоде, отказ пациента от прохождения контрольного обследования.
Перед проведением оперативного вмешательства были изучены основные предоперационные показатели у пациентов (табл. 1).
По данным представленной таблицы, средний возраст пациентов составил 65 лет, при этом самому молодому пациенту было 53 года, а самому возрастному, включенному в наше исследование – 88 лет. В проведенном нами исследовании у большинства пациентов отмечено наличие злокачественного образования головки поджелудочной железы (47 случаев; 73,4 %), в остальных случаях были пациенты с гепатоцеллюлярной карциномой (7 случаев; 10,9 %) и холангиокарциномой (10 случаев; 15,7 %).
Необходимо отметить, что большинство пациентов в исследуемой нами группе имели признаки недостаточной массы тела и белково-энергетической недостаточности, подтвержденные значениями индекса массы тела (ИМТ), который варьировал от 12,3 до 17,1 кг/м2, а также показателями уровня альбумина (от 27 до 31 г/л) и общего белка (от 44 до 57 г/л).
Таблица 1
Основные предоперационные показатели у пациентов
Main preoperative parameters in patients
Table 1
|
Показатель Indicator |
Исследуемая группа (n=64) Study group (n=64) |
|
Мужчины / женщины, n (%) Men / women, n (%) |
37 (57,8) / 27 (42,2) |
|
Возраст, лет Age, years |
61,1±10,4 |
|
Рак головки поджелудочной железы / гепатоцеллюлярная карцинома / холангиокарцинома, n (%) Pancreatic head cancer / hepatocellular carcinoma / cholangiocarcinoma, n (%) |
47 (73,4) / 7 (10,9) / 10 (15,7) |
|
Типы опухолевого поражения по классификации Bismuth-Corlette: Тип I / Тип II / Тип IIIA / Тип IIIB / Тип IV, n (%) Types of tumor lesion according to the Bismuth-Corlette: Type I / Type II / Type IIIA / Type IIIB / Type IV, n (%) |
49 (76,6) / 6 (9,4) / 5 (7,8) / 4 (6,2) / 0 (0) |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
16,4±2,4 |
|
Анемия, n (%) Anemia, n (%) |
59 (94,2) |
|
Альбумин, г/л Albumin, g/l |
30,4±2,1 |
|
Общий белок, г/л Total protein, g/l |
51,2±7,2 |
|
Печеночная энцефалопатия, n (%) Liver encephalopathy, n (%) |
49 (76,6) |
|
Общий билирубин, мкмоль/л Total bilirubin, μmol/l |
143,6±9,3 |
|
Протромбин (по Квику), % Prothrombin (according to Quick), % |
79,4±8,2 |
|
Асцит, n (%) Ascites, n (%) |
41 (64,1) |
|
Длительность клинических симптомов, мес. Duration of clinical symptoms, months |
1,1±0,4 |
|
Протяженность стеноза, см Stenosis extent, cm |
2,4±1,9 |
|
Диаметр оставшегося просвета, мм Diameter of remaining lumen, mm |
1,7±0,4 |
|
Химиотерапия до оперативного вмешательства, n (%) Chemotherapy before surgical intervention, n (%) |
21 (32,9) |
Также необходимо отметить, что у 59 пациентов (94,2 %) была зафиксирована анемия в ходе предоперационного обследования, которая являлась причиной хронической кровопотери на фоне нерезектабельного образования: у 11 больных (18,7 %) наблюдалась легкая степень тяжести, средняя степень тяжести была отмечена у 41 пациентов (69,4 %) и у 7 пациентов (11,9 %) – тяжелая степень тяжести.
Все пациенты были госпитализированы в онкологическое отделение с клинической картиной механической желтухи с соответствующими клиническими проявлениями: желтушность склер и кожных покровов, кожный зуд, потемнение мочи, светлый стул, тошнота, снижение аппетита, слабость. Уровень общего билирубина у пациентов был в пределах 143,6±9,3 мкмоль/л (норма 3,4 – 20,5 мкмоль/л), и данный показатель был повышен за счет прямой фракции билирубина. Продолжительность данных клинических симптомов до момента госпитализации составляла в среднем 1,1±0,4 месяцев. В связи с этим у данной группы пациентов отмечались явления печеночной энцефалопатии (49 случаев, 76,6 %).
В предоперационном периоде, помимо анализа лабораторных показателей крови, пациентам проводилось инструментальное обследование и предоперационная подготовка. Одним из ключевых методов обследования является МРХПГ, по данным которой оценивался диаметр оставшегося просвета желчных протоков и тип опухолевого поражения желчных протоков по классификации Bismuth-Corlette, принятая в 1970-х годах [12]. По данным нашего исследования, I тип опухолевого поражения (опухоль распространяется на желчные протоки без поражения конфлюенса) был зафиксирован у 49 пациентов (76,6 %), со II типом (опухоль распространяется на конфлюенс без вовлечения внутрипеченочных протоков) было 6 пациентов (9,4%), с IIIA типом (поражение общего печеночного протока и правого долевого протока) – 5 пациентов (7,8 %), с IIIB типом (поражение общего печеночного протока и левого долевого протока) – 4 пациента (6,2 %), с IV типом обструкции желчных протоков (опухолевое поражение конфлюенса и обоих долевых протоков) в нашем исследовании не было. Таким образом, протяженность стеноза варьировала в пределах 2,4±1,9 см, а диаметр оставшегося просвета желчных протоков составил 1,7±0,4 мм.
Также пациентам назначалась предоперационная эзофагогастродуоденоскопия (ЭГДС) с целью оценки наличия или отсутствия адекватного сброса желчи в двенадцатиперстную кишку, а также оценки проходимости верхних отделов желудочно-кишечного тракта и доступа к зоне большого дуоденального сосочка для технически возможного проведения эндоскопического ретроградного вмешательства.
На основе данных КТ органов грудной клетки и брюшной полости с внутривенным контрастированием, а также УЗИ органов брюшной полости мы проводили оценку распространенности процесса (наличие или отсутствие отдалённых метастазов), степень распространённости внутригрудной и внутрибрюшной лимфоаденопатии, и, соответственно, стадирование заболевания, а также определялась возмож- ность выполнения радикального хирургического лечения или курсов химиотерапии в послеоперационном периоде.
У 21 пациентов (32,9 %) в анамнезе проводились курсы химиотерапии до проведения хирургического вмешательства.
Эндоскопическое стентирование желчных протоков выполнялось натощак под комбинированным эндотрахеальным наркозом. При выполнении данного оперативного вмешательства применяли дуоденоскоп Olympus TJF-150, с диаметром рабочего канала 3,2 мм.
Оперативная техника. Положение пациента на операционном столе – на левом боку. Первым этапом дуоденоскоп проводили в просвет двенадцатиперстной кишки непосредственно к зоне большого дуоденального сосочка. Через инструментальный канал дуоденоскопа проводили папиллотом с целью канюляции общего желчного протока. После канюляции общего желчного протока, струну-проводник проводник проводили в проксимальные долевые печеночному протоки и выполняли холангиографию с целью определения дальнейшей тактики оперативного вмешательства.
По данным интраоперационной холангиографии (рис. 1), мы оценивали точную локализацию опухолевой стриктуры желчных протоков, протяженность обструкции и определяли тип устанавливаемого стента.
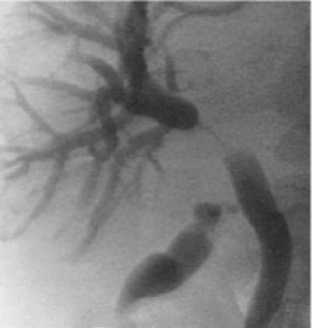
Рис. 1. Интраоперационная холангиграфия (дистальный опухолевый блок тип I по Вismuth-Corlette)
Fig. 1. Intraoperative cholangiography (distal tumor block type I according to Bismuth-Corlette)
Далее через папиллотом, проведенный в инструментальный канал дуоденоскопа, вводили полужесткую струну-проводник длиной 450 см и диаметром 0,035 in (0,89 мм) (рис. 2).
Струну-проводник проводили за зону опухолевого стеноза в проксимальные отделы печеночных протоков, чаще всего в правый или левый долевой печеночный проток. Далее под рентгеноскопическим и эндоскопическим контролем проводили непосредственно установку стента в зависимости от его типа. В большинстве случаев (54 случаев (84,4 %) мы применяли металлический саморасширяющий частично-покрытый или полностью покрытый стент типа Wallflex Billiary. При установке металлического саморасширяющегося стента мы использовали доставочное устройство, состоящее из внутренней трубки, вложенной во внешнюю трубку. Доставочное устройство проводили по струне-проводнику за область опухолевого стеноза (рис. 3).
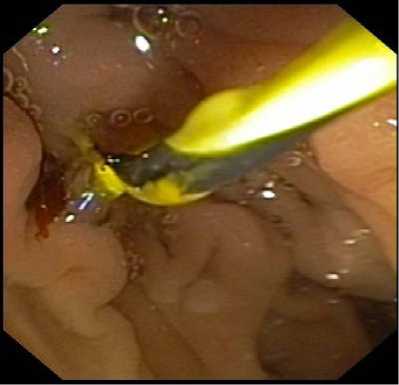
Рис. 2. Проведение полужесткой струны-проводника за зону опухолевого стеноза в проксимальные отделы желчных протоков Fig. 2. Conduction of semi-rigid guide-string behind the zone of tumor stenosis into proximal parts of bile ducts
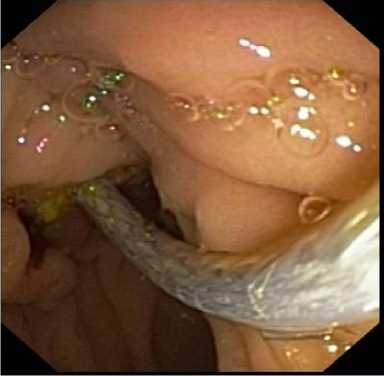
Рис. 3. Проведение доставочного устройства стента по струне-проводнику за зону опухоли в проксимальные отделы желчных протоков Fig. 3. Conduction of the stent delivery device by the guidewire string behind the tumor zone in the proximal parts of bile ducts
Далее позиционировали проксимальный и дистальный края стента на 2–3 см от краев опухоли и выполняли постепенное раскрытие стента. Этап раскрытия стента и его окончательный вид после высвобождения контролировался рентгеноскопически и эндоскопически (рис. 4, рис. 5).
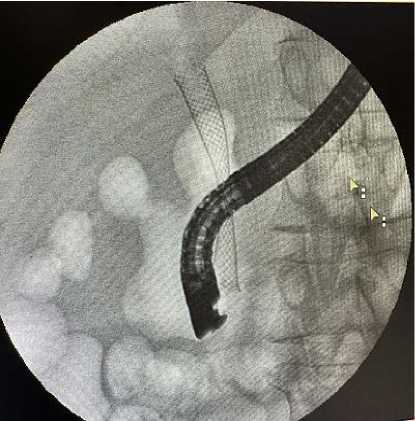
Рис. 4. Рентгеноскопический контроль установки билиарного металлического стента
Fig. 4. Fluoroscopic control of biliary metallic stent placement
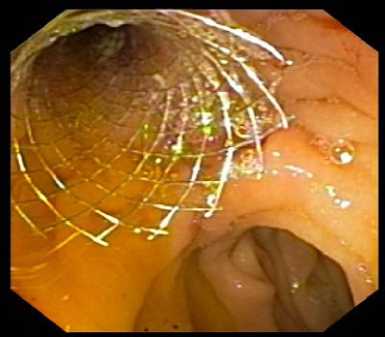
Рис. 5. Эндоскопический контроль установки билиарного металлического стента в просвете двенадцатиперстной кишки Fig. 5. Endoscopic control of biliary metallic stent placement in the duodenal lumen
При успешной установке металлического стента определялся адекватный сброс желчи в просвет двенадцатиперстной кишки.
Эндоскопическое ретроградное стентирование желчных протоков пластиковым стентом применили у 10 (15,6 %) пациентов. При установке пластикового стента по струне-проводнику через инструментальный канал эндоскопа проводили доставочное устройство пластикового стента в виде пластикового «толкателя» (система доставки типа RX Biliary) и далее позиционировали пластиковый стент за область опухолевого стеноза, при этом дистальный край с лепестком пластикового стента был установлен в просвете двенадцатиперстной кишки, а проксимальный край на 2–3 см выше края опухолевого стеноза. Далее доставочное устройство пластикового стента извлекалось. Рентгеноскопически контролировали правильное позиционирование пластикового стента после его установки (рис. 6), а при эндоскопическом контроле критерием адекватной установки пластикового стента являлся адекватный сброс желчи из просвета пластикового стента (рис. 7).
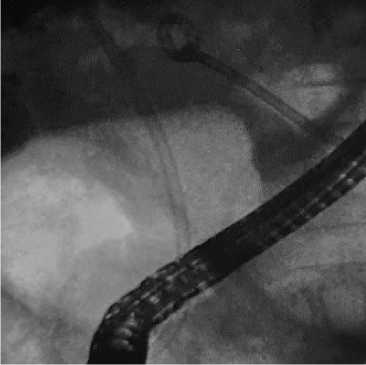
Рис. 6. Рентгеноскопический контроль установки билиарного пластикового стента
Fig. 6. Fluoroscopic control of biliary plastic stent placement
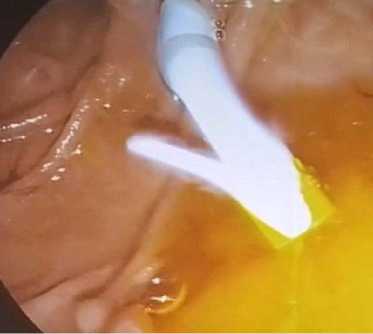
Рис. 7. Эндоскопический контроль установки билиарного пластикового стента в просвете двенадцатиперстной кишки Fig. 7. Endoscopic control of biliary plastic stent placement in the duodenal lumen
Результаты. Нами были проанализированы непосредственные результаты проведенных оперативных вмешательств (табл. 2).
Таблица 2
Непосредственные результаты выполненных оперативных вмешательств у пациентов
Table 2
Immediate results of performed surgical interventions in patients
|
Показатель Indicator |
Исследуемая группа (n=64) Study group (n=64) |
|
Среднее время операции, мин Average operation time, min |
31,2 ± 9,7 |
|
Технический успех, n (%) Technical success, n (%) |
58 (90,6) |
|
Клинический успех, n (%) Clinical success, n (%) |
57 (89,1) |
|
Миграция, n (%) Migration, n (%) |
1 (1,6) |
|
Перфорация органа, n (%) Organ perforation, n (%) |
0 (0) |
|
Кровотечение, n (%) Bleeding, n (%) |
0 (0) |
|
Постманипуляционный панкреатит, n (%) Postmanipulation pancreatitis, n (%) |
2 (3,1%) |
|
Срок госпитализации, сут. Period of hospitalization, days |
8,1 ± 4,1 |
|
Выраженный послеоперационный болевой синдром, n (%) Expressed postoperative pain syndrome, n (%) |
17 (26,6) |
Спустя 4 часа после оперативного вмешательства пациентам разрешалось пить воду в течение первых 24 часов. На следующий день пациенты начинали принимать воду и пищу в малых порциях дробно, постепенно увеличивая частоту приемов. У пациентов, которым был установлен металлический саморас-ширящийся стент с целью контроля и оценки диаметра раскрытия стента, а также выявления возможной миграции стента, через 24 часа после оперативного вмешательства проводилось рентгеноскопическое исследование брюшной полости (рис. 8).
А пациентам, которым был установлен пластиковый стент, контрольное рентгеноскопическое исследование брюшной полости мы проводили через 3 месяца, с последующей одномоментной заменой пластикового стента. Также необходимо отметить, что всем пациентам в период госпитализации, обычно через 48 часов после операции, проводилось контрольное лабораторное исследование биохимических показателей крови с целью оценки динамики снижения уровня показателей холестаза.
Длительность госпитализации пациентов в стационаре варьировалась от 9 до 13 дней, в зависимости от общего состояния пациентов и их послеоперационного восстановления.
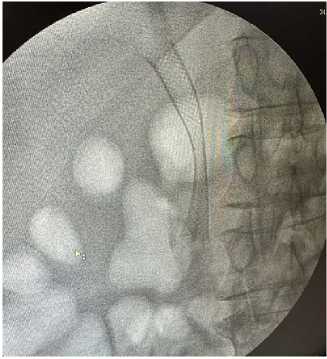
Рис. 8. Рентгеноскопический контроль раскрытия металлического стента через 24 часа после операции
Fig. 8. Fluoroscopic control of metal stent opening 24 hours after surgery
В ходе нашего исследования, интраоперационных осложнений, а также случаев перфорации и эпизодов кровотечения в раннем послеоперационном периоде зафиксировано не было.
У 17 пациентов (26,6 %) из исследуемой группы после выполнения стентирования желчных протоков на протяжении 1–2 суток отмечались явления болевого синдрома умеренной интенсивности в области вмешательства, купирующиеся приемом ненаркотических анальгетиков. Также болевой синдром был связан с развитием постманипуляционного острого панкреатита у 2 пациентов (3,1 %), у которых отмечалось повышение уровня панкреатической амилазы крови в пределах от 700 до 800 Ед/л (при норме 28–100 Ед/л). Данное состояние было купировано в течение 3–4 дней консервативными методами лечения по стандартным существующим протоколам лечения острого панкреатита.
Технический успех эндоскопического ретроградного стентирования желчных протоков был достигнут у 58 пациентов (90,6 %). У данных пациентов удалось эффективно купировать симптомы механической желтухи и улучшить общее самочувствие, а также отмечалось постепенное снижение лабораторных показателей холестаза и значительное уменьшение проявлений печеночной энцефалопатии. Клинический успех в нашем исследовании наблюдался у 57 пациентов (89,1 %).
У 6 пациентов (9,3 %) не удалось достичь технического, и соответственно, клинического успеха в виде купирования симптомов механической желтухи и сопутствующих ей клинических проявлений, что было обусловлено неудачной попыткой выполнения эндоскопического ретроградного стентирования желчных протоков в связи с выраженной ригидной опухолевой стриктурой на уровне проксимальных долевых желчных протоков, а в некоторых случаях – затруднениями при канюляции зоны большого дуоденального сосочка с целью доступа в просвет общего желчного протока. Данным пациентам было выполнено антеградное чрескожное чреспеченочное дренирование и стентирование желчных протоков, что позволило в конечном итоге достигнуть клинического успеха во всех случаях и купировать явления механической желтухи посредством декомпрессии желчных протоков.
У 1 пациента (1,6 %) в нашем исследовании, которому было выполнено эндоскопическое стентирование желчных протоков пластиковым стентом, не удалось достигнуть клинического успеха, так как при контрольном лабораторном обследовании через 48 часов было отмечено отсутствие положительной динамики в биохимических показателях холестаза и, соответственно, сохранялись явления механической желтухи. Данному пациенту выполнена обзорная рентгенография брюшной полости, при которой были выявлены признаки миграции пластикового стента в дистальном направлении от опухолевого стеноза в просвет двенадцатиперстной кишки, что мы связываем с наличием выраженной плотной опухолевой стриктуры в просвете общего желчного протока, которая привела к недостаточной фиксации пластикового стента в области опухолевого стеноза. Данному пациенту была выполнена повторная эндоскопическая ретроградная холангиопанкреатография, в ходе которой в просвет общего желчного протока был успешно установлен саморасширяющийся металлический стент.
С целью оценки отдаленных результатов после выполненной операции все пациенты через 3 месяца после операции проходили комплексное обследование (табл. 3). Всем пациентам назначается контрольное лабораторное обследование биохимических показателей крови и инструментальное обследование (УЗИ органов брюшной полости, МРХПГ, обзорная рентгенография органов брюшной полости и ЭГДС) с целью оценки проходимости и миграции ранее установленного металлического или пластикового стента, оценки адекватности сброса желчи в двенадцатиперстную кишку.
Важно подчеркнуть, что все пациенты находились под постоянным динамическим контролем онколога и эндоскописта. Пациентам назначались препараты для симптоматической терапии и проводились курсы химиотерапии при отсутствии противопоказаний.
Через 3 месяца после выполнения эндоскопического ретроградного стентирования желчных протоков, согласно данным контрольного ультразвукового исследования брюшной полости и МРХПГ, в 21,9 % случаев (14 пациентов) возникла необходимость повторного выполнения ретроградного стентирования желчных протоков. У 8 пациентов (12,5 %), которым было выполнено эндоскопическое стентирование желчных протоков пластиковым стентом, были выявлены явления механической желтухи, вызванные закупоркой и инкрустацией пластикового стента. В связи с этим, данным пациентам эндоскопическим путем была произведена замена установленного пластикового стента на другой пластиковый стент со сроком наблюдения и контрольного обследования через 3 месяца. У 2 пациентов (3,1 %), которым было выполнено эндоскопическое стентирование желчных протоков пластиковым стентом, при проведении контрольного эндоскопического исследования не было выявлено признаков инкрустации стента, так как отмечался адекватный сброс желчи в просвет двенадцатиперстной кишки, а также по клиническим проявлениям и лабораторным показателям явлений механической желтухи зафиксировано не было. Однако по истечению трехмесячного срока после вмешательства, данным пациентам была выполнена профилактическая замена пластикового стента эндоскопическим ретроградным путем на другой пластиковый стент. Пациенты были выписаны под динамическое наблюдение с последующим повторным обследованием каждые 3 месяца. У 4 пациентов (6,2 %), которым эндоскопическим путем был установлен металлический стент, на фоне прогрессирования опухолевого процесса в проксимальном направлении возникла обструкция просвета желчных протоков, что проявлялось клинической картиной механической желтухи. В связи с этим, данным пациентам было выполнено эндоскопическое рестентирование желчных протоков металлическим стентом по типу «стент-в-стент», что позволило восстановить проходимость желчных протоков и устранить симптомы механической желтухи.
Таблица 3
Результаты проведенных оперативных вмешательств у пациентов через 3 месяца после выполнения операции
Table 3
Results of the performed surgical interventions in patients 3 months after the operation
|
Показатель Indicator |
Исследуемая группа (n=64) Study group (n=64) |
|
Обструкция стента, n (%) Stent obstruction, n (%) |
8 (12,5) |
|
Продолженный рост опухоли, n (%) Continued tumor growth, n (%) |
4 (6,2) |
|
Миграция стента, n (%) Stent migration, n (%) |
0 (0) |
|
Необходимость повторного стентирования, n (%) Necessity of repeated stenting, n (%) |
14 (21,9) |
|
Летальность, n (%) Lethality, n (%) |
13 (20,3) |
После проведения эндоскопического ретроградного стентирования желчных протоков в течение трех месяцев не было зафиксировано ни одного случая миграции металлического или пластикового стента.
Трехмесячный показатель летальности в исследуемой группе пациентов составил 20,3 %, что было обусловлено прогрессированием основного заболевания.
Обсуждение
Эндоскопическое ретроградное стентирование желчных протоков – это минимально инвазивное хирургическое вмешательство, способствующее восстановлению нормального оттока желчи у пациентов, нуждающихся в паллиативной помощи в связи с нерезектабельной злокачественной обструкцией желчных протоков, что значительно улучшает качество жизни пациентов [13].
Полученные нами результаты эндоскопического ретроградного стентирования желчных протоков пластиковыми и металлическими саморасширяющимися стентами продемонстрировали низкую частоту ранних и отдаленных послеоперационных осложнений, при этом частота технического успеха составила 90,6 % случаев, а клинический успех достигнут в 89,1 % случаев. При стентировании желчных протоков эндоскопическим ретроградным способом в исследуемой нами группе пациентов, имеющих обструкцию желчных протоков опухолевого генеза, были успешно купированы симптомы механической желтухи, а также отмечалось постепенное снижение лабораторных показателей холестаза, что привело к улучшению общего самочувствия пациентов.
Однако, у 6 пациентов (9,3 %) технический, и соответственно, клинический успех не был достигнут, вследствие неудачной попытки выполнения эндоскопического ретроградного стентирования желчных протоков на фоне выраженной ригидной опухолевой стриктуры на уровне проксимальных долевых желчных протоков, а также в некоторых случаях на фоне неудачной попытки канюляции зоны большого дуоденального сосочка с целью доступа в просвет общего желчного протока. Достигнуть клинического успеха и купировать симптомы механической желтухи данным пациентам удалось путем выполнения антеградного чрескожного чреспеченочного дренирования.
Еще у 1 пациента (1,6 %) не был изначально достигнут клинический успех в связи с ранней миграцией пластикового стента в дистальном направлении на фоне выраженной плотной опухолевой стриктуры в просвете общего желчного протока. В связи с чем, данному пациенту была выполнена успешная эндоскопическая установка саморасширяющегося металлического стента в просвет желчного протока. Данные манипуляции позволили добиться купирования клинических симптомов механической желтухи.
Полученные в ходе нашего исследования результаты соответствуют данным, представленными различными авторами в современной литературе.
Rodrigo Castaño и соавторы [14] провели ретроспективное исследование, включающее 80 пациентов, имеющих злокачественную дистальную билиарную обструкцию, которые были поделены на две равные группы – 40 пациентам был установлен пластиковый стент в ходе эндоскопического ретроградного стентирования желчных протоков, и 40 пациентам – металлический саморасширяющийся стент. Клинический успех был одинаковым для обеих групп и составил 92 %. Проходимость желчных протоков была восстановлена в обеих группах в 92 % случаев, что подтвердилось снижением значения билирубина в лабораторных показателях более, чем на 50 % от первоначального уровня. Рецидив билиарной обструкции был выявлен у 19 из 40 пациентов с пластиковыми стентами (47,5 %) и у 13 из 40 пациентов с металлическими стентами (45 %). Средняя продолжительность проходимости стента у пациентов с установленными металлическими стентами составила 174,2 дня, а у пациентов с пластиковыми стентами – 108 дней, что демонстрирует статистически значимую разницу (p<0,05). Ранние послеоперационные осложнения, такие как кровотечение, панкреатит, холангит и миграция стента, наблюдались у 5 % пациентов, которым был установлен металлический стент и у 12,5 % пациентов, которым был установлен пластиковый стент. Более поздние осложнения, такие как обструкция стента были зафиксированы у 42,5 % пациентов с установленными пластиковыми стентами и у 30 % пациентов с установленными металлическими стентами.
Частота обструкции стента была выявлена у 8 пациентов (12,5 %) через 3 месяца после операции, которым был установлен пластиковый стент. У 4 пациентов (6,2 %) в нашем исследовании с установленным металлическим стентом на фоне продолженного роста опухоли и, соответственно, развития обструкции желчных протоков, было выполнено повторное эндоскопическое стетнирование желчных протоков по типу «стен-в-стент».
Fumisato Kozakai и соавторы [15] в своём одноцентровом исследовании сравнили осложнения, возникающие после эндоскопического стентирования пластиковыми и полностью покрытыми металлическими стентами. В исследование было включено 105 пациентов со злокачественной обструкцией желчных протоков, возникшей вследствие опухолевого поражения поджелудочной железы. 20 пациентам (19,1 %) эндоскопическим путем был установлен полностью покрытый металлический стент, а 85 (80,9) пациентам – пластиковый стент, 53 из которых (62,3 %) стентирование было проведено с помощью пластиковых стентов диаметром 10 Fr (3,3 мм) и более, а 32 пациентам (37,7 %) – с использованием пластиковых стентов диаметром меньше 10 Fr (3,3 мм). 29 пациентам (27,6 %) от общего количества исследуемых проводились курсы неоадъювантной химиотерапии. Показатели клинического успеха составили 100% для группы пациентов, которым был установлен полностью покрытый металлический стент, и 82,3 % для группы пациентов с установленными пластиковыми стентами. У 15 пациентов (17,6 %) после эндоскопического стентирования пластиковыми стентами клинический успех не был достигнут. Данным пациентам было проведено повторное эндоскопическое стентирование с заменой пластикового стента на полностью покрытый металлический стент и одному пациенту на пластиковый стент большего диаметра. По данным проведенного анализа, рецидив обструкции желчных протоков у пациентов с пластиковыми стентами наблюдался в 25,2 % случаев, а в группе металлических стентов подобных случаев зафиксировано не было. Частота ранних послеоперационных осложнений, по данным авторов, между группами существенно не различалась. Постманипуляционный панкреатит был диагностирован у 4 пациентов (20 %), которым эндоскопическое стентирование выполнялось полностью покрытым металлическим стентом, и у 7 пациентов (8,2 %), которым был установлен пластиковый стент.
Таким образом, полученные нами результаты применения эндоскопического стентирования желчных протоков показали высокую клиническую эффективность и низкую частоту осложнений.
Заключение
Эндоскопическое ретроградное стентирование желчных протоков – это минимально инвазивная безопасная процедура, позволяющая добиться быстрого купирования клинических проявлений механической желтухи, а также улучшить общее самочувствие и качество жизни пациентов с нерезектабель-ными опухолевыми поражениями гепатобилиарной зоны, что подчеркивает его ключевую роль в паллиативной помощи. Применение металлических саморасширяющихся стентов позволяет проводить более качественную и длительную декомпрессию желчных протоков. Также считаем целесообразным выполнение эндоскопического ретроградного стентирования желчных протоков при наличии дистального опухолевого блока желчных протоков, а при наличии проксимального опухолевого блока более предпочтительно применение методики антеградного чрескожного чреспеченочного дренирования желчных протоков.


