Анализ результатов лечения больных метастатическим раком почки, получавших анти-PD-1-терапию в рамках программы расширенного доступа: клиническая эффективность и потенциальные биомаркеры ниволумаба
Автор: Саяпина М.С., Савелов Н.А., Любимова Н.В., Тимофеев Ю.С., Носов Д.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.8, 2018 года.
Бесплатный доступ
Терапия ингибиторами контрольных точек иммунного ответа (анти-PD-1-терапия) стала стандартом лечения больных метастатическим почечно-клеточным раком (мПКР), резистентных к тирозинкиназным ингибиторам. Идентификация надежных иммунологических маркеров, предсказывающих чувствительность ПКР к данному виду иммунотерапии, способствовала бы повышению его эффективности и более рациональному использованию. В данной статье представлен анализ результатов лечения 23 пациентов с мПКР, получавших ниволумаб в рамках программы расширенного доступа к препарату. Частота объективного ответа в данной группе составила 21,7 %. Медиана выживаемости без прогрессирования - 4 мес. 95 % ДИ (1,37-10,04). Медиана общей выживаемости не достигнута при медиане времени наблюдения за пациентами 10 мес. (3-14 мес.). Частота токсических осложнений 3-4 стадий составила 13 %. При проведении иммунотерапии ниволумабом факторами, благоприятно влияющими на выживаемость без прогрессирования болезни, являлись: благоприятный прогноз согласно модели MSKCC, развитие гипотиреоза в процессе лечения и исходный уровень sPD-1, превышающий пороговое значение...
Рак почки, иммунотерапия, анти-pd-1
Короткий адрес: https://sciup.org/140243793
IDR: 140243793 | DOI: 10.18027/2224-5057-2018-8-3-31-38
Текст научной статьи Анализ результатов лечения больных метастатическим раком почки, получавших анти-PD-1-терапию в рамках программы расширенного доступа: клиническая эффективность и потенциальные биомаркеры ниволумаба
По результатам рандомизированного исследования III фазы CheckMate-025 у больных метастатическим почечно-клеточным раком (мПКР) было продемонстрировано значительное преимущество ниволумаба (моноклонального антитела к PD-1) над эверолимусом во второй линии терапии в виде увеличения медианы общей выживаемости с 19,6 до 25 мес. и частоты объективных ответов (ЧОО) с 5 до 25 %, а также благоприятный токсический профиль препарата [1]. Ранее было показано, что гиперэкспрессия в опухолевой ткани больных мПКР PD-L1 ассоциируется с плохим прогнозом [2]. При оценке общей выживаемости больных мПКР, получающих в первой линии сунитиниб/пазопаниб, в рамках рандомизированного исследования COMPARTZ гиперэкспрессия PD-L1 достоверно ассоциировалась со снижением показателей общей выживаемости [5]. В то же время данный маркер, несмотря на то, что фактически является опосредованной мишенью для регуляторов контрольных точек иммунного ответа, пока не может рассматриваться в качестве предиктивного при проведении анти-PD-1-терапии [3]. Существует несколько гипотез, объясняющих данный феномен:
1) различная степень экспрессии PD-L1 в первичной опухоли и отдаленных метастазах; 2) динамическая природа данного маркера и влияние предшествующей ан-ти-VEGFR-терапии на экспрессию PD-L1 в процессе прогрессирования заболевания; 3) повышенная экспрессия PD-L2 в опухолевой ткани; 4) отсутствие стандартов пороговых значений определения уровня экспрессии при проведении иммуногистохимического исследования (ИГХ) [4].
Идентификация надежных иммунологических маркеров, предсказывающих чувствительность опухоли к ан-ти-PD-1-терапии, способствовала бы повышению ее эффективности и более рациональному использованию.
В ряде исследований продемонстрировано преимущество оценки экспрессии PD-L1 совместно с FOXP3, поскольку PD-L1 способствует дифференцировке наивных CD4+Т-лимфоцитов в CD4+CD25+FOXP3+Т-reg [6–8]. Также в одном из поданализов показана динамическая нестабильность экспрессии PD-L1 на фоне лечения. У 26 пациентов, включая четырех больных с мПКР, проводился забор материала до лечения и в процессе, и было показано, что дисрегуляция (увеличение экспрессии) PD-L1 ассоциировалась с ЧОО. Данное наблюдение может указывать на адаптивные изменения экспрессии PD-L1 в ответ на лечение и необходимость мониторинга данного маркера в процессе терапии [9].
В настоящее время проводится изучение прогностической и предиктивной значимости растворимых форм PD-L1/ PD-1 (s). Продемонстрирована отрицательная прогностическая значимость наличия высокого уровня растворимой формы PD-L1 (sPD-L1) в плазме у пациентов с диффузной B-крупноклеточной лимфомой. Более того, резкое снижение sPD-L1 на фоне лечения ассоциировалось с полной ремиссией. В отдельных работах приводятся данные, показывающие отсутствие прямой связи между sPD-L1 и экспрессией PD-L1 в опухолевой ткани. Данный факт еще раз указывает на то, что помимо опухолевых клеток существуют дополнительные источники синтеза (при помощи матриксных металлопротеиназ в присутствии про-воспалительных факторов) [10]. При этом функциональное значение растворимой формы PD-1 (sPD-1) остается не совсем понятным.
Возможно, определение растворимых форм sPD-L1/PD-1 до и в процессе терапии будет иметь большую прогностическую значимость, чем уровень экспрессии данного белка в опухолевой ткани.
Материалы и методы
Всего в данное исследование за период с 2015 по 2017 г. было включено 23 пациента с мПКР. Дизайн исследования предусматривал, что пациент будет получать ниволумаб в дозе 3 мг/кг внутривенно каждые две недели. Лечение продолжалось до прогрессирования или неприемлемой токсичности (3–4 стадии). У всех пациентов до начала лечения и через два месяца производился забор крови для последующего определения сывороточных маркеров (TGF-|3 , IL-17A, sPD-1), а также подбор послеоперационных блоков для ИГХ-определения уровня экспрессии FOXP3 и PD-L1 в опухолевой ткани и на тумор-инфильтрирующих лейкоцитах (TILs). Средний возраст больных составил 62 года (от 52 до 69 лет). Среди пациентов преобладали мужчины (78,2 %). У всех пациентов (100 %) к моменту начала терапии было удовлетворительное соматическое состояние (ECOG=0-2), а диагноз подтверждался данными гистологического исследования (табл. 1). 11 больных, включенных в данное исследование, ранее получили две и более линии терапии.
Оценка частоты объективных эффектов проводилась в соответствии с критериями irRECIST на основании результатов КТ-исследования органов грудной клетки и брюшной полости с периодичностью каждые 8 нед.
Токсичность лечения оценивали в соответствии с международными общепринятыми критериями определения вида и степени токсичности (руководства NCI CTCAE, version 4.03).
Иммуноферментные исследования. Содержание исследуемых белков определяли в сыворотке крови согласно
Таблица 1. Характеристика больных мПКР, получавших терапию ниволумабом, за период с 2015 по 2017 г.
Иммуногистохимическое исследование (ИГХ) на PD-L1 и FOXP3. ИГХ выполнено на срезах опухолевой ткани, приготовленных по стандартной методике. Иммунное окрашивание произведено в полностью автоматическом иммуностейнере Leica BOND III с использованием предустановленных настроек иммуностейнера и стандартных реагентов производства Leica Biosystems. Первичные антитела к PD-L1 (клон SP142, 1:100, Spring Bioscience, USA) и FOXP3 (клон EP340, 1:100, Cell Marque, USA) инкубировались в течение 20 мин. Использованная система детекции – Bond Polymer Refine Detection. Для усиления сигнала использован DAB Enhancer BOND. Степень иммунного окрашивания PD-L1 оценивалась на поверхности лимфоцитов, инфильтрирующих строму опухоли. Оценивался
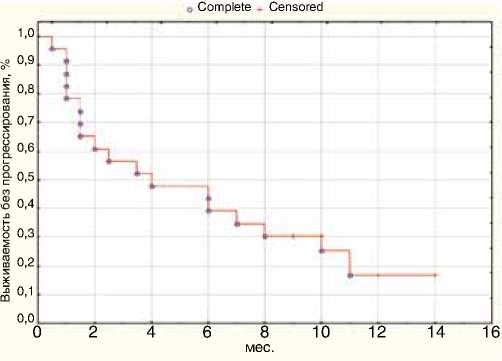
Рисунок 1. Выживаемость без прогрессирования заболевания.
Медиана – 4 мес. 95 % ДИ (1,37–10,04)
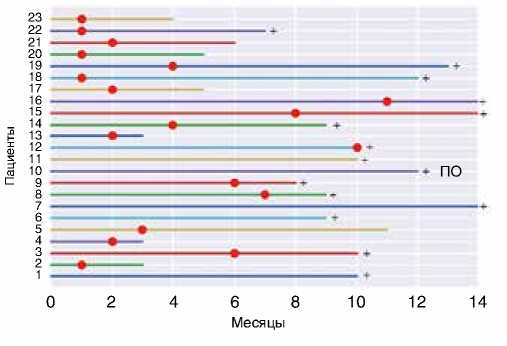
Рисунок 2. Выживаемость без прогрессирования заболевания и общая выживаемость у больных мПКР на фоне иммунотерапии ниволумабом ( + – живы и продолжают лечение; красная точка – время регистрации прогрессирования болезни; ПО – полный ответ)
Таблица 2. Осложнения и токсические реакции на фоне приема ниволумаба
Результаты лечения
Эффективность ниволумаба
Эффективность иммунотерапии ниволумабом оценена у 23 пациентов. Полный эффект достигнут у 1 (4,34 %) пациента, частичный – у 4 (17,4 %). Длительная стабилизация болезни (≥6 мес.) отмечена у 5 (21,7 %) больных. Общая частота контроля над заболеванием (полная и частичная ремиссии + длительная стабилизация) – 43,4 %.
Для всей группы из 23 пациентов медиана выживаемости без прогрессирования заболевания от начала иммунотерапии ниволумабом составила 4 мес., а однолетняя выживаемость без прогрессирования достигла 18 % (рис. 1).
У 5 из 23 больных на момент анализа материала сохранялся клинический эффект продолжительностью от 9 до 14+ мес. Еще у 18 пациентов зафиксировано прогрессирование процесса. Из них 10 пациентов после прогрессирования получали различные варианты терапии (акси-тиниб, сунитиниб, пазопаниб, сорафениб, бевацизумаб, эверолимус + ленватиниб). Несмотря на то что 48 % больных получали ниволумаб в качестве терапии 3–4 линий, у большинства пациентов после прогрессирования удавалось добиться эффекта от последующих линий терапии (материал не представлен), что могло отразиться на показателях общей выживаемости (рис. 2).
Медиана общей выживаемости не достигнута. Медиана времени наблюдения составила 10 мес. (от 3 до 14 мес.).
Токсичность терапии ниволумабом
Все пациенты (n=23) были включены в анализ токсичности и переносимости ниволумаба. Наиболее частыми видами негематологической токсичности всех степеней были слабость (21,7 %; n=5), бессонница (17 %; n=4), зуд (13 %; n=3) и гипотиреоз (13 %; n=3). Среди других видов негематологической токсичности всех степеней, связанных с приемом ниволумаба, преобладали сыпь (8,6 %), пневмонит (4,3 %), диарея (4,3 %), аутоиммунный нефрит (4,3 %), аутоиммунный гепатит (4,3 %) и обострение хронической почечной недостаточности (ХПН) (4,3 %). Выраженной гематологической токсичности отмечено не было. Осложнения 3–4 стадий наблюдались в 13 % случаев. Все токсические осложнения хорошо контролировались глюкокортикоидными препаратами. Общая частота побочных явлений, связанных с приемом препарата, приведена в табл. 2.
Прогностическое значение клинико-морфологических и иммунологических факторов
При оценке значимости различных клинико-морфологических и иммунологических показателей в прогнозировании эффективности иммунотерапии ниволумабом мы проанализировали их влияние на непосредственную
Таблица 3. Эффективность терапии ниволумабом в зависимости от прогноза
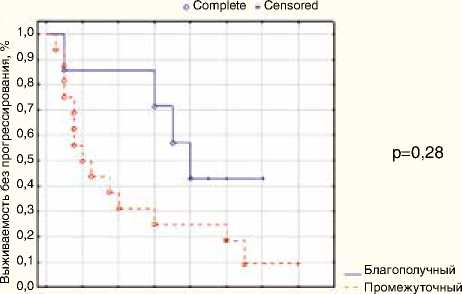
0 2 4 6 8 10 12 14 16 и плохой
А) мес.
Анализ клинических факторов
При анализе эффективности иммунотерапии ниволу-мабом в зависимости от принадлежности больных к прогностической группе (MSKCC/Heng) контроль над заболеванием был отмечен только в группах благоприятного и промежуточного прогноза (табл. 3). Ни у одного пациента с плохим прогнозом не наблюдался клинический эффект.
В результате однофакторного анализа прогноз больных, оцениваемый по критериям MSKCC, оказывал достоверное влияние на выживаемость без прогрессирования при проведении иммунотерапии ниволумабом у больных мПКР. Медиана выживаемости без прогрессирования у больных с промежуточным и плохим прогнозом в сравнении с группой благоприятного прогноза составила 2 и 8 мес. соответственно (р=0,028).
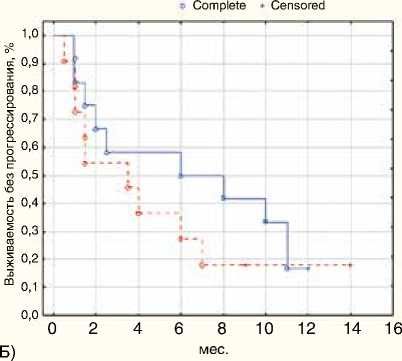
p=0,2
во 2 линии в 3 и более
Число ранее предшествующих линий терапии не оказало достоверного влияния на выживаемость без прогрессирования. Медиана выживаемости без прогрессирования составила 6 и 3,4 мес. (р=0,2) в группах пациентов, получавших ранее одну линию либо две или более линий терапии соответственно (рис. 3).
В дальнейшем был проведен регрессионный анализ, в котором была выявлена ассоциация между развитием гипотиреоза и достижением объективного эффекта (рис. 4). У всех трех пациентов с явлениями гипотиреоза, подтверждаемыми лабораторными методами (Т3, Т4, ТТГ), наблюдался выраженный объективный эффект.
Рисунок 3. Выживаемость без прогрессирования в зависимости от исходного прогноза по MSKCC (А) и количества предшествующих линий (Б)
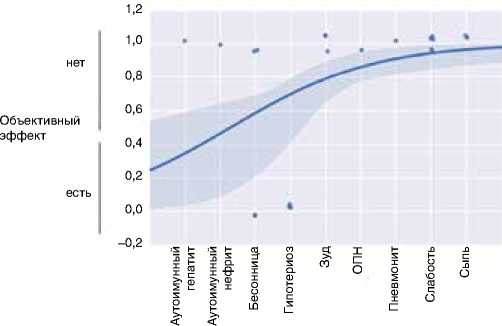
Рисунок 4. Взаимосвязь между токсичностью и эффективностью иммунотерапии ниволумабом
Анализ сывороточных факторов
Анализ sPD-1 в сыворотке крови был выполнен у 23 пациентов с мПКР до начала иммунотерапии ниволумабом и через два месяца после начала терапии. На фоне лечения у всей группы больных не было отмечено достоверных различий между уровнем sPD-1 до начала терапии и через два месяца после (p=0,15).
В дальнейшем было проведено сравнение исходных значений sPD-1 в зависимости от эффективности лечения (рис. 5). Согласно полученным нами данным, исходное значение концентрации растворимой формы рецептора
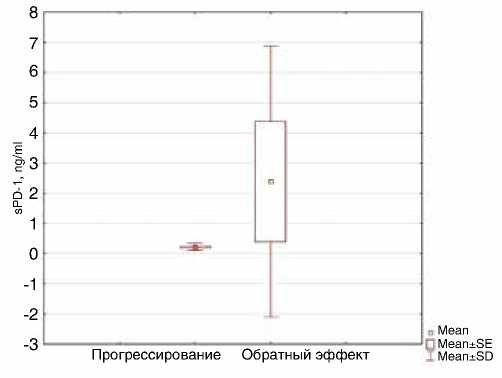
Рисунок 5. Содержание sPD-1 в периферической крови больных мПКР с наличием объективного эффекта и прогрессированием заболевания до начала иммунотерапии ниволумабом
А)
Б) мес. PD-L1>0,5%
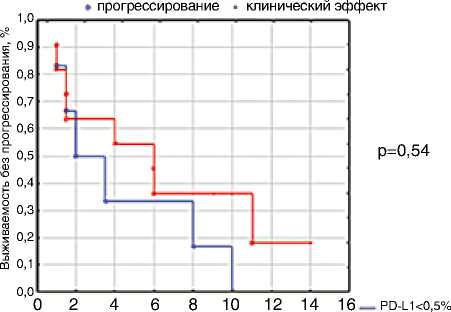
Рисунок 6. Экспрессия PD-L1 на TILs (A) и ее влияние на выживаемость без прогрессирования заболевания (Б)
sPD-1 (2,38±4,47 нг/мл) в группе объективного эффекта (n=5) достоверно (p=0,039) превышало данный показатель (0,22±0,11 нг/мл) в группе стабилизации и прогрессирования (n=17).
В соответствии с полученным пороговым уровнем (0,45 нг/мл) была подтверждена его предиктивная значимость. Так, у 40 % пациентов с зарегистрированным объек- тивным эффектом на фоне терапии ниволумабом уровень PD-1 был более 0,45 нг/мл. В подгруппе больных со стабилизацией и прогрессированием на фоне лечения у 89 % пациентов уровень PD-1 оказался ниже порогового значения.
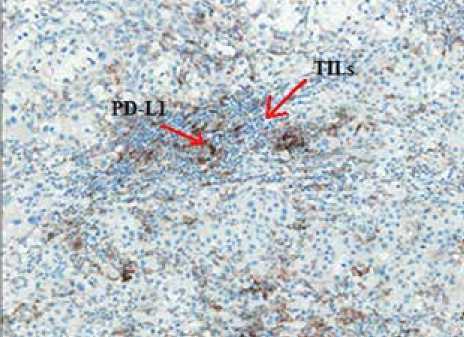
Анализ экспрессии PD-L1 и FOXP3 на TILs
У 17 (74 %) из 23 пациентов, получавших ниволумаб, была произведена оценка экспрессии PD-L1 и FOXP3 на TILs опухолевой ткани, полученной до лечения. Медиана времени от забора опухолевого материала до начала терапии составила 4 мес. (1–15 мес.).
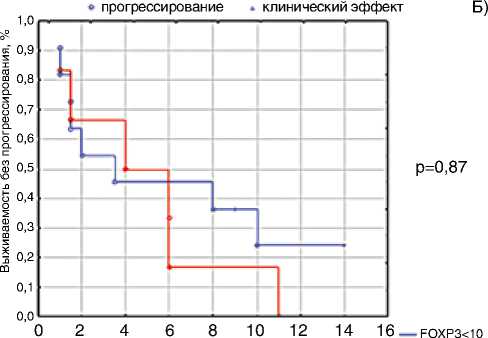
На первом этапе мы оценили прогностическую значимость данных маркеров. Анализ продемонстрировал отсутствие достоверного влияния экспрессии PD-L1 (рис. 6) и FOXP3 (рис. 7) на выживаемость без прогрессирования заболевания (p>0,05).
С использованием пороговых уровней ≥0,5 % и ≥1 % для оценки экспрессии PD-L1 позитивными рассматривались 11/17 (64 %) и 8/17 (47 %) пациентов соответственно. При использовании порогового уровня ≥0,5 % клинический эффект (объективный эффект + длительная стабилизация) был выше в группе PD-L1-позитивных пациентов (54,5 против 33,3 %, p>0,05). При пороговом значении ≥10 % для оценки степени экспрессии FOXP3 у 11 из 17 (64 %) пациентов экспрессия FOXP3 считалась позитивной. Клинический эффект был отмечен у 45 % FOXP3-позитивных и у 50 % FOXP3-негативных пациентов соответственно.
Таким образом, экспрессия PD-L1 и FOXP3 на TILs не оказывала достоверного влияния на выживаемость без прогрессирования у больных мПКР на фоне иммунотерапии ниволумабом и не несла предиктивной значимости.
Дискуссия
У 23 больных мПКР, включенных нами в программу расширенного доступа к препарату, частота объективных эффектов на фоне лечения, определяемая в соответствии с критериями irRECIST, достигла 21,7 %. Несмотря на то что медиана времени до прогрессирования процесса для всей группы оказалась всего 4 мес., однолетняя беc-прогрессивная выживаемость составила 18 %, а у 5 больных сохраняется клинический эффект от 9 до 14+ мес. Эти показатели в целом соответствуют результатам других более крупных исследований, которые указывают на то, что отдельная группа пациентов (15–20 %) получает максимальный выигрыш от использования данного подхода. Именно в этой группе регистрируются относительно высокие показатели беcпрогрессивной и общей выживаемости [11–13]. При этом среднее время наблюдения за пациентами в нашей группе небольшое – всего 10 мес., и медиана общей выживаемости не достигнута.
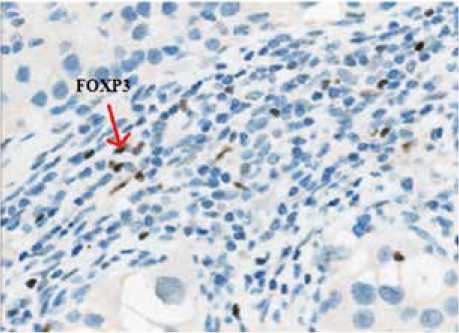
мес. FOXP3>10
Рисунок 7. Экспрессия FOXP3 на TILs (A) и ее влияние на выживаемость без прогрессирования заболевания (Б)
Результаты представленного исследования указывают на низкую токсичность и хорошую переносимость ниволу-маба и данного иммунотерапевтического подхода в целом у больных мПКР. Аутоиммунные осложнения 3–4 стадий отмечены лишь в 13 % случаев и хорошо контролировались глюкокортикоидными препаратами. Тем не менее у 1 (4,3 %) больного на фоне терапии было зарегистрировано обострение ХПН, потребовавшее проведения диализа. Невысокая частота побочных эффектов позволяет изучать данный препарат в комбинированных или после-довательных/альтернирующих режимах с другими ингибиторами контрольных точек, а также таргетными препаратами. Предварительные результаты исследования I–II фаз уже продемонстрировали возможность комбинированного использования ниволумаба и ипилимумаба в редуцированных дозах, атезолизумаба и бевацизумаба, авелумаба и акситиниба, пембролизумаба и акситиниба, а также пембролизумаба и ленватиниба [14].
Дополнительный анализ продемонстрировал, что развитие гипотиреоза в серии наших наблюдений в 100 % случаев ассоциировалось с регистрацией объективного эффекта на фоне терапии ниволумабом. Таким образом, данный вид токсичности, в основе которого, вероятнее всего, лежат аутоиммунные нарушения, может косвенно свидетельствовать об эффективности индуцированного противоопухолевого иммунного ответа в результате ан-ти-PD-1-терапии. При этом степень выраженности гипотиреоза не превышала 1–2 стадий и он хорошо корреги-ровался с помощью заместительной терапии.
При анализе потенциальных предиктивных и прогностических клинических факторов количество предшествующих линий терапии не оказывало достоверного влияния на выживаемость без прогрессирования больных (p=0,2). При этом принадлежность больных к группе риска в соответствии с моделью MSKCC не утратила своей прогностической значимости. Медиана выживаемости без прогрессирования у больных с благоприятным прогнозом достоверно превышала данный показатель у больных с промежуточным и плохим прогнозом и составила 8 и 2 мес. соответственно (р=0,028). Очевидно, что больные с плохим прогнозом особенно остро нуждаются в более эффективной противоопухолевой терапии, в том числе основанной на комбинации таргетных препаратов и регуляторов контрольных точек иммунного ответа.
При анализе молекулярных факторов экспрессия PD-L1 и FOXP3 на TILs не обладала предиктивной или прогностической значимостью у больных мПКР, получавших иммунотерапии ниволумабом. С другой стороны, независимым молекулярным фактором, предсказывающим достижение объективного эффекта, т. е. сокращение размеров отдаленных метастазов на 30 % и более, являлся исходно повышенный уровень sPD-1. Нам сложно объяснить данный факт, но, возможно, повышенное содержание растворимой формы PD-1-рецептора в сыворотке может косвенно свидетельствовать о его избыточной экспрессии в опухолево-инфильтрирующих лимфоцитах и, соответственно, указывать на наличие мишени для ниволумаба. Безусловно, необходимы дополнительные клинические исследования по валидации данного потенциального маркера и поиску других биомаркеров, которые позволят более рационально и с большей эффективностью использовать новый иммунотерапевтический подход.
Список литературы Анализ результатов лечения больных метастатическим раком почки, получавших анти-PD-1-терапию в рамках программы расширенного доступа: клиническая эффективность и потенциальные биомаркеры ниволумаба
- Motzer R. J. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N. Engl. J. Med. 2015. Vol. 37. P. 1803-1813.
- Thompson R. H., Dong H., Kwon E. D. Implications of B7-H1 expression in clear cell carcinoma of the kidney for prognostication and therapy. Clin. Cancer Res. 2007. Vol. 13. No. 2. P. 709-715.
- Choueiri T. K., Figueroa D. J., Fay A. P. Correlation of PD-L1 tumor expression and treatment outcomes in patients with renal cell carcinoma receiving sunitinib or pazopanib: results from COMPARZ, a randomized controlled trial. Clin. Cancer Res. 2015. No. 21. Р. 1071-1077.
- Choueiri T. K., Fishman M. N., Escudier B. J. Immunomodulatory activity of nivolumab in previously treated and untreated metastatic renal cell carcinoma (mRCC): biomarker-based results from a randomized clinical trial. J. Clin. Oncol. 2014. No. 32. 5s (suppl; abstr 5012).
- Choueiri T. K., Fishman M. N., Escudier B. et al. Immunomodulatory activity of nivolumab in metastatic renal cell carcinoma (mRCC): association of biomarkers with clinical outcomes. J. Clin. Oncol. 2015. Vol. 33 (suppl; abstr 4500).
- Li Z. et al. PD-L1 Expression Is Associated with Tumor FOXP3+ Regulatory T-Cell Infiltration of Breast Cancer and Poor Prognosis of Patient. J. Cancer. 2016. Vol. 7 (7). P. 784-793.
- Hou J., Yu Z., Xiang R., Li C., Wang L., Chen S. et al. Correlation between infiltration of FOXP3+ regulatory T cells and expression of B7-H1 in the tumor tissues of gastric cancer. Exp. Mol. Pathol. 2014. Vol. 96. P. 284-291.
- Geng Y., Wang H., Lu C., Li Q., Xu B., Jiang J. et al. Expression of costimulatory molecules B7-H1, B7-H4 and Foxp3 (+) Tregs in gastric cancer and its clinical significance. Intern. J. Clinical Oncology. 2015. Vol. 20. P. 273-281.
- Powderly J. D., Koeppen H., Hodi F. S. et al. Biomarkers and associations with the clinical activity of PD-L1 blockade in a MPDL3280A study. J. Clin. Oncol. 2013. Vol. 31 (suppl; abstr 3001).
- Rossille D. et al. sPD-L1 in blood and diffuse large B-cell lymphoma. Leukemia. 2014. P. 1-9.
- Motzer R. J. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N. Engl. J. Med. 2015. Vol. 373. P. 1803-1813.
- Motzer R. J., Rini B. I., McDermott D. F. et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J. Clin. Oncol. 2015. Vol. 33. P. 1430-1437.
- Motzer RJ., Rini B. I., McDermott D. F. et al. Nivolumab for metastatic renal cell carcinoma (mRCC): results of a randomized, doseranging phase II trial. J. Clin. Oncol. 2015. Vol. 33. P. 1430-1437.
- Rini B. I., McDermott D. F., Hammers H., Bro W., Bukowski R. M. et al. Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of renal cell carcinoma. J. ImmunoTherapy of Cancer. 2016. Vol. 4. P. 81.


