Анализ результатов применения флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиом высокой степени злокачественности
Автор: Бывальцев Вадим Анатольевич, Степанов Иван Андреевич, Кичигин Александр Иванович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.17, 2018 года.
Бесплатный доступ
Глиомы высокой степени злокачественности (ГВЗ) представляют собой наиболее агрессивную группу первичных опухолей головного мозга. Степень резекции опухоли (СРО) является доказанным прогностическим фактором выживаемости пациентов с ГВЗ. Поиск литературных источников в базах данных Pubmed, Medline и e-Library показал отсутствие исследований по применению флуоресцентной навигации с 5-аминолевулиновой кислотой (ФН-5-АЛК) в хирургии ГВЗ, основанных на сопоставлении нейровизуализационных, интраоперационных параметров и клинических данных. Цель исследования - провести анализ результатов применения ФН-5-АЛК в хирургии ГВЗ путем изучения и сопоставления нейровизуализационных характеристик, интраоперационных параметров и клинических результатов. материал и методы. В исследование включены 48 пациентов (30 мужчин, 18 женщин) в возрасте от 35 до 76 лет (средний возраст - 47,3 ± 8,4 года), прооперированных по поводу впервые диагностированных ГВЗ головного мозга. Определены значения СРО, особенности интраоперационной флуоресценции различных типов ГВЗ и возможность определения границ опухоли с прилежащим веществом головного мозга при использовании ФН-5-АЛК, а также изучены показатели функционального статуса пациентов по индексу Карновского. Результаты. Анализ СРО показал, что в 40 (83,3 %) случаях впервые диагностированных ГВЗ удалось достигнуть максимальной СРО (90-98 %). Максимальная СРО выполнена у 28 (58,3 %) пациентов с глиобластомами и у 12 (25 %) пациентов с глиомами III степени злокачественности (p=0,408). Кроме того, максимальная СРО достигнута при микронейрохирургическом удалении 9 (18,75 %) ГВЗ, имеющих объем ≥9 см3, и 21 (43,75 %) ГВЗ объемом 3 (р=0,029). При сопоставлении данных ФН-5-АЛК и интраоперационной нейронавигации у 28 (58,3 %) пациентов границы опухолевой ткани не совпадали. Расхождения в полученных данных относительно границ опухолей отмечены у 19 (39,5 %) пациентов с глиобластомами и в 3 (6,25 %) случаях глиом III степени злокачественности (p=0,014), а также в 9 (18,75 %) случаях ГВЗ объемом ≥9 см3 и в 14 (29,1 %) случаях ГВЗ, имеющих объем 3 (p=0,677). Оценка функционального статуса пациентов до и после оперативного вмешательства показала следующие результаты: у 36 (75 %) пациентов отмечено улучшение функционального статуса по индексу Карновского, в 9 (18,75 %) случаях статус остался на прежнем уровне и у 3 (6,25 %) пациентов отмечено ухудшение функционального статуса. Заключение. Применение ФН-5-АЛК при микронейрохирургической резекции ГВЗ различных локализаций позволяет в большинстве случаев достигнуть тотальной СРО. Размеры ГВЗ и локализация являются важнейшими факторами в достижении максимальной СРО.
Глиомы высокой степени злокачественности, флуоресцентная навигация, 5-аминолевулиновая кислота, степень резекции опухоли, нейронавигация
Короткий адрес: https://sciup.org/140254171
IDR: 140254171 | УДК: 616.831-006.484-089 | DOI: 10.21294/1814-4861-2018-17-2-18-26
Текст научной статьи Анализ результатов применения флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиом высокой степени злокачественности
Глиомы высокой степени злокачественности (ГВЗ) представляют собой наиболее агрессивную группу первичных опухолей головного мозга. Заболеваемость ГВЗ составляет в среднем 5,26 на 100 тыс. населения в год [1, 2]. Несмотря на значительные успехи современной микронейрохи‑ рургии, химио‑, радиотерапии, а также таргетной терапии, прогноз для данной группы пациентов по‑прежнему остается неблагоприятным. Доказа‑ но, что степень резекции опухоли с минимальным повреждением прилежащей мозговой ткани – важ‑ нейший интраоперационный фактор, влияющий на исходы хирургического лечения ГВЗ [3]. По этой причине одним из основных научных поисков в нейроонкологии является разработка оперативных доступов, методик интраоперационной навигации и микронейрохирургических приемов, позволяю‑ щих достигнуть максимальной степени резекции опухолевой ткани.
Степень резекции опухоли (СРО) является дока‑ занным прогностическим фактором выживаемости пациентов с ГВЗ [4, 5]. Ряд авторов установили достоверную корреляционную зависимость между объемом СРО и общей выживаемостью пациентов с ГВЗ. Значения общей выживаемости при СРО, равной 95–100 % и <98 %, в среднем составляют 13 и 8,8 мес соответственно [6]. Кроме того, уста‑ новлено, что у пациентов с впервые диагностиро‑ ванными ГВЗ выполненная ≥78 % СРО позволяет значимо увеличить общую выживаемость [7].
5‑аминолевулиновая кислота (5‑АЛК) – пред‑ шественник гемоглобина, индуцирующий синтез и накопление эндогенных флуоресцирующих порфиринов, в частности протопорфирина IX. Особенностью метаболизма протопорфирина IX в пределах центральной нервной системы является его селективное накопление преимущественно в злокачественных опухолях (ГВЗ, метастазы в головной мозг, анапластические менингиомы). Флуоресценцию протопорфирина IX можно на‑ блюдать с помощью операционного микроскопа, имеющего специальный сине‑фиолетовый режим освещения с длиной волны 400–440 нм, а также с помощью эндоскопической техники в режиме фотодинамической диагностики. Необходимо от‑ метить, что при интраоперационной визуализации опухолевой ткани в режиме флуоресценции при‑ нято выделять три основные зоны: (1) зона некроза, не имеющая участков флуоресценции (или имею‑ щая слабый красный оттенок флуоресценции); (2) зона собственно опухолевой ткани, характеризую‑ щаяся ярко‑розовым и/или фиолетовым оттенком флуоресценции; и (3) зона инфильтрированного опухолью прилежащего мозгового вещества с «неопределенной» флуоресценцией. Idoate et al. [8] при изучении взаимосвязи между патогистоло‑ гическими характеристиками вышеперечисленных зон и степенью флуоресценции с 5‑АЛК пришли к заключению, что интенсивность флуоресценции напрямую зависит от значения клеточной плот‑ ности опухоли.
Многими исследованиями доказана высокая эффективность применения флуоресцентной на‑ вигации с 5‑АЛК (ФН‑5‑АЛК) в хирургии ГВЗ. Более того, ряд авторов утверждают, что приме‑ нение ФН‑5‑АЛК при микронейрохирургической резекции ГВЗ позволяет увеличить не только СРО, но и общую выживаемость пациентов [9–11]. Тем не менее при поиске литературных источников в базах данных Pubmed, Medline и e‑Library нами не найдены исследования по применению ФН‑5‑АЛК в хирургии ГВЗ, основанные на сопоставлении нейровизуализационных, интраоперационных параметров и клинических результатов.
Цель исследования – провести анализ резуль‑ татов применения ФН‑5‑АЛК в хирургии ГВЗ путем изучения и сопоставления нейровизули‑ зационных характеристик, интраоперационных параметров и клинических результатов.
Материал и методы
Выполнено нерандомизированное ретроспек‑ тивное когортное моноцентровое исследование на базе Центра нейрохирургии НУЗ «Дорожная кли‑ ническая больница на ст. Иркутск‑Пассажирский» ОАО «РЖД‑Медицина» (Иркутск, Россия) в период с января 2015 г. по сентябрь 2017 г.
Критерии включения: в исследование включены все случаи впервые диагностированных ГВЗ го‑ ловного мозга, прооперированных с применением ФН‑5‑АЛК. Критериями исключения являлись: случаи рецидивов ГВЗ, ранее выполненные опера‑ тивные вмешательства по поводу ГВЗ, состояние после химио‑ и лучевой терапии, а также индекс Карновского менее 50 %. Протокол исследования одобрен этическим комитетом ФГБОУ ВО «Иркут‑ ский государственный медицинский университет» Министерства здравоохранения РФ (протокол № 7 от 10.02.17). Исследование проводилось в соответствии с принципами надлежащей клиниче‑ ской практики и Хельсинкской декларации. Перед началом исследования пациенты дали письменное информированное согласие.
Всем пациентам в предоперационном периоде выполнялась магнитно‑резонансная томография (МРТ) головного мозга с внутривенным контра‑ стированием в различных режимах (стандартные Т1‑ и Т2‑взвешенные изображения) (рис. 1а–в). За 2–4 ч до операции все пациенты перорально принимали препарат Аласенс ® (НИОПИК, Россия), содержащий соль 5‑АЛК в дозе 20 мг/кг. Операции выполнялись с помощью операционного микроскопа OPMI Pentero 900 (Carl Zeiss, Гер‑ мания), оснащенного режимом флуоресцентной навигации Blue‑400. Во всех случаях микроней‑ рохирургическое удаление ГВЗ осуществлялось одной хирургической бригадой и под контролем интраоперационной нейронавигации СURVE
(Brainlab, Германия) (рис. 1г, д). После основного этапа операции ложе новообразования повторно осматривалось в режиме Blue‑400 на предмет наличия остаточной опухолевой ткани. Микро‑ нейрохирургическая резекция опухоли прекра‑ щалась при отсутствии визуализации последней в обычном световом режиме и при контрольном осмотре ложа опухоли в режиме флуоресцент‑ ной навигации или при расположении опухоли в функционально значимой зоне головного мозга по данным интраоперационной нейронавигации. В послеоперационном периоде всем пациентам повторно выполнялась МРТ головного мозга с внутривенным контрастированием в различных режимах с целью оценки объема выполненной резекции опухоли (рис. 1е–з).
Адъювантная химиолучевая терапия ГВЗ про‑ водилась в соответствии с клиническими реко‑
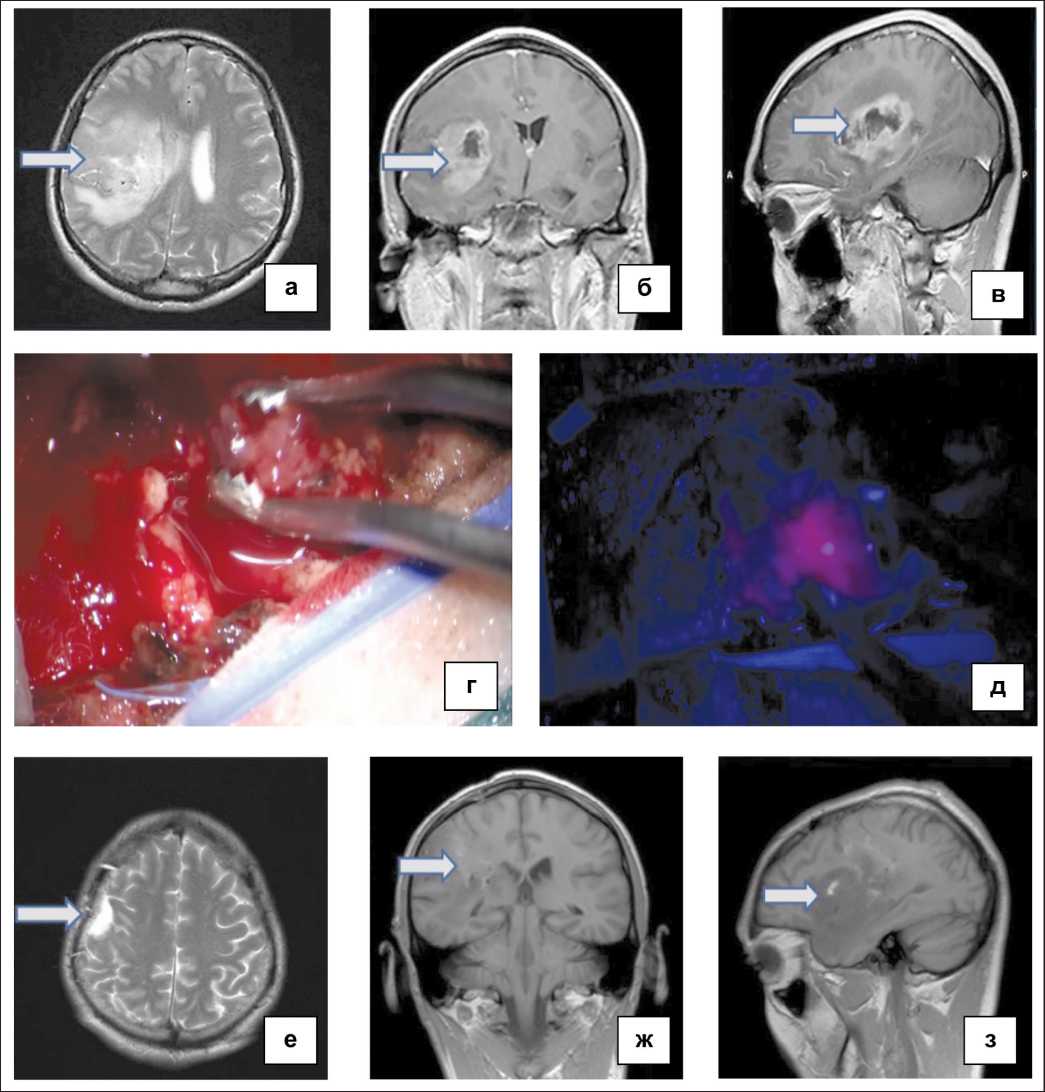
Рис. 1. Пациент Ч., 43 лет. Диагноз: ГВЗ правой височной и теменной долей головного мозга.
По данным гистологического исследования и ИГХ: глиобластома (IV степень злокачественности по ВОЗ), индекс пролиферативной активности Ki67 – 87 %. Примечание:
а, б, в – предоперационная МРТ (Т1-, Т2-взвешенные изображения) головного мозга с внутривенным контрастированием;
г, д – интраоперационные фотографии опухолевой ткани в обычном световом режиме и в режиме Blue-400;
е, ж, з – послеоперационная МРТ (Т1-, Т2-взвешенные изображения с внутривенным контрастированием)
мендациями Ассоциации нейрохирургов России. У части пациентов с глиобластомой применялся таргетный препарат бевацизумаб.
При оценке полученных результатов были определены значения СРО, особенности интра‑ операционной флуоресценции различных типов ГВЗ и возможность определения границ опухоли с прилежащим веществом головного мозга при использовании ФН‑5‑АЛК, а также изучены по‑ казатели функционального статуса пациентов по индексу Карновского.
СРО оценивалась на основании МРТ‑сканов в различных режимах, полученных с помощью ап‑ парата МРТ Siemens Magnetom Essenza 1,5 Т (Гер‑ мания) до и после введения контрастного вещества Ультравист ® (Bayer Schering Pharma AG, Германия). Для оценки СРО использовались критерии Vogelbaum et al. [12], по которым удаление более 90–98 % опухоли соответствует максимальной или тотальной СРО, менее 90 % – субтотальной СРО. МРТ выполнялась в первые 72 ч после операции. Полученные МРТ‑сканы анализировались двумя специалистами, подсчет СРО выполнялся с помо‑ щью программного обеспечения RadiAnt DICOM Viewer.
Особенности флуоресценции опухолевой ткани, а также визуализация границ между опухолью и прилежащим веществом головного мозга оцени‑ вались как интраоперационно, так и по данным видеозаписей.
Статистическую обработку данных проводили c помощью программного обеспечения Microsoft Excel 2010. Все измерения проверены на нормаль‑ ность с помощью теста Колмогорова – Смирнова. Полученные данные оценены с помощью методов описательной статистики (абсолютных и относи‑ тельных величин). Категориальные переменные выражены в процентах. Статистический анализ для категориальных переменных проводился с по‑ мощью критерия χ2. В случае полученных значений менее 10 использовался точный критерий Фишера. Порог значимости р выбран равным 0,05.
Результаты
В исследование включены 48 пациентов (30 мужчин и 18 женщин) в возрасте от 35 до 76 лет (средний возраст – 47,3 ± 8,4 года), прооперирован‑ ных по поводу впервые диагностированных ГВЗ головного мозга. При гистологическом исследо‑ вании у 33 (68,75 %) пациентов верифицированы глиобластомы (IV cтепень злокачественности по классификации ВОЗ) и у 15 (31,25 %) – глиомы III cтепени злокачественности по классификации ВОЗ (анапластические астроцитомы, олигоастро‑ цитомы и олигодендроглиомы) (табл. 1).
Анализ СРО показал, что в 40 (83,3 %) случаях впервые диагностированных ГВЗ удалось до‑ стигнуть максимальной СРО (90–98 %). При этом 90–98 % СРО достигнута у 11 (22,9 %) пациентов с
ГВЗ, расположенными в функционально значимых зонах (первичная двигательная и чувствительная кора больших полушарий головного мозга, ба‑ зальные ядра, таламус, гипоталамус, ножки мозга и хвостатое ядро) и у 25 (52,1 %) пациентов с ГВЗ функционально незначимых областей головного мозга (р=0,036). Максимальная СРО выполнена у 28 (58,3 %) пациентов с глиобластомами и у 12 (25 %) пациентов с глиомами III степени злокаче‑ ственности (p=0,408). Кроме того, максимальная СРО достигнута при микронейрохирургическом удалении 9 (18,75 %) ГВЗ, имеющих объем ≥9 см3 и 21 (43,75 %) ГВЗ объемом < 9см3 (р=0,029) .
При визуализации опухолевой ткани в режиме Blue‑400 во всех случаях отмечалась отчетливая флуоресценция в виде ярко‑розового или фиоле‑ тового свечения. Стоит отметить, что у 24 (50,0 %) пациентов с глиобластомами и у 1 (2,1 %) пациента с анапластической астроцитомой (р=0,003), а также в 10 (20,8 %) случаях ГВЗ объемом ≥9 см3 и в 17 (35,4 %) ГВЗ объемом <9 см3верифицирован трех‑ зональный характер флуоресценции опухолевой ткани и прилежащего мозгового вещества.
При сопоставлении данных ФН‑5‑АЛК и интрао‑ перационной нейронавигации у 28 (58,3 %) паци‑ ентов границы опухолевой ткани не совпадали. Во всех указанных случаях границы опухоли на этапе микронейрохирургического удаления определялись с помощью интраоперационной навигации. Расхо‑ ждения в полученных данных относительно границ опухолей отмечены у 19 (39,5 %) пациентов с глио‑ бластомами и в 3 (6,25 %) случаях глиом III степени злокачественности (p=0,014), а также в 9 (18,75 %) случаях ГВЗ объемом ≥9 см3 и в 14 (29,2 %) случаях ГВЗ, имеющих объем <9 см3 (p=0,677).
таблица 1
Клинико-хирургическая характеристика пациентов
|
Параметры |
Количество |
|
пациентов (n=48) |
|
|
Пол |
|
|
Мужчины |
30 (62,5 %) |
|
Женщины |
18 (37,5 %) |
|
Средний возраст |
47,3 ± 8,4 лет |
|
Степень злокачественности ГВЗ по классификации ВОЗ |
|
|
ГБМ (IV ст.) |
33 (68,75 %) |
|
Анапластическая астроцитома (III ст.) |
10 (20,84 %) |
|
Анапластическая олигоастроцитома (III cт.) |
3 (6,25 %) |
|
Анапластическая олигодендроглиома (III ст.) |
2 (4,17 %) |
|
Локализация ГВЗ |
|
|
Функционально значимая зона |
19 (39,5 %) |
|
Функционально незначимая зона |
29 (60,4 %) |
|
Объем ГВЗ |
|
|
≥9 см3 |
17 (35,4 %) |
|
<9 см3 |
31 (64,5 %) |
При оценке функционального статуса до и по‑ сле оперативного вмешательства установлено, что у 36 (75 %) пациентов отмечено улучшение функ‑ ционального статуса по индексу Карновского – с 63,8 ± 7,6 до 82,3 ± 4,3 балла, в 9 (18,75 %) случаях статус пациентов остался на прежнем уровне, в среднем – 57,6 ± 7,2 балла, у 3 (6,25 %) пациентов отмечено ухудшение функционального статуса – с 53,3 ± 5,7 до 36,6 ± 5,7 балла.
Обсуждение
Как отмечалось выше, СРО при ГВЗ представ‑ ляет собой важнейший прогностический фактор для данной группы пациентов. Полученные нами результаты, касающиеся СРО, во многом согласу‑ ются с некоторыми данными мировой литерату‑ ры. Так, по данным Schucht et al. [13], показатель тотальной СРО в среднем составил 89 %. При этом тотальная СРО при ГВЗ, расположенных в функционально незначимых зонах, составила 97 %, а при ГВЗ функционально значимых областей головного мозга – 74 %. В отечественном иссле‑ довании [14] показано, что применение методики ФН‑5‑АЛК позволяет достигнуть максимальной или тотальной СРО лишь в 65 % случаев. Stum‑ mer et al. [15] также достигли 65 % тотальной СРО у пациентов с ГВЗ. Тем не менее необходимо учесть тот факт, что данные наблюдения носили характер рандомизированных контролируемых мультицентровых с включением большого коли‑ чества пациентов. Высокие показатели тоталь‑ ной или максимальной СРО при ГВЗ головного мозга, представленные в настоящих клинических сериях, во многом обусловлены развитием и со‑ вершенствованием интраоперационных методов нейронавигации и картирования головного мозга. С другой стороны, сохранение функциональной активности определенных зон головного мозга и улучшение качества жизни пациентов являются основными задачами в хирургическом лечении пациентов с ГВЗ, в результате чего возникает противоречие между достижением максимальной СРО и сохранением функциональной активности определенных областей головного мозга. В том же исследовании Stummer et al. [15] наглядно про‑ демонстрировано, что остаточный объем ГВЗ по данным послеоперационных МРТ‑грамм голов‑ ного мозга достоверно больше при локализации последних в функционально значимых областях го‑ ловного мозга. Авторы пришли к заключению, что близость ГВЗ к функционально значимой зоне го‑ ловного мозга является достоверным независимым фактором высоких значений остаточных объемов опухолей. По этой причине применение ФН‑5‑АЛК и нейрофизиологического мониторинга при микро‑ нейрохирургическом удалении ГВЗ представляет собой перспективное направление в современной нейроонкологии. Feigl et al. [16] проанализированы результаты хирургического лечения 18 пациентов с ГВЗ, расположенных в функционально значимых зонах головного мозга, с применением ФН‑5‑АЛК и нейрофизиологического мониторинга. При этом максимальной СРО удалось достигнуть в 64 %, у 24 % пациентов оперативное вмешательство пре‑ кращено, согласно данным нейромониторинга, ухудшение неврологического дефицита отмечено в 11 % случаев. Della Puppa et al. [17] оценены результаты хирургического лечения 31 пациента с ГВЗ функционально значимых зон головного мозга. Тотальная СРО отмечена у 93 % пациен‑ тов, в 26 % случаев оперативное вмешательство приостановлено согласно показателям нейрофи‑ зиологического мониторинга и в 3 % случаев вери‑ фицировано ухудшение клинико‑неврологического статуса. Результаты ряда работ, посвященных мультимодальному применению ФН‑5‑АЛК с нейрофизиологическим мониторингом в хирургии ГВЗ функционально значимых зон, в целом согла‑ суются с вышеуказанными данными [13, 18].
Анализ исследований, посвященных функцио‑ нальному статусу пациентов после оперативных вмешательств с применением ФН‑5‑АЛК по пово‑ ду ГВЗ головного мозга, показывает, что данная ме‑ тодика в большинстве случаев позволяет улучшить статус пациентов. В 34 (85 %) случаях отмечено улучшение функционального статуса пациентов по шкале Карновского после выполнения микроней‑ рохирургической резекции глиобластом с примене‑ нием ФН‑5‑АЛК – с 65,5 ± 14,4 до 70,4 ± 15 баллов [14]. В работе Stummer et al. [15] наглядно под‑ тверждено улучшение функционального статуса у 39 (75 %) пациентов с ГВЗ головного мозга после выполнения оперативного вмешательства. Ана‑ логичные результаты получены в проспективном когортном исследовании, основанном на анализе результатов хирургического лечения 85 пациентов с ГВЗ головного мозга [9]. По нашим данным, у 36 (75 %) пациентов отмечено улучшение функцио‑ нального статуса по индексу Карновского с 63,8 ± 7,6 до 82,3 ± 4,3 балла, что в целом согласуется с результатами указанных исследований.
Пробудительная хирургия («awake surgery») является золотым стандартом хирургического ле‑ чения пациентов с внутримозговыми опухолями, расположенными в или вблизи функционально зна‑ чимых областей. Основная цель ее применения – достижение максимальной СРО с минимальным повреждением прилежащего вещества головного мозга. В метаанализе доказано, что пробудитель‑ ная хирургия позволяет значимо снизить частоту неврологического дефицита на 58 % и увеличить процент СРО [19]. С другой стороны, Chang et al. [20] сообщают, что пробудительная хирургия ис‑ пользуется нейрохирургами лишь в 22 % случаев глиом головного мозга. Авторы предполагают, что низкая распространенность применения методики обусловлена сложностью как для оперирующего нейрохирурга, так и для нейроанестезиолога, а также большим количеством противопоказаний и высоким процентом отказов пациентов. Hervey‑ Jumper et al. [21] представлен самый большой опыт применения пробудительной хирургии у пациентов с опухолями головного мозга (859). Авторами от‑ мечена высокая эффективность данной методики в лечении пациентов с опухолями функционально значимых областей головного мозга с низкой ча‑ стотой нежелательных явлений. Тем не менее при предоперационном планировании необходимо учи‑ тывать возможные факторы риска: балл по шкале Американского общества анестезиологов (ASA, American Society of Anesthesiologists), значение индекса массы тела, сопутствующую нозологию, наличие психопатологической симптоматики, курение, а также признаки масс‑эффекта и пери‑ туморального отека вещества головного мозга. В целом методика пробудительной хирургии яв‑ ляется относительно безопасной и эффективной при микронейрохирургической резекции опухолей головного мозга, расположенных в или вблизи функционально значимых областей.
Комбинированное использование ФН‑5‑АЛК и интраоперационной нейронавигации является высокоэффективным способом хирургического ле‑ чения пациентов с опухолями центральной нервной системы, в том числе и с ГВЗ головного мозга. Как известно, при микронейрохирургической резекции объемных образований головного мозга его струк‑ туры могут смещаться в операционном поле и тем самым затруднять нейрохирургу визуализацию границ опухоли («brain shift»). По этой причине ис‑ пользование интраоперационной нейронавигации, основанной на данных предоперационной МРТ, мо‑ жет привести к определению ложных границ ГВЗ, особенно при локализации последних в функцио‑ нально значимых зонах головного мозга. По дан‑ ным ряда авторов, различия в определении границ ГВЗ при ФН‑5‑АЛК и нейронавигации составляют 25–64 % [2, 3, 9, 11]. Della Puppa et al. [17] показано, что несовпадение границ опухолей зарегистриро‑ вано в 34 (42 %) случаях глиобластом и 7 (53 %) глиом III степени злокачественности (р=0,549), а также в 29 (57 %) случаях ГВЗ объемом ≥9 см3 и в 12 (28 %) случаях – объемом <9 см3 (p<0,01). Результаты нашего исследования показывают, что при сопоставлении данных ФН‑5‑АЛК и интраопе‑ рационной нейронавигации у 28 (59,5 %) пациентов границы опухолевой ткани не совпадали. При этом расхождения в полученных данных относительно границ опухолей отмечены у 19 (39,5 %) пациентов с глиобластомами и в 3 (6,25 %) случаях глиом III степени злокачественности (p=0,681), а также в 12 (25 %) случаях ГВЗ объемом ≥9 см3 и в 14 (29,1 %) случаях ГВЗ, имеющих объем <9 см3 (p=0,012), что в целом согласуется с данными мировой литерату‑ ры. Решением проблемы может быть применение интраоперационной МРТ, позволяющей определить истинные границы и локализацию опухоли, а также ее взаимоотношение с функционально значимыми областями головного мозга [22]. Однако некоторые авторы опровергают высокую эффективность ме‑ тодики интраоперационной МРТ в определении истинных границ ГВЗ.
Влияние методики ФН‑5‑АЛК на показатели времени до прогрессирования и общей выживае‑ мости пациентов с ГВЗ является предметом дис‑ куссий. Некоторыми исследователями получены данные о значимом влиянии ФН‑5‑АЛК на общую выживаемость пациентов с ГВЗ [3]. Другие авторы не обнаружили указанной зависимости [9–11]. В ранее опубликованном нами метаанализе, посвя‑ щенном изучению эффективности ФН‑5‑АЛК в хирургии глиобластомы, наглядно продемонстри‑ ровано, что имеет место разница в показателях общей выживаемости между группой пациентов, прооперированных с использованием ФН‑5‑АЛК и без ее применения. Необходимо отметить тот факт, что при анализе указанных данных отмечался широкий 95 % ДИ и высокая степень гетероген‑ ности. Это обусловлено тем, что часть пациентов с глиобластомой из указанных клинических серий подвергались повторному оперативному лечению с применением ФН‑5‑АЛК. Учитывая результаты данных исследований, а также отсутствие реги‑ страции других методов лечения, не представ‑ ляется возможным утверждать, что применение ФН‑5‑АЛК в хирургии глиобластом дает значи‑ тельное преимущество в общей выживаемости пациентов [3].
Представленное исследование имеет ряд не‑ достатков, которые необходимо обозначить. Ис‑ следование имеет ретроспективный характер и включает небольшое количество пациентов, что не могло не отразиться на результатах статистиче‑ ской обработки данных. Кроме того, при выборе тактики ведения пациентов нами не учитывались молекулярно‑генетические особенности ГВЗ: му‑ тация изоцитратдегидрогеназы‑1 и статус метили‑ рования метилгуанин‑ДНК‑метилтрансферазы.
Заключение
Применение ФН‑5‑АЛК при микронейрохирур‑ гической резекции ГВЗ различных локализаций позволяет в большинстве случаев достигнуть тотальной СРО. Размеры ГВЗ и их локализация являются важнейшими факторами в достижении максимальной СРО. Тем не менее для объективной оценки эффективности методики ФН‑5‑АЛК в хирургическом лечении ГВЗ головного мозга необ‑ ходимо проведение крупных рандомизированных мультицентровых исследований на большем коли‑ честве респондентов и с комплексным применени‑ ем интраоперационных МРТ и нейронавигации.
Исследование выполнено при поддержке гранта Российского научного фонда (проект №14-32-00006).
Список литературы Анализ результатов применения флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиом высокой степени злокачественности
- Бывальцев В.А., Степанов И.А., Белых Е.Г., Яруллина А.И. Молекулярные аспекты ангиогенеза в глиобластомах. Вопросы онкологии. 2017; 63 (1): 19-27.
- Belykh E., Martirosyan N.L., Yagmurlu K., Miller E.J., Eschbacher J.M., Izadyyazdanabadi M., Bardonova L.A., Byvaltsev V.A., Nakaji P., Preul M.C. Intraoperative Fluorescence Imaging for Personalized Brain Tumor Resection: Current State and Future Directions. Front Surg. 2016 Oct 17; 3: 55
- Бывальцев В.А., Степанов И.А. Применение флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиобластомы: метаанализ. Сибирский онкологический журнал. 2017; 16 (4): 54-64. DOI: 10.21294/1814-4861-2017-16-4-54-64
- Keles G.E., Lamborn K.R., Chang S.M., Prados M.D., Berger M.S. Volume of residual disease as a predictor of outcome in adult patients with recurrent supratentorial glioblastomas multiforme who are undergoing chemotherapy. J Neurosurg. 2004; 100 (1): 41-46. DOI: 10.3171/jns.2004.100.1.0041
- Chaichana K.L., Jusue-Torres I., Navarro-Ramirez R., Raza S.M., Pascual-Gallego M., Ibrahim A., Hernandez-Hermann M., Gomez L., Ye X., Weingart J.D., Olivi A., Blakeley J., Gallia G.L., Lim M., Brem H., Quinones-Hinojosa A. Establishing percent resection and residual volume thresholds affecting survival and recurrence for patients with newly diagnosed intracranial glioblastoma. Neuro Oncol. 2014 Jan; 16 (1): 113-22. DOI: 10.1093/neuonc/not137


