Анализ результатов применения методики чрескожной пункционной эндоскопической гастростомии
Автор: Фролова Е.В., Емельянов С.И., Самсонян Э.Х., Луцевич О.Э., Богданов Д.Ю., Баширов Р.А., Секундова М.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
Введение. Увеличение частоты применения минимально инвазивных, в том числе эндоскопических, методик в хирургии обусловливает необходимость выбора наиболее рациональной, технически безопасной и клинически эффективной оперативной техники.Цель исследования - сравнение результатов применения двух методик установки чрескожной пункционной эндоскопической гастростомии (ЧПЭГ) - методика «на себя» и «от себя».Материал и методы исследования. Были изучены результаты установки ЧПЭГ у 103 пациентов. Все пациенты были разделены на 2 группы: группа 1 - 53 случая установки ЧПЭГ по методике «на себя» и группа 2 - 50 случаев установки ЧПЭГ по методике «от себя».Результаты исследования. Технический успех достигнут в 100 % случаев, при этом оперативная техника «на себя» установки ЧПЭГ продемонстрировало явные технические преимущества. Клинический успех в группе 1 наблюдался у 100 % больных, а в группе 2 - у 98 % пациентов (p>0,05). Время оперативного вмешательство в группе 1 составило 12,2±3,4 минуты, в группе 2 - 22,3±3,6 минут (р > 0,05). Общий процент осложнений в обеих группах составил 13,5 %: в группе 1 было зафиксировано 6 случаев осложнений, в группе 2-8 случаев осложнений. 30-дневный показатель летальности в группе 1 составил 5,7 % (3 пациента), в группе 2-2 % (1 пациент).Заключение. ЧПЭГ у пациентов с дисфагией различного генеза характеризуется хорошими результатами независимо от применяемых методик. Применение методики установки ЧПЭГ «на себя» является более простым в техническом плане.
Гастростома, чрескожная пункционная эндоскопическая гастростомия
Короткий адрес: https://sciup.org/142241726
IDR: 142241726 | УДК: 616.33-072.1-71 | DOI: 10.17238/2072-3180-2024-2-12-22
Текст научной статьи Анализ результатов применения методики чрескожной пункционной эндоскопической гастростомии
В последние годы, на фоне роста частоты применения минимально инвазивных, в том числе эндоскопических, методик в хирургии, именно методика чрескожной пункционной эндоскопической гастростомии (ЧПЭГ) может быть применена у пациентов с невозможностью перорального питания длительностью свыше 1 месяца. Энтеральное питание, осуществляемое через ЧПЭГ, является более физиологичным в сравнении с парентеральным, так как оно связано с наименьшим риском осложнений в отличии от кормления через назогастральный или назоинтестинальный зонд, менее травматично и менее финансово затратно по сравнению с хирургической лапара-томной и лапароскопической гастростомией [1, 2].
В настоящее время наиболее часто применяются методики ЧПЭГ «на себя» – «pull-technique» и «от себя» – «push-technique». Отличием этих методик друг от друга является то, что при методике ЧПЭГ «на себя» гастростомическая трубка проводится через желудок на переднюю брюшную стенку, а при методике «от себя» – через переднюю брюшную стенку в желудок, после предварительной гастропексии и, в некоторых случаях, дилатации гастростомического канала.
Более распространённой считается методика ЧПЭГ «на себя», впервые выполненная в 1979 году хирургами M.W. Gauderer и J.L. Ponsky ребёнку в возрасте 4,5 месяцев с дисфагией неврологической этиологии [3]. Со временем, внедрённая в практику M.W. Gauderer методика эндоскопической гастростомии, по сути, почти полностью заменила лапаротомную и лапароскопическую гастростомию, поскольку данная методика имеет меньший объём оперативной травмы, связана с более низкими рисками осложнений и смертности, экономически менее затратна [4]. Данная методика является более технически простой в применении, так как не требует дополнительной гастропексии и расширения гастростомического канала с помощью троакаров, в отличии от методики «от себя», что так же влияет на общее время манипуляции. Так же методика ЧПЭГ «от себя» сопровождается большим процентом частоты возникновения кровотечений, в связи с использованием Т-клемм во время гастропексии и траокара для расширения гастростомического канала, по сравнению с методикой ЧПЭГ «на себя» [5].
Однако, есть клинические случаи, когда применение методики ЧПЭГ «от себя» более целесообразно. Существуют исследования, подтверждающие риск трансплантации опухолевых клеток в область установки гастростомической трубки у пациентов с опухолью пищевода, при применении техники ЧПЭГ «на себя» [6]. Такой риск возникает при подтягивании устройства ЧПЭГ через ротовую полость в желудок и далее на переднюю брюшную стенку, когда устройство проходит участок опухоли в пищеводе и может обсеменяться опухолевыми клетками. По этому же принципу может происходить обсеменение устройства ЧПЭГ бактериями, находящимися в ротовой полости, что впоследствии может приводить к повышенному риску возникновения инфицирования раны в месте установки гастростомической трубки, однако, профилактическое применение антибактериальной терапии во время установки ЧПЭГ может снизить или вовсе устранить риск инфицирования [7].
Цель исследования. Провести сравнительный анализ результатов применения методик установки «на себя» и «от себя» чрескожной пункционной эндоскопической гастростомии.
Материалы и методы
В основу проведённого исследования положен сравнительный анализ результатов формирования чрескожной пункционной эндоскопической гастростомии (ЧПЭГ) у 103 пациентов, разделённых на две группы. В группу 1 вошли 53 пациента (51,5 %), которым была выполнена ЧПЭГ по методике «на себя». В группу 2 вошли 50 пациентов (48,5 %), которым была выполнена ЧПЭГ по методике «от себя». Показанием к выполнению ЧПЭГ была дисфагия различного генеза, требующая длительного энтерального питания (свыше 4 недель), что соответствует рекомендациям Европейского общества гастроинтестинальной хирургии по применению эндоскопического доступа с целью осуществления энтерального питания [1, 17].
С учётом нормативной базы, дизайна исследования и особенностей выбранного оперативного доступа нами были избраны следующие критерии включения пациентов: возраст 18 лет и старше; дисфагия различного генеза (неврологического, онкологического, травматического), требующая длительного (более 4 недель) осуществления энтерального питания; информированное, добровольное согласие пациента или его представителей на операцию и участие в исследовании.
Критериями исключения больных из исследования были выявление у пациента в ходе предоперационного обследования заболевания, влияющего на объем и характер оперативного вмешательства; невыполнение рекомендаций лечащего врача в послеоперационном периоде; отказ от прохождения контрольного обследования.
В рамках подготовки к оперативному вмешательству пациентам были выполнены необходимые, общепринятые инструментально-диагностические и лабораторные методы обследования.
В рамках подготовки к оперативному вмешательству оценивались данные лабораторной диагностики, в частности показателей крови (табл. 3). У всех пациентов была зафиксирована анемия лёгкой и средней степени тяжести со значениями уровня гемоглобина от 90 до 115 г/л. Другие показатели биохимического анализа крови и коагулограммы у исследуемых варьировались в пределах нормы.
Данные, представленные в таблицах 1, 2 и 3, демонстрируют, что сравниваемые группы были сопоставимы по всем основным учитываемым нами предоперационным показателям, что подтверждается отсутствием статистически значимых различий (р>0,05 для всех показателей).
Таблица 1 Основные лабораторные показатели, полученные в процессе предоперационного обследования пациентов в исследуемых группах
Table 1
Basic laboratory parameters obtained during the preoperative examination of patients in the study groups
|
Показатель Index |
Всего Total |
Группа 1 Group 1 |
Группа 2 Group 2 |
р |
|
Мужчины/женщины, n (%) male / female, n (%) |
48/55 (47 %/ 53 %) |
27/31 (51 %/ 49 %) |
21/24 (42 %/ 48 %) |
>0,05 |
|
Средний возраст, годы/ Average age, years |
– |
67±7,4 |
63±6,2 |
>0,05 |
|
Индекс массы тела, кг/м2/ Body mass index, kg/m2 |
– |
20,4±1,7 |
19,3±2,1 |
>0,05 |
|
Печёночная энцефалопатия, n (%)/ Hepatic encephalopathy, n (%) |
6 (5,8 %) |
4 (7,5 %) |
2 (4 %) |
>0,05 |
|
Асцит (умеренный), n (%)/ Ascites (moderate), n (%) |
8 (7,8 %) |
5(9,4 %) |
3 (6 %) |
>0,05 |
|
Длительность дисфагии, мес./ Duration of dysphagia, months |
– |
1,3±0,4 |
1,1±0,3 |
>0,05 |
Таблица 2
Причины дисфагии в исследуемых группах
Causes of dysphagia in the study groups
Table 2
Таблица 3 Основные лабораторные показатели, полученные в процессе предоперационного обследования пациентов в исследуемых группах
Table 3
Main laboratory parameters obtained during the preoperative examination of patients in the study groups
|
Показатель/ Index |
Группа 1/ Group 1 |
Группа 2/ Group 2 |
р |
|
Гемоглобин, г/л/ Hemoglobin, g/l |
10312 |
988 |
>0,05 |
|
Тромбоциты, тыс/мкл/ Platelets, thousand/µl |
317±110 |
298±102 |
>0,05 |
|
Протромбиновое время, сек Prothrombin time, sec |
11±3 |
12±2 |
>0,05 |
|
Протромбин по Квику, %/ Prothrombin according to Quick, % |
95,3±15,2 |
101±13,7 |
>0,05 |
|
МНО/ INR |
1,10±0,11 |
1,11±0,12 |
>0,05 |
|
АЧТВ, сек/ APTT, sec |
27±5,1 |
25±7,4 |
>0,05 |
|
Тромбиновое время, сек/ Thrombin time, sec |
17±3,1 |
20,1±2,9 |
>0,05 |
|
Фибриноген, г/л/ Fibrinogen, g/l |
2,9±1,2 |
3,1±1,1 |
>0,05 |
|
Общий белок, г/л/ Total protein, g/l |
66,2±7,2 |
71,2±7,2 |
>0,05 |
|
Альбумин, г/л/ Albumin, g/l |
42,6±8,1 |
43,1±11,4 |
>0,05 |
|
АЛТ, Ед/л ALT, U/l |
21±4,3 |
18±11,2 |
>0,05 |
|
АСТ, Ед/л/ AST, U/l |
29±6,3 |
23±13,7 |
>0,05 |
|
Общий билирубин, мкмоль/л/ Total bilirubin, µmol/l |
10,7±4,3 |
12,1±2,7 |
>0,05 |
Все оперативные вмешательства ЧПЭГ выполнялись строго натощак. Всем пациентам в день операции назначалась профилактическая доза антибактериального препарата широкого спектра действия из группы цефалоспоринов I поколения, в дозировке 1 грамм, внутривенно, за исключением пациентов, которые уже получали антибактериальную терапию в связи с сопутствующей патологией.
Оперативная техника. Оперативные вмешательства выполнялись в операционной под эндотрахеальным наркозом с целью снижения рисков развития аспирации, учитывая, что положение пациента на операционном столе – на спине. Оперативное вмешательство проводили врач-эндоскопист и ассистент (врач-эндоскопист или врач-хирург).
Для установки ЧПЭГ использовались готовые гастростоми-ческие наборы для первичной установки: фирма-производитель PULL – AVANOS (HALYARD) Kimberly-Clark MIC PEG – для установки ЧПЭГ по методике «на себя»; низкопрофильная гастростомическая питательная трубка – фирма–производитель HALYARD Kimberly-Clark MIC-KEY G Feeding Tubes – для установки ЧПЭГ по методике «от себя». Данные гастростоми-ческие трубки имеют различный диаметр. В зависимости от антропометрических данных пациента нами индивидуально подбирался диаметр трубки, чаще всего мы использовали трубку диаметрами 18 Fr, 20Fr, 24Fr.
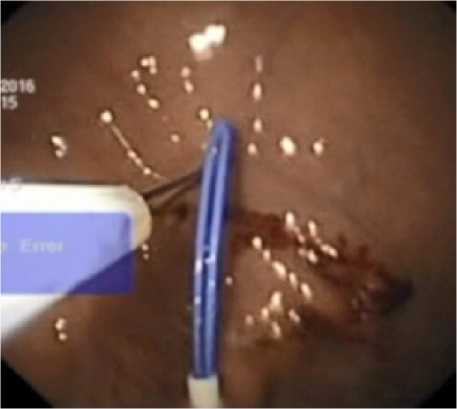
Рис. 2. Захват петлевого проводника эндоскопической петлей
Fig. 2. Capturing the loop conductor with an endoscopic loop
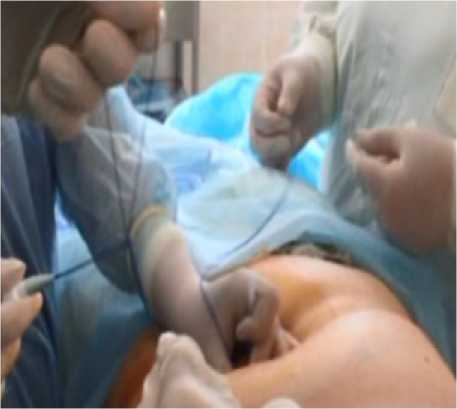
Рис. 3. Выведенный через ротовую полость проводник, к которому фиксируется гастростомическая трубка
Fig. 3. A conductor brought out through the oral cavity to which a gastrostomy tube is fixed
К дистальному концу проводника фиксировалась гастро-стомическая трубка и подтягивалась в желудок и далее на переднюю брюшную стенку, где фиксировалась при помощи антибампера, при этом положение внутреннего бампера контролировалось эндоскопически (рис. 4, рис. 5).
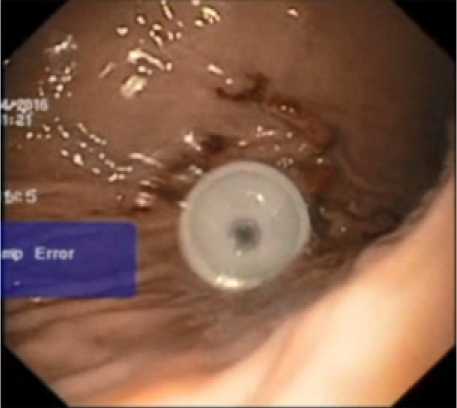
Рис. 4. Установленный внутренний бампер после подтягивания
Fig. 4. Installed inner bumper after tightening
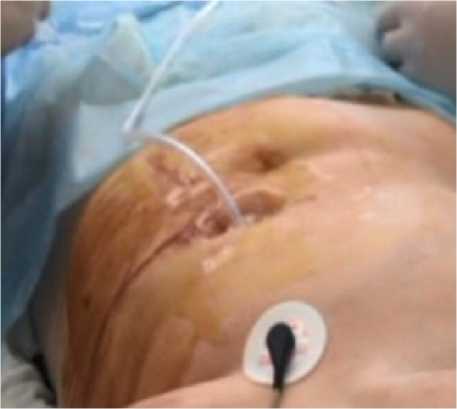
Рис. 5. Фиксация гастростомической трубки при помощи антибампера на передней брюшной стенке
Fig. 5. Fixation of the gastrostomy tube using an anti-bumper on the anterior abdominal wall
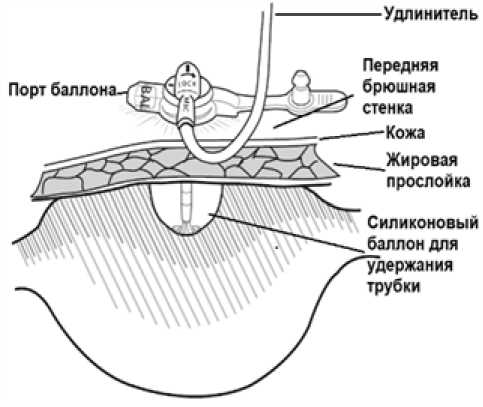
Порт баллон
Удлинитель
Передняя брюшная стенка
■—Кожа
Жировая прослойка
Силиконовый баллон для удержания трубки
Рис. 6. Схематическое изображение размещения низкопрофильной гастростомической трубки Fig. 6. Schematic illustration of low-profile gastrostomy tube placement
Проходимость гастростомической трубки контролировалась путём промывания последней.
В первые сутки пациентам с целью обезболивания назначались нестероидные противовоспалительные препараты. На следующий день после установки ЧПЭГ начиналась активизация пациента. Кормление через гастростому начинали через сутки после её установки – дробно, 8–10 раз в сутки вводили 80–120 мл измельчённой кашицеобразной пищи или питательной смеси, в такой же форме было разрешено введение лекарственных средств. До и после введения пищи гастростомическую трубку промывали 50 мл физиологического раствора. Для снижения рисков возникновения бампер – синдрома, у пациентов с гастро-стомической трубкой, установленной по методке «на себя», производили ежедневную её мобилизацию – прокручивали вокруг оси и с умеренно-дозированным усилием выталкивали внутрь.
Через месяц после того, как гастростомический канал был сформирован, пациентам, которым была установлена ЧПЭГ по методике «на себя», производилась замена стандартной гастростомической трубки на низкопрофильную.
В срок не позднее чем через 6 месяцев при необходимости продолжения энтерального питания производилась замена гастростомической трубки.
Результаты
Технический успех достигнут в 100 % случаев в группе 1 и в группе 2. Клинический успех в группе 1 наблюдался у 100 % больных, а в группе 2 – у 98 % пациентов (p>0,05). Время оперативного вмешательство в группе 1 составило 12,2±3,4 минуты, в группе 2 – 22,3±3,6 минут (р>0,05). Минимальный срок госпитализации в группе 1 составил 2 суток, максимальный срок – 7 суток, в группе 2, соответственно, – 3 и 7 суток, что не составило статистически значимой разницы (р>0,05) (табл. 4).
Таблица 4
Основные показатели выполненных оперативных вмешательств в исследуемых группах
Table 4
Immediate results of performed surgical procedures interventions in the study groups
|
Показатель/ Index |
Группа 1/ Group 1 |
Группа 2/ Group 2 |
р |
|
Технический успех/ Technical success |
100 % |
100 % |
>0,05 |
|
Клинический успех/ Clinical success |
100 % |
98 % |
>0,05 |
|
Время оперативного вмешательства (мин.)/ Surgery time (min.) |
12,2±3,4 |
22,3±3,6 |
>0,05 |
|
Срок госпитализации (сут.)/ Length of hospitalization (days) |
3,35±1,75 |
4,12±1,60 |
>0,05 |
Аспирационная пневмония наблюдалась у трёх пациентов: у 1 пациента в группе 1 (1,9 %) (на третьи сутки) и у 2 (4 %) пациентов в группе 2 (на четвертые сутки), вследствие чрезмерного ввода питательной смеси при осуществлении кормления. Все пациенты были переведены в отделение реанимации, где им была осуществлена санационная бронхоскопия, дезинтокси-кационная и антибиотикотерапия, с последующим лечением в отделениях терапевтического профиля.
В первые 7 дней после операции в 4 случаях (7,5 %) в группе 1 (на третьи сутки после операции) и в 2 случаях (4 %) в группе 2 (на третьи сутки после операции) наблюдалось локальное воспаление послеоперационной раны в месте размещения гастростомической трубки. Пациентам проводилась местная антибиотикотерапия с положительным эффектом с переводом пациентов на амбулаторное лечение.
Таблица 5
Непосредственные результаты выполненных оперативных вмешательств в исследуемых группах
Table 5
Immediate results of performed surgical procedures interventions in the study groups
|
Показатель/ Index |
Всего, n (%)/ Total, n (%) |
Группа 1, n (%)/ Group 1, n (%) |
Группа 2, n (%)/ Group 2, n (%) |
р |
|
Диффузное кровотечение/ Diffuse bleeding |
3 (2,9 %) |
0 |
3 (6 %) |
>0,05 |
|
Аспирационная пневмония/ Aspiration pneumonia |
3 (2,9 %) |
1 (1,9 %) |
2 (4 %) |
>0,05 |
|
Локальное воспаление послеоперационное раны/ Local inflammation of the postoperative wound |
6 (5,9 %) |
4 (7,5 %) |
2 (4 %) |
>0,05 |
|
«Бампер-синдром»/ «Bumper syndrome» |
1 (0,9 %) |
1 (1,9 %) |
0 |
>0,05 |
|
Миграция гастро-стомической трубки/ Gastrostomy tube migration |
1 (0,9 %) |
0 |
1 (2 %) |
>0,05 |
|
Всего:/ Total: |
14 (13,5 %) |
6 (11,3 %) |
8 (16 %) |
>0,05 |
В отдаленном послеоперационном периоде, при динамическом наблюдении за пациентами, на сроках от 3 до 6 недель, в обеих группах наблюдалось подтекание желудочного содержимого вокруг стомы вследствие закупорки гастростомической трубки: в 1 группе у 1 (1,9 %) пациента, во 2 группе у 2 (4 %) пациентов. Причинами закупорки гастростомической трубки во всех случаях явилось нарушение пациентами режима и вида питания и правил ухода за гастростомической труб- кой (закупорка гастростомической трубки произошла из-за введения пациентами более плотной по консистенции пищи и несоблюдения правил промывания). Данным пациентам была произведена замена гастростомической трубки на трубку большего диаметра.
30-дневный показатель летальности в группе 1 составил 5,7 % (3 пациента), в группе 2 – 2 % (1 пациент). Летальность в обеих группах была связана с развитием полиорганной недостаточности на фоне выраженной сопутствующей патологии и прогрессирования основного заболевания (табл. 6).
Таблица 6
Отдалённые результаты выполненных оперативных вмешательств в исследуемых группах
Table 6
Long-term results of surgical interventions performed in the study groups
|
Показатель/ Index |
Всего, n (%)/ Total, n (%) |
Группа 1, n (%)/ Group 2, n (%) |
Группа 2, n (%)/ Group 2, n (%) |
р |
|
«Бампер-синдром»/ «Bumper syndrome» |
0 |
0 |
0 |
– |
|
Миграция гастросто-мической трубки/ Gastrostomy tube migration |
0 |
0 |
0 |
– |
|
Подтекание желудочного содержимого вокруг стомы вследствие закупорки гастросто-мической трубки/ Leakage of gastric contents around the stoma due to blockage of the gastrostomy tube |
3 (2,9 %) |
1 (1,9 %) |
2 (4 %) |
>0,05 |
|
30-дневный срок летальности/ 30-day case fatality period |
4 (3,9 %) |
3 (5,7 %) |
1 (2 %) |
>0,05 |
Обсуждение
Чрескожная пункционная эндоскопическая гастростомия является малоинвазивной процедурой, обеспечивающей энтеральное питание у пациентов с длительной (свыше 4 недель) дисфагией различного генеза [1, 2, 8]. В нашем исследовании технический успех был достигнут в 100 % случаев. Клинический успех в группе 1 наблюдался у 100 % больных, а в группе 2 – у 98 % пациентов (p>0,05).
В своём одноцентровом ретроспективном исследовании Bouchiba at all. анализировали результаты выполнения ЧПЭГ у 854 пациентов. В общей сложности авторами было установлено 513 (61,6 %) гастростомий по методике «от себя» и 320 (38,6 %) – по методике «на себя». Размещение ЧПЭГ было успешным у 833 пациентов (97,5 %), что схоже с нашими результатами. В общей сложности у 854 пациентов было зарегистрировано 364 (42,6 %) осложнения, что значительно превышает общий процент осложнений в нашем исследовании (13,5 %), однако выборка в нашем исследовании значительно ниже. Смертность, связанная с ЧПЭГ, составила 0,2 %, в нашем исследовании смертность, связанная с ЧПЭГ, отсутствовала. 30-дневный срок летальности, не связанный с установкой ЧПЭГ, составил 4 %, что так же схоже с нашими результатами (3,9 %). В заключении исследования авторы пришли к выводу, что размещение ЧПЭГ по методикам «на себя» и «от себя» является безопасной процедурой с низким процентом смертности, связанной с ЧПЭГ [9].
Полученные нами результаты и сравнительный анализ применения двух методик формирования ЧПЭГ в целом продемонстрировали сходство с данными, проанализированными нами при анализе работ других исследователей.
Данные мировой литературы по поводу общего процента осложнений противоречивы и в среднем варьируются от 8 до 30 % [8, 10]. В нашем исследовании общий процент осложнений составил 13,5 %.
Инфекционные осложнения со стороны послеоперационной раны считаются самыми распространёнными при установке ЧПЭГ [11]. В нашем исследовании они так же составили самый высокий процент осложнений – 5,9 %. В случае с установкой ЧПЭГ по методике «на себя» это, вероятнее всего, связано с проведением гастростомической трубки через ротовую полость и обсеменением ее бактериальной микрофлорой, содержащейся непосредственно в ротовой полости и глотке [12], а также снижение общей сопротивляемости организма может вызвать инфекционные осложнения в области установки ЧПЭГ, что актуально для данной группы пациентов.
Умеренное диффузное кровотечение во время операции наблюдалось в 6 % случаев, у пациентов из группы 2, которым выполнялась установка ЧПЭГ по методике «от себя», что коррелируется с данными других исследователей, которые доказывают, что в связи с предшествующей гастропексией и бужированием гастростомического канала, техника «от себя», имеет более высокие риски развития кровотечений, чем техника «от себя» [9].
Миграция гастростомической трубки встречается с частотой от 13 до 30 % [10]. В нашем исследование миграция произошла в первые 10 дней после операции у 1 пациента, что показывает более низкий процент данного осложнения по сравнению с данными мировой литературы. Считается, что гастростоми-ческий тракт формируется в течение 4 недель. При миграции гастростомической трубки в срок до 4 недель, не рекомендуется повторное введение трубки в сформированный ранее гастро-стомический канал, так как из-за его незрелости возможен ряд осложнений, таких как неправильное расположение трубки в брюшной полости и как следствие подтекание желудочного содержимого в брюшную полость и возникновение перитонита. В данном случае ESGE рекомендует выполнить рестомию, после закрытия первоначального гастростомического канала, что и было выполнено в нашем исследовании [7].
Аспирационная пневмония в нашем исследовании была зафиксирована в трех случаях, которые были разрешены методами консервативной терапии (санационная бронхоскопия, инфузионная дезинтоксикационная и антибактериальная терапия) и была следствием чрезмерного кормления через гастро-стомическую трубку, которое в свою очередь выполнялось в полулежащем положении пациента. Ряд исследований показывают, что риск возникновения аспирационной пневмонии выше у пациентов, прошедших процедуру ЧПЭГ в связи с дисфагией неврологического генеза. Однако при осуществлении энтерального питания в данной группе пациентов риск аспирационной пневмонии гораздо ниже при использовании ЧПЭГ, чем при использовании назогострального зонда [15].
В нашем исследовании у 3-х пациентов (2,9 %) в обеих группах наблюдалось подтекание желудочного содержимого вокруг гастростомы вследствие закупорки гастростомической трубки. Все случаи были зафиксированы в период от 3 до 6 недель по- сле выписки из стационара и были следствием несоблюдения правил использования гастростомической трубки. Так как устранить закупорку консервативными методами не представлялось возможным, во всех случаях нами была произведена замена гастростомической трубки на трубку большего диаметра через существующий гастростомический канал. Алгоритм действия при незапланированной замене гастростомической трубки можно соотнести с алгоритмом действия при миграции гастростомической трубки. По данным литературы, в том числе и клиническим рекомендациям ESGE, замену гастростомиче-ской трубки через тот же гастростомический канал возможно произвести только после его созревания – на сроке около 4 недель. Если замена гастростомической трубки необходима в срок до 4 недель после установки, то рекомендовано выполнить рестомию недалеко от первичного гастростомического канала, после его заживления. При замене используют гастростоми-ческую трубку баллоного типа [7, 10].
Заключение
Методика ЧПЭГ у пациентов с дисфагией различного генеза характеризуется хорошими результатами независимо от применяемых методик оперативной техники. Наше исследование не показало статистически значимого различия между методиками установки ЧПЭГ. Наш оперативный опыт продемонстрировал, что установка ЧПЭГ по методике «на себя» имеет явные технические преимущества и может рассматриваться как приоритетный метод.
Список литературы Анализ результатов применения методики чрескожной пункционной эндоскопической гастростомии
- Arvanitakis M., Gkolfakis P., Despott E.J., Ballarin A., Beyna T., Boeykens K., Elbe P., Gisbertz I., Hoyois A., Mosteanu O., Sanders D.S., Schmidt P.T., Schneider S.M., van Hooft J.E. Endoscopic management of enteral tubes in adult patients - Part 1: Definitions and indications. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy, 2021, № 53(1), pp. 81-92. https://doi.org/10.1055/a-1303-7449
- McClave S.A., DiBaise J.K., Mullin G.E., Martindale R.G. ACG Clinical Guideline: Nutrition therapy in the adult hospitalized patient. Am J Gastroenterol, 2016, № 111, pp. 315-334. https://doi.org/10.1038/ajg.2016.28
- Gauderer M. Twenty years of percutaneous endoscopic gastrostomy: origin and evolution of a concept and its expanded applications. Gastrointestinal Endoscopy, 1999, № 50, pp. 879-883. https://doi.org/10.1016/s0016-5107(99)70186-0
- Stiegmann G.V., Goff J.S., Silas D., Pearlman N., Sun J., Norton L. Endoscopic versus operative gastrostomy: final results of a prospective randomized trial. Gastrointestinal Endoscopy, 1990, № 36, pp. 1-5. https://doi.org/10.1016/s0016-5107(90)70911-x
- Köhler G., Kalcher V., Koch O.O., Luketina R.R., Emmanuel K., Spaun G. Comparison of 231 patients receiving either “pull-through” or “push” percutaneous endoscopic gastrostomy. Surgical Endoscopy, 2015, № 29(1), pp. 170-175. https://doi.org/10.1007/s00464-014-3673-9
- Siu J., Fuller K., Nadler A., Pugash R., Cohen L., Deutsch K., Enepekides D., Karam I., Husain Z., Chan K., Singh S., Poon I., Higgins K., Xu B., Eskander A. Metastasis to gastrostomy sites from upper aerodigestive tract malignancies: a systematic review and meta-analysis. Gastrointestinal Endoscopy, 2020, № 91(5), pp. 1005-1014. https://doi.org/10.1016/j.gie.2019.12.045
- Arvanitakis M., Gkolfakis P., Despott E.J., Ballarin A., Beyna T., Boeykens K., Elbe P., Gisbertz I., Hoyois A., Mosteanu O., Sanders D.S., Schmidt P.T., Schneider S.M., van Hooft J.E. Endoscopic management of enteral tubes in adult patients - Part 2: Peri- and post-procedural management. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy, 2021, № 53(02), pp. 178-195. https://doi.org/10.1055/a-1331-8080
- Vujasinovic M., Ingre C., Silva F.B., Frederiksen F., Yu J., Elbe P. Complications and outcome of percutaneous endoscopic gastrostomy in a highvolume centre. Scandinavian Journal of Gastroenterology, 2019, №54(4), pp.513-518. https://doi.org/10.1080/00365521.2019.1594354
- Bouchiba H., Jacobs M.A.J.M., Bouma G., Ramsoekh D. Outcomes of push and pull percutaneous endoscopic gastrostomy placements in 854 patients: A single‐center study. JGH Open, 2022, № 6(1), pp. 57-62. https://doi.org/10.1002/jgh3.12694
- Anderloni A., Di Leo M., Barzaghi F., Maconi G., Manes G., Gullota R. Complications and early mortality in percutaneous endoscopic gastrostomy placement in lombardy: A multicenter prospective cohort study. Digestive and Liver Disease, 2019, № 51, pp. 1380-1387. https://doi.org/10.1016/j.dld.2019.03.024
- Rahnemai-Azar A.A., Rahnemaiazar A.A., Naghshizadian R., Kurtz A., Farkas DT. Percutaneous endoscopic gastrostomy: indications, technique, complications and management. World J Gastroenterol, 2014, № 20, pp. 7739-7751. https://doi.org/10.3748/wjg.v20.i24.7739
- Koide T., Inamori M., Kusakabe A., Uchiyama T., Watanabe S., Lida H., Endo H., Hosono K., Sakamoto U., Fujita K., Takahashi H., Yoneda M., Tokoro C., Yasuzaki H., Goto A., Yasunobu A., Kobayashi, Kubota K., Saito S., Nahajima A. Early complications following percutaneous endoscopic gastrostomy: results of use of a new direct technique. Hepatogastroenterology, 2010, № 57, pp. 1639-1644.
- McClave S.A., Chang W.K. Complications of enteral access. Gastrointestinal Endoscopy, 2003, № 58, pp. 739-751. https://doi.org/10.1016/S0016-5107(03)02147-3
- Kim Y.S., Oh Y.L., Shon Y., Yang H.D., Lee S.I., Cho E.Y., Choi C.S., Seo G.S., Choi S.C., Na Y.H. A case of buried bumper syndrome in a patient with a balloon-tipped percutaneous endoscopic gastrostomy tube. Endoscopy, 2006, № 38(2), pp. E41-2. https://doi.org/10.1055/s-2006-944675
- Ikenaga Y., Kusunoki T., Yamaguchi H. Percutaneous Endoscopic Gastrostomy Reduces Aspiration Pneumonia Rate in Stroke Patients with Enteral Feeding in Convalescent Rehabilitation Wards. Progress in Rehabilitation Medicine, 2021, № 6, pp. 1-10. https://doi.org/10.2490%2Fprm.20210031


