Анализ структуры промысла и динамики роста стада северного морского котика (Callorhinus ursinus) острова Тюлений в период эксплуатации и после её завершения
Автор: Жданова О.Л., Кузин А.Е., Фрисман Е.Я.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Математическое моделирование. Биология
Статья в выпуске: 1 т.27, 2024 года.
Бесплатный доступ
На основе длинных временных рядов данных биологического мониторинга стада северных морских котиков о-ва Тюлений, а также подробной информации о характере промысла из этой популяции проанализированы тенденции ее роста. Представлены результаты исследования изменений величины среднего репродуктивного успеха секача и возрастной структуры самцов северного морского котика о-ва Тюлений как показателей влияния промысла на репродуктивный потенциал популяции. Получено достаточно убедительное обоснование гипотезы о том, что промысел носил селективный характер: из популяции изымались наиболее продуктивные производители. Это привело к существенной перестройке возрастной структуры популяции и резкому замедлению роста ее численности, даже на фоне небольшого увеличения естественной выживаемости практически всех возрастных групп. Выявленная достаточно затяжная в последние годы близость индикатора потенциального роста к критическому единичному значению приводит к неутешительному прогнозу. Дальнейший рост численности популяции северного морского котика если и произойдет, то будет не быстрым. Для его ускорения необходима новая естественная перестройка структуры популяции: улучшение ее качественного состава и увеличение доли самцов с высоким репродуктивным успехом.
Callorhinus ursinus, результаты промысла, математическое моделирование, матричная модель, индекс потенциального роста
Короткий адрес: https://sciup.org/143182534
IDR: 143182534 | УДК: 591.526:51 | DOI: 10.31433/2618-9593-2024-27-1-21-35
Текст научной статьи Анализ структуры промысла и динамики роста стада северного морского котика (Callorhinus ursinus) острова Тюлений в период эксплуатации и после её завершения
Северный морской котик ( Сallorhin usursinus ), обитающий в северной части Тихого океана на островах Прибылова в Беринговом море, на Командорских и Курильских островах, а также острове Тюлений в Охотском море, долгое время был ценным промысловым объектом. Коммерческий промысел северных морских ко
тиков значительно сократил их численность на всем ареале обитания. Охота на них началась в конце 18 века на Командорских островах и вскоре после этого распространилась на Прибылов-ские, а также о. Тюлений. История коммерческого промысла на северных морских котиков хорошо документирована [7, 10, 15, 27, 38–39 и др.] и демонстрирует значительно изменяющуюся тактику эксплуатации, начиная от охоты без половой избирательности (промысел как самцов, так и самок) до экстренных мер по восстановлению катастрофически сокращающихся запасов. В 50–60-е гг. прошлого века на Прибыловских и Командорских островах в целях снижения плотности популяции котиков стратегия промысла позволяла изъятие части самок. Данное решение вскоре привело к резкому снижению численности популяции морского котика на этих островах [1, 7, 30, 35, 43]. Более щадящим режимом эксплуатации представлялось изъятие самцов-холостяков этого вида, которое начали практиковать на островах Прибыло-ва с 1835 г. [36, 38], на Командорских островах с 1871 г. и на о. Тюленьем с 1891 г. [2].
В середине прошлого века государства, на территориях которых простирается ареал обитания северного морского котика (это Канада, Япония, СССР и США), заключили четырехстороннюю международную Конвенцию по сохранению котиков северной части Тихого океана. В ходе её реализации проводились масштабные исследования биологии этих животных с ежегодной оценкой численности половых и возрастных групп на каждом из их крупных лежбищ, а также определялись условия и размер допустимой добычи. Однако на фоне многолетнего регулируемого промысла (несмотря на его предполагаемую биологическую обоснованность и оптимальность) в популяции морского котика о-ва Тюлений появились признаки депрессии [8, 9], наиболее явным проявлением которой стало уменьшение продукции новорожденных щенков к концу 80-х годов практически вдвое относительно средних значений предыдущего периода. Аналогичная картина наблюдалась и в других популяция морского котика северной части Тихого океана: Командорской и Прибылов-ской [7, 30, 35, 43, 45]. Промысел на о-ве Тюлений был значительно ограничен к 90-м годам, а после 2008 г. полностью прекращен, однако ожидаемого восстановления популяции не произошло, можно отметить только стабильный рост численности секачей, количество которых уже превысило максимум предыдущих периодов, при этом численность новорожденных щенков находится ниже уровня середины 60-х гг. прошлого века. Такая тенденция позволяет предположить, что на фоне промысла в популяции произошли значительные изменения, связанные с перестройкой внутрипопуляционных параметров, результатом которых стало снижение репродуктивного потенциала стада морских котиков. Более детально изучить имеющиеся данные наблюдений и выявить те внутрипопуляционные параметры, которые могут быть ответственны за стагнацию в этой популяции, является задачей настоящего исследования.
Известно, что основные факторы, определяющие динамику популяции, это рождаемость, смертность, иммиграции и эмиграции; учитывая крайнюю изолированность популяции о-ва Тюлений [14, 23], два последних фактора можно исключить из рассмотрения и связывать динамику популяционного роста только с соотношением величин рождаемости и выживаемости. Оценкам выживаемости различных половозрастных групп северного морского котика на основе доступных данных наблюдений за более чем полувековой период посвящена серия наших предыдущих исследований [3–5]. Помимо данных учётов ежегодной численности секачей и суммарного объема промысла, численности новорожденных щенков на лежбище (1958–2013 гг.) использовалась информация о возрастном составе животных, добытых в ходе берегового промысла (1958–2008 гг.), а также данные учета физиологического состояния и возрастного состава самок в морских пробах (доступных за период 1958–1988 гг.). Наши расчеты [4] показали, что весь наблюдаемый период (с 1958 по 1988 гг.) в поселении снижалась выживаемость самок младших возрастных групп, уменьшалась их общая численность, а также происходило старение женской части популяции. Позже (после 1988 г.) ситуация изменилась: ювенильная выживаемость самок значительно увеличилась, демонстрируя положительные тенденции динамики их численности. Последний вывод представляет собой результат численных экспериментов, в ходе которых были получены оценки минимально допустимых выживаемостей самок, необходимых для достижения ими того уровня численности, при котором они могли бы произвести наблюдаемое на лежбище количество новорожденных щенков в позднем периоде. Подчеркнем, что реальных учётов численности самок этой популяции после 1988 г. не производилось, поэтому мы вынуждены использовать наблюдаемую численность новорожденных щенков как единственно доступную нижнюю границу оценки численности половозрелых самок. Значительно больше данных наблюдений имеется для самцовой части популяции, кроме того, она была подвержена длительному коммерческому промыслу. Наши расчёты [48] показали, что выживаемость ювенильной группы самцов не демонстрирует видимого снижения на протяжении всего периода наблюдений, а выживаемости их старших групп даже имеют тенденцию к росту (рис. 1а), од-
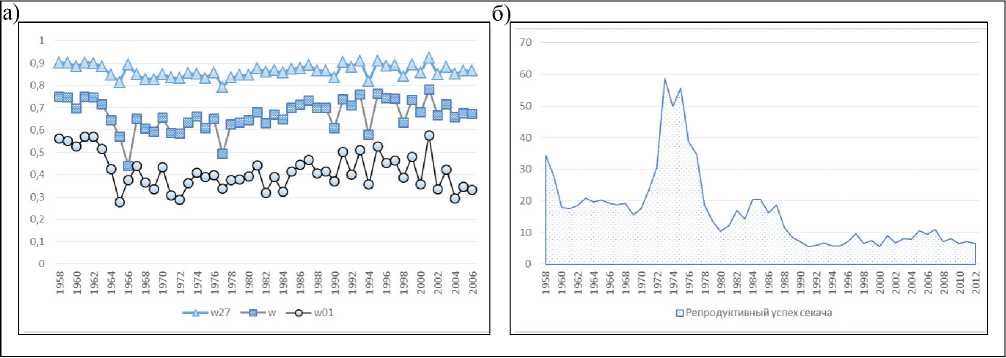
Рис. 1. (а) Расчётная динамика выживаемостей различных возрастных групп самцов (w01 – ювенильной, w27 – холостяков и w – секачей).
(б) Наблюдаемая динамика репродуктивного успеха секача (P(n+1)/M7+(n))
Fig. 1. The calculated dynamics of survival rates for different age groups of males w01 – juvenile, w27 – subadults, and w – bulls). (б) Observed dynamics of the bulls reproductive success нако значительно снизился репродуктивный успех секача, который можно представить как среднее количество новорожденных щенков, появившихся в следующем году, на одного секача текущего года (P(n+1)/M7+(n)) (рис. 1б). Все это может говорить об изменении генофонда популяции и более остро ставит вопрос об изучении эволюционных последствий промысла.
В данной работе на базе матричной модели динамики наблюдаемой части популяции (самцов) мы оценим среднюю скорость роста и стационарный возрастной состав этой части популяции по средним оценкам рождаемости и выживаемости для периодов различной динамики; проанализируем динамику промысла: изменение общего объема и возрастного состав промысловых животных в разные периоды времени. Это исследование приблизит нас к пониманию основных причин затяжной депрессии и прояснит возможности ее преодоления.
Модель динамики численности и возрастной структуры самцов популяции северного морского котика о-ва Тюлений
На данном этапе, используя оценки выживаемости каждой возрастной группы самцов и среднего репродуктивного успеха секача (рис. 1), даже не рассматривая явно динамику самок, мы можем провести подробный модельный анализ динамики численности и возрастной структуры самцовой части популяции. Для этого естественно воспользо- ваться хорошо разработанным, мощным аппаратом матричных моделей [12, 19]. Представим жизненный цикл самцов популяции северного морского котика в идее графа, приведенного на рис. 2.
В соответствии с этим графом динамику численности и возрастного состава рассматриваемой части популяции описывает модель Лес-ли-Лефковича:
M ( n +1)= A ∙ M ( n) (1)
Вектор-столбец M ( n )=( M0 ( n ), M1 ( n ), M2 ( n ), M3 ( n ), M4 ( n ), M5 ( n ) M6 ( n ), M7+ ( n )) T представлен численностями самцов соответствующего возраста в n -м году.
Заметим, что численность новорожденных самцов M 0( n ) равна половине численности всех новорожденных щенков P ( n ), а репродуктивная группа секачей ( M7+ ) представлена половозрелыми самцами всех возрастов от семи лет и старше.
Проекционная матрица А, состоящая из коэффициентов модели, имеет следующий вид:
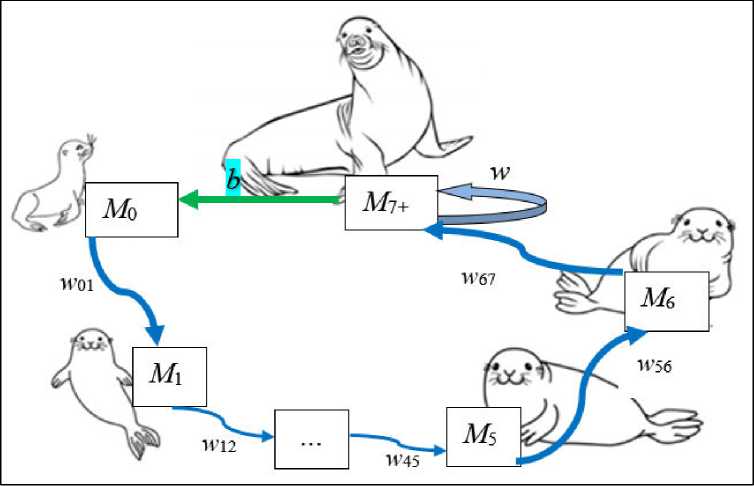
Рис. 2. Граф жизненного цикла самцов северного морского котика
Fig. 2. Life cycle graph for Northern fur seal males
Покажем, что матрица вида (2) является неразложимой и примитивной.
-
1. Неразложимость матрицы A вида (2) следует из того, что старший возрастной класс имеет ненулевой вклад в рождаемость (другими словами, здесь нет пострепродуктивной группы), что обеспечивает сильную связность ассоциированного с проекционной матрицей орграфа (т. е. для любой пары различных вершин графа существует ориентированный путь из одной вершины в другую).
-
2. Примитивность матрицы А вытекает из следующей теоремы [25]: неразложимая неотрицательная матрица A примитивна тогда и только тогда, когда Am > 0 для некоторого m ≥ 1. Причем наименьший из таких m находится как: min( m ) = n + s ( n -2), где n – это размерность матрицы A (число возрастных групп), s – длина кратчайшего из простых (т. е. без самопересечений) циклов в орграфе A . В данном случае: n =8, s =1, следовательно, min( m ) = 14. Все элементы матрицы A 14 действительно оказываются положительными при условии, что все коэффициенты выживаемости и рождаемость положительны { w 01, w 12,…, w 67, w , b > 0}.
Следовательно, здесь применима классическая теорема Перрона-Фробениуса для неотрицательных матриц [11], из которой следует, что в спектре неразложимой матрицы А имеется положительное число λ1 = ρ(А) (доминантное собственное число), совпадающее со спектральным радиусом матрицы ρ(А) ≥|λj|, j = 1,..,n и имеющее алгебраическую кратность 1; причем для всех λj кроме λ1 неравенство строгое (т. к. проекционная матрица примитивная). Доминантному собственному числу соответствует положительный собственный вектор х*>0: Ах*= λ1х*, который называется Перроновым вектором, при условии нормировки: сумма его компонент равна 1. В математической популяционной биологии такой вектор называется относительной возрастной структурой популяции. Кроме того, из примитивности проекционной матрицы следует, что отображение имеет неподвижную точку, которой и является Перронов вектор – единственный (в проективном пространстве) положительный собственный вектор неразложимой неотрицательной матрицы. Это значит, что для всех x из положительного n-мерного по-лупростанства (Rn) имеет место сходимость: t limLx = CX *.
t ^“ 21 t
Таким образом, существует единственная асимптотическая относительная структура х*, глобально устойчивая в r +. Это соответствует эргодичности процесса и интерпретируется как отсутствие памяти о начальном состоянии популяции в череде поколений. Асимптотически x(t) в матричном уравнении динамики представляет собой геометрический рост со скоростью λ1, и потому λ1 считается аналогом мальтузианского па- раметра в моделях роста (неструктурированных) популяций.
Собственные числа матрицы А определяют- ся из характеристического уравнения: |Л - и\ = 0 или p(λ,A) = λ8–wλ7 – b·w01·w12·w23·w34·w45·w56·w67 = 0.(3)
Далее, используя имеющиеся оценки коэффициентов выживаемости возрастных групп самцов северного морского котика, а также коэффициент репродуктивного успеха секача, можно найти мальтузианский параметр этой популяции (который характеризует доминантное собственное число λ1 матрицы А ), что позволит понять, растет ли популяция и как изменилась скорость ее роста. Кроме того, вычислив Перронов вектор проекционной матрицы, можно определить естественную стационарную относительную возрастную структуру этой популяции, установлению которой наверняка препятствовал многолетний промысел вплоть до 2008 г.
Ранее было показано [3], что адекватные оценки коэффициентов выживаемости возрастных классов самцов удается получить для выживаемости новорожденных щенков до двух лет – w02 и соответствующих среднегодовых коэффици- ентов выживаемости от двух до семи лет – w27, а также среднегодовой выживаемости секачей – w. Учитывая это, будем полагать, что для каждого рассматриваемого периода выживаемости w23, w34, w45, w56, w67 равны между собой и равны w27. Выживаемости новорожденных щенков до двух лет представим в виде произведения выживаемо-стей на первом и втором годах жизни: w02 = w01 w12 . Известно, что наименьшая выживаемость у самцов на первом году жизни. Далее вплоть до семи лет, когда самцы вступают в размножение, их выживаемость достаточно высока и меняется мало; поэтому будем считать, что выживаемость на втором году жизни равна средней выживаемости холостяков: w12 = w27. Далее можно определить выживаемость на первом году жизни w01=w02/w27, а рождаемость b принять как половину от коэффи- циента репродуктивного успеха секача, поскольку самок и самцов рождается фактически поровну.
Проекционная матрица А в этом случае преобра- зуется к виду
( 0
О b У
• О
О О
О w 7 w ?
и ей соответствует следующее характеристиче- ское уравнение:
p ( λ,A ) = λ 8 - wλ 7 – bw 01 w 276 = 0. (5)
Далее для каждого года по уравнению (5) можно численно рассчитать максимальное по модулю собственное число проекционной матрицы (Xj). Как уже отмечалось, оно в данном случае действительное и положительное. Затем вычислить Перронов вектор (х*) проекционной матрицы, определяющий естествен- ную стационарную относительную возрастную структуру рассматриваемой популяции для каждого года наблюдений; он определяется как решение следующего уравнения: Ах* = λ1х* 8
Z 4 = 1
с нормировкой i = 1 , x * > 0.
Однако прежде чем переходить к расчётам этих характеристик, отметим, что для ответа на вопрос «Растет популяция, убывает или остается в равновесии?», не обязательно находить доминантное собственное значение проекционной матрицы (4), достаточно найти значение функции ИПР (индикатор потенциального роста, [11]) при λ=1:
ИПР = 1- p ( λ,A ) = w + bw 01 w 276. (6)
Значения ИПР однозначно определяют динамику популяции: при ИПР больше единицы популяция растет; при ИПР меньше единицы убывает. Следовательно, можно вывести соотношение параметров модели, выполнение которого необхо- димо для роста популяции: b > (1 - w)( w0 w6 ).
На рис. 3а представлена динамика ИПР для каждого года наблюдений, также мы привели наблюдаемую динамику репродуктивного успеха секача (выраженного в количестве новорожденных щенков в расчете на одного секача), чтобы визуально оценить, насколько согласованно изменение этих показателей.
Можно заметить, что в самые ранние годы наблюдений, когда промысел только начинался и вряд ли как-то повлиял на состояние популяции, значения ИПР были очень высоки и далеки от критического уровня (равного 1). Далее динамика этого показателя значительно изменялась и напоминает сходящиеся колебания. Причём начиная с 80-х годов прошлого века средний уровень стабилизировался вблизи единицы. Качественно похожа динамика ИПР и другого показателя – репродуктивного успеха секача; коэффициент корреляции Пирсона = 0.776 высоко значим (p-value = = 5.867e-11); однако по диаграмме рассеяния (рис. 3б) хорошо видна неоднородность данных, что требует выделения периодов с более одно-
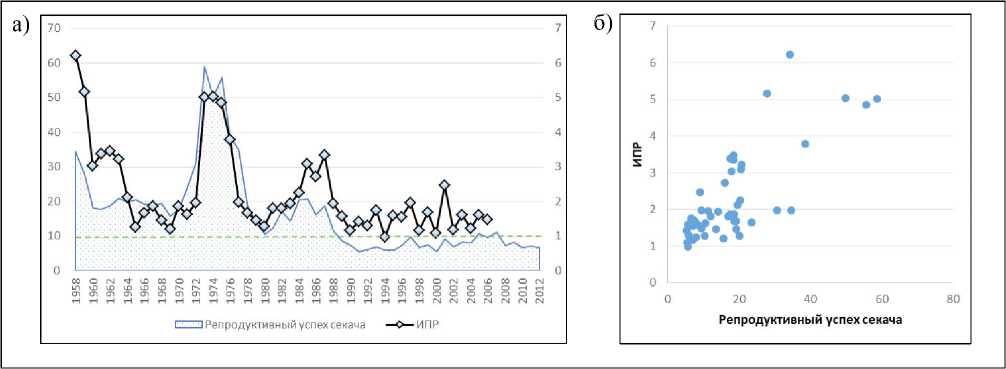
Рис. 3. (а) Динамика ИПР и репродуктивного успеха секача (P(n+1)/M7+(n)). (б) Диаграмма рассеяния этих показателей
Fig. 3. (a) Dynamics of the potential growth index (PGI) and reproductive success of adult males (P(n+1)/M7+(n)). (b) Scatter plot of these indicators родной динамикой. Одной из наиболее вероятных причин изменения динамики этих показателей представляется характер промысла, которому подверглась рассматриваемая популяция. Далее мы проанализируем изменение его объёма и структуры, чтобы в зависимости от характера эксплуатации самцовой части этой популяции попытаться выделить более-менее однородные временные периоды, внутри которых можно рассчитать средние оценки характеристик популяционного роста и возрастной структуры.
Динамика промысла
Анализ данных учёта численности и возрастного состава животных, добытых в ходе берегового промысла, показывает, что динамика изъятия менялась на протяжении всего периода эксплуатации рассматриваемой популяции.
Объемы промысла в раннем (1958–1972 гг.) и позднем (1973–2008 гг.) периодах отличаются более чем в два раза (рис. 4). Кроме того, отличается и возрастной состав добытых животных. На начальном этапе в период интенсивного промысла изымались не только холостяки, но и секачи. Такая практика была введена для «оздоровления» популяции – выбивали визуально слабых, больных животных. Доля выбитых секачей от общего их количества составляла десятки процентов, а в отдельные годы доходила до 40–50%. Отметим, что такая стратегия изъятия не согласуется с представлениями об оптимальном промысле, при котором основное изъятие должно быть сконцентрировано на молодых неполовозрелых самцах. Кроме того, характер промысла холостяков тоже не укладывается в теоретическую схему, которая предписывала преимущественное изъятие 3–4-летних самцов. Здесь нельзя не отметить вклад добычи 2-леток, которые на протяжении всего периода промысла (за исключением первых 5–6 лет) составляли заметную часть от общего изъятия, и на протяжении многих лет их было забито даже больше, чем 4-леток (рис. 4, низ). Вряд ли это было преднамеренным нарушением предписанной стратегии, поскольку точный возраст самца определяли лишь у убитых особей по зубным кольцам. Принимали же решение о забое по внешнему виду животного, при этом наиболее крупные двухлетки могли быть ошибочно приняты за трёх- или даже четырёхлетних самцов, которые и были целевой группой изъятия. Именно этот факт наиболее настораживает, так как он свидетельствует о том, что промысел, задуманный как неселективный, по-видимому, был селективным, и уже в двухлетнем возрасте самцовая часть популяции могла лишиться своих наиболее крупных и активных особей с большой тягой к лежбищу.
К 1972 г. стало понятно, что популяцию переэксплуатировали, так как непродолжительный период роста численности секачей сменился её резким падением, она уменьшилась более чем вдвое относительно максимальных значений этого периода; 1973–1975 гг. характеризуются катастрофически низкой численностью секачей. Начиная с 1972 г. стратегия промысла значительно изменилась: изъятие секачей было практически
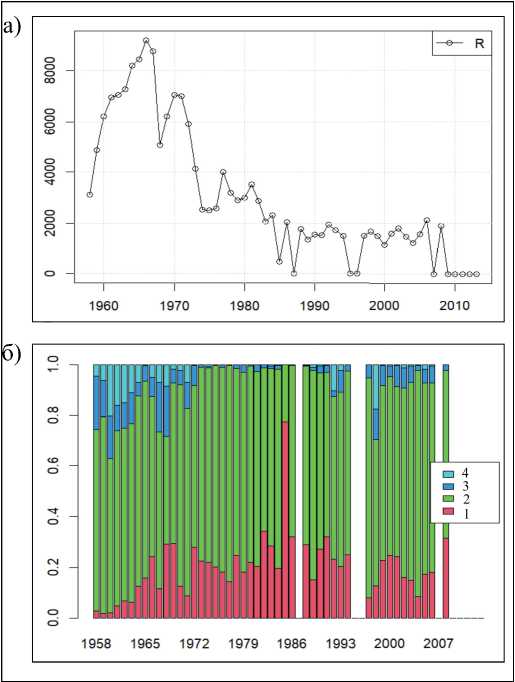
Рис. 4. (верх) Динамика общего количества добытых самцов северного морского котика (R). (низ) Возрастной состав добытых животных: представлены доли от общего изъятия для следующих возрастных групп: R2/R – двухлетних самцов (1), (R3 +R4)/R – трёх и четырёхлетних (2), (R5 +R6)/R – пяти- и шестилетних (3), R7+ – секачей (4)
Fig. 4. (top) Dynamics of the total number of harvested Northern fur seal males (R). (bottom) Age composition of harvested animals: the proportions of the total harvest are shown for the following age groups: R2/R – two-year-old males (1), (R3 +R4)/R – three and four-year-olds (2), (R3 +R4)/R – fi ve and six-year-olds (3), R7+ – bulls (4)
прекращено и заметно снижен общий объем промысла, но доля изымаемых двухлеток по-прежнему оставалась высокой, т.е. промысел оставался селективным. Отметим, что снижение объемов изъятия довольно быстро привело к восстановлению численности секачей и их дальнейшему росту, а количество новорожденных щенков продолжило снижаться вплоть до 1988 г. С начала 90-х гг. прошлого столетия наблюдаемое поголовье секачей на лежбище о. Тюлений стабильно выше всех значений предыдущего периода, поэтому слабый рост числа новорожденных щенков, очевидно, является результатом снижения рождаемости в этой популяции и может быть связан с изменением качества секачей.
Проведённый анализ стратегии промысла позволяет выделить следующие периоды: 1959–1973 гг. – период интенсивного промысла (включая секачей и полусекачей), 1974–1988 гг. – практически мораторий на изъятие секачей и полусекачей при резком снижении общего объема изъятия; после 1988 г. – очередное снижение объема изъятия и отмена моратория на изъятие половозрелых самцов на фоне значительного восстановления их численности. Отметим, что внутри второго периода 1974–1988 гг. показатель репродуктивного успеха секача значительно изменялся, в частности, 1973–1977 гг. характеризуются крайне высокими значениями рождаемости в популяции; поэтому при расчёте средних показателей, чтобы достичь большей их однородности, мы выделим эти годы интенсивного восстановления популяции в отдельный период.
Характеристики динамики популяции на фоне меняющейся стратегии промысла
Результаты расчётов по уравнению (5) для выделенных периодов приведены в табл.; они показывают, что в позднем периоде популяция все еще растет, хотя скорость роста значительно замедлилась: от 14–25% в год в раннем периоде до 8% в позднем. При этом выживаемость всех возрастных групп (щенков на первом году жизни, холостяков и секачей) выше, чем в предыдущие периоды, т.е. замедление темпа роста популяции связано со значительным уменьшением репродуктивного успеха секача. Также заметны изменения стационарного возрастного состава популяции: доля щенков уменьшилась от 38–47% в раннем периоде до 30% в позднем, а доля секачей выросла от 2–5% до 9% соответственно.
Зависимость ИПР от репродуктивного успеха секача (в рассматриваемой модели выраженного через параметр b = 0.5* P / M 7+) представлена на рис. 5. Значения других параметров зафиксированы так, чтобы понять, какой уровень воспроизводства обеспечил бы рост популяции даже в случае минимальной (из наблюдаемых) выживаемости ювенильной группы. В качестве w 01 зафиксировано его минимальное значение за период, w 27 выбрано в соответствии с минимальным w 01, w – среднее для периода. На рис. 5 выделенные периоды отличаются цветом линии: 1959–1973 – линия голубого цвета, 1974–1978 – черная, 1979– 1988 – зеленая и после 1988 г. – серая. На линии
Таблица
Результаты расчетов. Стационарная возрастная структура (компоненты вектора х*) и скорость популяционного роста(XJ
Table
Calculation results. Stationary age structure (components of the vector x *) and population growth rate (X j )
|
1959– 1973 |
1974– 1978 |
1979– 1988 |
после 1988 |
|
|
0 |
0.40 |
0.47 |
0.38 |
0.30 |
|
1 |
0.18 |
0.19 |
0.17 |
0.15 |
|
2 |
0.13 |
0.12 |
0.13 |
0.13 |
|
3 |
0.09 |
0.08 |
0.10 |
0.11 |
|
4 |
0.07 |
0.05 |
0.07 |
0.09 |
|
5 |
0.05 |
0.04 |
0.06 |
0.07 |
|
6 |
0.04 |
0.02 |
0.04 |
0.06 |
|
7+ |
0.04 |
0.02 |
0.05 |
0.09 |
|
λ 1 |
1.14 |
1.25 |
1.15 |
1.08 |
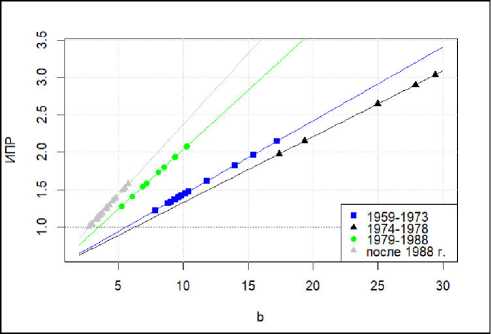
Рис. 5. Зависимость ИПР от параметра b при фиксированных значениях других параметров (w, w01 и w27) для каждого выделенного периода: 1959–1973 – линия голубого цвета, 1974– 1978 – черная, 1979–1988 – зеленая и после 1988 г. – серая. На линии нанесены точки – наблюдаемые значения b для каждого периода (соответствующего цвета)
Fig. 5. Dependence of the PGI on the parameter b with fixed values of the other parameters (w, w01, and w27) for each period: 1959–1973 – blue line, 1974–1978 – black, 1979–1988 – green, and after 1988 – gray. At the lines, the observed values of b for each period are plotted (in the corresponding color)
нанесены точки – наблюдаемые значения b для каждого периода (соответствующего цвета).
Как видно на этом рис. 5, в позднем периоде репродуктивный успех секача настолько низкий (серые кружки), что если бы такой же успех имел место и в более ранних периодах, то его было бы явно недостаточно для преодоления границы ИПР=1. Только произошедшее увеличение как средних, так и минимальных значений выживаемости позволяет популяции расти даже при таком уровне репродуктивных возможностей самцов, однако рост этот нельзя назвать стабильным.
Обсуждение и заключение
Современные исследования в демографии и популяционном моделировании показывают, что у долгоживущих видов популяционный рост обычно в большей степени связан с увеличением выживаемости половозрелых групп [24, 33. 40], а уровень воспроизводства имеет меньшее значение. Тем не менее, в самцовой части популяции северного морского котика (как показывают результаты матричной модели (2)) рост выживаемости не компенсирует падение рождаемости. Произошла существенная перестройка возрастной структуры популяции и резкое замедление ее роста, даже на фоне небольшого увеличения естественной выживаемости практически всех возрастных групп. Результаты моделирования выявили старение мужской части популяции: доля щенков в стационарном возрастном составе позднего периода наблюдений значительно уменьшилась, а доля секачей выросла примерно в 2 раза. Позитивный результат состоит в том, что популяция всё-таки растёт. Хотя, если полагать, что причина наблюдаемого снижения продукции гаремов – результат селективного промысла, то и дальнейший рост популяции северного морского котика будет весьма небыстрым. По-видимому, для его ускорения необходима новая перестройка качественного состава популяции: увеличение доли самцов с высоким репродуктивным успехом. Эта перестройка наверняка уже идет в популяции под действием естественного отбора после прекращения промысла, но позитивные процессы естественного отбора могут потребовать большого количества времени. Получение объективных количественных оценок как о современной степени дифференциации секачей по величине репродуктивного успеха, так и об интенсивности ее изменения требует обстоятельных дополнительных исследований.
Поскольку из рассматриваемой популяции изымались только самцы, представляется разумным ожидать изменения прежде всего в этой ча- сти популяции. Наше исследование показывает, что изменения среднего репродуктивного успеха секача значительно согласуются с характером промысла. Другим объяснением снижения рождаемости в популяции может быть недостаток репродуктивных самок. Отметим, что коммерческий промысел самок из этой популяции не производился (исключая морские пробы с научно-исследовательской целью, которые были сравнительно малы по отношению к общему числу самок в популяции); а влиянию неблагоприятных факторов окружающей среды подвержены как самки, так и самцы; т.е. изменение внешних условий, позволившее самцам увеличить свою выживаемость и в результате получить рост количества секачей, закономерно должен сопровождаться увеличением и количества репродуктивных самок (что согласуется с наблюдаемым ростом их численности на лежбищах) [6]. Тем не менее, остаётся вопрос о том, какие естественные причины могли бы повлиять на популяционные процессы так, чтобы рост популяции мог быть настолько неравномерен у самцов и самок.
Скудное количество наблюдений для оценки выживаемости и других физиологических характеристик самок в естественных популяциях ластоногих – общая проблема [17], с которой мы также столкнулись, не имея адекватных данных для прямого сравнения выживаемости самцов и самок этой популяции. Тем не менее, принято считать, что самки млекопитающих живут дольше самцов [20, 37], что объясняется их большей выживаемостью. Это убеждение было основано на исследованиях, проведенных среди человеческих популяций, небольшом количестве тематических исследований диких млекопитающих или записях о млекопитающих, содержащихся в неволе [18]. Хотя продолжительность жизни и модели старения часто не репрезентативны для сородичей в дикой природе [42], недавнее исследование на основе демографических данных по 134 популяциям млекопитающих, охватывающих 101 вид [31], показало, что и в дикой природе средняя продолжительность жизни самок в среднем на 18,6% больше, чем у самцов того же вида. Высокая степень конкуренции самцов между собой, как правило, сопровождает крайнюю полигинию и часто приводит к более низкой продолжительности жизни по сравнению с видами с меньшей степенью полигамии или моногамии [20, 41]. Отметим, что северный морской котик относится к видам с экстремальной степенью полигинии по классификации Le Boeuf [28], поэтому отношение естественной смертности самцов к смертности самок должно быть высоким. Всё это не добавляет убедительности гипотезе о нехватке репродуктивных самок в популяции этого вида на о. Тюлений.
С другой стороны, эволюционные изменения наблюдаются у многих видов, подвергшихся селективному промыслу (напр., [22, 29, 34]). Выборочный по размеру промысел, при котором преимущественно отбираются крупные особи определенного вида, обычен как в морских, так и в наземных местообитаниях. Исследования показали, что преимущественное удаление более крупных особей вида оказывает негативное влияние на его демографию, историю жизни и экологию, и эмпирические исследования все чаще документируют такое воздействие [22]. Размер тела считается одной из наиболее важных характеристик организма, поскольку он коррелирует со многими аспектами его биологии, от жизненного цикла до экологических характеристик. При этом отбор крупных особей – это искусственный отбор, действующий в направлении, противоположном естественному отбору. Его результат незамедлительно проявляется в наблюдаемом уменьшении размера особей [16] и множестве других менее очевидных последствий. В качестве одного из, по-видимо-му, наиболее контринтуитивных признаков, на который влияет выборочный отбор по размеру, можно упомянуть качество потомства. Появляется все больше доказательств такого эффекта как у морских, так и у наземных видов. Например, выборочный по размеру промысел атлантической атерины (Menidia menidia) привел к снижению скорости роста личинок, потребления пищи и эффективности пищеварения, а также уменьшению количества позвонков [21, 47]. Среди наземных животных в некоторых популяциях копытных, на которых ведется избирательная охота по полу (и избирательно по размеру), наблюдается снижение веса потомства. У лося (Alces alces) и северного оленя (Rangifer tarandus) может наблюдаться снижение веса потомства, когда самки вынуждены спариваться с молодыми самцами, т.к. в результате охоты снижается количество более старых. У медведей гризли (Ursus arctos) и африканских львов (Panthera leo) на крупных и социально доминирующих самцов также выборочно охотятся в качестве трофеев, что имеет побочный эффект в виде снижения выживаемости молодых особей из-за усиления инфантицидного поведения менее доминирующих самцов [32, 46]. Кроме того, у долгоживущих видов с низким уровнем естественной смертности взрослых особей селектив- ный по размеру промысел может влиять на вклад половозрелых особей в воспроизводство. Ожидаемый вклад особи в рост популяции (репродуктивная ценность) изменяется с возрастом, поскольку молодые половозрелые особи имеют низкую репродуктивную ценность, а более старшие зрелые особи высокую, причём у долгоживущих организмов репродуктивная ценность очень медленно снижается с возрастом [27]. Естественно, что выборочный отбор по размеру старших половозрелых особей с самой высокой репродуктивной ценностью может привести к снижению темпов роста популяции.
Не менее важно учитывать способность промысла влиять на поведенческие признаки в эксплуатируемых популяциях [44], поскольку искусственный отбор может привести к эволюции поведения, отличного от того, которому способствует естественный отбор [29]. Например, были зафиксированы изменения в поведении из-за выборочного по размеру промысла у данио-рерио ( Danio rerio ) [44]. Адаптируясь к высокому селективному давлению промысла, эти рыбки достигали меньшего размера тела и оказывались менее любопытными и смелыми. Фенотипические изменения казались незначительными, но сопровождались генетическими изменениями функциональных локусов. При этом также было показано, что наблюдаемые изменения жизненного цикла увеличивают темпы роста популяции в условиях промысла, но замедляют ее восстановление в условиях смоделированного моратория на изъятие. Следовательно, эволюционные последствия промысла, селективного по размеру, могут проявиться в виде поддержания продуктивности популяций в эксплуатируемых условиях, но оставить её в невыгодном положении в условиях естественного отбора, часто благоприятствующего крупным размерам тела и другому типу поведения.
В заключение отметим, что всех описанных выше эффектов селективного промысла, по-види-мому, не избежала и популяция северного морского котика о. Тюлений. На фоне активного изъятия секачей в первые годы интенсивного промысла произошло резкое падение их численности, а её восстановление происходило уже за счёт молодых (только вступающих в репродуктивный возраст) особей с низкой репродуктивной ценностью, уже испытавших на себе (начиная с двухлетнего возраста) селективный отбор, наверняка внесший правки в их генофонд. И это вполне может объяснить первую фазу снижения репродуктивного успеха секачей после начала восстановления их численности. Последовавшее снижение объема промысла и прекращение изъятия секачей не изменило его селективности по размеру (что видно по значительной доле изъятых двухлетних самцов) и наверняка по поведению – наиболее стремящиеся к лежбищу самцы с хорошим гормональным фоном более вероятно оказывались подвержены промыслу. Наблюдаемое увеличение средней выживаемости самцов вместе со снижением средней продукции гаремов вполне может быть следствием ослабления половой конкуренции самцов, что характерно для видов с меньшей степенью полигинии. Следствием этого могло быть и уменьшение преимущества в выживаемости самок относительно самцов, с последующим изменением соотношения полов в сторону уменьшения доли самок, но вряд ли столь катастрофического, чтобы объяснить сохранение высокой доли беременных самок в популяции, поскольку естественная выживаемость самок выше даже у моногамных видов (напр., [13]). Учитывая все приведенные факты, мы вынуждены заключить, что влияние селективности промысла представляется наиболее реалистичной причиной наблюдаемого снижения рождаемости в рассматриваемой популяции.
Работа выполнена в рамках государственных заданий Института автоматики и процессов управления ДВО РАН (тема № FWFW-2021-0004) и Института комплексного анализа региональных проблем ДВО РАН.
Список литературы Анализ структуры промысла и динамики роста стада северного морского котика (Callorhinus ursinus) острова Тюлений в период эксплуатации и после её завершения
- Болтнев А.И. Северный морской котик Командорских островов. М.: ВНИРО, 2011. 264 с.
- Дорофеев С.В. Северные морские котики (Callorhinus ursinus L.) // Известия ТИНРО. 1964. Т. 54. С. 23-50.
- Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Динамика выживаемости самцов северного морского котика (Callorhinus ursinus) острова Тюлений (Охотское море) по данным многолетних наблюдений // Зоологический журнал. 2017. Т. 96, № 6. С. 720-739.
- Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Математическое моделирование динамики выживаемости самок северного морского котика СаПогЫпш ursinus (Linnaeus, 1758) стада острова Тюлений // Биология моря. 2017. Т. 43, № 5. С.310-320.
- Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Оценка ювенильной выживаемости самцов северного морского котика (Callorhinus ursinus): математическое моделирование и анализ данных // Математическая биология и биоинформатика. 2018. Т. 13, № 2. С. 360-375. DOI: 10.17537/2018.13.360.
- Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Динамика репродуктивных характеристик у самок северного морского котика Callorhinus Ursinus (Linnaeus, 1758) острова Тюлений на фоне активного промысла самцов // Биология моря. 2022. Т. 48, № 6. С. 388-396. DOI: 10.31857/S013434752206016X.
- Корнев С.И., Блохин И.А., Генералов А.А., Се-меринов А.П. Исторический тренд командорской популяции северного морского котика за 50 лет (1958-2007 гг.) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. 2008. № 11. С. 105-120.
- Кузин А.Е. Северный морской котик. М.: Совет по морским млекопитающим, 1999. 395 с.
- Кузин А.Е. Интрапопуляционная структура северного морского котика острова Тюленьего в годы выхода из депрессии (1993-2009 гг.) // Известия ТИНРО. 2010. Т. 161. С. 53-67.
- Кузин А.Е. Анализ промысла северного морского котика (Callorhinus ursinus) на о. Тюленьем // Известия ТИНРО. 2015. Т. 183, № 4. С. 71-80. DOI: 10.26428/1606-9919-2015-18371-80.
- Логофет Д.О., Белова И.Н. Неотрицательные матрицы как инструмент моделирования динамики популяций: классические модели и современные обобщения // Фундаментальная и прикладная математика. 2007. Т. 13, № 4. С. 145-164.
- Логофет Д.О. Матричные модели в популяци-онной биологии / Д.О. Логофет, Н.Г. Уланова. М.: МАКС Пресс, 2017. 128 с.
- Романов М.С., Мастеров В.Б., Курилович Л.Я. Анализ кривых выживания белоплечего орлана. Стареют ли самцы быстрее самок? // Russian Journal of Ecosystem Ecology. 2019. Т. 4, № 4. DOI: 10.21685/2500-0578-2019-4-3.
- Фрисман Е.Я. Математическое моделирование динамики численности северного морского котика и оптимальное управление котиковым хозяйством / Е.Я. Фрисман, Е.И. Скалецкая, А.Е. Кузин. Владивосток: ДВНЦ АН СССР, 1985. 156 с.
- Atkinson C.E. Fisheries management: an historical overview // Marine Fisheries Review. 1988. Vol. 50. P. 111-123.
- Birkeland C., Dayton P.K. The importance in fishery management of leaving the big ones // Trends in Ecology & Evolution. 2005. Vol. 20. P. 356-358.
- Brusa J.L., Rotella J.J., Banner K.M., Hutchins P.R. Challenges and opportunities for comparative studies of survival rates: An example with male pinnipeds // Ecology and Evolution. 2021. Vol. 11, N 12. P. 79801-7999. DOI: 10.1002/ece3.7627.
- Carey J.R. Longevity Records: Life Spans of Mammals, Birds, Reptiles, Amphibians and Fish / J.R. Carey, D.S. Judge. Odense: Odense University Press, 2000. 241 p.
- Caswell H. Matrix population models: construction, analysis, and interpretation. Sunderland, Mass.: Sinauer Associates, 2000. 722 p.
- Clutton-Brock T.H., Isvaran K. Sex differences in ageing in natural populations of vertebrates // Proc. Biol. Sci. 2007. Vol. 274. P. 3097-3104.
- Duffy T.A., Picha M.E., Borski R.J., Conover D.O. Circulating levels of plasma IGF-I during recovery from size-selective harvesting in Menidia menidia // Comparative Biochemistry and Physiology. Part A. 2013. Vol. 166. P. 222-227.
- Fenberg P.B., Roy K. Ecological and evolutionary consequences of size-selective harvesting: how much do we know? // Molecular Ecology. 2008. Vol. 17. P. 209-220. DOI: 10.1111/j.1365-294x.2007.03522.x.
- Frisman E.Ya., Skaletskaya E.I., Kuzin A.E. A mathematical model of the population dynamics of a local northern fur seal with seal herd // Ecological Modelling. 1982. Vol. 16. P. 151-172.
- Heppell S., Caswell H., Crowder L.R. Life histories and elasticity patterns: Perturbation analysis of species with minimal demographic data // Ecology. 2000. Vol. 81. P. 654-665.
- Horn R.A. Matrix analysis / R.A. Horn, C.R. Johnson. New York: Cambridge university press, 1990.
- Gentry R.L. Behavior and ecology of the northern fur seal. Princeton, New Jersey: Princeton University Press, 1997. 392 p.
- Kokko H., Lindstrom J., Ranta E. Life histories and sustainable harvesting // Conservation of Exploited Species / eds. J.D. Reynolds, G.M. Mace, K.H. Redford, J.G. Robinson. London: Cambridge University Press, 2001. P. 301-322.
- Le Boeuf B.J. Piiniped mating systems on land, ice, and in the water: Emphasis on the Phocidae // The Behaviour of Pinnipeds / ed. D. Renouf. Springer Science & Business Media, 1991. P. 45-65.
- Leclerc M., Zedrosser A., Pelletier F. Harvesting as a potential selective pressure on behavioural traits // Journal of Applied Ecology. 2017. Vol. 54. P. 1941-1945.
- Lee O.A., Burkanov V., Neill W.H. Population trends of northern fur seals (Callorhinus ursinus) from a metapopulation perspective // Journal of Experimental Marine Biology and Ecology. 2014. Vol. 451. P. 25-34.
- Lemaitre J.F., Ronget V., Tidiere M., Allainé D., Berger V., Cohas A., Gaillard J.M. Sex differences in adult lifespan and aging rates of mortality across wild mammals // Proc. Nat. Acad. Sci. 2020. Vol. 117, N 15. P. 8546-8553. DOI: 10.1073/pnas.1911999117.
- Loveridge A.J., Searle A.W., Murindagomo F., Macdonald D.W. The impact of sport-hunting on the population dynamics of an African lion population in a protected area // Biol. Conserv. 2007. Vol. 134. P. 548-558.
- Maestri M.L., Ferrati R., Berkunsky I. Evaluating management strategies in the conservation of the critically endangered Blue-throated Macaw (Ara glaucogularis) // Ecological Modeling. 2017. Vol. 361. P. 74-79.
- Milner J., Nilsen E., Andreassen H. Demographic side effects of selective hunting in ungulates and carnivores // Conserv. Biol. 2007. Vol. 21. P. 36-47.
- Northern fur seal (Callorhinus ursinus): Eastern Pacific Stock // Angliss R.P., Lodge K.L. Alaska Marine Mammal Stock Assessments, 2003. NOAA Technical Memorandum NMFS-AFSC-144. Washington, DC: US Department of Commerce, 2004. P. 18-24.
- Osgood W.H. The fur seals and other life of the Pribilof Islands, Alaska, in 1914. № 820 / W.H. Osgood, E.A. Preble, G.H. Parker. Washington: Government Printing Office, 1915.
- Promislow D.E. Costs of sexual selection in natural populations of mammals // Proc. R. Soc. Lond. B Biol. Sci. 1992. Vol. 247. P. 203-210.
- Roppel A.Y., Davey S.P. Evolution of fur seal management on the Pribilof Islands // J. Wildl. Manage. 1965. Vol. 29. P. 448-463.
- Roppel A.Y. Management of northern fur seals on the Pribilof Islands, Alaska, 1786-1981. NOAA Technical Report NMFS-4. Washington: US Department of Commerce, 1984.
- Saether B., Bakke 0. Avian life history variation and contribution of demographic traits to the population growth rate // Ecology. 2000. Vol. 81. P. 642-653.
- Tidiere M., Gaillard J.-M., Müller D.W.H., Lackey L.B., Gimenez O., Clauss M., Lemaitre J.-F. Does sexual selection shape sex differences in longevity and senescence patterns across vertebrates? A review and new insights from captive ruminants // Evolution. 2015. Vol. 69. P. 3123-3140. DOI: 10.1111/evo.12801.
- Tidiere M., Gaillard J.M., Berger V. et al. Comparative analyses of longevity and senescence reveal variable survival benefits of living in zoos across mammals // Sci. Rep. 2016. Vol. 6. P. 36361. DOI: 10.1038/srep36361.
- Trites A.W., Larkin P.A. The decline and fall of the Pribilof fur-seal (Callorhinus Ursinus) - a simulation study // Can. J. Fish. Aquat. Sci. 1989. Vol. 46. P. 1437-1445.
- Uusi Heikkila S., Whiteley A.R., Kuparinen A., Matsumura S., Venturelli P.A., Wolter C. et al. The evolutionary legacy of size selective harvesting extends from genes to populations // Evol. Appl. 2015. Vol. 8. P. 597-620. DOI: 10.1111/eva.12268.
- Wickens P., York A.E. Comparative population dynamics of fur seals // Mar. Mammal Sci. 1997. Vol. 13, N 2. P. 241-292.
- Whitman K., Starfield A.M., Quadling H.S., Packer C. Sustainable trophy hunting of African lions // Nature. 2004. Vol. 428. P. 175-178.
- Walsh MR., Munch S.B., Chiba S., Conover D.O. Maladaptive changes in multiple traits caused by fishing: impediments to population recovery // Ecology letters. 2006. Vol. 9, N 2. P. 142-148.
- Zhdanova O.L., Kuzin A.E., Skaletskaya E.I., Frisman E.Y. Why the population of the northern fur seals (Callorhinus ursinus) of Tyuleniy Island does not recover following the harvest ban: analysis of 56 years of observation data // Ecological Modelling. 2017. Vol. 363. P. 57-67. DOI: 10.1016/j.ecolmodel.2017.08.027.


