Анализ связи полиморфизма -31G/С (RS9904341) в гене BIRC5 с риском возникновения рака мочевого пузыря
Автор: Башмакова Е.Е., Панамарев Н.С., Кудрявцев А.Н., Черняев Д.В., Слепов Е.В., Зуков Р.А., Франк Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Цель исследования - изучить связь полиморфизма - 31G/С (rs9904341) в промоторной области гена белка сурвивина BIRC5 с риском возникновения рака мочевого пузыря (РМП) у пациентов Красноярского края. Материал и методы. Аллельный состав исследуемого гена был определен в группе из 158 пациентов (128 мужчин и 30 женщин) с клинически установленным РМП, средний возраст - 65,6 ± 10,7 года (медиана: 66,5; С25-С75: 59-72), а также в контрольной группе из 117 здоровых доноров (90 мужчин и 27 женщин), средний возраст - 60,2 ± 5,1 года (медиана: 60; С25-С75: 57-63,25). Аллельный состав определяли биолюминесцентным способом, ранее разработанным авторами. В качестве контроля использовали образец с генотипом GC, подтвержденным секвенированием по Сэнгеру (ЦКП Геномика, Новосибирск, Россия). Для сравнения количественных данных использовали U-тест Манна-Уитни. Для сравнения частот вариантов гена среди контрольных образцов и случаев РМП применяли критерий χ2 Пирсона. Исследуемая выборка находилась в равновесии Харди-Вайнберга (p>0,05). Ассоциацию между вариантами rs9904341 и РМП оценивали по отношению шансов (OШ) с 95 % доверительным интервалом (ДИ), с уровнем значимости p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак мочевого пузыря, ген birc5, однонуклеотидный полиморфизм (snp) rs9904341, сурвивин, биолюминесцентный анализ
Короткий адрес: https://sciup.org/140295753
IDR: 140295753 | УДК: 616.62-006.6:575.174.015.3 | DOI: 10.21294/1814-4861-2022-21-4-64-71
Текст научной статьи Анализ связи полиморфизма -31G/С (RS9904341) в гене BIRC5 с риском возникновения рака мочевого пузыря
Доля рака мочевого пузыря (РМП) составляет 3–5 % всех злокачественных новообразований и около 40 % от опухолевых заболеваний мочеполовой системы [1, 2]. До 80 % случаев РМП составляет немышечно-инвазивный рак мочевого пузыря (НМИ РМП), для которого характерна склонность к рецидивированию. Поиск диагностических и предикторных параметров, позволяющих предсказать течение заболевания, является актуальной проблемой. Принимая во внимание сложность и неоднозначность процессов онкогенеза, можно предположить, что наиболее успешным будет интегративный подход, сочетающий клиникоморфологические и молекулярно-генетические параметры [3]. В ряде исследований были обнаружены факторы генетической предрасположенности к риску развития РМП и прогрессированию этого заболевания. В частности, была подтверждена взаимосвязь полиморфизма -31G/С, расположенного в промоторной области гена белка сурвивина, приводящего к изменению уровня мРНК этого белка, c риском развития рецидивирующего рака. Сурвивин – это одноцепочечный низкомолекулярный белок (м.м. 16,5 кДа), относящийся к группе белков-ингибиторов апоптоза (IAP), все члены которого имеют как минимум один бакуловирус-ный IAP повтор (BIR), состоящий примерно из 70 аминокислот. Данный повтор обеспечивает их взаимодействие с проапоптотическими белка- ми. Сурвивин – мультифункциональный белок, способный ингибировать апоптоз, регулировать деление клеток и способствовать ангиогенезу [4]. Практически во всех типах рака наблюдается сверхэкспрессия сурвивина [5, 6], что может объясняться нуклеотидными вариациями в регуляторной области гена этого белка. В частности, было показано, что полиморфизм -31G>C (rs9904341), расположенный в промоторной области гена сурви-вина, коррелирует с экспрессией этого гена: аллель 31С проявляет существенно более высокую активность по сравнению с 31G [7]. По данным метаанализа 2019 г., выполненного Мoazeni-Roodi et al., наличие 31С аллеля коррелирует с риском возникновения большинства типов рака либо в целом, либо среди азиатского населения [8]. Для случая рака мочевого пузыря в азиатской популяции установлена ассоциация полиморфизма rs9904341 для рецессивной модели наследования (СС vs GG+GC, ОШ 1,8, 95 % ДИ 1,36–2,54 p<0,001). В то же время этот генотип у европейской популяции был связан с защитой против рака полости рта, рака легких, уротелиального рака и опухоли Вильмса, а для таких типов рака, как гепатоцеллюлярная карцинома, карцинома пищевода, рак кожи и рак шейки матки, ассоциаций вообще не было выявлено. В работах [9–11] показана ассоциация полиморфизма rs9904341 с риском уротелиального рака. Исследования, демонстрирующие связь данного полиморфизма с риском возникновения РМП, немногочисленны, проведены только для азиатского населения [12–14]. Во всех публикациях отмечается необходимость дополнительных исследований данной ассоциации.
Целью нашего исследования было изучить связь между полиморфизмом -31G/С (rs9904341) в промоторной области гена белка сурвивина BIRC5 и риском возникновения заболевания РМП у пациентов Красноярского края.
Материал и методы
Образцы крови пациентов с диагнозом РМП отобраны специалистами КГБУЗ «Красноярского краевого клинического онкологического диспансера им. А.И. Крыжановского». Исследование одобрено на заседании локального этического комитета, протокол № 27 от 02.07.2020. От всех пациентов, принявших участие в исследовании, получено информированное согласие. После клинического обследования и опроса у врача-онколога заболевание было охарактеризовано по клинико-морфологическим признакам, к которым относились: стадия, степень дифференцировки, прогрессирование заболевания и инвазия опухоли в стенку мочевого пузыря. Образцы венозной крови здоровых доноров получены от Красноярского краевого центра крови № 1.
Всего исследовали 158 образцов ДНК пациентов, среди них: 30 женщин и 128 мужчин (средний возраст 65,6 ± 10,7 года, медиана: 66,5; С25 – С75: 59 – 72). В контрольной группе были образцы ДНК 117 здоровых доноров, среди которых 27 женщин и 90 мужчин, средний возраст 60,2 ±5,1 года (медиана: 60; С25 – С75: 57 – 63,3). В группе пациентов и контрольной группе русские соcтавляли 95,4 и 96,6 % соответственно.
ДНК выделяли набором «ExtractDNA Blood» (Евроген, Россия). Синтез участка, содержащего полиморфизм rs9904341, проводили с помощью ПЦР с использованием ДНК-полимеразы Hot Start Taq (Евроген, Россия) и праймеров, фланкирующих целевой участок: Up праймер – 5’- GAAGGCCGCGGGGGGTGGACC – 3’; Dn праймер – 5’- GCGGTGGTCCTTGAGAAA-GGGCTGCC – 3’.
Олигонуклеотиды, использованные в работе, синтезированы ООО Биосан (Россия).
Высокоочищенные препараты белков репортеров – мутантных вариантов Са2+-регулируемого фотопротеина обелина (OL) с разными характеристиками биолюминесценции, а также их конъюгатов: OL(W92F,H22E)-политимидилат (dT)30 и OL(Y138F)-антитело к 6-карбоксифлуоресцеину (FAM), получали, как описано ранее [15].
Реакцию удлинения специфичных праймеров (РЕХТ) проводили в 20 мкл реакционной смеси, содержащей 1-кратный буфер SNPdetect (Евроген, Россия), по 2,5 μM каждого dNTP, 2,5 μM Bio-dUTP (Биосан, Россия), по 1 pmol праймеров PEXT G – FAM-CCATTAACCGCCAGATTTGAATCGCG и PEXT C – (A)27-CCATTAACCGCCAGATTTGAATCGCC, 2 ед. акт. полимеразы SNPdetect (Евроген, Россия). Условия реакции: 95 °С в течение 5 мин; 3 цикла (95 °С – 15 сек, 60 °С –15 сек, 72 °С – 15 сек); 95 °С в течение 5 мин.
Биолюминесцентный анализ продуктов реакции PEXT проводили, как описано ранее [15]. Кратко: в лунки планшета (Costar, США), активированные стрептавидином [16], вносили 47 мкл гибридизационного буфера и 3 мкл раствора продуктов PEXT-реакции или буфера (контрольные образцы), инкубировали 30 мин и промывали. Далее в лунки вносили по 50 мкл смеси конъюгатов OL(W92F,H22E)-(dT)30 и OL(Y138F)-антитела к FAM, инкубировали, промывали и измеряли биолюминесценцию сформированных на поверхности комплексов с помощью планшетного люминометра Mithras LB 940 Multimode Reader (Berthold, Германия) сразу после впрыскивания 70 мкл 0,1 М CaCl2 в 0,1 М Tris-HCl pH 8,8. Интегральные сигналы записывали по очереди: фиолетовый через оптический фильтр ФС6 (ЛенЗОС, Россия) в течение 1 с и далее зеленый через оптический фильтр ЖС17 (ЛенЗОС, Россия) – в течение 3 с. Все измерения проводили в 2 повторностях, учитывали сигналы от контрольных лунок. Генотип определяли по отношению величины зеленого сигнала к фиолетовому (дискриминационный фактор, D).
Последовательности трех образцов с генотипами GG, GC, CC дополнительно подтверждены секвенированием по Сэнгеру (ЦКП «Геномика» СО РАН, Россия). При генотипировании образец GC использовали как внутренний контроль.
Статистическую обработку проводили с помощью программного обеспечения Statistica 12 (Statsoft, Россия) и Microsoft Excel для Windows 10. Для сравнения количественных данных использовали U-тест Манна–Уитни. Для качественных характеристик использовали тест χ2. Для сравнения частот вариантов гена среди контрольных образцов и случаев РМП применяли критерий χ2-Пирсона. Исследуемая выборка находилась в равновесии Харди–Вайнберга для контролей и для случаев (p>0,05). Ассоциацию между вариантами rs9904341 и РМП оценивали по отношению шансов (OШ) с 95 % доверительным интервалом (ДИ), с уровнем значимости p<0,05.
Для вычисления отношения шансов использовали калькулятор расчета статистики в исследованиях «случай–контроль» на сайте «Ген Эксперт» http://84.201.145.131/.
Среднее значение величин указано с квадратичным отклонением.
Результаты
Для выявления аллельного состава ДНК использовали способ, разработанный и успешно протестированный нами ранее. Он реализуется в 3 этапа: а) синтез фрагмента, содержащего полиморфный сайт, с помощью реакции ПЦР; б) реакция удлинения аллель-специфичных праймеров, несущих разные метки (олиготимидилат либо анти- FAM антитело), в ходе которой в состав продукта включаются звенья биотинилированного уридина; в) твердофазный биолюминесцентный анализ полученных биотинилированных продуктов, схема которого приведена на рис. 1. Наличие аллелей определяют по биолюминесцентному сигналу соответствующих репортеров: зеленый сигнал регистрируется при наличии аллеля G, фиолетовый – аллеля С. Отношение этих сигналов – дискриминационный фактор D – отражает аллельный состав образца ДНК. Данный способ был нами ранее успешно использован при исследовании полиморфизмов, связанных с предрасположенностью к возникновению меланомы кожи [17], нарушениями гемостаза [18], склонностью к развитию нейросенсорной тугоухости [19]. Надежность этого способа генотипирования обеспечивает существенная (около порядка) разница между значениями дискриминационного фактора D для каждого генотипа. Так, в нашем исследовании D принимал следующие значения: 6,52±2,13 (n=105) генотип GG; 0,99±0,21 (n=136) генотип GС; 0,06±0,04 (n=34) генотип CC.
Полиморфизм rs9904341(G/C) определен для всех 275 образцов ДНК (табл. 1). Исследуемые генотипы и аллели находились в равновесии Харди–Вайнберга (p>0,05). Между экспериментальной и контрольной группами не было выявлено статистически значимых различий при анализе распределения генотипов (табл. 1).
Анализ результатов генотипирования аллельных вариантов полиморфизма rs9904341(G/C) показал, что в исследуемой группе (пациенты плюс контроль) частота встречаемости аллелей G и С составила 0,629 и 0,371 соответственно. По данным о частоте исследуемых аллелей, представленным в базе NCBI результатов проекта 1000 Genomes , они сопоставимы с таковыми для европейской популяции: 0,693 и 0,306 для аллелей G и С соответственно.
Связь между наличием аллеля С и риском возникновения рака мочевого пузыря оценивали по рецессивной модели наследования, объединив всех носителей – гетерозигот и гомозигот (табл. 2).
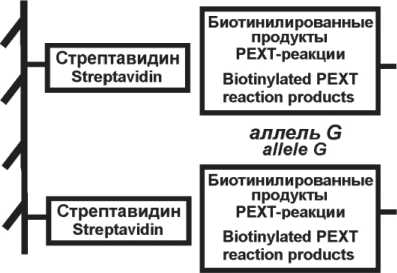
аллель С allele С
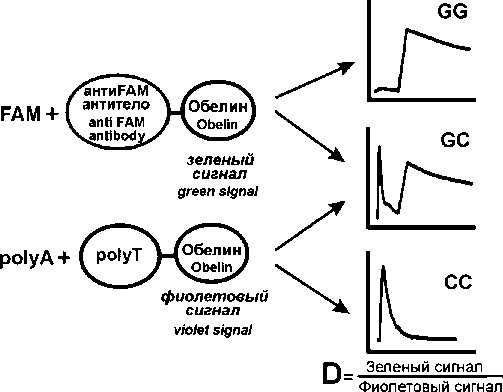
Г\_ Green signal
Violet signal
Рис. 1. Схема твердофазного биолюминесцентного анализа продуктов PEXT-реакции Fig. 1. Scheme of the bioluminescent solid-phase analysis of the PEXT reaction products
Таблица 1/Table 1
Распределение частот генотипов полиморфного варианта среди пациентов и в контрольной группе distribution of genotype frequencies for polymorphic variant among patients and in the control group
|
Генотип/ Genotype |
Сравниваемые группы/Study groups |
ОШ (95% ДИ)/ OR (95% CI) |
р |
|
|
Больные/Pаtients (n=58) |
Контроль/Control (n=117) |
|||
|
GG |
62 (39,2 %) |
43 (36,8 %) |
1,11 (0,68–1,82 %) |
|
|
GC |
82 (51,9 %) |
54 (46,2 %) |
1,26 (0,78–2,03 %) |
0,12 |
|
CC |
14 (8,9 %) |
20 (17,1 %) |
0,47 (0,23–0,98 %) |
|
Таблица 2/Table 2
Распределение генотипов по рецессивной модели наследования genotypes distribution according to the recessive inheritance model
|
Генотип/ Genotype |
Сравниваемые группы/Study groups |
ОШ (95% ДИ)/ OR (95% CI) |
р |
|
|
Больные/Pаtients (n=58) |
Контроль/Control (n=117) |
|||
|
GG + GC |
144 (91,1 %) |
97 (82,9 %) |
2,12 (1,02–4,4 %) |
0,04 |
|
CC |
14 (8,9 %) |
20 (17,1 %) |
0,47 (0,23–0,98 %) |
|
Таблица 3/Table 3
Распределение генотипов среди пациентов с разным типом инвазии РМП genotypes distribution among patients with different types of bladder cancer invasion
|
Генотип Genotype |
Мышечно-инвазивный тип (T2-T4)/ Muscle-invasive type (T2-T4) (n=55) |
Немышечно-инвазивный тип (Та, Tis, T1)/ Non-muscle invasive type (Та, Tis, T1) (n=103) |
ОШ (95% ДИ %) OR (95% CI %) |
р |
|
GG |
27 (49,1 %) |
35 (34 %) |
1,87 (0,96–3,65 %) |
|
|
GC |
26 (47,3 %) |
56 (54,4 %) |
0,75 (0,39–1,45 %) |
0,08 |
|
CC |
2 (3,6 %) |
12 (11,7 %) |
0,29 (0,06–1,33 %) |
Можно видеть, что носителей генотипа CС достоверно меньше в группе пациентов: (8,9 % vs 17,1 %, p=0,04), т.е. риск развития рака мочевого пузыря у них почти в 2 раза меньше по сравнению с GG генотипом.
В табл. 3 приведены результаты исследования по распределению генотипов среди пациентов, имеющих мышечно-инвазивный (T2-T4) и немышечноинвазивный тип опухоли (Tа, Tis, T1).
Можно видеть, что носители генотипа СС в группе пациентов с мышечно-инвазивным типом опухоли встречались реже, чем в группе с немышечно-инвазивным типом опухоли: 3,6 % vs 11,7 %, однако данное различие не было статистически значимым (p>0,05).
В исследуемой группе у 21 пациента наблюдалось прогрессирование заболевания (как для мышечно-инвазивного, так и для немышечноинвазивного типа), однако связи прогрессирования с генотипом не обнаружено.
Обсуждение
Обнаруженная нами связь свидетельствует о наличии защитного эффекта для носителей СС генотипа в отношении риска возникновения РМП. Этот факт отличается от опубликованных ранее данных о повышенном риске РМП [12–14], в которых носительство аллеля С связано с повышенным риском возникновения рака. В то же время Srivastava et al. в своем метаанализе показали, что такая связь характерна только для азиатских популяций. То есть расхождения с опубликованными данными могут быть связаны с этническими различиями между изучаемыми группами населения [20]. При сравнении частот встречаемости этого аллеля среди европейского и азиатского населений и исследованной нами группы людей (275 человек) ее можно отнести к европейской популяции (табл. 1). К сожалению, данные о связи аллельного состава с риском РМП среди европейцев весьма немногочисленны. Единственное исследование на эту тему, проведенное в Европе (Сербия), обнаружило эффект повышенного риска уротелиального рака для носителей GG генотипа [11]. Защитный эффект носительства СС генотипа среди европейцев был показан для некоторых других видов рака [21].
Нельзя исключить, что наблюдаемый нами эффект связан с тем, что контрольная группа в целом моложе экспериментальной (p<0,05) (см. Материал и методы). Однако, поскольку точные сроки возникновения заболевания установить невозможно, более старший возраст в группе пациентов может быть связан с поздним обращением к врачу.
В литературе изложено несколько версий о механизме эффекта данного полиморфизма при изучении других видов опухолей. Так, Antonacopoulou et al. в своем исследовании колоректального рака показали, что аллель -31С связан с повышенной экспрессией изоформ сурвивина. При этом у пациентов с генотипом GG худшая выживаемость по сравнению с носителями аллеля С [22]. Функции изоформ сурвивина еще не до конца изучены. Однако в ряде публикаций сообщается о проапопто-тическом эффекте изоформ сурвивина 2β и 2α [23, 24]. Это связано с тем, что транслируемая область этих изоформ не содержит полную последовательность домена BIR, который отвечает за антиапопто-тическую форму сурвивина: у сурвивина 2β домен BIR укорочен, а у сурвивина 2α он отсутствует. При этом изоформы сурвивина способны образовывать «молчащие» гетеродимеры с сурвивином дикого типа, блокируя его антиапоптическую функцию, характерную для гомодимера дикого типа [25]. Andric et al. показали, что снижение экспрессии проапоптотических изоформ сурвивина у носителей генотипа GG может способствовать развитию опухоли [26].
Исследования на клеточных линиях CHO, HeLa показали намного более высокую транскрипционную активность аллеля С по сравнению с аллелем G, что приводит к повышенной экспрессии сурвивина [27]. Однако это не свидетельствует об однозначно плохом прогнозе и повышении шанса
Список литературы Анализ связи полиморфизма -31G/С (RS9904341) в гене BIRC5 с риском возникновения рака мочевого пузыря
- Аксель Е.М., Матвеев В.Б. Статистика злокачественных новообразований мочевых и мужских половых органов в России и странах бывшего СССР. Онкоурология. 2019. 15(2): 15-24. [Axel E.M., Matveev V.B. Statistics of malignant tumors of urinary and male urogenital organs in Russia and the countries of the former USSR. Cancer Urology. 2019; 15(2): 15-24. (in Russian)]. doi: 10.17650/1726-9776-2019-152-15-24.
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., JemalA. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68(6): 394-424. doi: 10.3322/caac.21492.
- Черняев Д.В., Слепов Е.В., Мазаев А.В., Сафонцев И.П., Зуков Р.А. Интегративные модели оценки риска развития рецидива немышечно-инвазивного рака мочевого пузыря. Эффективная фармакотерапия. 2021. 17(2): 38-42. [Chernyaev D.V., Slepov Ye.V., Mazayev A.V., Safontsev I.P., Zukov R.A. Assessing the recurrence risk of non-muscle-invasive bladder cancer by integrative models. Effective Pharmacotherapy. 2021; 17(2): 38-42. (in Russian)]. doi: 10.33978/23073586-2021-17-2-38-42.
- JaiswalP.K., GoelA., MittalR.D. Survivin: A molecular biomarker in cancer. Indian J Med Res. 2015; 141(4): 389-97. doi: 10.4103/09715916.159250.
- Martínez-García D., Manero-Rupérez N., Quesada R., Korrodi-Gregório L., Soto-Cerrato V. Therapeutic strategies involving survivin inhibition in cancer. Med Res Rev. 2019; 39(3): 887-909. doi: 10.1002/ med.21547.
- Слепов Е.В., Башмакова Е.Е., Панамарев Н.С., Франк Л.А., Зуков Р.А. Белок сурвивин как перспективный маркер диагностики и лечения злокачественных новообразований. Эффективная фармакотерапия. 2021. 17(2): 58-63. [Slepov Ye.V., Bashmakova Ye.Ye., PanamarevN.S., FrankL.A., ZukovR.A. The survivin protein as novel anticancer diagnosis and treatment marker. Effective Pharmacotherapy. 2021; 17(2): 58-63. (in Russian)]. doi 10.33978/2307-3586-2021-17-2-58-63.
- Xu Y., Fang F., Ludewig G., Iones G., Jones D. A mutation found in the promoter region of the human survivin gene is correlated to overexpression of survivin in cancer cells. DNA Cell Biol. 2004; 23(9): 527-37. doi: 10.1089/dna.2004.23.527.
- Moazeni-Roodi A., Ghavami S., Hashemi M. Survivin rs9904341 polymorphism significantly increased the risk of cancer: evidence from an updated meta-analysis of case-control studies. Int J Clin Oncol. 2019; 24(4): 335-49. doi: 10.1007/s10147-019-01408-y.
- Mazoochi T., Karimian M., Ehteram H., Karimian A. Survivin c.-31G>C (rs9904341) gene transversion and urinary system cancers risk: a systematic review and a meta-analysis. Per Med. 2019; 16(1): 67-78. doi: 10.2217/pme-2018-0053.
- Lin Y.C., Hour T.C., Tsai Y.C., Huang S.P., Wu W.J., Chen C.H., Pu Y.S., Chung S.D., Huang C.Y. Preliminary evidence of polymorphisms of cell cycle regulatory genes and their roles in urinary tract urothelial cancer susceptibility and prognosis in a Taiwan population. Urol Oncol. 2017; 35(9). doi: 10.1016/j.urolonc.2016.08.001.
- BogdanovicL., LazicM., Bogdanovic J., Soldatovic I., NikolicN., RadunovicM., Radojevic-Skodric S., Milasin J., Basta-Jovanovic G. Polymorphisms of survivin-31 G/C gene are associated with risk of urothelial carcinoma in Serbian population. J BUON. 2017; 22(1): 270-7.
- Kawata N., Tsuchiya N., Horikawa Y., Inoue T., Tsuruta H., Maita S., Satoh S., Mitobe Y., Narita S., Habuchi T. Two survivin polymorphisms are cooperatively associated with bladder cancer susceptibility. Int J Cancer. 2011; 129(8): 1872-80. doi: 10.1002/ijc.25850.
- Jaiswal P.K., Goel A., Mandhani A., Mittal R.D. Functional polymorphisms in promoter survivin gene and its association with susceptibility to bladder cancer in North Indian cohort. Mol Biol Rep. 2012; 39(5): 5615-21. doi: 10.1007/s11033-011-1366-1.
- Huang Z.M., Chiang Y.T., Tung M.C., Wu C.C., Chen K.C., Huang M.T., Wang Y.H., Shen C.H. Survivin promoter rs9904341 polymorphism is associated with tumor stage and grade in patients with bladder cancer. Adv Biosci Biotechnol. 2013; 4(1): 1-5. doi: 10.4236/ abb.2013.41001.
- Krasitskaya V.V., Kudryavtsev A.N., Shimomura O., Frank L.A. Obelin mutants as reporters in bioluminescent dual analyte binding assay. Anal Methods. 2013; 5(3): 636-40. doi: 10.1039/C2AY25976A.
- Башмакова Е.Е., Кудрявцев А.Н., Франк Л.А. Разработка способа получения функционально активного рекомбинантного стрептавидина в клетках Escherichia coli. Журнал Сибирского федерального университета. Биология. 2020. 13(2): 218-29. [Bashmakova E.E., Kudryavtsev A.N., Frank L.A. Development of the method to produce functionally active recombinant streptavidin in Escherichia coli cells. J Sib Fed Univ. Biol. 2020; 13(2): 218-29. (in Russian)]. doi: 10.17516/1997-1389-0324.
- Bashmakova E.E., Krasitskaya V.V., Bondar A.A., Eremina E.N., Slepov E.V., Zukov R.A., Frank L.A. Bioluminescent SNP genotyping technique: Development and application for detection of melanocortin 1 receptor gene polymorphisms. Talanta. 2018; 189: 111-5. doi: 10.1016/j. talanta.2018.06.057.
- Bashmakova E.E., Krasitskaya V.V., Frank L.A. Simultaneous genotyping of four single nucleotide polymorphisms associated with risk factors of hemostasis disorders. Comb Chem High Throughput Screen. 2015; 18(10): 930-6. doi: 10.2174/1386207318666150917100134.
- БашмаковаЕ.Е., КрасицкаяВ.В., Юшкова А.Д., Добрецов К.Г., Франк Л.А. К вопросу о генетической предрасположенности к развитию хронической нейросенсорной тугоухости. Вестник оториноларингологии. 2021; 86(1): 15-9. [Bashmakova E.E., Krasitskaya V.V., Yushkova A.D., Dobrecov K.G., Frank L.A. To the question of genetic predisposition to the development of professional sensorineural hearing loss. Bulletin of Otorhinolaryngology. 2021; 86(1): 15-9. (in Russian)]. doi: 10.17116/otorino20218601115.
- SrivastavaK., SrivastavaA., MittalB. Survivin promoter -31G/C (rs9904341) polymorphism and cancer susceptibility: a meta-analysis. Mol Biol Rep. 2012; 39(2): 1509-16. doi: 10.1007/s11033-011-0889-9.
- Andric M., Nikolic N., Boskovic M., Milicic B., Skodric S., Basta Jovanovic G., Milasin J. Survivin gene promoter polymorphism -31G/C as a risk factor for keratocystic odontogenic tumor development. Eur J Oral Sci. 2012; 120: 9-13. doi: 10.1111/j.1600-0722.2011.00919.x.
- AntonacopoulouA.G., FloratouK., Bravou V., Kottorou A., Dimi-trakopoulos F.I., Marousi S., Stavropoulos M., Koutras A.K., Scopa C.D., Kalofonos H.P. The survivin-31 snp in human colorectal cancer correlates with survivin splice variant expression and improved overall survival. Anal Cell Pathol (Amst). 2010; 33(5): 177-89. doi: 10.3233/ACP-CL0-2010-0537. Erratum in: Cell Oncol (Dordr). 2011; 34(4): 407-8.
- Krieg A., Mahotka C., Krieg T., Grabsch H., Müller W., Takeno S., Suschek C.V., Heydthausen M., Gabbert H.E., Gerharz C.D. Expression of different survivin variants in gastric carcinomas: first clues to a role of survivin-2B in tumour progression. Br J Cancer. 2002; 86(5): 737-43. doi: 10.1038/sj.bjc.6600153.
- CaldasH., HonseyL.E., AlturaR.A. Survivin 2a: a novel survivin splice variant expressed in human malignancies. Mol Cancer. 2005; 4. 11. doi: 10.1186/1476-4598-4-11.
- Pavlidou A., Kroupis C., DimasK. Association of survivin splice variants with prognosis and treatment of breast cancer. World J Clin Oncol. 2014; 5(5): 883-94. doi: 10.5306/wjco.v5.i5.883.
- Jang J.S., Kim KM, Kang K.H., Choi J.E., Lee W.K., Kim C.H., Kang Y.M., Kam S., Kim I.S., Jun J.E., Jung T.H., Park J.Y. Polymorphisms in the survivin gene and the risk of lung cancer. Lung Cancer. 2008; 60(1): 31-9. doi: 10.1016/j.lungcan.2007.09.008.
- Suga K., Yamamoto T., Yamada Y., Miyatake S., Nakagawa T., Tanigawa N. Correlation between transcriptional expression of survivin isoforms and clinicopathological findings in human colorectal carcinomas. Oncol Rep. 2005; 13(5): 891-7.
- Koike H., Sekine Y., Kamiya M., Nakazato H., Suzuki K. Gene expression of survivin and its spliced isoforms associated with proliferation and aggressive phenotypes of prostate cancer. Urology. 2008; 72(6): 1229-33. doi: 10.1016/j.urology.2007.12.064.
- Zhang M., Yang J., Li F. Transcriptional and post-transcriptional controls of survivin in cancer cells: novel approaches for cancer treatment. J Exp Clin Cancer Res. 2006; 25(3): 391-402.


