Анализ связи полиморфного локуса RS1052133 гена OGG1 с риском развития злокачественных новообразований у людей, подвергшихся радиационному воздействию
Автор: Янишевская М.А., Блинова Е.А., Кореченкова А.В., Аклеев А.В.
Рубрика: Научные статьи
Статья в выпуске: 3 т.32, 2023 года.
Бесплатный доступ
В настоящее время не вызывает сомнения, что одним из факторов риска развития злокачественных новообразований (ЗНО) является генетическая предрасположенность. Так, определённый вклад в инициацию рака могут вносить однонуклеотидные полиморфизмы (ОНП) генов, поддерживающих стабильность генома, в том числе, ОНП генов репарации ДНК. Исследователи из разных стран особое внимание уделяют полиморфизму rs1052133 гена эксцизионной репарации оснований OGG1 . Предполагается, что полиморфизм rs1052133 в данном гене может быть связан с предрасположенностью к развитию ЗНО. Целью настоящего исследования стало установление связи между полиморфизмом rs1052133 гена эксцизионной репарации оснований OGG1 и риском развития ЗНО у лиц, подвергшихся хроническому радиационному воздействию. В исследование вошли 888 человек, подвергшихся хроническому облучению в малых и средних дозах на реке Тече и Восточно-Уральском радиоактивном следе. В результате проведённого исследования был установлен повышенный риск развития ЗНО у облучённых носителей аллеля rs1052133*G: ОШ=1,38; 95% ДИ [1,05-1,83], p=0,02. Была отмечена значимость межфакторных взаимодействий, носящих синергетический характер, между дозой на красный костный мозг и полиморфизмом rs1052133 гена OGG1 (TBA=0,56; CVC=10/10; p=0,01).
Однонуклеотидные полиморфизмы, ген ogg1, rs1052133, генотипирование, аллель, mdr, канцерогенез, хроническое радиационное воздействие, река теча
Короткий адрес: https://sciup.org/170200563
IDR: 170200563 | УДК: 616-006.04-02:614.876]-07 | DOI: 10.21870/0131-3878-2023-32-3-97-108
Текст научной статьи Анализ связи полиморфного локуса RS1052133 гена OGG1 с риском развития злокачественных новообразований у людей, подвергшихся радиационному воздействию
Рак является мультифакторным заболеванием, характеризующимся сложным взаимодействием как генетических, так и внешнесредовых этиологических факторов. На сегодняшний день не вызывает сомнения тот факт, что существенный вклад в инициацию рака вносят генетические факторы [1], среди которых определённую роль играют однонуклеотидные полиморфизмы (ОНП).
Сегодня особое внимание исследователей уделяется полиморфизму rs1052133 гена оксогуанин-гликозилазы 1 – OGG1 (8-Oxoguanine DNA Glycosylase-1) [2, 3]. OGG1 кодирует фермент ДНК-8-оксогуанин-ДНК-гликозилазу 1, которая участвует в эксцизионной репарации оснований, защите ДНК от повреждения и индукции онкотрансформации [4]. Согласно литературным данным минорный аллель G полиморфизма rs1052133 вызывает снижение активности репарации ДНК и связан с риском развития злокачественных новообразований (ЗНО) различных локализаций [5, 6]. В эпидемиологических исследованиях носительство гомозиготного генотипа G/G полиморфизма rs1052133 связывают с повышенным риском возникновения различных типов ЗНО, включая рак пищевода [7], желчного пузыря [8], рака лёгкого [9], а также с повышенным риском развития карциномы лёгкого [10].
Генетическая предрасположенность может являться одним из факторов повышенного риска возникновения ЗНО, возникающих при внешнесредовых воздействиях, в частности, ионизирующего излучения (ИИ). В последнее десятилетие особую актуальность имеет изучение влияния малых доз ИИ на риск развития ЗНО [11], главным образом, в контексте широкого внедрения радиационных методов в медицинскую практику [12]. По данным некоторых авторов до 2% ЗНО могут быть результатом медицинского облучения [13]. Важным вкладом в оценку средне-популяционных рисков возникновения ЗНО при хроническом воздействии ИИ являются исследования последствий радиоактивного загрязнения территорий р. Течи и Восточно-Уральского радиоактивного следа (ВУРСа). Согласно Крестининой и др. (2020) [14] избыточный относительный радиационный риск заболеваемости ЗНО у населения этих территорий составляет 0,08 на 100 мГр (95% доверительный интервал (ДИ) 0,039-0,113).
В настоящее время проблема индивидуального риска возникновения радиационных эффектов у лиц, имеющих генетическую предрасположенность, является открытой. Согласно Публикации 103 МКРЗ (2007) [15] в научной среде находит признание факт, что вариантные гены низкой пенетрантности могут создавать «высокопеременную экспрессию рака после радиационного воздействия». В частности, предполагается, что полиморфизмы в генах, принимающих непосредственное участие в процессах репарации повреждений ДНК, в сочетании с радиационным воздействием, могут модифицировать ответ организма и влиять на канцерогенный риск [16]. Однако, спустя почти 15 лет с момента выхода в свет Публикации 103 МКРЗ (2007), объём данных в пользу такой точки зрения по-прежнему ограничен. В связи с этим, ОНП в данных генах могут рассматриваться как потенциальные предикторы развития радиационно-индуцированного канцерогенеза.
Целью настоящего исследования стало установление ассоциативной связи между полиморфизмом rs1052133 гена эксцизионной репарации оснований OGG1 и риском развития ЗНО у лиц, подвергшихся хроническому радиационному воздействию.
Материалы и методы
Характеристика группы облучённых лиц. Исследование риска развития ЗНО проводилось среди лиц, подвергшихся хроническому радиационному воздействию на р. Тече и ВУРСе. Облучённые лица, вошедшие в настоящее исследование, много лет наблюдаются в ФГБУН «Уральский научно-практический центр радиационной медицины ФМБА России» (УНПЦ РМ). В рамках этих наблюдений у пациентов проводился забор цельной крови. При этом все пациенты подписывали добровольное информированное согласие на проведение исследования, согласованное с этическим комитетом УНПЦ РМ. Для исследуемых лиц были рассчитаны индивидуальные поглощённые дозы облучения красного костного мозга (ККМ) и мягких тканей с использованием дозиметрической системы Techa River Dosimetry System (TRDS 2016) [17]. Следует отметить, что из-за присутствия остеотропных изотопов 89,90Sr среди радионуклидов, попавших в окружающую среду, поглощённые дозы на ККМ на порядок превышали дозы на мягкие ткани и у отдельных лиц достигали нескольких Гр. При этом дозы на мягкие ткани были меньше 750 мГр у всех обследованных (табл. 1). Исследуемые в данной работе лица были разделены на две группы: облучённые лица с онкологическими заболеваниями («облучённые с ЗНО» – 300 человек), у которых на период проведения анализа в анамнезе содержались сведения о ЗНО различной локализации, и облучённые лица без онкологических заболеваний («облучённые без ЗНО» – 588 человек). Подробная характеристика исследуемых лиц представлена в табл. 1.
Таблица 1
Характеристика исследуемых лиц
|
Показатель |
Облучённые без ЗНО |
Облучённые с ЗНО |
|
Объём выборки, N |
N=588 |
N=300 |
|
мужчины Пол, N (%) жен щины |
198 (33,7%) 390 (66,3%) |
127 (42,3%) 173 (57,7%) |
|
славяне Этническая группа, N (%) |
286 (48,6%) 302 (51,4%) |
145 (48,3%) 155 (51,7%) |
|
Возраст, лет1 (min-max) |
75,46±8,22 (57-98) |
75,84±7,53 (55-95) |
|
Доза облучения ККМ, мГр M±SD (min-max)2 |
592,83±26,14 (0,70-3393,51) |
523,10±33,89 (0,74-3507,07) |
|
Доза облучения мягких тканей, мГр M±SE (min-max)2 |
83,61±4,51 (0,02-644,64) |
87,69±6,83 (0,02-740,78) |
Примечание: 1 – среднее значение ± стандартное отклонение (min-max); 2 – среднее значение ± стандартная ошибка (min-max).
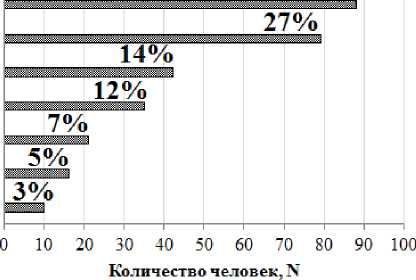
Представленные группы были сопоставимыми по полу, этническому составу, возрасту, а также по дозам облучения ККМ и мягких тканей. Структура заболеваемости ЗНО среди исследуемых лиц представлена на рис. 1.
30%
Органы пищеварительной системы а Органы женской репродуктивной системы “ Органы покровной системы я Органы дыхательной системы - Органы мочевыделительной системы и Органы мужской репродуктивной системы
Органны эндокринной системы
Рис. 1. Структура ЗНО у лиц когорты реки Течи.
Всего в анализ были включены 300 человек с подтверждёнными случаями ЗНО различных локализаций. Среди диагностированных форм солидных ЗНО были следующие: ЗНО органов пищеварительной системы – 89 человек (код по МКБ-10 С00.2, C02.1, C04.9, С06.9, C15.9, C16.9, С18.4, С19, C22.9, C25.9), органов женской репродуктивной системы – 80 человек (код по МКБ-10 С50, С53.9, С54.9, С57.4), органов покровной системы – 43 человека (код по МКБ-10 С44.90), органов дыхательной системы – 36 человек (код по МКБ-10 C32.9, С33, С34), органов мочевыделительной системы – 22 человека (код по МКБ-10 C67.9, C68.9), органов мужской репродуктивной системы – 19 человек (код по МКБ-10 С61), органов эндокринной системы – 11 человек (код по МКБ-10 С73). Основным источником информации о состоянии здоровья пациентов являлась база данных УНПЦ РМ и программный комплекс REGISTR, разработанный в УНПЦ РМ [18]. Выявленные случаи ЗНО диагностированы в период с 1969 по 2020 гг. Верификация диагнозов осуществлялась на основе гистологического, цитологического и лабораторно-инструментального подтверждения.
Генотипирование. Для генотипирования использовались замороженные при -80 °С образцы ДНК, хранящиеся в банке тканей УНПЦ РМ. Генотипирование проводилось методом ПЦР «в реальном времени» на приборе StepOnePlus™ Real-Time PCR System (Applied Biosystems, США) с использованием набора для генотипирования полиморфного маркера («Тест-Ген», Россия). Нуклеотидная последовательность праймера (F): 5′-CAGTGGATTCTCATTGCCTTC-3′, (R): 5′-AACCCTTTCTGCGCTTTG-3′. Условия амплификации соответствовали протоколу фирмы-производителя: первая денатурация – 95 °С/2 мин; 94 °С/10 сек, 60 °С/1 мин – 40 циклов.
Статистический анализ. Оценка отклонения распределения частот генотипов исследованного полиморфизма от ожидаемого равновесного распределения по закону Харди-Вайнберга (HWE) проводилась с использованием критерия χ2 в онлайн-калькуляторе Gene Calc . Анализ различий в частотах генотипов между группами проводили с использованием онлайн-калькулятора Medstatistic calculators/. Оценка ассоциации аллелей и генотипов в полиморфном локусе rs1052133 с риском развития ЗНО проводилась с использованием расчёта показателя отношения шансов (ОШ) и 95% ДИ. Ассоциация считалась статистически значимой при р<0,05.
Анализ межфакторных взаимодействий в отношении риска развития ЗНО проводился методом многофакторного снижения размерности [19]. Расчёты проводились в программном пакете MDR v. 3.0.2 . Значимость взаимодействий оценивалась точностью предсказания (Testing Balanced Accuracy, TBA) не менее 55% и согласованностью перекрёстной проверки (Cross Validation Consistency, CVC) не менее 9 из 10. Значение p было установлено с помощью теста 1000-кратной перестановки. Ассоциация считалась статистически значимой при р<0,05. Вклад каждого фактора и/или их взаимодействия оценивается величиной энтропии Н, выраженной в процентах.
Результаты и обсуждение
Оценка связи полиморфизма rs1052133 с риском развития ЗНО. В ранее проведённых нами исследованиях, включающих 170 облучённых человек с онкологическими заболеваниями, была выявлена связь полиморфизма rs1052133 гена OGG1 с риском развития ЗНО. В соответствии с кодоминантной моделью было установлено, что у носителей генотипа С/G полиморфизма rs1052133 ОШ составило 2,14, 95% ДИ [1,43-3,22] [16].
В настоящем исследовании мы расширили группу облучённых лиц с ЗНО до 300 человек и провели анализ связи полиморфизма rs1052133 с риском развития ЗНО. Распределение частот аллелей и генотипов по полиморфному локусу rs1052133 гена OGG1 представлено в табл. 2.
Распределение частот аллелей и генотипов по полиморфному локусу rs1052133 гена OGG1 соответствовали ожидаемому равновесному распределению по закону Харди-Вайнберга в группе «Облучённые без ЗНО» p=0,97. В то же время, в группе «Облучённые с ЗНО» наблюдалось отклонение от равновесия Харди-Вайнберга (p=0,04). Для установления причины нарушения равновесия Харди-Вайнберга было рассчитано значение индекса Fis (Fixation index size), которое составило -0,146, что указывает на избыток гетерозигот в данной группе.
Далее была проведена оценка связи полиморфизма rs1052133 гена OGG1 с риском развития онкологических заболеваний на основе рецессивной и доминантной моделей наследования, рассматриваемых в настоящем исследовании (табл. 3).
Таблица 2
Частотное (%) распределение аллелей и генотипов по полиморфному локусу rs1052133 гена OGG1
|
Группа |
Частота генотипов, N (%) |
Частота аллелей, N (%) |
p-value (HWE1) |
|||
|
OGG1 rs1052133 |
||||||
|
G/G |
C/G |
C/C |
G |
C |
||
|
Облучённые с ЗНО (N=300) |
13 (4,33%) |
135 (45%) |
152 (50,67%) |
161 (26,83%) |
439 (73,17%) |
0,04 |
|
Облучённые без ЗНО (N=588) |
31 (5,27%) |
212 (36,05%) |
345 (58,68%) |
274 (23,30%) |
902 (76,70%) |
0,97 |
|
χ2 |
χ2=6,70, p=0,04 |
χ2=2,68, p=0,10 |
||||
Примечание: 1 – HWE – Hardy-Weinberg Equilibrium (равновесие Харди-Вайнберга).
Таблица 3
Анализ связи полиморфизма rs1052133 гена OGG1 с риском развития ЗНО
|
Модель |
Генотип |
Облучённые без ЗНО |
Облучённые с ЗНО |
ОШ (95% ДИ) |
p-value |
|
Рецессивная |
C/C-C/G |
557 (94,7%) |
287 (95,7%) |
1,00 |
0,54 |
|
(GG/GC+CC) |
G/G |
31 (5,3%) |
13 (4,3%) |
0,81 (0,42-1,58) |
|
|
Доминантная |
C/C |
345 (58,7%) |
152 (50,7%) |
1,00 |
0,02 |
|
(CC/GG+GC) |
C/G-G/G |
243 (41,3%) |
148 (49,3%) |
1,38 (1,05-1,83) |
В результате исследования выявлено, что риск развития ЗНО у носителей минорного аллеля rs1052133*G был статистически значимо выше по сравнению с носителями генотипа C/C. Значение ОШ составили 1,38; 95% ДИ [1,05-1,83], p=0,02.
В большинстве исследований влияния полиморфных участков генов на риск развития рака рассматриваются отдельные локализации. С целью установления связи выявленного полиморфного участка с отдельными видами ЗНО был проведён анализ в группе облучённых лиц с ЗНО, которые наиболее широко представлены в исследуемой выборке и составили в общей сложности более 50% от общего числа регистрируемых новообразований. Для этого была составлена группа облучённых лиц с ЗНО органов пищеварительной системы (89 человек) и женской репродуктивной системы (80 человек).
В результате проведённого анализа не было обнаружено статистически значимой связи между носительством минорного аллеля rs1052133*G и риском развития новообразований органов пищеварительной системы и женской репродуктивной системы.
Согласно результатам проведённого MDR анализа наибольший вклад в формирование предрасположенности к развитию заболевания вносит доза облучения ККМ (0,66%) и полиморфизм rs1052133 (0,54%), тогда как доза на мягкие ткани не оказывает значимого влияния (<0,01%). При рассмотрении межфакторных связей был отмечен синергизм между полиморфизмом и дозой на ККМ (TBA=0,56; CVC=10/10; p=0,01). Дендрограмма межфакторных взаимодействий представлена на рис. 2.
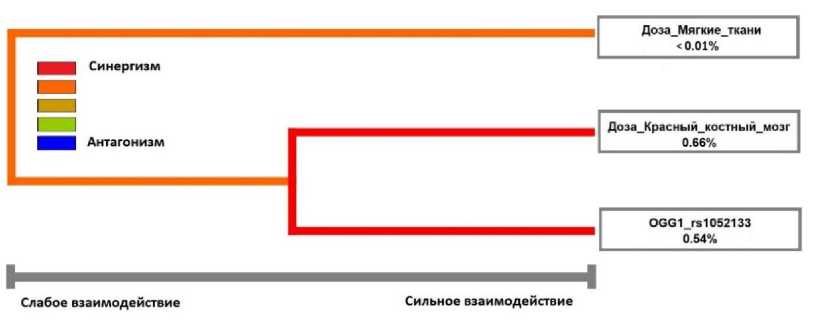
Рис. 2. Дендрограмма межфакторных взаимодействий.
Продукт гена OGG1 – 8-оксогуанин-ДНК-гликозилазы 1 играет важную роль на первом этапе защиты клетки от накопления повреждений ДНК. Фермент вырезает побочный продукт окисления гуанина – 8-дигидро-7,8-оксогуанозина (8-oxodG), который возникает в результате повреждения ДНК активными формами кислорода. В случае, если не происходит удаление 8-oxodG, то он может стать причиной ошибок кодирования и приводить к трансверсии C→A, которая достаточно часто встречается в злокачественных опухолях [20]. Результаты различных исследований поиска ассоциации ОНП генов, защищающих клетку от повреждающего действия ИИ, с канцерогенным риском свидетельствуют о потенциальной возможности применения некоторых ОНП в качестве биологических маркеров предрасположенности к отдалённым эффектам воздействия ИИ, прежде всего, ЗНО [21]. Однако наличие рискового полиморфного аллеля не всегда определяет риск развития патологии, в связи с этим оценивается не только ассоциативная связь, но и регуляторный потенциал конкретного ОНП. Несмотря на отсутствие данного полиморфного участка в базе данных полногеномных исследований GWAS на основе анализа открытых ресурсов VannoPortal и RegulomeDB был установлен регуляторный потенциал полиморфного участка rs1052133. Согласно рангу RegulomeDB полиморфный участок rs1052133 обладает высоким регуляторным потенциалом (значение 0,554 по шкале от 0 до 1) и представляет собой вариант экс-прессионного локуса в мотиве связывания транскрипционного фактора или в регионе гиперчувствительности к ДНКазе (eQTL-вариант). Подобные замены приводят к изменению в сайтах связывания транскрипционных факторов, меняя их афинность, что в свою очередь может отражаться на эффективности транскрипции [22]. Данный вариант представляет собой миссенс мутацию С/G и приводит к замене Pro332Ala. Кроме того, при оценке геномной патогенности согласно модели прогнозирования regBase полиморфизм rs1052133 имеет вероятность вовлечённости в патологический процесс (значение по шкале 0,77; likely pathogenic), а оценка онкогенно-сти указывает на наличие драйверного эффекта (0,96; likely cancer driver).
На сегодняшний день многочисленные исследования подтвердили связь между rs1052133 и риском развития многих видов рака у необлучённых людей. Результаты генетических исследований показали статистически значимую связь аллеля rs1052133*G с повышенным риском таких видов рака как: рак мочевого пузыря ОШ=2,05; 95% ДИ [1,36-3,08] [23], рак желчного пузыря ОШ=4,5; 95% ДИ [1,1-22,4] [24] и рак лёгких ОШ=2,1; 95% ДИ [1,2-3,7] [25]. Наблюдаемый сенсибилизирующий эффект аллеля G в отношении риска развития рака может быть обусловлен тем, что OGG1, несущий аллель дикого типа rs1052133*С, обладает в 7 раз более высокой активнос- тью в отношении удаления 8-oxodG из ДНК, чем OGG1, несущий мутантный аллель rs1052133*G [26]. Однако результаты исследований по установлению связи rs1052133 с отдельными видами рака до сих пор остаются противоречивыми. Данные тезисы справедливы, например, для гинекологического рака, где повышенный риск у носителей аллеля rs1052133*G был обнаружен в работах [27-29], но не подтверждён в других работах [30-32].
В настоящем исследовании установлено, что аллель rs1052133*G гена OGG1 является рисковым в отношении развития ЗНО у облучённых людей. У облучённых лиц (888 человек) обнаружена статистически значимая связь аллеля rs1052133*G гена OGG1 с развитием злокачественных опухолей различных локализаций ОШ=1,38; 95% ДИ [1,05-1,83], p=0,02, согласно доминантной модели наследования. Однако при оценке риска развития отдельных ЗНО (пищеварительной и женской репродуктивной систем) не выявлено статистически значимой связи, что вероятно связано с низкой статистической мощностью из-за небольшого количества обследованных лиц, имеющих данные виды рака.
Был отмечен синергетический эффект взаимодействия накопленной дозы облучения ККМ и аллеля rs1052133*G гена OGG1 в отношении риска развития ЗНО.
Отсутствие значимого влияния дозы облучения мягких тканей на модификацию генетически-ассоциированного риска появления злокачественных опухолей, вероятно, связано с тем, что средняя доза облучения мягких тканей находится в диапазоне до 100 мГр, и выборка в 500-700 человек слишком мала, чтобы обнаружить статистически значимый эффект. Это хорошо согласуется с оценкой избыточного относительного риска заболеваемости (8% на 100 мГр).
Заключение
В результате исследования было установлено, что полиморфизм rs1052133 гена OGG1 может быть рассмотрен в качестве потенциального биологического маркера риска развития злокачественных опухолей различной локализации, при хроническом радиационном воздействии в диапазоне доз от 0,74 до 3507,07 мГр (среднее 523,10±33,89 мГр). Отмечено, что наличие рискового генотипа rs1052133*G в сочетании с радиационным воздействием может модифицировать риск развития ЗНО, на что указывает синергическая взаимосвязь данного ОНП и дозы облучения ККМ.
Список литературы Анализ связи полиморфного локуса RS1052133 гена OGG1 с риском развития злокачественных новообразований у людей, подвергшихся радиационному воздействию
- Lichtenstein P., Holm N.V., Verkasalo P.K., Iliadou A., Kaprio J., Koskenvuo M., Pukkala E., Skytthe A., Hemminki K. Environmental and heritable factors in the causation of cancer - analyses of cohorts of twins from Sweden, Denmark, and Finland //N. Engl. J. Med. 2000. V. 343, N 2. P. 78-85.
- Wang Y., Gao X., Wei F., Zhang X., Yu J., Zhao H., Sun Q., Yan F., Yan C., Li H., Ren X. The hOGGI Ser326Cys polymorphism contributes to digestive system cancer susceptibility: evidence from 48 case-control studies //Tumour Biol. 2015. V. 36, N 2. P. 1029-1038.
- Floyd R.A. The role of 8-hydroxyguanine in carcinogenesis //Carcinogenesis. 1990. V. 11, N 9. P. 1447-1450.
- Boiteux S., Radicella J.P. The human OGG1 gene: structure, functions, and its implication in the process of carcinogenesis //Arch Biochem Biophys. 2000. V. 377, N 1. P. 1-8.
- Weiss J.M., Goode E.L., Ladiges W.C., Ulrich C.M. Polymorphic variation in hOGG1 and risk of cancer: a review of the functional and epidemiologic literature //Mol. Carcinog. 2005. V. 42, N 3. P. 127-141.
- Kohno T., Shinmura K., Tosaka M. Genetic polymorphisms and alternative splicing of the hOGG1 gene, that is involved in the repair of 8-hydroxyguanine in damaged DNA //Oncogene. 1998. V. 16, N 25. P. 3219-3225.
- Xing D.Y., Tan W., Song N., Lin D.X. Ser326Cys polymorphism in hOGG1 gene and risk of esophageal cancer in a Chinese population //Int. J. Cancer. 2001. V. 95, N 3. P. 140-143.
- Jiao X., Huang J., Wu S., Lv M., Hu Y., Jianfu Su X., Luo C., Ce B. hOGG1 Ser326Cys polymorphism and susceptibility to gallbladder cancer in a Chinese population //Int. J. Cancer. 2007. V. 121, N 3. P. 501-505.
- Le Marchand L., Donlon T., Lum-Jones A., Seifried A., Wilkens L.R. Association of the hOGG1 Ser326Cys polymorphism with lung cancer risk //Cancer Epidemiol. Biomarkers Prev. 2002. V. 11, N 4. P. 409-412.
- Литвяков Н.В., Фрейдин М.Б., Тахауов Р.М., Агеева А.М., Волкова Н.М., Иванина П.В., Гончарик О.О., Васильева Е.О., Скобельская Е.В., Карпов А.Б. Взаимосвязь генного полиморфизма с риском развития злокачественных новообразований в условиях низкоинтенсивного радиационного воздействия //Экологическая генетика. 2009. Т. 7, № 4. С. 23-33.
- Effects and risks of ionizing radiation. UNSCEAR 2020/2021. Report the General Assembly with Scientific Annexes. ANNEX C: Scientific Annex C: Biological mechanisms relevant for the inference of cancer risks from low-dose and low-dose-rate radiation. New York: United Nations, 2021.
- Цыб А.Ф., Иванов В.К., Бирюков А.П. Возможности радиационной эпидемиологии при решении проблем радиационной безопасности медицинского облучения //Радиация и риск. 2008. Т. 17, № 2. С. 50-62.
- Sulieman A., Adam H., Elnour A., Tamam N., Alhaili A., Alkhorayef M., Alghamdi S., Khandaker M.U., Bradley D.A. Patient radiation dose reduction using a commercial iterative reconstruction technique package //Radiat. Phys. Chem. 2021. V. 178. P. 108996. DOI: 10.1016/j.radphyschem.2020.108996.
- Крестинина Л.Ю., Силкин С.С., Микрюкова Л.Д., Епифанова С.Б., Аклеев А.В. Риск заболеваемости солидным раком в уральской когорте случайно облучённого населения: 1956-2017 гг. //Радиационная гигиена. 2020. T. 13, № 3. C. 6-17.
- ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103 //Ann. ICRP. 2007. V. 37, N 2-4. P. 1-61.
- Блинова Е.А., Аклеев А.В. Связь однонуклеотидных полиморфизмов генов репарации ДНК с риском развития злокачественных новообразований у лиц, подвергшихся хроническому радиационному воздействию //Медицина экстремальных ситуаций. 2017. T. 61, № 3. С. 104-109.
- Дегтева М.О., Напье Б.А., Толстых Е.И., Шишкина Е.А., Бугров Н.Г., Крестинина Л.Ю., Аклеев А.В. Распределение индивидуальных доз в когорте людей, облучённых в результате радиоактивного загрязнения реки Течи //Медицинская радиология и радиационная безопасность. 2019. Т. 64, № 3. С. 46-53.
- Старцев Н.В., Шишкина Е.А., Блинова Е.А., Аклеев А.В. Справочно-информационный комплекс REGISTR Уральского научно-практического центра радиационной медицины ФМБА России //Медицинская радиология и радиационная безопасность. 2022. Т. 67, № 1. С. 46-53.
- Hahn L.W., Ritchie M.D., Moore J.H. Multifactor dimensionality reduction software for detecting gene-gene and gene-environment interactions //Bioinformatics. 2003. V. 19, N 3. P. 376-382.
- Alexandrov L.B., Nik-Zainal S., Wedge D.C., Aparicio S., Behjati S., Biankin A.V., Bignell G.R., Bolli N., Borg A., Borresen-Dale A.L., Boyault S., Burkhardt B., Butler A.P., Caldas C., Davies H.R., Desmedt C., Eils R., Eyfjord J.E., Foekens J.A., Greaves M., Hosoda F., Hutter B., Ilicic T., Imbeaud S., Imielinsk M., Jager N., Jones D.T. W., Jones D., Knappskog S., Kool M., Lakhani S.R., Lopez-Otin C., Martin S., Mun-shi N.C., Nakamura H., Northcott P.A., Pajic M., Papaemmanuil E., Paradiso A., Pearson J.V., Puente X.S., Raine K., Ramakrishna M., Richardson A.L., Richter J., Rosenstiel Philip Schlesner M., Schumacher T.N., Span P.N., Teague J.W., Totoki Y., Tutt A.N.J., Valdes-Mas R., van Buuren M.M., van't Veer L., Vincent-Salomon A., Waddell N., Yates L.R., Zucman-Rossi J., Futreal P.A., McDermott U., Lichter P., Meyerson M., Grimmond S.M., Siebert R., Campo E., Shibata T., Pfister S.M., Campbel P.J., Stratton M.R. Signatures of mutational processes in human cancer //Nature. 2013. V. 500. P. 415-421.
- Аклеев А.В., Аклеев А.А. Пострадавший от радиационного воздействия человек - кто он? //Радиационная гигиена. 2022. Т. 15, № 2. С. 87-94.
- Бабушкина Н.П., Кучер А.Н. Регуляторный потенциал SNP-маркеров в генах, кодирующих белки системы репарации ДНК //Молекулярная биология. 2023. Т. 75, № 1. С. 24-46.
- Arizono K., Osada Y., Kuroda Y. DNA repair gene hOGG1 codon 326 and XRCC1 codon 399 polymorphisms and bladder cancer risk in a Japanese population //Jpn. J. Clin. Oncol. 2008. V. 38, N 3. P. 186-191.
- Jiao X., Huang J., Wu S., Lv M., Hu Y., Jianfu Z., Su X., Luo C., Ce B. hOGG1 Ser326Cys polymorphism and susceptibility to gallbladder cancer in a Chinese population //Int. J. Cancer. 2007. V. 121, N 3. P. 501-505.
- Sorensen M., Raaschou-Nielsen O., Hansen R.D., Tjonneland A., Overvad K., Vogel U. Interactions between the OGG1 Ser326Cys polymorphism and intake of fruit and vegetables in relation to lung cancer //Free Radic. Res. 2006. V. 40, N 8. P. 885-891.
- Kohno T., Shinmura K., Tosaka M. Genetic polymorphisms and alternative splicing of the hOGG1 gene, that is involved in the repair of 8-hydroxyguanine in damaged DNA //Oncogene. 1998. V. 16, N 25. P. 3219-3225.
- Chen H., Wang H., Liu J., Cheng Q., Chen X., Ye F. Association of base excision repair gene hOGG1 Ser326Cys polymorphism with susceptibility to cervical squamous cell carcinoma and high-risk human papilloma virus infection in a Chinese population //Genet. Test. Mol. Biomarkers. 2019. V. 23, N 2. P. 138-144.
- Smolarz B., Michalska M.M., Samulak D., Wojcik L., Romanowicz H. Studies of correlations between single nucleotide polymorphisms of DNA repair genes and endometrial cancer in Polish women //Anticancer Res. 2018. V. 38, N 9. P. 5223-5229.
- Michalska M.M., Samulak D., Romanowicz H., Bienkiewicz J., Sobkowski M., Ciesielski K., Smolarz B. Single nucleotide polymorphisms (SNPs) of hOGG1 and XRCC1 DNA repair genes and the risk of ovarian cancer in Polish women //Tumour Biol. 2015. V. 36, N 12. P. 9457-9463.
- Verma S., Sharma V., Nagpal A., Bhat A., Bhat G. R., Shah R., Wakhloo A., Suri, J., Abrol D., Kaul S., Bhat A., Verma V., Kumar R. DNA base excision repair genes variants rs25487 (X-ray repair cross-complementing 1) and rs1052133 (human 8-oxoguanine glycosylase 1) with susceptibility to ovarian cancer in the population of the Jammu region, India //J. Cancer Res. Ther. 2019. V. 15, N 6. P. 1270-1275.
- Sobczuk A., Poplawski T., Blasiak J. Polymorphisms of DNA repair genes in endometrial cancer //Pathol. Oncol. Res. 2012. V. 18, N 4. P. 1015-1020.
- Romanowicz-Makowska H., Smolarz B., Houli A., Szyllo K. Single nucleotide polymorphism in DNA base excision repair genes XRCC1 and hOGG1 and the risk of endometrial carcinoma in the Polish population //Pol. J. Pathol. 2011. V. 62, N 2. P. 89-94.


