Анализ вероятности перехода монофокального клинически изолированного синдрома в клинически достоверный рассеянный склероз
Автор: Захаров А.В., Повереннова И.Е., Хивинцева Е.В., Грешнова И.В., Гендуллина Е.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: История медицины, юбилейные даты
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Цель: изучить первую атаку демиелинизирующего заболевания с поражением одной функциональной системы; оценить факторы, влияющие на скорость перехода монофокального клинически изолированного синдрома (КИС) в клинически достоверный рассеянный склероз (КДРС). Материалы и методы. Проведено изучение структуры монофокального КИС на примере 102 наблюдений. Прослежена конверсия монофокального КИС в КДРС. Изучены результаты клинических и инструментальных исследований: магнитно-резонансной томографии (МРТ) и мультимодальных вызванных потенциалов (ММВП). Результаты: выявлены клинические и инструментальные маркеры высокой вероятности перехода монофокального КИС в КДРС. Заключение. Ранний возраст возникновения КИС и большое количество очагов демиелинизации по результатам МРТ являются факторами высокого риска развития КДРС.
Клинически изолированный синдром, магнитно-резонансная томография, рассеянный склероз
Короткий адрес: https://sciup.org/14917548
IDR: 14917548
Текст научной статьи Анализ вероятности перехода монофокального клинически изолированного синдрома в клинически достоверный рассеянный склероз
1Введение. Клинически изолированный синдром (КИС) — это монофазно (впервые, с быстрым началом) развившаяся симптоматика, а точнее, отдельный клинический эпизод, который вызван предположительно воспалительным демиелинизирующим заболеванием. КИС имеет синоним: «первый демиелинизирующий эпизод» или «первый эпизод демиелинизации» [1, 2].
В современной классификации КИС выделяют следующие его варианты [3]:
тип 1 — клинически монофокальный; по меньшей мере 1 асимптомный МРТ-очаг;
тип 2 — клинически мультифокальный; по меньшей, мере 1 асимптомный МРТ-очаг;
тип 3 — клинически монофокальный; МРТ может быть без патологии; нет асимптомных МРТ-очагов;
тип 4 — клинически мультифокальный; МРТ может быть без патологии; нет асимптомных МРТ-очагов;
тип 5 — нет клинических проявлений, предполагающих демиелинизирующее заболевание, но есть наводящие МРТ-данные.
Критерием КИС является не семиотически-топи-ческая (синдромная) изолированность клинической неврологической симптоматики, а ее «временная ограниченность» — монофазность, то есть отсутствие признаков диссеминации во времени. КИС может быть монофокальным или мультифокальным, но всегда без признаков диссеминации во времени — монофазным [4-6].
При КИС складывается следующая ситуация: с одной стороны, имеется клиника атаки рассеянного склероза (РС), которую можно расценить как дебют заболевания. С другой стороны, отсутствуют так называемые критерии клинически достоверного рассеянного склероза (КДРС) по W. McDonald et al. (2001, 2010) — многосистемность поражения и дис-
Адрес: 443095, г. Самара, ул. Ташкентская, 220, кв. 141.
Тел.: +79171620301.
семинация очагов демиелинизации в пространстве и во времени. Поэтому такому пациенту диагноз РС не ставится и, соответственно, не проводится соответствующих лечебно-профилактических мероприятий [7—11].
Цель исследования : изучение вопроса о сроках перехода, о степени и факторах риска конверсии КИС в КДРС.
Методы. Группу исследования составили пациенты с моносистемным (монофокальным) проявлением КИС (102 наблюдения). Длительность наблюдения за больными была от 1 года до 7 лет. Возраст пациентов колебался от 15 до 25 лет и составил в среднем 25,9 + 6,8 года. Показателем трансформации КИС в КДРС служила диссеминация процесса в пространстве и во времени. Это выражалось в возникновении второй атаки заболевания (диссеминация во времени) и/или в увеличении количества очагов демиелинизации на МРТ до 10 и более, возрастании их размеров, появлении контрастируемых очагов (дис-семинация в пространстве).
Неврологическое обследование на разных этапах включало оценку по шкале инвалидизации EDSS, применяемой для определения выраженности неврологического дефицита и функций самообслуживания у больных с рассеянным склерозом (РС), которая используется при других, близких к РС, многоочаговых демиелинизирующих заболеваниях для сравнения клинических характеристик прогрессирования и прогноза. Магнитно-резонансную томографию (МРТ) головного мозга проводили всем больным на аппарате INTERA с напряженностью магнитного поля 1,5 TL. Толщина срезов составила 3-5 мм. Для получения информации о состоянии афферентных проводников использовали вызванные потенциалы разной модальности (слуховые, зрительные, соматосенсорные). Всем больным производили осмотр глазного дна, где обращали внимание на состояние диска зрительного нерва: его цвет, границы, ход и калибр сосудов, наличие очаговых изменений.
В основу статистического анализа положена идея построения математической модели заболевания с целью решения основного вопроса, который возникает при анализе данных клиники и инструментальных методов: насколько высока вероятность развития КДРС у больного с КИС. Данная задача решалась с помощью метода логистической регрессии и ROC-анализа — аппарата для анализа качества построенной модели, а также определения вероятности перехода КИС в КДРС.
Результаты. В ходе работы было проведено клиническое обследование 102 пациентов с монофо-кальным КИС. У всех больных заболевание возникло остро, симптомы развивались на протяжении от 1-2 часов до 2 дней и держались не менее 48 часов. Учитывали возраст, пол, время появления симптомов. Для объективизации тяжести неврологического дефицита применяли шкалу J. Kurtzke с определением степени инвалидизации. Возраст дебюта заболевания составил от 15 до 25 лет, при этом «пик заболеваемости» приходился на 25 лет, после чего заболеваемость экспоненциально снижалась к 45 годам, после чего монофокальный КИС не регистрировался. Таким образом, средний возраст дебюта составил 25,09±6,68 года, медиана — 24 года, минимальный возраст — 16 лет, максимальный — 44 года.
Все начальные симптомы заболевания (моносим-птомное поражение) были объединены в следующие группы: зрительные, чувствительные, двигательные, координаторные, стволовые, тазовые, другие (астенический синдром).
Чаще всего КИС был представлен ретробульбарным невритом (30 наблюдений, или 29,4%). У 20 больных (19,6%) отмечались стволовые нарушения, у 18 пациентов (17,6%) двигательные нарушения, по 15 больных (14,7%) нарушения со стороны чувствительной и мозжечковой систем. По 2 наблюдения (2,0%) заболевание дебютировало астеническим синдромом или нарушением функций тазовых органов. Можно отметить, что, несмотря на моносимптом-ность проявлений, выраженность их была довольно значительной, что заставило пациентов обратиться за медицинской помощью и пройти обследование.
На МРТ головного мозга у всех больных выявлялась картина очагового поражения белого вещества головного мозга от 1 до 9 очагов, расположенных пе-ривентрикулярно, в мозолистом теле. Форма очагов овальная, длинник перпендикулярен коре головного мозга. Размер описываемых очагов от 3 мм и более. Очаги гиперденсные в Т2 режиме, изоденсные в Т1 режиме. Наличие нескольких гиперинтенсивных очагов в Т2 режиме свидетельствовало о диссеминации демиелинизирующего процесса в пространстве, но не наблюдалось необходимой для диагноза РС дис-семинации во времени: наличия гипоинтенсивных в Т1 режиме очагов или накапливания контрастного вещества только в некоторых из выявленных очагов. С учетом клинической картины (моносимптомность поражения) и данных МРТ ставился диагноз: «клинически изолированный синдром».
Распределение пациентов в зависимости от выраженности неврологической симптоматики по шкале инвалидизации (EDSS) носило следующий характер: 45 (44,1%) пациентов были с 1 баллом; 2,0 балла имел 31 (30,4%) больной, 1,5 балла имели 13 (12,7) больных. Пациенты со значением EDSS более 3 баллов составили единичные наблюдения. Среднее значение — 1,5 балла.
Из общего количества наблюдаемых с монофо-кальным КИС на протяжении от 1 года до 7 лет у 23 пациентов (22,5%) произошло конвертирование в КДРС в соответствии с критериями МакДональда (2010). К моменту возникновения второй атаки заболевания, что можно расценивать как развитие КДРС, средний возраст составил 29,2±8,16 года.
У 7 пациентов (30,4%) наблюдался минимальный неврологический дефицит: 1 и 1,5 балла, у 4 (17,4%) — 2 балла, у 2 (8,7%) — 3 балла, в единичных наблюдениях 2,5, 3,5 и 6 баллов (по 4,3%). Таким образом, выраженность неврологического дефицита при конверсии КИС в КДРС также имела тенденцию к минимальным значениям, выраженная симптоматика наблюдалась редко.
Анализ показал, что размер очагов при монофо-кальном КИС у 78 обследуемых (79,5%) в среднем составлял 8,17±3,57 мм, а у пациентов со свершившимся переходом в КДРС 12,34±5,36 мм. Дисперсия по данному критерию составила р=0,01, что свидетельствует о достоверной разнице в размере очагов для монофокального КИС и КДРС. Полученные результаты согласуются с ранее опубликованными данными, а именно: прогностическими критериями для развития КДРС служат характеристики очагов, точнее, их размер и овальная форма [8].
При монофокальном КИС отмечено достаточно «мягкое» поражение зрительной системы (1-2 балла). У пациентов, не совершивших перехода в КДРС, достоверно чаще отсутствовало поражение зрительной системы. Наличие стволовой симптоматики при первой атаке заболевания не влияло на вероятность перехода КИС в КДРС.
При конверсии в КДРС поражение пирамидной системы по своей выраженности не носило тяжелого характера (легкий, преимущественно рефлекторный, гемипарез или парапарез). Мозжечковые же нарушения, не отличавшиеся по выраженности у совершивших и не совершивших переход в КДРС, после конверсии становились более выраженными. Чувствительные нарушения при КИС не имели зависимости степени выраженности и частоты конвертирования в КДРС. В случаях перехода в КДРС отмечено нарастание сенсорных расстройств от легких до умеренной степени выраженности.
Нарушения функций тазовых органов, а также астенические расстройства отмечены в единичных наблюдениях при монофокальном КИС и при конверсии КИС в КДРС. Поражение данных функциональных систем не является характерным для первой атаки демиелинизирующего заболевания. Вместе с тем, жалобы пациента на нарушение функций кишечника и мочевого пузыря или утомляемость, снижение физической и умственной активности обычно не являются поводом для обращения к специалисту по демиелинизирующим заболеваниям ЦНС.
В анализе данных мультимодальных вызванных потенциалов при второй атаке заболевания и развитии КДРС у больных с монофокальным КИС наиболее информативными оказались зрительные вызванные потенциалы (ЗВП) на реверсивный шахматный паттерн. Так, увеличение латентности пика N75 наблюдалось достоверно чаще в группе пациентов, совершивших переход в КДРС. Акустические стволовые вызванные потенциалы (АСВП) оставались в пределах нормы на протяжении всего исследования во всех группах больных. Удлинение латентности пика N13 соматосенсорных вызванных потенциалов (ССВП) является дополнительным признаком диссе- минации демиелинизирующего процесса в пространстве, так как данный пик появляется вследствие постсинаптической активации ядер продолговатого мозга. Изменение латентностей основных пиков ССВП при стимуляции срединного нерва было более выражено относительно пиков, генерируемых в шейном отделе спинного мозга, и таламо-кортикальной лучистости. В целом полученные данные свидетельствуют о неоднозначной реакции показателей мультимодальных вызванных потенциалов в ответ на первую атаку демиелинизирующего процесса, а также при конверсии КИС в КДРС.
Зависимость между временем наступления второй атаки демиелинизирующего процесса и зависимыми переменными, которыми являлись возраст и количество очагов, была на уровне р=0,0006, что показывает высокую достоверность полученных зависимостей.
Обсуждение. Данную зависимость можно изобразить в виде трехмерного графика (рисунок). Как видно, наименьшая скорость развития второй атаки заболевания наблюдается у пациентов с монофо-кальным КИС в возрасте от 25 до 47 лет с количеством очагов, выявляемых на МРТ при первой атаке, менее 10, а точнее, от 1 до 7.
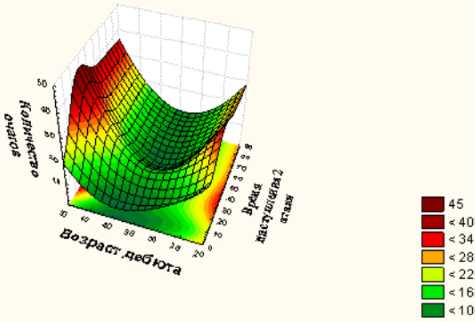
Трехмерный график зависимости скорости перехода моно-фокального КИС в КДРС
В группу высокого риска входили больные КИС в возрасте моложе 25 лет и с количеством очагов на первичной МРТ более 20. Данные пациенты перешли в КДРС уже через 20 месяцев наблюдения. В дальнейшем в этой группе продолжало нарастать количество переходов в КДРС. При первоначальном количестве очагов более 36 скорость перехода не возрастала и оставалась линейной на протяжении всего наблюдения.
Заключение. Таким образом, для монофокально-го КИС количество очагов более семи и возраст до 25 лет являются наиболее неблагоприятными признаками в плане скорости наступления второй атаки и конверсирования в КДРС, поэтому для ведения данных пациентов должна выбираться не наблюдательная тактика, а максимально быстрая дифференцировка монофокального КИС от возможных заболеваний, маскирующих процесс демиелинизации, и активное лечение с использованием препаратов, изменяющих течение РС.
Список литературы Анализ вероятности перехода монофокального клинически изолированного синдрома в клинически достоверный рассеянный склероз
- Гусев Е. И., Бойко А. Н., Столяров И. Д. Рассеянный склероз: справ. М.: Реал Тайм, 2009. 296 с.
- Завалишин И. А., Переседова А. В, Стойда Н. И. Диагностика и лечение рассеянного склероза//Неврологии и психиатрии. 2011. № 6. С. 24 -28
- Шмидт Т. Е., Яхно Н. Н. Рассеянный склероз: рук-во для врачей. 2-е изд. М.: МЕДпресс-информ, 2010. 272 с.
- Прахова Л. Н., Ильвес А. Г. Структурные и функциональные изменения головного мозга при рассеянном склерозе (механизмы развития, роль и методы оценки с использованием современных методов нейровизуализации)//Неврологический журнал. 2009. № 6. С. 19 -23
- Столяров И. Д., Вотинцева М. В. Рассеянный склероз: новое в диагностике и лечении (по материалам 26-го конгресса Европейского комитета по лечению и исследованию РС//Нейроиммунология. 2010. № 8. С. 64 -66
- Brain lesion location and clinical status status 20 years after a diagnosis of clinically isolated syndrome suggestive of multiple sclerosis/C. Dalton, B. Bodini, R. Samson [et al.]//Mult. Scler. 2011. Vol. 30. P. 38 -41
- Трофимова Т. Н. Лучевая диагностика рассеянного склероза СПб.: ЭЛБИ. 2010. 125 с.
- Correale J., Peirano I., Romano L. Benign multiple sclerosis: a new defnition of this entity is needed//Mult. Scler. 2011. Vol. 24.
- Lesion detection at seven Tesla in multiple sclerosis using magnetisation prepared 3D-FLAIR and 3D -DIR/W. L. De Graaf, J. J. Zwanenburg, F. Visser [et al.]//Eur. Radiol. 2011. Vol. 27
- Milo R., Panitch H. J. Combination therapy in multiple sclerosis//Neuroimmunol. 2011. Vol. 231. P. 23 -31
- Comi G., Fillipi M., Wolinsky J. S. European Canadian multi-center, double-blined, randomized, placebo-controlled study of the effects of glatiramer acetate on magnetic resonance imaging-measured disease activity and burden in patients with relapsing multiple sclerosis//Ann. Neurol. 2001. Vol. 49. P. 290 -297.


