Анализ влияния бифенила, хлор/хлоргидроксибифенилов и продуктов их биотрансформации на иммунный ответ и морфофункциональное состояние печени
Автор: Гейн С.В., Егорова Д.О., Королев Н.А., Логинова Н.П., Горбунова Т.И., Наговицина Е.С.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Установлено, что бифенил и ПХБ 12 (3,4-дихлорбифенил) угнетали гуморальный иммунитет, снижая количество антителообразующих клеток в селезенке. После микробной деградации исследуемых соединений штаммом Rhodococcus ruber 25 в течение 7 и 14 сут метаболиты ПХБ 12 и бифенила продолжали оказывать угнетающее влияние на количество антителообразующих клеток. Смесь Р, представляющая собой смесь хлорированных и гидроксилированных производных бифенила, не влияла на гуморальный ответ, но стимулировала клеточноопосредованный ответ, этот эффект нивелировался после микробной деградации. Гистологические исследования показали, что бифенил, ПХБ 12 и смесь Р в печени приводили к развитию хронического гепатита с признаками жировой и очаговой гидропической (центролобулярной) дистрофии гепатоцитов. Имелась реакция со стороны сосудов в виде полнокровия с признаками гемолиза эритроцитов. Наблюдались явления периваскулярной лимфогистиоцитарной инфильтрации. Под воздействием метаболитов, образованных в процессе деградации исследуемых соединений штаммом R. ruber Р25 в течении 7-14 дней, в печени сохранялись дистрофические изменения в гепатоцитах (без некровоспалительной реакции), и развивались признаки репаративной регенерации.
Бифенил, пхб, гуморальный иммунитет, клеточноопосредованный иммунитет
Короткий адрес: https://sciup.org/147251158
IDR: 147251158 | УДК: 615.9/579.222/571.27/612.35 | DOI: 10.17072/1994-9952-2025-1-103-115
Текст научной статьи Анализ влияния бифенила, хлор/хлоргидроксибифенилов и продуктов их биотрансформации на иммунный ответ и морфофункциональное состояние печени
Проблема токсического воздействия на организм человека и животных соединений органического синтеза является одной из наиболее актуальных в настоящее время. Особое внимание уделяется веществам, включенным, согласно Стокгольмской конвенции, в группу стойких органических загрязнителей (СОЗ), а также их производным, образующимся под действием природных экосистем [Final act ..., 2001]. Анализ научных библиотек, в том числе PubMed и Web of Science, за период с 2015 по 2021 гг. по ключевым словам «полихлорированные бифенилы» (входят в группу СОЗ), «ПХБ», «Aroclor» выявил более 60 тысяч научных сообщений, среди них 1586 статей, посвященных изучению влияния ПХБ и их производных на организм человека и животных [Carlson et al., 2023].
ПХБ – группа веществ 2 класса опасности, состоящая из 209 соединений, отличающихся количеством хлорных заместителей в молекуле и их расположением. ПХБ выпускались в промышленных масштабах в виде коммерческих смесей, содержащих 40–70 конгенеров [Erickson, Kaley, 2011]. Область применения ПХБ была чрезвычайно широкой, что привело к загрязнению данными веществами обширных территорий. Характерными особенностями ПХБ являются устойчивость к воздействию внешних факторов среды, растворимость в органических растворителях (в том числе в жирах), способность к биоаккумуляции и сорбции на различных поверхностях [Murinová, Dercová, 2014; Reddy et al., 2019; Devi, 2020].
Рядом исследований установлено, что ПХБ поступают в организм животных и человека, поднимаясь по пищевым цепям, а также в ингаляционной форме при проникновении в организм с мелкими частицами пыли [Frossard et al., 2023; Simpson et al., 2024; Ling et al., 2024]. Кроме того, дети, проживающие на территориях с высоким уровнем загрязнения, в первые годы жизни получают ПХБ с молоком матери [Guo et al., 2023]. ПХБ негативно влияют практически на все органы и системы человека и животных. Известно, что хроническое отравление ПХБ приводит к нарушениям нервной, репродуктивной и иммунной систем, генетическим поражениям, канцерогенезу [Spector et al., 2014; Ermler et al., 2022; Carlson et al., 2023; Guo et al., 2023; Tam et al., 2023; Miletić et al., 2023; Wu et al., 2024].
В последнее время появились данные о возможной природной трансформации ПХБ до гидроксипроизводных, которые являются вторичными поллютантами [Camara et al., 2004; Passatore et al., 2014; Tehrani, Van Aken, 2014; Sun et al., 2016, 2018; Li et al., 2019]. Находясь длительное время в почве, ПХБ выступают селективным фактором для отбора микроорганизмов, обладающих ферментативными системами окисления данных веществ. Под воздействием специфичных моно- и диоксигеназ, выявленных у штаммов родов Pseudomonas , Rhodococcus , Burkholderia и ряда других, происходит образование моно-или дигидроксилированных производных ПХБ [Parales, Resnick, 2006; Fukuda, 2014; Goto et al., 2018; Sun et al., 2018; Agulló et al., 2019]. Показано, что в организме человека также возможно образование моногидроксипроизводных ПХБ [Ludewig 2013; Yabu et al., 2022]. Период полувыведения гидроксилированных производных сопоставим с таковым для исходных ПХБ (от 1 до 20 лет) [Rengelshausen et al., 2023]. При этом данные вещества не менее опасны для человека и животных, чем негидроксилированные ПХБ [Ludewig 2013; Rengelshausen et al., 2023].
В большинстве работ показано, что негативный эффект оказывают либо смеси ПХБ, либо высокохло-рированные бифенилы. Так, на примере популяции, длительно проживающей на ПХБ-загрязненной территории, показано, что иммуносупрессия развивается в результате снижения пролиферации Т-лимфоцитов под воздействием смеси ПХБ [Hall et al., 2018]. Присутствие в организме ПХБ 126 (пен-тахлорированный бифенил) вызывало снижение функций гуморального и клеточноопосредованного иммунитета [Duffy et al., 2002]. Однако остается открытым вопрос о влиянии низкохлорированных бифенилов и их производных на отдельные органы и системы млекопитающих.
Цель работы – оценить влияние бифенила и его производных, содержащих 1-2 хлор- и/или гидрко-сигруппы, на показатели гуморального и клеточноопосредованного иммунитета, а также на гистологическую картину печени до и после микробной трансформации штаммом Rhodococcus ruber P25.
Материалы и методы исследования
В качестве объекта исследования служили мыши породы Swiss, массой приблизительно 18–23 г обоих полов. Животные содержались в условиях лабораторного вивария с 12-часовым циклом освещения, двухразовым питанием натуральным кормом в количестве, соответствующем суточным нормам, при неограниченном доступе к воде. Эксперименты были проведены в соответствии с рекомендациями и этическими нормами, указанными в «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» [Страсбург,1986].
Штамм-деструктор Rhodococcus ruber P25 (ВКМ Ас-3025, ИЭГМ896) – представитель аэробных, грамположительных, неспорообразующих, неподвижных бактерий, характеризующийся высокой биоде-градативной активностью в отношении хлорированных и гидроксилированных бифенилов [Плотникова и др., 2012; Egorova et al., 2020, Gorbunova et al., 2021].
В работе использованы аналитически чистые (>98%) бифенил («ACROS-Organics», США), 3,4-дихлорбифенил (ПХБ 12) (ИОС УрО РАН, Россия), смесь Р (в составе 3-хлорбифенил, 4-хлорбифенил, 3-гидрокси-4-хлорбифенил, 4-гидрокси-3-хлорбифенил) (ИОС УрО РАН, Россия) (табл. 1) [Егорова и др., 2021].
Таблица 1
Химическая характеристика исследуемых соединений [Chemical characterization of the studied compounds]
|
Наименование |
Молекулярная формула |
Структурная формула |
Молярная масса, г/моль |
Растворимость |
|
|
Н 2 О |
жиры |
||||
|
Бифенил |
С 12 H 10 |
vj\=/ |
154.21 |
– |
+ |
|
ПХБ 12 |
C 12 H 8 O 2 |
Cl Cl |
223.10 |
– |
+ |
Смесь Р
|
X© о4 ОО ^ |
ПХБ 2 |
C 12 H 9 Cl |
Cl |
188.66 |
– |
+ |
|
|
ПХБ 3 |
C 12 H 9 Cl |
Cl с |
"Л 7 |
188.66 |
– |
+ |
|
|
х© об о. |
3-гидрокси- 4-хлорбифенил |
C 12 H 9 ClO |
HO Cl |
204.66 |
± |
+ |
|
|
3-хлор-4-гидрокси-бифенил |
C 12 H 9 ClO |
Cl HO vT" |
204.66 |
± |
+ |
||
Бактериальную деструкцию бифенила, ПХБ 12 и смеси Р проводили согласно [Egorova et al., 2020]. Культуральную среду с продуктами деградации очищали от бактериальных клеток центрифугированием (центрифуга miniSpin, «Eppendorf», Германия) при 10 000 об/мин в течение 3 мин. Метаболиты деструк- ции бифенила и его хлор(гидрокси)производных определяли в культуральной жидкости методами спектрофотометрии и высокоэффективной жидкостной хроматографии согласно [Egorova et al., 2020; Егорова и др., 2021]. Присутствие исходных соединений контролировали методом газовой хроматографии с масс-селективным детектором согласно [Egorova et al., 2020; Егорова и др., 2021]. Отбор культуральной среды производили на 7 и 14 сутки культивирования.
Моделирование метаболических путей трансформации бифенила, ПХБ 12 и соединений, входящих в состав смеси Р, осуществляли на основании полученных экспериментальных результатов и международных баз данных: Brenda , KEGG , ExplorEnz , GenBank . Для визуализации метаболических путей использован пакет программ ACDLabs Freeware.
В ходе работы оценивали воздействие бифенила, ПХБ 12, смеси Р, а также продуктов их бактериальной деструкции, присутствующих в культуральной среде на 7 и 14 сутки, на показатели адаптивного и врожденного иммунитета.
Исследуемые вещества вводили мышам перорально, в кукурузном масле, последовательно, через день, в дозировке 100 мг/кг, в течение 24 дней. Выбор дозировки основан на материалах литературных источников [Руководство …, 2012].
Мыши были разделены на следующие группы:
-
1-я группа – контрольная, мышам из этой группы перорально вводили чистое кукурузное масло;
-
2-я группа – вводили перорально бифенил (подгруппа А), в кукурузном масле, и продукты его микробной деструкции (подгруппа Б – 7 суток деструкции, подгруппа В – 14 суток деструкции);
-
3-я группа – вводили перорально ПХБ 12 (подгруппа А), в кукурузном масле, и продукты его микробной деструкции (подгруппа Б – 7 суток деструкции, подгруппа В – 14 суток деструкции);
-
4-я группа – вводили перорально смесь Р (подгруппа А), в кукурузном масле, и продукты ее микробной деструкции (подгруппа Б – 7 суток деструкции, подгруппа В – 14 суток деструкции).
На 19-ый день эксперимента животных иммунизировали эритроцитами барана в брюшную полость в концентрации 108 клеток в 200 мкл физиологического раствора для индукции гуморального иммунитета в селезенке. На 24-ый день мышам вводили разрешающую дозу эритроцитов барана под кожу левой стопы и аналогичный объем физиологического раствора (0,9%-ный раствор NaCl), под кожу правой стопы, для индукции реакции гиперчувствительности замедленного типа (ГЗТ). На 25-ый день животных выводили из эксперимента методом декапитации под эфирным наркозом. Гуморальный иммунный ответ оценивали по количеству антителообразующих клеток (АОК) методом локального гемолиза в геле агарозы по методу Ерне [Jerne, Nordin, 1963]. Выраженность реакции ГЗТ оценивали путем измерения отека лапы по индексу массы.
Для оценки гистологического состояния печени орган фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.2) и заливали в парафин «Гистомикс». Гистологические препараты готовили по стандартным гистологическим методикам. Для оценки общей морфологической картины срезы (толщина 4–5 мкм) окрашивали гематоксилином и эозином.
Статистический анализ полученных результатов проводили с использованием непарного t-критерия Стьюдента. Данные представляли в виде средней и стандартной ошибки (M±m).
Результаты и их обсуждение
В результате проведенного исследования установлено, что незамещенный бифенил снижает количество АОК в селезенке по относительным показателям (Log10АОК/млн) (табл. 2). Появление двух атомов хлора у 3 и 4 углеродных атомов одного из колец молекулы бифенила (ПХБ 12) приводит к увеличению токсичности соединения, что выражается в угнетении антителогенеза по всем исследуемым показателям, в том числе в снижении количества ядросодержащих клеток (ЯСК/орган) (табл. 2). Отметим, что смесь Р, в составе которой присутствуют монохлорированные и монохлор-моногидроксипроизводные бифенила, не оказывает влияния на количество антителообразующих клеток, однако достоверно снижает количество ядросодержащих клеток (табл. 2).
Как видно из табл. 2, деградация бифенила и ПХБ 12 в течение 7 суток штаммом Rhodococcus ruber P25 (R. ruber Р25) (табл. 2) не приводила к изменению направленности эффекта в отношении количества АОК в селезенке, оно оставалось сниженным по сравнению с контролем как по абсолютным, так и по относительным показателям, однако нивелировала индуцированное ПХБ 12 и смесью Р угнетение в селезенке количества ядросодержащих клеток.
После 14 суток деградации исследуемых соединений штаммом R. ruber P25 метаболиты ПХБ 12 и бифенила продолжали оказывать угнетающе влияние на количество антителообразующих клеток, а также ПХБ 12 снижал клеточность селезенки. Помимо этого, метаболиты после14 суток деградации смеси Р штаммом R. ruber Р25 достоверно снижали в селезенке количество ядросодержащих клеток.
Таблица 2
Влияние бифенила, ПХБ 12, смеси Р и продуктов их микробной деградации на количество АОК в селезенке
[The effect of biphenyl, PCB 12, mixture of P and products of their microbial degradation on the amount of PFC (plaque forming cells) in the spleen]
|
Воздействие |
Log 10 АОК/млн |
Log 10 АОК/орг |
ЯСК/орган |
|
До биодеструкции |
|||
|
Контроль (n=8) |
2.40±0.05 |
4.90±0.07 |
348.00±31.99 |
|
Бифенил (n=8) |
2.05±0.19* |
4.40±0.17 |
277.60±33.85 |
|
ПХБ 12 (n=6) |
1.90±0.16* |
4.30±0.13* |
229.44±35.67* |
|
Смесь Р (n=8) |
2.40±0.05 |
4.80±0.05 |
228.15±11.23* |
7 сут деструкции
|
Контроль (n=15) |
2.43±0.04 |
4.71±0.08 |
235.41±36.94 |
|
Бифенил (n=8) |
1.54±0.32* |
3.73±0.23* |
176.20±37.67 |
|
ПХБ 12 (n=10) |
1.50±0.34* |
3.75±0.32* |
190.40±36.74 |
|
Смесь Р (n=8) |
2.02±0.20 |
4.33±0.20 |
205.87±23.23 |
14 сут деструкции
|
Контроль (n=8) |
2.29±0.12 |
4.62±0.14 |
235.40±36.45 |
|
Бифенил (n=8) |
1.77±0.34 |
3.98±0.19* |
196.16±87.83 |
|
ПХБ 12 (n=8) |
1.62±0.40 |
3.53±0.42* |
81.92±4.84* |
|
Смесь Р (n=8) |
2.18±0.27 |
4.19±0.28 |
105.92±9.70* |
Примечание: АОК ─ антителообразующие клетки. *p < 0.05 по сравнению с контролем по непарному t-критерию Стьюдента.
При анализе влияния бифенила, ПХБ 12, смеси Р и продуктов их микробной деградации на клеточноопосредованный иммунитет (табл. 3) были получены следующие результаты. Бифенил, ПХБ 12 и продукты их биодеградации не влияли на выраженность реакции ГЗТ, в то же время введение мышам смеси Р приводило к стимуляции данного показателя по сравнению с контрольными животными. Разложение смеси Р штаммом R. ruber Р25 в течении как 7, так и 14 суток приводило к нивелированию стимулирующего действия соединений смеси.
Таблица 3
Влияние бифенила, ПХБ 12, смеси Р и продуктов их микробной деградации на выраженность реакции ГЗТ в селезенке
[The effect of biphenyl, PCB 12, mixture of P and products of their microbial degradation on the severity of the DTH reaction in the spleen]
|
Индекс реакции (%) |
Контроль |
Бифенил |
ПХБ12 |
Смесь Р |
|
Без деградации |
23.63±1.85 |
28.55±3.14 |
22.69±2.01 |
32.84±3.94* |
|
7 сут |
24.52±2.67 |
29.35±3.27 |
32.58±3.77 |
24.18±3.30 |
|
14 сут |
23.61±5.65 |
11.96±4.81 |
13.327±2.81 |
17.76±3.02 |
Примечание: *p < 0.05 по сравнению с контролем по непарному t-критерию Стьюдента.
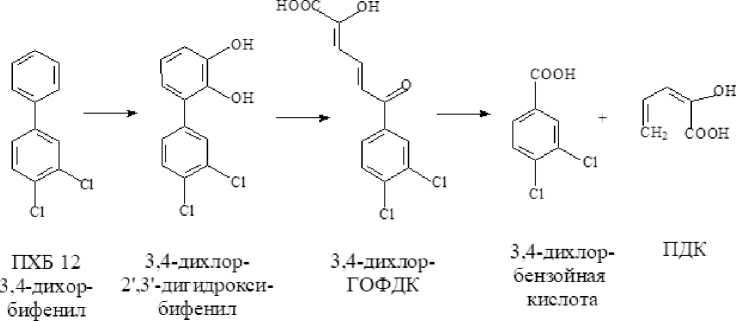
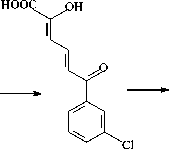
В результате анализа культуральной среды установлено, что при биодеструкции бифенила детектируется только бензойная кислота (БК) (табл. 4). Однако при разложении ПХБ 12 и смеси Р в среде обнаруживаются гидрокси-оксо-фенил-гексадиеновые кислоты (ГОФДК) с заместителями в положениях, соответствующих начальному субстрату, хлорбензойные (ХБК), хлор-гидрокси-бензойные (ХГБК) и пентадиеновые (ПДК) кислоты. Полученные данные согласуются с опубликованными ранее [Егорова и др., 2021].
Полученные в настоящем исследовании и опубликованные ранее данные позволяют утверждать, что штамм R. ruber P25 осуществляет разложение исследуемых соединений по классическому «верхнему» бифенильному пути (рис. 1, 2) [Егорова и др., 2021].
Несмотря на то, что к 7 суткам деструкции количество бифенила и ПХБ 12 существенно снизилось (табл. 4), токсический эффект сохранялся (табл. 2). Можно предположить, что появление дигидроксипроизводных бифенила/хлорбифенила и (хлор)бензойных кислот (ХБК/БК) вносит свой вклад в подавление процессов антителогенеза. При воздействии на организм мышей продуктами 14-ти дневной деструкции бифенила и ПХБ 12 токсический эффект сохраняется только для метаболитов ПХБ 12 (табл. 2). Исходное соединение в смеси отсутствует, однако зафиксировано значительное количество промежуточных продуктов, в том числе гидроксилированных метаболитов (табл. 4, рис. 2), что подтверждает высказан- ное ранее предположение о токсичности образующихся при биотрансформации бифенила/ПХБ промежуточных соединений [Camara et al., 2004; Passatore et al., 2014; Tehrani, Van Aken, 2014; Sun et al., 2016, 2018; Li et al., 2019].
Таблица 4
Эффективность деструкции и формирование метаболитов при биотрансформации бифенила и его производных
H
OH
COOH

CH 2 COOH
бифенил 2,3-дигидроксибифенил
ГОФДК
бензойная кислота
ПДК
Рис. 1. Схема метаболического пути деструкции бифенила штаммом R. ruber P25 [Scheme of the metabolic pathway of biphenyl destruction by the R. ruber strain P25]
[The efficiency of destruction and formation of metabolites during biotransformation of biphenyl and its derivatives]
|
Субстрат |
Время, сут |
Деструкция, % |
Основные метаболиты |
|
|
ГОФДК, о.е. |
БК/ХБК/ХГБК |
|||
|
бифенил |
7 |
97 |
0 |
0.1 мг/л |
|
14 |
100 |
0 |
0.3 мг/л |
|
|
ПХБ 12 |
7 |
95 |
λ 438 = 0.120 |
0.2 мг/л |
|
14 |
100 |
λ 438 = 0.285 |
0.4 мг/л |
|
|
Смесь Р |
7 |
88 |
λ 436 = 0.112 λ 438 = 0.268 |
5.2×107 мВ·с |
|
14 |
100 |
λ 418 = 0.134 λ 438 = 0.382 |
4.4×107 мВ·с |
|
Рис. 2. Схема метаболического пути деструкции ПХБ 12 штаммом R. ruber P25 [Егорова и др., 2021] [Scheme of the metabolic pathway of PCB 12 destruction by the R. ruber strain P25 [Егорова и др., 2021]]
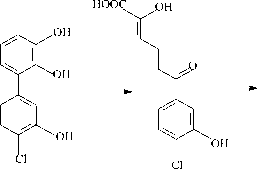
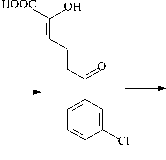
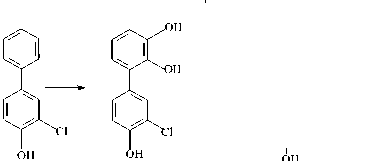
Трансформация компонентов смеси Р происходит через стадии образования ди- и тригидроксилирован-ных продуктов (рис. 3). Интересно отметить, что смесь Р, содержащая монохлорированные и монохлормоногидрокси-бифенилы, угнетала образование ядросодержащих клеток в селезенке, не влияя на АОК, и стимулировала реакцию клеточноопосредованного иммунитета (табл. 2). Через 7 суток деструкции количество смеси Р снижается до 12% от исходного содержания, что приводит к нивелированию ранее отмеченных эффектов. Однако через 14 суток, когда в среде присутствуют только метаболиты бактериальной деструкции смеси Р, вновь отмечается угнетение в селезенке количества ядросодержащих клеток (табл. 2, 4). Данное явление может быть следствием накопления метаболитов, в том числе хлор-гидрокси-бензойных кислот, гидрокси-пентадиеновых кислот, гидроксилированных ГОФДК и тригидрокси-хлорбифенилов (рис. 3, табл. 4). Известно, что гидроксилирование продуктов биотрансформации ПХБ приводит к увеличению их водорастворимости и чувствительности к ряду детоксицирующих ферментных систем [Haraguchi et al., 1997; Yabu et al., 2022]. Однако ферменты окисления производных ПХБ у разных видов млекопитающих отличаются по активности к одному и тому же конгенеру ПХБ и его метаболитам [Yabu et al., 2022]. Данный факт вносит дополнительные трудности при интерпретации данных о токсичности тех или иных продуктов биодеструкции ПХБ для отдельных видов млекопитающих.
COOH
Cl
3-хлор- 3-хлор-
ГОФДК бензойная кислота

CH 2 COOH
ПДК
ПХБ 2 3-хлор-
3-хлор- 2',3'-дигидрокси- бифенил бифенил
ПХБ 3 4-хлор-
4-хлор- 2',3'-дигидрокси- бифенил бифенил
Cl
4-хлор-ГОФДК
COOH
4-хлор-бензойная кислота

CH 2 COOH
ПДК
Cl
3-гидрокси-4-хлорбифенил
3-гидрокси-4-хлор-ГОФДК
3,2',3'-тригидрокси-4-хлорбифенил
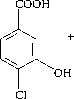
3-гидрокси-4-хлор-бензойная кислота

COOH
ПДК
3-хлор-4-гидрокси-
ГОФДК
3-хлор-4-гидроксибифенил
3-хлор-2',3',4-тригидрокси-бифенил
COOH
+
Cl
OH
3-хлор-4-гидрокси-бензойная

CH 2 COOH
ПДК
кислота
Рис. 3. Схема путей биодеструкции компонентов смеси Р штаммом R. ruber P25
[Scheme of the biodegradation pathways of the components of the P mixture by the R. ruber strain P25]
В работе [Rengelshausen et al., 2023] отмечено, что низкохлорированные бифенилы и их метаболиты могут циркулировать в клетках печени. Кроме того, низкохлорированные конгенеры ПХБ способны инициировать гепатокарциногенез у млекопитающих [Ludewig et al., 2013].
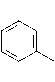
В настоящем исследовании установлено, что на фоне перорального введения бифенила, ПХБ 12 и смеси Р в печени имела место гистоморфологическая картина хронического гепатита (рис. 4), фиксировалась распространенная «пылевидная» и мелкокапельная жировая дистрофия гепатоцитов, очаговая гидропическая (центролобулярная) дистрофия гепатоцитов. В сосудах портальной системы имелись признаки застоя клеток крови. В части центральных вен долек печени наблюдались признаки выраженного переполнения кровью, явления гемолиза эритроцитов. Эндотелий был несколько увеличен в объеме, что свидетельствует о его гипертрофии. Целостность сосудистых стенок сохранена. Явлений диапедеза, геморрагий нет. Верифицируются участки периваскулярной лимфогистиоцитарной инфильтрации.
А
Б
В
Г
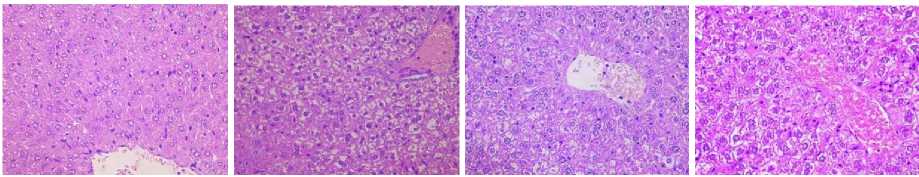
Рис. 4. Структура печени в контрольной группе (А), под воздействием бифенила (Б), ПХБ 12 (В) и смеси Р (Г). Ув. 400
[The structure of the liver in the control group (A), under the influence of biphenyl (B), PCB 12 (C) and the P mixture (D). Magnification 400]
После 7 суток деградации штаммом R. ruber Р25 под воздействием образовавшихся метаболитов всех исследуемых соединений в печени сохранялась распространенная белковая дистрофия гепатоцитов с гидратацией цитоплазмы; мелкоочаговые дегенеративные изменения ядер гепатоцитов; повышенная пролиферативная активность гепатоцитов (рис. 5).
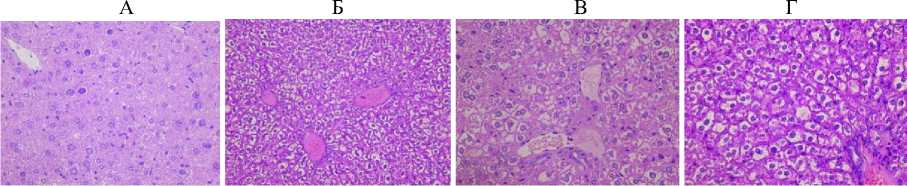
Рис. 5. Структура печени в контрольной группе (А), под воздействием бифенила (Б), ПХБ 12 (В) и смеси Р (Г) после 7 суток деградации штаммом R. ruber Р25. Ув. 400
[The structure of the liver in the control group (A), under the influence of biphenyl (B), PCB 12 (B) and the P mixture (G) after 7 days of degradation by the R. ruber strain P25. Magnification 400]
После 14 суток деградации штаммом R. ruber Р25 под воздействием образовавшихся метаболитов всех исследуемых соединений мы продолжаем наблюдать в печени распространенную белковую дистрофию гепатоцитов, мелкие фокусы некроза отдельных гепатоцитов и групп гепатоцитов без некровос-палительной реакции, выраженный анизокариоз и увеличение количества двуядерных гепатоцитов в центральных областях печеночных долек (рис. 6).
А
Б
В
Г
Рис. 6. Структура печени в контрольной группе (А), под воздействием бифенила (Б), ПХБ 12 (В) и смеси Р (Г) после 14 суток деградации штаммом R. ruber Р25. Ув. 400
[The structure of the liver in the control group (A), under the influence of biphenyl (B), PCB 12 (B) and the P mixture (G) after 14 days of degradation by the R. ruber strain P25. Magnification 400]
Заключение
В результате проведенных исследований установлено, что бифенил, ПХБ 12 и продукты их биодеструкции, образованные под воздействием ферментативных систем штамма Rhodococcus ruber P25, оказывают угнетающее действие на гуморальный иммунитет млекопитающих. Напротив, смесь Р, представленная смесью монохлорированных и монохлор-моногидроксилированных бифенилов, не оказывала влияния на гуморальный иммунитет, однако стимулировала клеточноопосредованный ответ. Стоит отметить, что трансформация компонентов смеси Р штаммом R. ruber P25 приводила к нивелированию выявленных эффектов в отношении иммунных реакций млекопитающих. Установлено, что бифенил, ПХБ 12 и смесь Р вызывают развитие хронического гепатита с признаками дистрофии гепатоцитов. Под воздействием метаболитов, образованных при трансформации бифенила, ПХБ 12 и смеси Р штаммом R. ruber P25, в печени образуются дистрофические изменения в гепатоцитах (без некровоспалительной реакции), при этом развивались признаки репаративной регенерации.


