Анализ влияния уровня экспрессии генов и сетей межмолекулярных взаимодействий на развитие радиорезистентности опухолевых клеток
Автор: Погодина Е.С., Расторгуева Е.В., Юрова Е.В., Белобородов Е.А., Сугак Д.Е., Саенко Ю.В., Фомин А.Н., Волков М.А., Костишко Б.М.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Несмотря на свои успехи радиационная терапия сталкивается с проблемами ускоренной репродукции опухолевых клеток и радиорезистентности злокачественных новообразований. Цель исследования заключалась в анализе влияния уровня экспрессии генов и сетей межмолекулярных взаимодействий на развитие радиорезистентности опухолевых клеток. Материалы и методы. Использовали 4 опухолевые клеточные линии: К562, HCT-116р53 (+/+), НСТ-116р53 (-/-) и Me45. Для исследования транскриптома выбранных клеточных линий применяли гибридизационные ДНК-чипы высокой плотности Affymetrix серии HGU133А. Биоинформационный анализ динамики экспрессии генов проводили с помощью оригинальной программы Gene Selector. Изучение сетей межмолекулярных взаимодействий выполняли с использованием онлайн-системы STRING. Результаты. Установлено, что уровень экспрессии генов DAAM1, IFNAR2, PALLD и STK17A после воздействия ионизирующего излучения в дозе 4 Гр возрастает в клеточной линии К562 и снижается в HCT-116р53 (+/+), НСТ-116р53 (-/-) и Me45. При использовании онлайн-системы STRING обнаружены многочисленные комплексы белков исследуемых генов. Из этого следует, что гены DAAM1, IFNAR2, PALLD и STK17A способны оказывать воздействие на деятельность некоторых участников сети межмолекулярных взаимодействий. Отобранные гены DAAM1, IFNAR2, PALLD и STK17A и белок-белковые комплексы, кодируемые данными генами: DAAM1, TNK2, PTBP2 и DVL2; IFNAR2, STAT2, IRF9, JAK1, GNB2L1 и IFNAR1; PALLD, LPP и ACTN2 - можно использовать в качестве потенциальных мишеней, модуляция которых позволит увеличить ответ клеток злокачественных новообразований на воздействие ионизирующего излучения.
Злокачественная опухоль, экспрессия генов, радиорезистентность опухолевых клеток, ионизирующее излучение, белок-белковое взаимодействие
Короткий адрес: https://sciup.org/14125352
IDR: 14125352 | УДК: 616-006.6:615.849.015.46:577.21 | DOI: 10.34014/2227-1848-2022-3-142-155
Текст научной статьи Анализ влияния уровня экспрессии генов и сетей межмолекулярных взаимодействий на развитие радиорезистентности опухолевых клеток
Введение. Ежегодно в мире насчитывают более 14 млн случаев заболеваемости и смертности от злокачественных новообразований, и в последующие десятилетия их количество предположительно увеличится до 22 млн [1]. Доказано, что из всех методов терапии злокачественных опухолей менее тяжелыми последствиями характеризуется радиационная терапия. В радиационной терапии используется ионизирующее излучение (ИИ) для преобразования молекул воды опухолевых клеток в пероксид-радикалы, способные разрушать внутриклеточные структуры, главным образом ДНК клетки [2]. Низкая выживаемость опухолевых клеток также связана с мутациями, которые возникают под влиянием ИИ. Однако, несмотря на успехи, радиацион- ная терапия сталкивается с проблемами ускоренной репродукции опухолевых клеток и радиорезистентности злокачественных новообразований [3].
Доказано, что радиоустойчивость клеток злокачественных опухолей формируется на разных уровнях воздействия на клетку и на каждом из них активируются различные молекулы [4]. Такой процесс, как правило, приводит к блокированию некоторых внутриклеточных процессов, нарушению контроля клеточного цикла и апоптозу [5]. В связи с этим некоторые специалисты представляют канцерогенез как хронический стресс, а радиоустойчивость клеток опухолей связывают с гиперэкспрессией стрессовых белков, которая является реакцией клеток на стрессовое воз- действие. Подтверждение этому обнаружено в исследованиях, проведенных на опухолевых клетках мышей: ИИ в дозе 6 Гр оказывало влияние на клетки опухоли и усиливало экспрессию стрессовых белков [6]. В других исследованиях показано, что увеличение количества некоторых белков позволяет защитить злокачественную опухоль от воздействия ИИ. Таким образом, одной из главных причин формирования радиорезистентности опухолевых клеток является измененная экспрессия генов [7].
Доказано [8], что на воздействие ИИ ра-диоустойчивые опухолевые клетки реагируют не напрямую. Между внешним стимулом и особым ответом опухолевых клеток имеется особый каскад сигнальных молекул. Его описывают как биохимический путь, который способен усилить или ослабить внутриклеточный сигнал и превратить его в форму, реализующую ответные реакции. Соответственно, важным условием развития устойчивости опухолевых клеток к ИИ, кроме активности некоторых генов, является изменение свойств и внутриклеточной концентрации белков. В данном случае имеется в виду их биохимическое взаимодействие и взаимосвязи, на основе которых осуществляется передача сигналов в клетке.
Таким образом, для понимания процесса развития резистентности опухолевых клеток к ИИ важно учитывать степень интенсивности экспрессии генов. Ее изучение имеет фундаментальное значение с точки зрения выявления определенных генов и практическое значение, которое заключается в увеличении ответа радиоустойчивых клеток опухоли на воздействие ИИ.
Цель исследования. Провести анализ влияния уровня экспрессии генов и сетей межмолекулярных взаимодействий на развитие радиорезистентности опухолевых клеток.
Материалы и методы. Использовали 4 линии опухолевых клеток: К562 - суспензионную линию человеческих эритролейкемических лимфобластоидных клеток; HCT-116p53 (+/+) и HCT-116p53 (-/-) - клеточные линии рака прямой кишки человека с нормальным и мутантным геном ТР53 ; Ме45 - клеточную линию меланомы человека. Культивирование клеток исследуемых линий проводили при стандартных условиях: в СО 2 -инкубаторе
МСО-18А1С СО2 (Helicon, Япония) при постоянной температуре 37 °С, 5 % СО 2 и 98 % влажности. Для поддержания жизнедеятельности использовали питательную среду DMEM/F12 («ПанЭко», Россия) без L-глутамина, с 10 % эмбриональной бычьей сывороткой и 5 мкг/мл гентамицина для линий HCT-116p53 (+/+), HCT-116p53 (-/-) и Ме45 и среду RPMI-1640 («ПанЭко», Россия), содержащую L-глутамин, 10 % эмбриональную бычью сыворотку и 5 мкг/мл гентамицина, для линии К562. Через каждые 4 дня проводили замену питательной среды. В качестве источника излучения использовали цифровой линейный ускоритель Elekta Synergy (ELEKTA, Швеция). Облучение клеток ИИ проводили однократно в дозе 4 Гр. Клеточные линии подвергались облучению в ГУЗ Областной клинический онкологический диспансер г. Ульяновска.
Дифференцирование клетки с признаками апоптоза и некроза проводили с использованием комплекта V-FITC Apoptosis Kit (Invit-rogen, США) методом проточной цитометрии. РНК выделяли с помощью набора для выделения РНК в соответствии с инструкцией производителя. Целостность выделенной РНК анализировали биоанализатором Agilent 2100 (Agilent Technologies, США). Библиотеку клонированных ДНК готовили с использованием комплекта Gene Chip Expression 3'-Amplifica-tion One - Cycle cDNA Synthesis Kit. Мечение биотином антисмысловых библиотек клонированных РНК и очистку выполняли с помощью набора Gene Chip Expression 3'-Ampli-fication Reagentsfor IVT Labeling в соответствии с протоколом производителя. Общее число полученных РНК и ДНК устанавливали с использованием спектрофотометра NanoDrop. Гибридизацию кРНК выполняли с матрицей HGU133А. Окрашенную матрицу отмывали от несвязавшегося белка. После чего ее сканировали на специальном сканере GeneArray G2500A. Выбор генов по уровню интенсивности их экспрессии и поиск общих в исследуемых опухолевых клеточных линиях осуществляли с помощью оригинальной программы Gene Selector. Анализ сети межмолекулярных взаимодействий проводили на основе базы данных STRING 9.0 (Search Tool for the Retrieval of Interacting Genes/Proteins).
Определение уровня чувствительности исследуемых линий опухолевых клеток к ИИ осуществляли методом проточной цитофлуо-метрии с использованием Annexin-V-FITC и иодида пропидия.
В качестве контроля использовали аналогичные клеточные линии, которые не подвергались воздействию ИИ.
Результаты и обсуждение. После облучения в дозе 4 Гр в радиочувствительных клеточных линиях рака прямой кишки человека HCT-116p53 (-/-) и HCT-116p (+/+) выявлено соответственно 24,9 % и 20 % клеток с призна- ками апоптоза и некроза; в радиочувствительной клеточной линии меланомы человека Ме45 у 28,4 % клеток обнаружены признаки деградации. Менее радиочувствительной оказалась линия человеческих эритролейкемических лим-фобластоидных клеток К562, в которой после ее облучения только у 12,8 % клеток выявлены признаки апоптоза и некроза. Таким образом, опухолевые клетки линии К562 являются более радиорезистентными к воздействию ИИ, чем клетки линий HCT-116p (+/+), HCT-116p (-/-) и Me45 (рис. 1).
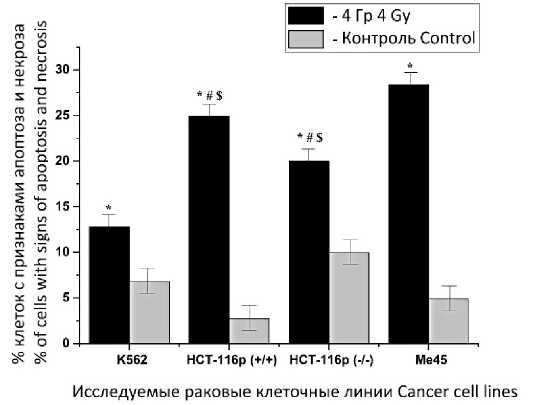
Рис. 1. Общее число клеток с признаками апоптоза и некроза в исследуемых линиях опухолевых клеток через 24 ч после воздействия ИИ в дозе 4 Гр (достоверные различия при р<0,05: * - с контрольной группой, # - с клеточной линией K562, $ - с клеточной линией Me45)
Fig. 1. The total number of cells with signs of apoptosis and necrosis in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p (-/-) and Me45) 24 hours after irradiation with ionizing radiation at a dose of 4 Gy. (* - the differences are significant compared with the control group (p<0.05), # - the differences are significant compared with K562 cell line (p<0.05), $ - the differences are significant compared with Me45 cell line (p<0.05))
Поиск потенциальных генов-мишеней в исследуемых клеточных линиях осуществляли с помощью ДНК-микрочипа на основе ответа генов на воздействие ИИ. В клеточной линии К562 были отобраны гены, отвечающие ростом экспрессии в ответ на облучение, в линиях НСТ-116р (+/+), НСТ-116р (-/-) и Me45 -ее спадом. Уровень экспрессии генов измеряли с помощью матрицы HGU133А. В радио-резистентной клеточной линии выявлено 109 генов, уровень экспрессии которых неизменно увеличивался. В линиях опухолевых клеток HCT-116p53 (+/+) и HCT-116p53 (-/-) обнаружен 231 ген, а в Me45 - 63 гена, у которых в рамках эксперимента зафиксирован постоянный спад уровня экспрессии. В числе найденных отобраны четыре гена, которые являются общими для исследуемых клеточных линий: DAAM1 (Disheveled-associated activator of morphogenesis 1), IFNAR2 (Interferon Alpha And Beta Receptor Subunit 2), PALLD (Palladin, Cytoskeletal Associated Protein) и STK17A (Serine/threonine-protein kinase 17A) (рис. 2).
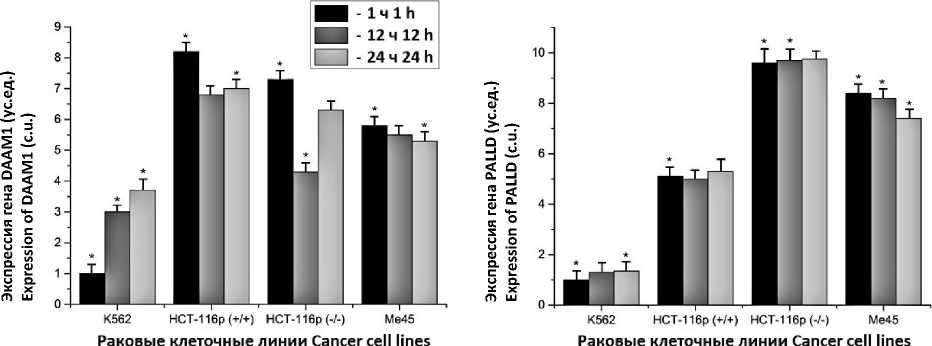
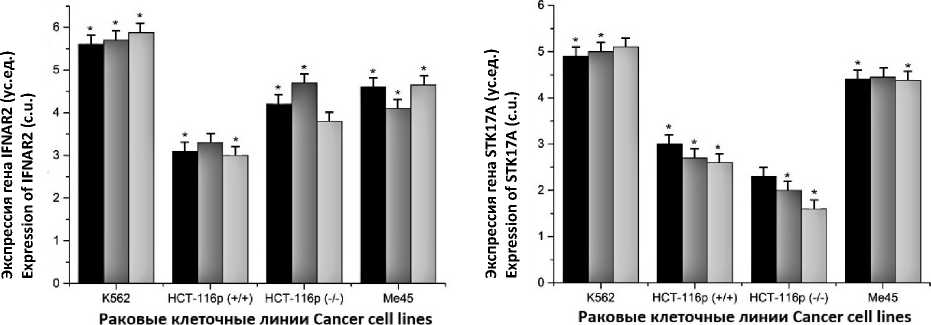
Рис. 2. Динамика экспрессии генов DAAM1 , PALLD , IFNAR2 и STK17A в опухолевых клеточных линиях K562, HCT-116р (+/+), HCT-116р (–/–) и Me45 в течение 1, 12 и 24 ч с момента облучения в дозе 4 Гр (* – достоверные различия (р≤0,05) с контрольной группой)
Fig 2. Dynamics of DAAM1 , PALLD , IFNAR2 , STK17A gene expression in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p (–/–) and Me45) during 1, 12 and 24 hours after irradiation at a dose of 4 Gy (* – the difference is significant in comparison with the control group (p≤0.05))
Высокий уровень экспрессии отмечен в клеточной линии К562 у генов IFNAR2 (5,88) и STK17A (5,07) через 24 ч после облучения. У генов DAAM1 и PALLD в К562 уровень экспрессии имеет относительно небольшие значения (рис. 2 а, б), однако, в отличие от уровня экспрессии данных генов в клетках линий HCT-116р (–/–), HCT-116р (+/+) и MЕ45, для него характерен постоянный рост. Из этого следует, что под воздействием ИИ увеличение уровня экспрессии генов DAAM1, IFNAR2, PALLD и STK17A в радиоустойчивой клеточной линии может быть связано с развитием радиорезистентности опухолевых клеток.
При изучении взаимодействий между белками отобранных генов было выявлено, что продукт гена DAAM1 напрямую взаимодействует с белками генов FNBP1 (Formin Binding Protein 1), TRIP10 (Thyroid Hormone Receptor Interactor 10), ARHGAP1 (Rho GTPase activating protein 1), DVL1 (Dishevelled Segment Polarity Protein 1), DVL2 (Dishevelled Segment Polarity Protein 2), DVL3 (Dishevelled Segment Polarity Protein 3), PTBP2 (Polypyrimidine Tract Binding Protein 2), RHOA (Ras Homolog Family Member A), SRRM4 (Serine/Arginine Repetitive Matrix 4), через которые оказывает влияние на деятельность белков генов ARHG-DIA (Rho GDP Dissociation Inhibitor Alpha), BAIAP2 (BAR/IMD Domain Containing Adaptor Protein 2), CDC42 (Cell Division Cycle 42), PAK1 (P21 (RAC1) Activated Kinase 1), PAK2
(P21 (RAC1) Activated Kinase 2), PARD6A (Par-6 Family Cell Polarity Regulator Alpha), PTBP2 (Polypyrimidine Tract Binding Protein 2), TNK2 (Tyrosine kinase non receptor 2), TRIP10 (Thyroid Hormone Receptor Interactor 10), WAS (WASP Actin Nucleation Promoting Factor),
WASL (WASP Like Actin Nucleation Promoting Factor). Непрерывно увеличивающаяся экспрессия гена DAAM1 могла повлиять на экспрессию генов TNK2 и DVL2 (табл. 1), которая постоянно увеличивалась во всех исследуемых клеточных линиях.
Таблица 1
Table 1
Уровень экспрессии генов, функционально связанных с геном DAAM1 , через 1, 12 и 24 ч с момента облучения в дозе 4 Гр в опухолевых клеточных линиях K562, HCT-116p (+/+), HCT-116p ( - / - ), Me45
The expression level of genes functionally related to the DAAM1 gene 1, 12 and 24 hours after irradiation at a dose of 4 Gy in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p ( - / - ) and Me45) *
|
Название гена Gene |
Радиорезистентная клеточная линия Radioresistant cell line |
Радиочувствительные клеточные линии Radiosensitive cell lines |
||||||||||
|
К562 |
HCT-116p (+/+) |
HCT-116p (-/-) |
Mе45 |
|||||||||
|
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
|
|
DVL2 |
-0,010 |
0,163 |
-0,048 |
-0,127 |
-0,043 |
0,058 |
0,002 |
0,016 |
0,154 |
-0,082 |
-0,075 |
-0,011 |
|
PTBP2 |
0,018 |
0,137 |
-0,044 |
0,131 |
0,059 |
0,008 |
0,451 |
0,271 |
0,240 |
0,044 |
0,015 |
-0,042 |
|
TNK2 |
-0,006 |
0,034 |
0,144 |
-0,217 |
-0,179 |
-0,068 |
-0,139 |
-0,103 |
-0,068 |
-0,070 |
-0,044 |
0,000 |
Примечание. Данные в таблице представлены как отношение уровня экспрессии гена к уровню экспрессии гена в контроле.
Note. The data are presented as the ratio of the gene expression level to the gene expression level in the control. Similar cell lines not exposed to IR were used as controls.
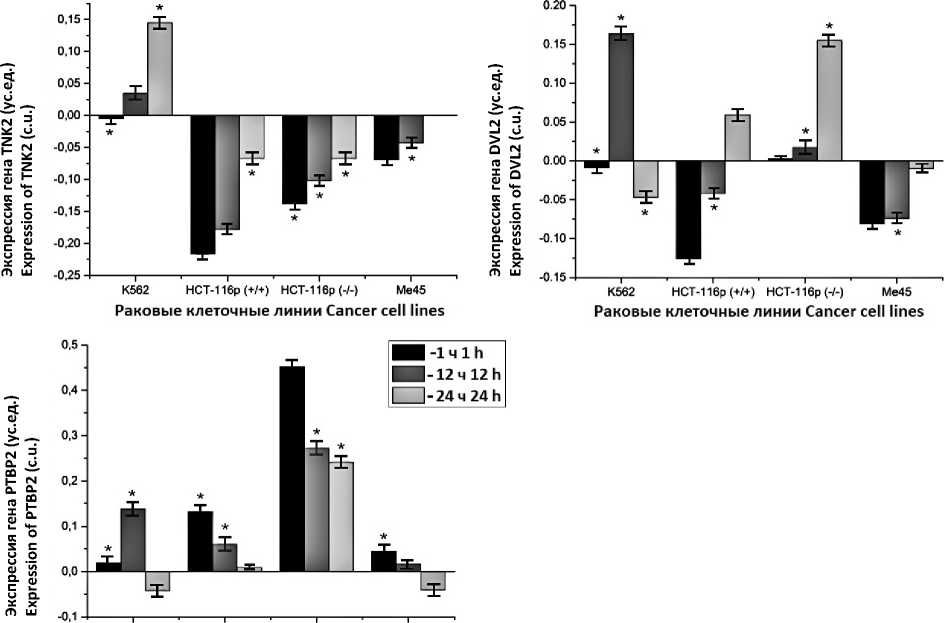
Основное различие заключается в том, что уровень экспрессии гена TNK2 в клеточной линии К562 намного выше, чем в HCT-116p ( - / - ), HCT-116p (+/+) и Me45. Экспрессия гена DVL2 в радиорезистентной клеточной линии через 12 ч после облучения резко снижается и имеет минимальное значение по отношению к значениям экспрессии в клеточных линиях HCT-116р (–/–), HCT-116р (+/+) и Mе45, в которых ее уровень продолжает увеличиваться (рис. 3).
Уровень экспрессии гена PTBP2 (Polypyrimidine Tract Binding Protein 2) во всех ис- следуемых клеточных линиях достигает своего минимального значения через 24 ч после облучения. Однако в радиорезистентной клеточной линии отмечается резкий рост показателя через 12 ч после облучения, что, возможно, обусловлено влиянием работы гена DAAM1.
Ген IFNAR2 непосредственно взаимодействует с генами TYK2 (Tyrosine Kinase 2), GNB2L1 (Receptor For Activated C Kinase 1), STAT1 (Signal Transducer And Activator Of Transcription 1), IFNA8 (Interferon Alpha 8), JAK1 (Janus Kinase 1), IFNW1 (interferon omega 1), STAT2 (Signal Transducer And Activator Of
Transcription 2), IFNAR1 (Interferon alpha and beta receptor subunit 1 (human)), JAK2 (Janus kinase 2), STAT3 (Signal Transducer And Activator Of Transcription 3) и IFNA5 (Interferon alpha 5), через которые оказывает влияние на гены IL2RB (Interleukin 2 receptor subunit beta), IRS1 (Insulin Receptor Substrate 1), EGFR (Epidermal Growth Factor Receptor), IFNGR1 (Interferon
Gamma Receptor 1), CREBBP (CREB Binding Protein), IRF1 (Interferon Regulatory Factor 1), EP300 (E1A Binding Protein P300) и IRF9 (Interferon Regulatory Factor 9). Значения уровня экспрессии генов в исследуемых клеточных линиях, на интенсивность которых оказала влияние работа гена IFNAR2 , представлены в табл. 2.
Раковые клеточные линии Cancer cell lines
Рис. 3. Динамика экспрессии генов TNK2 , DVL2 и PTBP2 в опухолевых клеточных линиях K562, HCT-116р (+/+), HCT-116р (–/–) и Me45 через 1, 12 и 24 ч после облучения в дозе 4 Гр
Fig. 3. Dynamics of TNK2 , DVL2 , PTBP2 gene expression in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p (–/–) and Me45) during 1, 12 and 24 hours after irradiation at a dose of 4 Gy
Таблица 2
Table 2
Уровень экспрессии генов, функционально связанных с геном IFNAR2 , через 1, 12 и 24 ч с момента облучения в дозе 4 Гр в опухолевых клеточных линиях K562, HCT-116p (+/+), HCT-116p ( - / - ) и Me45
The expression level of genes functionally related to the IFNAR2 gene 1, 12 and 24 hours after irradiation at a dose of 4 Gy in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p ( - / - ) and Me45)
|
Название гена Gene |
Радиорезистентная клеточная линия Radioresistant cell line |
Радиочувствительные клеточные линии Radiosensitive cell lines |
||||||||||
|
К562 |
HCT-116p (+/+) |
HCT-116p (-/-) |
Mе45 |
|||||||||
|
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
|
|
GNB2L1 |
-0,012 |
-0,014 |
-0,023 |
0,017 |
0,024 |
0,009 |
-0,006 |
0,001 |
-0,008 |
-0,013 |
0,008 |
0,019 |
|
IFNAR1 |
-0,216 |
-0,028 |
0,155 |
0,258 |
0,449 |
0,315 |
-0,026 |
0,195 |
0,078 |
-0,071 |
-0,063 |
-0,109 |
|
IRF9 |
0,025 |
-0,051 |
-0,125 |
-0,060 |
-0,242 |
-0,206 |
-0,031 |
-0,257 |
-0,161 |
-0,094 |
-0,030 |
-0,049 |
|
JAK1 |
-0,066 |
-0,012 |
0,008 |
0,007 |
-0,106 |
-0,069 |
-0,014 |
-0,095 |
-0,069 |
0,100 |
0,149 |
0,057 |
|
STAT2 |
-0,107 |
-0,101 |
0,071 |
-0,197 |
-0,234 |
-0,194 |
0,127 |
-0,030 |
-0,127 |
-0,144 |
-0,148 |
-0,078 |
Примечание. Данные в таблице представлены как отношение уровня экспрессии гена к уровню экспрессии гена в контроле.
Note. The data are presented as the ratio of the gene expression level to the gene expression level in the control. Similar cell lines not exposed to IR were used as controls.
Установлено, что уровень экспрессии генов STAT2 , GNB2L1 , IRF9 , IFNAR1 и JAK1 в клеточной линии К562 существенно отличается от аналогичных показателей в клеточных линиях HCT- 116р (-/-), HCT- 116р (+/+) и Mе45 (рис. 4). Гиперэкспрессия гена IFNAR2 провоцирует спад уровня экспрессии генов GNB2L1 и IRF9 в клеточной линии К562. В клеточных линиях HCT-116p (-/-), HCT-116p (+/+) и
Mе45 экспрессия генов GNB2L1 и IRF9 не обладает четкой динамикой развития. Вместе с тем непрерывный рост уровня экспрессии генов STAT2, Jaki и IFNAR1 отмечен в радиоре-зистентной клеточной линии. В радиочувствительных клеточных линиях HCT-116p (-/-), HCT-116p (+/+) и Mе45 динамика экспрессии данных генов не имеет четкой направленности.
Экспрессия гена Jak1 (ус.ед.) Экспрессия гена GNB2L1 (ус.ед.)
Expression of Jak1 (c.u.) Expression of GNB2L1 (c.u.)
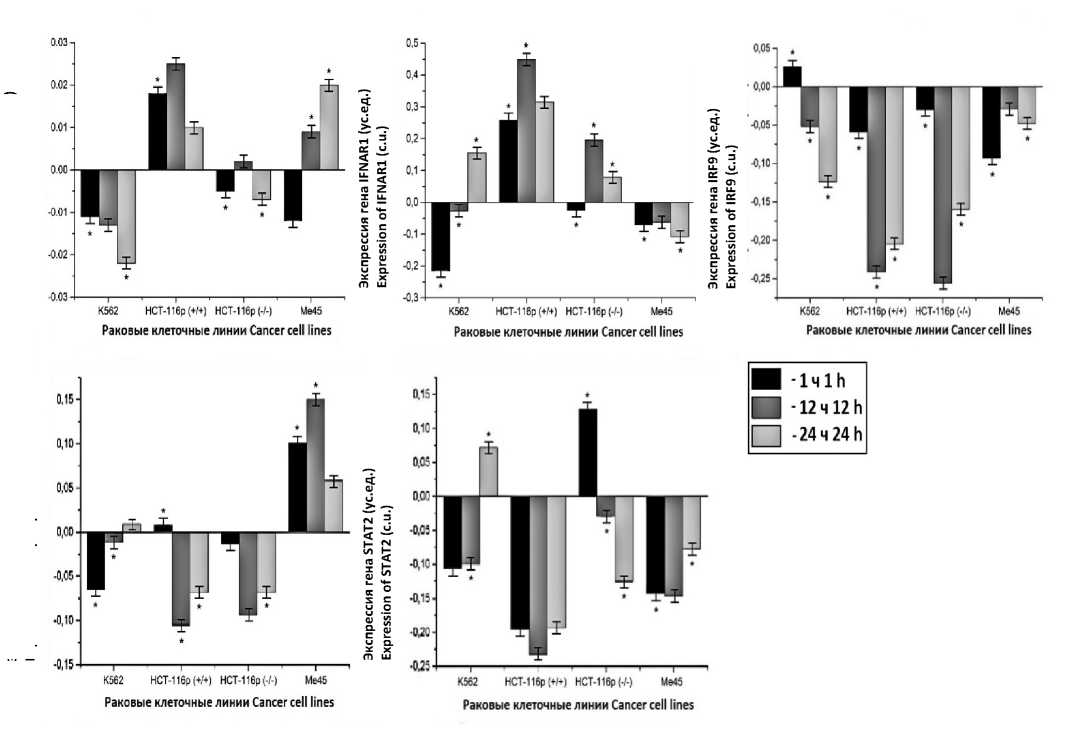
Рис. 4. Динамика экспрессии генов GNB2L1, IFNAR1, IRF9, Jak1 и STAT2 в опухолевых клеточных линиях K562, HCT-116р (+/+), HCT-116р (–/–) и Me45 в течение 1, 12 и 24 ч после облучения в дозе 4 Гр
Fig. 4. Dynamics of GNB2L1, IFNAR1, IRF9, Jak1 , STAT2 gene expression in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p (–/–) and Me45) during 1, 12 and 24 hours after irradiation at a dose of 4 Gy
Отмечено, что экспрессия генов STAT2, Jak1 и IFNAR1 в радиочувствительных клеточных линиях в рамках проведенного эксперимента была непостоянна. Такие колебания уровня экспрессии могут быть связаны с влиянием сверхэкспрессии гена IFNAR2 .
Продукт гена PALLD взаимодействует с белками генов TGFB1 (Transforming Growth Factor Beta 1), AKT1 (AKT Serine/Threonine Kinase 1), EPS8 (Epidermal Growth Factor Receptor Pathway Substrate 8), LPP (Lipoma-Preferred Partner), ACTN1 (Actinin alpha 1), ACTN2 (Ac- tinin alpha 2), EZR (Ezrin), SRC (SRC Proto-Oncogene, Non-Receptor Tyrosine Kinase). Данные о динамике уровня экспрессии генов, на который оказывает влияние ген PALLD, представлены в табл. 3.
Вероятно, влияние гена PALLD способствовало росту экспрессии генов LPP и ACTN2 (рис. 5) в радиорезистентной клеточной линии. Значения уровня экспрессии в клеточной линии К562 после окончания эксперимента были выше, чем в радиочувствительных клеточных линиях HCT-116р (–/–), HCT-116р (+/+) и Mе45.
Таблица 3
Table 3
Уровень экспрессии генов, функционально связанных с геном PALLD , через 1, 12 и 24 ч после облучения в дозе 4 Гр в опухолевых клеточных линиях
K562, HCT-116p (+/+), HCT-116p ( - / - ) и Me45
The expression level of genes functionally related to the PALLD gene 1, 12 and 24 hours after irradiation at a dose of 4 Gy in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p ( - / - ) and Me45)
|
Название гена Gene |
Радиорезистентная клеточная линия Radioresistant cell line |
Радиочувствительные клеточные линии Radiosensitive cell lines |
||||||||||
|
К562 |
HCT-116p (+/+) |
HCT-116p (-/-) |
Mе45 |
|||||||||
|
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
1 ч 1 hour |
12 ч 12 hours |
24 ч 24 hours |
|
|
ACTN2 |
-0,072 |
0,025 |
0,129 |
0,025 |
-0,132 |
-0,071 |
-0,065 |
-0,122 |
-0,082 |
-0,030 |
-0,003 |
-0,003 |
|
LPP |
-0,029 |
0,019 |
0,036 |
-0,041 |
0,011 |
-0,048 |
-0,123 |
-0,018 |
-0,062 |
-0,105 |
-0,061 |
-0,040 |
Примечание. Данные в таблице представлены как отношение уровня экспрессии гена к уровню экспрессии гена в контроле.
Note. The data are presented as the ratio of the gene expression level to the gene expression level in the control. Similar cell lines that exposed to IR were used as controls.
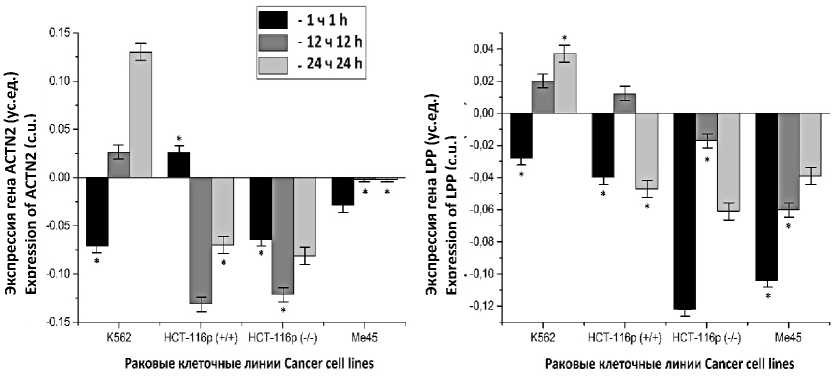
Рис. 5. Динамика экспрессии генов ACTN2 и LPP в опухолевых клеточных линиях K562, HCT-116p (+/+), HCT-116p (-/-) и Me45 в течение 1, 12 и 24 ч с момента облучения в дозе 4 Гр
Fig. 5. Dynamics of ACTN2 and LPP gene expression in the studied tumor cell lines (K562, HCT-116p (+/+), HCT-116p (-/-) and Me45) during 1, 12 and 24 hours after irradiation at a dose of 4 Gy
При анализе взаимодействия гена STK17A было установлено, что данный ген не оказывает прямого воздействия на другие гены. Из этого следует, что ген STK17A практически не изучен, поэтому база данных STRING не содержит информации о его функциональной взаимосвязи с другими генами.
Обсуждение. На основе полученных данных можно предположить, что гены IFNAR2, DAAM1, STK17A и PALLD способны оказывать влияние на интенсивность работы некоторых компонентов белковой сети. К примеру, на наш взгляд, интенсивность динамики экспрессии гена TNK2 (рис. 3) может быть результатом его взаимодействия с геном-мишенью DAAM1 . Показано, что функциональная активность гена TNK2 в клетках злокачественной опухоли формирует ее устойчивость к воздействию ИИ. Кроме того, данный ген принимает участие в регуляции гена ATM (Ataxia Telangiectasia Mutated) [9]. Его гиперэкспрессия играет основную роль в процессе становления радиорезистентности опухолевых клеток и осложняет процесс радиотерапии [10].
Также мы считаем, что рост уровня экспрессии гена IFNAR2, который был спровоцирован воздействием ИИ, является причиной гиперэкспрессии гена GNB2L1 (рис. 4) в радио-устойчивой клеточной линии К562. Доказано, что данный ген играет ключевую роль в адгезии и миграции клеток злокачественных опухолей [11]. Кроме того, ген GNB2L1 контролирует стабильность HIF-1 (Hypoxia-induciblefac-tor 1) [12]. Ошибка в данном процессе приводит к высокому уровню экспрессии HIF-1, что является следствием плохого ответа определенных злокачественных новообразований на радиационную терапию [13]. Показано, что если HIF-1 не активен в клетках опухоли, то их уровень радиорезистентности снижается [14–16]. Более того, в радиочувствительных клеточных линиях активность гена IFNAR2 не приводит к спаду экспрессии гена GNB2L1, в Ме45 она растет, а в HCT-116р (–/–) и HCT-116р (+/+) у нее отсутствует четкая динамика.
Заключение. Таким образом, отобранные гены-мишени и комплексы белков, кодируемых данными генами: DAAM1, TNK2, PTBP2 и DVL2 ; IFNAR2, STAT2, IRF9, JAK1, GNB2L1 и IFNAR1 ; PALLD, LPP и ACTN2 – можно использовать в роли потенциальных мишеней, модуляция которых позволит увеличить ответ клеток злокачественных новообразований на воздействие ионизирующего излучения.
Работа выполнена при поддержке Министерства образования и науки РФ в рамках государственного задания № 0830-2020-0008.
Список литературы Анализ влияния уровня экспрессии генов и сетей межмолекулярных взаимодействий на развитие радиорезистентности опухолевых клеток
- Stewart B. W., Bray F., Forman D. Cancer prevention as part of precision medicine: 'plenty to be done'. Carcinogenesis. 2016; 37 (1): 2-9.
- Srinivas U.S., Tan B.W.Q., Vellayappan B.A., Jeyasekharan A.D. ROS and the DNA damage response in cancer. Redox Biol. 2019; 25.
- Arnold C.R., Mangesius J., Skvortsova I.I., Ganswindt U. The Role of Cancer Stem Cells in Radiation Resistance. Front Oncol. 2020; 10: 164.
- Galeaz C., Totis C., Bisio A. Radiation Resistance: A Matter of Transcription Factors. Front Oncol. 2021; 11.
- Tang L., Wei F., Wu Y. Role of metabolism in cancer cell radioresistance and radiosensitization methods. J. Exp. Clin. Cancer Res. 2018; 37 (1): 87.
- Schwab M., Thunborg K., Azimzadeh O. Targeting Cancer Metabolism Breaks Radioresistance by Impairing the Stress Response. Cancers (Basel). 2021; 13 (15): 3762.
- ZhangM.X., Wang L., Zeng L., Tu Z. W. LCN2 Is a Potential Biomarker for Radioresistance and Recurrence in Nasopharyngeal Carcinoma. Front Oncol. 2021; 2: 10.
- Lewis J.E., Forshaw T.E., Boothman D.A., Furdui C.M., Kemp M.L. Personalized Genome-Scale Metabolic Models Identify Targets of Redox Metabolism in Radiation-Resistant Tumors. Cell Syst. 2021; 12 (1): 68-81.
- Liu X., Wang X., Li L., Han B. Research Progress of the Functional Role of ACK1 in Breast Cancer. Biomed Res Int. 2019; 1-6.
- Foy J.P., Bazire L., Ortiz-Cuaran S. A 13-gene expression-based radioresistance score highlights the heterogeneity in the response to radiation therapy across HPV-negative HNSCC molecular subtypes. BMC Med. 2017; 15 (1): 165.
- Zhou C., Chen T., Xie Z., Qin Y., Ou Y., Zhang J., Li S., Chen R., Zhong N. RACK1 forms a complex with FGFR1 and PKM2, and stimulates the growth and migration of squamous lung cancer cells. Mol Carcinog. 2017; 56 (11): 2391-2399.
- Wang J., Chen X., Hu H. PCAT-1 facilitates breast cancer progression via binding to RACK1 and enhancing oxygen-independent stability of HIF-1a. Mol. Ther Nucleic Acids. 2021; 24: 310-324.
- Byun J.Y., HuangK., Lee J.S., Huang W., Hu L. Targeting HIF-1a/NOTCH1 pathway eliminates CD44+ cancer stem-like cell phenotypes, malignancy, and resistance to therapy in head and neck squamous cell carcinoma. Oncogene. 2022; 41 (9): 1352-1363.
- Moreno R.E., GrootA.J., YarominaA. HIF-1a and HIF-2a Differently Regulate the Radiation Sensitivity of NSCLC Cells. Cells. 2019; 8 (1): 45.
- Wang G., Xiao L., Wang F., Yang J., Yang L., Zhao Y., Jin W. Hypoxia inducible factor-1a/B-cell lymphoma 2 signaling impacts radiosensitivity of H1299 non-small cell lung cancer cells in a normoxic environment. Radiat Environ Biophys. 2019; 58 (3): 439-448.
- Zhang J., Zhang Y., Mo F., Patel G., Butterworth K., Shao C., Prise K.M. The Roles of HIF-1a in Radiosensitivity and Radiation-Induced Bystander Effects Under Hypoxia. Frontiers in Cell and Developmental Biology. 2021; 9.


