Анализ внутрипопуляционного полиморфизма сортов моркови столовой по устойчивости к возбудителям микозных гнилей корнеплодов
Автор: Козарь Елена Георгиевна, Енгалычева Ирина Александровна, Ветрова Светлана Александровна, Мухина Ксения Сергеевна, Вюртц Татьяна Сергеевна, Степанов Виктор Алексеевич, Маркарова Анна Эдуардовна
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 3 (53), 2020 года.
Бесплатный доступ
Актуальность. Целью данного исследования являлось изучение изменчивости степени поражения перспективных сортопопуляций моркови столовой болезнями различной этиологии, определение уровня их полиморфизма по признаку устойчивости к различным видам возбудителей и результативности отбора на основе индивидуальной иммунологической оценки маточных корнеплодов. Материалы и методы. Экспериментальная часть работы выполнена в 2017-2020 годах в ФГБНУ «Федеральный научный центр овощеводства» на маточных корнеплодах сортопопуляций Маргоша и Минор. Идентификацию видового состава патогенов, степень поражения и уровень устойчивости сортообразцов проводили согласно соответствующим методикам и определителям. Для иммунологической оценки устойчивости сортопопуляций моркови in vitro использовали наиболее вирулентные изоляты разных видов грибов из коллекции лаборатории иммунитета и защиты растений ФНЦО. Результаты. Проведен анализ структуры патогенного комплекса кагатных гнилей моркови столовой в период хранения, представленный во все годы возбудителями белой, серой, черной, фузариозной и фомозной гнилей, а в отдельные - питиозной, полой пятнистостью и бактериальной мокрой гнилью. Установлено, что в сортопопуляциях Маргоша и Минор при естественных условиях хранения соотношение и степень распространения экономически значимых болезней существенно отличаются в разные годы. В условиях in vivo в сортопопуляции Маргоша отмечена более высокая вариабельность степени распространения болезней по повторностям. На основании иммунологической оценки in vitro выявлен высокий полиморфизм индивидуальной устойчивости генотипов в пределах обеих популяций к большинству микромицетов и выделены наиболее устойчивые формы к наиболее опасным видам патогенов. Иммунологический анализ полученного потомства подтвердил высокую эффективность группового отбора на основе комплексной оценки устойчивости индивидуальных маточных корнеплодов в условиях in vivo и in vitro. Ценные генотипы с высоким уровнем групповой устойчивости включены в селекционный процесс как исходный материал для создания новых линий и гибридов моркови столовой.
Морковь столовая, микозы, кагатные гнили, сортопопуляция, фитопатогены, полиморфизм
Короткий адрес: https://sciup.org/140250293
IDR: 140250293 | УДК: 635.132:632.488 | DOI: 10.18619/2072-9146-2020-3-81-87
Текст научной статьи Анализ внутрипопуляционного полиморфизма сортов моркови столовой по устойчивости к возбудителям микозных гнилей корнеплодов
УДК 635.132:632.488
М орковь столовая – одна из самых распространенных и стратегически важных овощных культур. Высокие питательные и целебные свойства этой культуры, в первую очередь, связаны с высоким содержанием провитамина А, аскорбиновой кислоты, а также кальция, железа, калия [1]. Одной из причин снижения эффективности производства моркови столовой являются потери товарной продукции в результате длительного хранения, которые через 3-6 месяцев могут достигать 25-60% и выше. В этой связи на первый план решения этой проблемы выходит устойчивость сортов, которые способны сохранять высокие товарные качества корнеплодов в течение всего периода хранения и обеспечить круглогодичное поступление на рынок свежей моркови [1, 2].
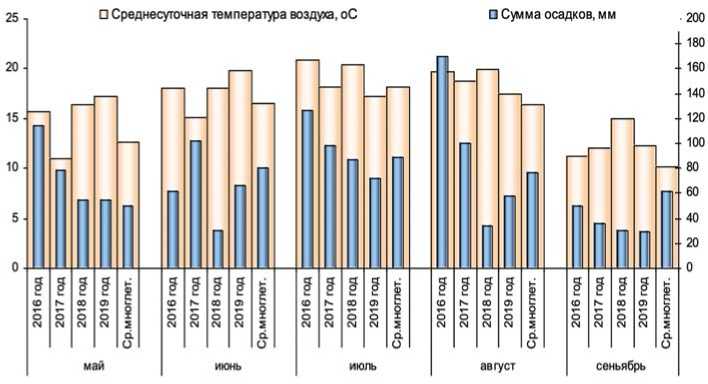
Рис. 1. Среднесуточная температура воздуха и суммарное количество осадков по месяцам в различные годы исследований (Московская область, 2016-2019 годы)
Fig. 1. The average daily air temperature and the total amount of precipitation by months in various years of research (Moscow region, 2016-2019)
Известно, что в структуре патокомплекса в период хранения на корнеплодах может присутствовать до 75% всех фитопатогенных видов микроорганизмов, поражающих культуру моркови столовой [10]. Состав и соотношение возбудителей меняется не только под влиянием сортового разнообразия, эколого-географических факторов, погодных условий в зоне возделывания, но и в результате появления новых видов и рас возбудителей, источником которых являются импортируемый в страну товарный и семенной материал. Недостаточная изученность видового состава, уровня вирулентности различных патогенов в отношении конкретных сортов и гибридов моркови часто является одной из причин неблагополучной фитопатологической обстановки в период хранения [5, 12].
Изменение генетического разнообразия популяций патогенов, в том числе и микромицетов, оказывает существенное влияние на устойчивость или восприимчивость существующих сортов. Поэтому скрининг генофонда созданных сортов и гибридов на устойчивость к различным видам возбудителей для каждого селекционно-семеноводческого центра-оригина-тора остается постоянно актуальным как с точки зрения ведения сортоподдерживающей селекции, так и поиска новых источников устойчивости для селекции на иммунитет [8].
Цель работы – изучить изменчивость проявления признака устойчивости сортопопуляций моркови столовой Минор и Маргоша селекции ФГБНУ ФНЦО к болезням различной этиологии в период хранения, определить уровень их полиморфизма и результативность отбора на групповую устойчивость к различным видам возбудителей на основе индивидуальной иммунологической оценки маточных корнеплодов.
Материал и методика исследований
Материалом исследований являлись маточные корнеплоды элиты и суперэлиты сортопопуляций Маргоша, Минор и стандарта устойчивости к микозным гнилям – гибрида Надежда F1, выращенные на полях опытно-производственной базы ФГБНУ ФНЦО (Одинцовский район, Московская область) в 2017-2020 годах. Хранение корнеплодов осуществляли в овощехранилище при температуре 1…2 ° С и влажности 90-92% в течение шести месяцев (с III декады сентября по I декаду апреля).
Во все годы исследований было отмечено превышение среднемноголетних значений температуры воздуха (рис.1).
Исключение составила первая половины вегетации 2017 года, когда на фоне понижения температуры с мая по июль отмечались обильные осадки в течение всей вегетации. Климатические условия 2018-2019 годов характеризовались повышенной среднесуточной температурой в течение вегетации и дефицитом осадков.
Фитосанитарное обследование в период хранения in vivo, отбор пораженных корнеплодов при весеннем анализе, идентификацию видового состава патогенов, степень поражения и уровень устойчивости сортообразцов проводили, используя соответствующие методики и определители [3-7, 9, 13-18].
Иммунологическую оценку устойчивости сортопопуляций моркови столовой in vitro проводили путем искусственного заражения высеченных из корнеплодов дисков в условиях влажной камеры, на которые наносили агаровые блоки десятисуточной культуры возбудителей на среде Чапека, в контроле – стерильный агаровый блок. При популяционной оценке анализировали не менее десяти корнеплодов в каждом образце. Для изучения полиморфизма сортопопуляций по устойчивости индивидуальных генотипов в каждой из них отбирали и нумеровали по 50 наиболее типичных маточных корнеплодов без внешних признаков поражения, у которых отрезали 1/3 нижней части, делили на диски и проводили инфицирование аналогичным способом.
Для заражения использовали наиболее вирулентные изо-ляты видов грибов: Alternaria radicina, Stemphylium sp., Fusarium oxysporum var. oxysporum, F. oxysporum var. ortho-ceras, F. chlamydosporum, F. avenaceum, Botrytis cinerea и Sclerotinia slerotiorum, из коллекции лаборатории иммунитета и защиты растений ФГБНУ ФНЦО. Учет степени поражения проводили на седьмые сутки после заражения, измеряя диаметр (d) и глубину зоны (h) поражения, и рассчитывали объем зоны поражения (Vзп=3.14*(d/2)2*h, см3), который является наиболее информативным критерием оценки уровня устойчивости как сортопопуляции в целом, так и внутри-популяционного полиморфизма (Сv>60%). Ранжирование образцов и индивидуальных генотипов по устойчивости к возбудителям проводили отдельно в пределах каждого варианта опыта, выделяя группы: относительно устойчивые (I), среднеустойчивые (II), средневосприимчивые (III) и восприимчивые (IV). Итоговую оценку сортопопуляций и отбор генотипов на групповую устойчивость к возбудителям микозных гнилей корнеплодов проводили на основе анализа всей совокупности данных, полученных в нескольких сериях независимых лабораторных опытов. Обработку данных проводили по соответствующим методам статистического анализа (Доспехов, 1975) с использованием программ LightCycler® 480 SW 1.5.1 и MS EXEL 2010.
Результаты
Фитосанитарный анализ состояния корнеплодов моркови после хранения за годы исследований выявил существенные отличия по общей напряженности естественного инфекционного фона, сложившегося в период хранения (рис. 2А). Наиболее высокие показатели развития болезней хранения были отмечены в 2018 году, наименьшие – в 2017 году. В 2019 и 2020 годах при сравнимых значениях распространенности, интенсивность поражения корнеплодов болезнями в 2019 году была существенно выше. Отмеченные различия в характере проявления болезней хранения в первую очередь связаны с погодными условиями года и неравнозначной
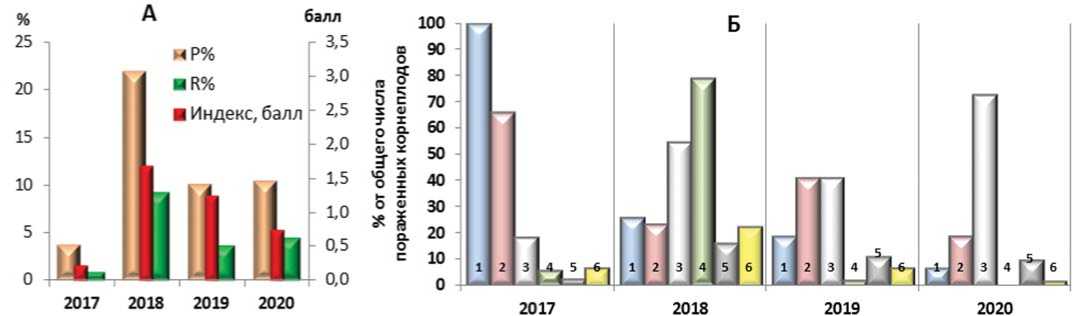
Рис.2. Характеристика развития кагатной гнили при хранении корнеплодов моркови столовой в разные годы (А) и доля корнеплодов с симптомами поражения болезнями разной этиологии от общего числа больных (Б). Обозначения: Р% - распространенность, R% - степень развития. Индекс – средний балл поражения; 1 – черная гниль, 2 – фузариозная гниль, 3 – белая гниль, 4 – серая гниль, 5 – фомоз, 6 – сумма малораспространенных и редко встречаемых болезней хранения
Fig.2. Characterization of the development of rot during storage of root crops of carrots in the dining room in different years (A) and the proportion of root crops with symptoms of diseases of different etiologies from the total number of patients (B). Designations: P% – prevalence, R% – degree of development, Index - average lesion score; 1 – black rot, 2 – fusarium rot, 3 – white rot, 4 – gray rot, 5 – phomosis, 6 – the sum of rare and rarely encountered storage diseases
Таблица 1.Характеристика образцов моркови столовой по степени поражения корнеплодов болезнями в период хранения Table 1.The characteristics of the samples of table carrots according to the degree of defeat of root crops by diseases during storage
|
год |
Образец |
Пораженность корнеплодов кагатными гнилями |
||||||||
|
общая |
сухие |
смешанные |
||||||||
|
Р% |
I, балл |
R% |
I, балл |
R% |
I, балл |
R% |
I, балл |
R% |
||
|
2017 |
Надежда F1-st. |
1,5 |
0,3 |
0,13 |
0,5 |
0,06 |
0,1 |
0,11 |
0,2 |
0,13 |
|
Маргоша |
2,9 |
0,2 |
0,18 |
0,2 |
0,01 |
0,6 |
0,18 |
0,3 |
0,16 |
|
|
Минор |
5,4 |
0,5 |
0,69 |
0,6 |
0,09 0,1 0,14 |
0,9 |
0,85 |
|||
|
НСР05 |
1,5 |
0,41 |
0,05 |
0,04 |
0,06 |
|||||
|
2018 |
Надежда F1-st. |
17,1 |
1,8 |
7,70 |
1,9 |
1,59 |
1,7 |
3,28 |
1,6 |
3,90 |
|
Маргоша |
10,3 |
1,9 |
4,89 |
1,0 |
1,20 |
1,5 |
4,12 |
3,2 |
4,89 |
|
|
Минор |
18,5 |
2,1 |
9,70 |
3,4 |
4,47 |
1,8 |
7,20 |
2,6 |
8,16 |
|
|
НСР05 |
5,7 |
3,38 |
2,32 |
2,96 |
2,22 |
|||||
|
2019 |
Надежда F1-st. |
2,6 |
0,4 |
0,58 |
0,0 |
0,00 |
2,0 |
0,29 |
0,0 |
0,00 |
|
Маргоша |
5,9 |
1,4 |
1,16 |
2,0 |
2,76 |
1,5 |
0,15 |
1,0 |
1,38 |
|
|
Минор |
27,1 |
2,2 |
3,39 |
2,8 |
7,00 |
1,8 |
1,20 |
2,3 |
3,77 |
|
|
НСР05 |
8,6 |
1,90 |
3,01 |
0,97 |
1,40 |
|||||
|
2020 |
Надежда F1-st. |
7,4 |
2,2 |
6,70 |
2,7 |
6,44 |
2,0 |
0,25 |
0,0 |
0,00 |
|
Маргоша |
6,6 |
1,1 |
5,70 |
2,4 |
5,70 |
0,0 |
0,00 |
0,0 |
0,0 |
|
|
Минор |
12,5 |
2,8 |
8,92 |
3,0 |
8,50 |
3,0 |
0,21 |
3,0 |
0,21 |
|
|
НСР05 |
6,1 |
3,62 |
3,25 |
0,15 |
0,20 |
|||||
инфекционной нагрузкой агрофона на полях в период выращивания и в период хранения. На основе проявления внешних симптомов и фитопатологической экспертизы корнеплодов моркови столовой с различным типом поражения проведен анализ структуры патогенного комплекса, который в основном был представлен смешанными группами разных патогенов, вызывающих гнили разной этиологии (рис.2Б).
Среди возбудителей сухих гнилей наиболее распространены были возбудители черной гнили (альтернариоидные гифомицеты Alternariaradicina и Stemphilium spp.) и фомоза ( Phoma spp.). Существенно реже встречались грибы из родов Pythium spp. (питиозная гниль), Cylindrocarpon spp. (полая пятнистость 'Cavity Spot'), Verticillium spp. (вертициллез), Aspergillus spp. и Penicillium spp. (плесени хранения). Фузариозная гниль корнеплодов в зависимости от вида возбудителя, их комбинации, интенсивности и локализации поражения могла проявляться в виде сухой или мокрой гнилей. Среди комплекса грибов этого рода Fusarium в последние годы наиболее часто выделялись виды F. oxysporum, F. sporotrichiella, F. solani и F. avenaceum, реже виды F. culmo-rum, F. semitectum, F. gibbosum, F. sambucinum . В составе мокрых гнилей преобладали возбудители из рода Sclerotinia ( S. sclerotiorum, S. nivale ) и Botrytis cinerea , вызывающих белую и серую гнили, значительно реже встречался Gliocladium roseum , вызывающий глиокладиумную гниль. В отдельные годы отмечали значительное поражение корнеплодов бактериальной мокрой гнилью, вызываемой Pectobacterium carotovora.
То есть, как видно на рисунке 2Б, основу патогенного комплекса в условиях Московской области составляют возбудители белой, серой, черной, фузариозной и фомозной гнилей, которые ежегодно встречались на корнеплодах моркови столовой в период хранения. Однако степень их распространения, как состав и соотношение других сопутствующих видов возбудителей, в разные годы существенно отличается. Так, в 2017 году преобладали возбудители фузариозной и черной гнили, симптомы которых были отмечены на 66-100% корнеплодах от общего числа пораженных (по всей совокупности образцов). В 2018 году наиболее широко были распространены белая и серая гнили (54-79% от числа пораженных), в 2019 году – белая и фузариозная гнили (более 40%). В 2020 году доминировала белая гниль, возбудителями которой было поражено более 70% всех больных корнеплодов. В группе сопутствующих болезней следует отметить значительную распространённость симптомов поражения корнеплодов в 2017 году – Cylindrocarpon spp. (4%), в 2018 году – Pythium spp. (21%) и в 2019 году – Pectobacterium carotovora (до 13% от общего числа пораженных).
В большинстве случаев перечисленные возбудители одновременно присутствовали на пораженных корнеплодах, поэтому сравнительную оценку отдельных сортопопуляций проводили по частоте встречаемости характерных симптомов и среднему индексу поражения основными типам гнилей: сухие, смешанные (с доминированием грибов рода Fusarium или B. cinerea) и мокрые (с доминированием грибов рода Sclerotinia). В результате было установлено, что анализируемые сортопо-пуляции Маргоша и Минор, значимо различаются по устойчивости корнеплодов, как в целом, так и по отдельным группам болезней (табл. 1). При этом у Маргоша отмечен более высокий коэффициент варьирования степени распространения болезней по повторностям (Cv>70%); тогда как у сорта Минор процент пораженных корнеплодов в среднем был выше, но по отдельным повторностям в разные годы был сопоставим (Cv <25%).
В среднем устойчивость сортопопуляции Маргоша была на уровне стандарта и общий процент пораженных корнеплодов в зависимости от года составил 2,9-10,3%, тогда как у гибрида Надежда F 1 этот диапазон изменчивости был шире – от 1,5% до 17,1%. Степень развития мокрых, сухих и смешанных гнилей на корнеплодах Маргоша во все годы была на уровне стандарта. Пораженность корнеплодов сортопопу-ляции Минор варьировала от 5,4 до 27,1%, и при поражении смешанными гнилями во все годы была достоверно выше на 0,21-4,26%, чем у стандарта устойчивости. Достоверное же превышение относительно стандарта сухими гнилями отмечено в 2018 году на 3,92%, мокрыми – в 2018 и 2019 годах на 2,88 и 7%, соответственно. Наибольшим распространением в патогенезе мокрой гнили во все годы исследований выделялись грибы рода Sclerotinia . Средний индекс поражения белой гнилью сортопопуляции Минор в среднем за четыре года составил 2,4 бала, Маргоша – 1,4 балла, стандарта – 1,3 балла.
Индекс поражения корнеплодов смешанными гнилями у Маргоша существенно превысил стандарт (в два раза) только на фоне высокого распространения серой гнили в период хранения (2018 год), тогда как у Минор во все годы он был выше. В среднем за годы исследований индекс поражения гнилями смешанной этиологии у гибрида Надежда F 1 составил 0,4 балла, сортопопуляции Маргоша – 1,1 балла, Минор – 2,2 балла, а сухими гнилями – 1,4; 0,9 и 1,7, соответственно. При этом отмечено, что степень развития сухих гнилей на корнеплодах Минор в большей степени зависела от распространения возбудителей черной гнили (2019-2020 годы), Маргоша – возбудителей фузариоза (2020 год), тогда как у гибрида Надежда F 1 – возбудителей фомоза (2018-2020 годы).
Информация о степени поражения образцов разными группами патогенов при хранении является основой селек-
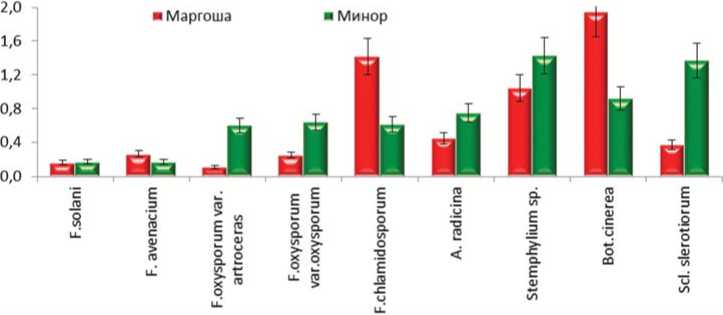
Рис.3. Степень поражения (Vзп, см3) корнеплодов сортопопуляций Маргоша и Минор разными видами возбудителей при иммунологической оценке in vitro (среднее трех независимых опытов, 2017-2019 годы)
Fig. 3. The degree of damage (Vzp, cm3) of root crops with Margosha / Minor by different types of pathogens during in vitro immunological evaluation (average of three independent experiments, 2017-2019)
ции на групповую устойчивость. Но наиболее значимым является иммунологический анализ устойчивости корнеплодов к определенными видам возбудителей, что позволяет более объективно определить направление и оценить возможности отбора при работе с каждым образцом.
Иммунологическую оценку in vitro проводили путем искусственного заражения дисков корнеплодов агаровыми блоками с чистой культурой наиболее распространенных видов фитопатогенных грибов из родов Alternaria, Stemphilium, Fusarium, Botrytis и Sclerotinia , которые проявили различную степень агрессивности в отношении изучаемых сортопопуляций. Наиболее высокой агрессивностью обладали возбудители белой и серой гнилей, среди возбудителей черной гнили выделяется Stemphylium sp., среди возбудителей фузариозной гнили – F. chlamydosporum (рис. 3).
На основании анализа результатов трех независимых серий опытов выявлены значительные различия по степени поражения корнеплодов этими патогенами в пределах каждой сортопопуляции. Корнеплоды Маргоша в целом более устойчивы к видам F. oxysporum var. oxysporum, F. oxyspo-rum var. orthoceras, A. radicina, Stemphylium sp. и S. sclerotiorum , тогда как Минор – к B. cinerea . К видам F. solani и F. avenaceum оба сорта оказались наименее восприимчивы, хотя последний из них поражал корнеплоды сортопопу-ляции Маргоша в большей степени (рис. 3).
Полученные в результате оценки результаты распределения по степени поражения корнеплодов, показали наличие широкого диапазона варьирования индивидуальной устойчивости генотипов в обеих сортопопуляциях – от относительно устойчивых до сильновосприимчивых в отношении практически всех видов патогенов (табл. 2). Соотношение групп корнеплодов с разным уровнем устойчивости характеризует резистентность всей сортопопуляции к конкретному виду фитопатогена, которая определяется уровнем устойчивости доминирующих групп генотипов в популяции. Как видно из таблицы 2, у Маргоша более половины проанали- зированных корнеплодов проявили высокую устойчивость S. sсlerotiorum (I группа), тогда как в отношении B. cinerea большая часть (75%) оказалась восприимчива. У Минор генотипы по группам устойчивости к данным возбудителям распределились более равномерно. Тем не менее, более высокая резистентность сорта Минор к возбудителю серой гнили объясняется присутствием в популяции высокого процента генотипов I-II групп устойчивости.
Относительно высокая устойчивость сортопопуляции Маргоша к возбудителям черной гнили – альтернариоидным гифомицетам, в первую очередь, связана с отсутствием в популяции высоко восприимчивых генотипов, доля которых у Минор в среднем составила 18-45%. Различия по устойчивости сортопопуляций к F. chlamydosporum связаны с преобладанием в сортопопуляции Маргоша восприимчивых генотипов (34%), а у Минор – относительно устойчивых (48%). В отношении грибов F. oxysporum и F. avenaceum в структуре обеих сортопопуляций отмечается высокая доля восприимчивых корнеплодов (табл. 2).
Выявленный высокий полиморфизм индивидуальной устойчивости генотипов в пределах обеих популяций свидетельствует о возможности ведения внутрипопуляционного отбора наиболее устойчивых форм в рамках сортоулучшающей селекции. При этом ранжирование корнеплодов по группам устойчивости к каждому виду возбудителя позволяет также выделить наиболее ценные генотипы, проявляющие более высокую групповую резистентность к большинству патогенов из I-II групп устойчивости. Доля таких генотипов от общего числа проанализированных корнеплодов составила около 5% в сортопопуляции Маргоша и 7% – Минор. Наиболее восприимчивые к большинству патогенов генотипы, доля которых соответственно составила 32% и 34%, рекомендуется выбраковывать при сортоподдерживающей селекции.
Результативность группового отбора на устойчивость. На основе анализа полученных данных, в сортопопуляции
Таблица 2.Структура сортопопуляций моркови столовой Маргоша и Минор по группам устойчивости корнеплодов к основным возбудителям болезней хранения (%)
Table 2.Structure of variety populations of carrots Margosha and Minor by resistance groups of root crops to the main pathogens of storage diseases (%)
|
X н о а X т >х о га с с 1— |
га .с га |
1 Е |
£ га га |
I 8 |
! Е „го |
га .с 0 со |
Е ф <л |
|||||||
|
га о о. га Z |
о. о X Z |
га а о о. га Z |
о. о X Z |
га а о о. га Z |
о. о X Z |
га а о о. га Z |
о. о Z X Z |
га а о о. га Z |
о. о Z X Z |
га а о о. га Z |
о. о Z X Z |
га а о о. га Z |
о. о Z X Z |
|
|
I |
5 |
5 |
14 |
5 |
28 |
36 |
36 |
24 |
12 |
48 |
7 |
33 |
51 |
18 |
|
II |
50 |
48 |
50 |
23 |
23 |
50 |
22 |
43 |
10 |
20 |
7 |
33 |
29 |
38 |
|
III |
45 |
30 |
36 |
28 |
30 |
10 |
34 |
8 |
44 |
23 |
11 |
13 |
8 |
28 |
|
IV |
0 |
18 |
0 |
45 |
19 |
5 |
8 |
25 |
34 |
10 |
75 |
23 |
12 |
18 |
Маргоша в 2018 году была отобрана группа маточных корнеплодов с наилучшим сочетанием уровня устойчивости к комплексу патогенов, которые были высажены на отдельном изоучастке и получен семенной материал от свободного переопыления выбранных генотипов. Выращенные из полученных семян корнеплоды были заложены на хранение и весной проведен полный анализ устойчивости потомств отобранной группы и группы маточных корнеплодов исходной сортопопуляции in vivo и in vitro .
Сохранность корнеплодов на естественном инфекционном фоне у обеих анализируемых групп была на одном уровне и составила 85-94%, в зависимости от повторности. На всех пораженных корнеплодах в 2020 году были отмечены признаки поражения мокрой гнилью, в патогенезе которой преобладали грибы рода Sclerotinia . Однако по результатам иммунологической оценки устойчивость и структура популяций анализируемых групп к разным видам фитопатогенов существенно отличалась, о чем свидетельствуют полученные распределения по интенсивности поражения дисков (рис. 4).
В потомстве отбора практически отсутствуют высоковосприимчивые генотипы ко всем возбудителям, и четко виден сдвиг основного пика кривых распределения в сторону устойчивых генотипов к видам B. cinerea, A. radicina и Stemphylium sp. В отношении грибов S. sclerotiorum и F. chlamydosporum отмечено существенное сужение диапазона варьирования признака относительно исходной сортопопу-ляции, в то время как кривые распределения по устойчивости генотипов к менее агрессивному виду F. avenaceum в обоих группах практически совпали.
То есть, даже однократный отбор на основе результатов комплексной оценки устойчивости индивидуальных маточных корнеплодов in vivo и in vitro оказался весьма результативным. В потомстве отбора были выделены уникальные генотипы с сочетанием более высоких уровней устойчивости к разным фитопатогенам, по сравнению с лучшими геноти- пами исходной сортопопуляции. В том числе, они проявили относительную резистентность и в отношении нового высоко агрессивного изолята Fusarium sp., который был выделен в этом году с больных корнеплодов иностранного образца из коллекционного питомника. Данные генотипы представляют особый интерес не только как источники устойчивости в сортоулучшающей селекции, но как ценный исходный материал для селекции на гетерозис при создании новых фертильных линий-опылителей путем проведения инбридинга.
Заключение
Сорта моркови столовой по ряду признаков представляют собой достаточно гетерогенную популяцию, в которой в различных соотношениях могут присутствовать биотипы с разным уровнем проявления того или иного признака. Фитопатологичекий мониторинг развития болезней в период хранения in vivо не всегда позволяет дать объективную оценку устойчивости различных образцов моркови столовой ввиду высокой изменчивости напряженности естественного инфекционного фона и структуры патогенного комплекса возбудителей в разные годы исследований. Особенно затруднен сравнительный анализ в годы с высокой сохранностью корнеплодов, когда распространенность даже наиболее опасных групп патогенов не превышает 12%. Поэтому более информативным является иммунологический анализ in vitro, выявляющий степень полиморфизма каждой популяции по устойчивости к отдельным видам возбудителей.
В изученных сортопопуляциях Минор и Маргоша отмечена значительная индивидуальная вариабельность по признаку устойчивости к большинству наиболее распространенных микромицетов – от высоковосприимчивых до устойчивых генотипов, соотношение которых отвечает за уровень устойчивости популяции в целом и определяет выбор стратегии дальнейшей работы в рамках сортоулучшающей селекции на иммунитет. Так, в сортопопуляции Минор прио-
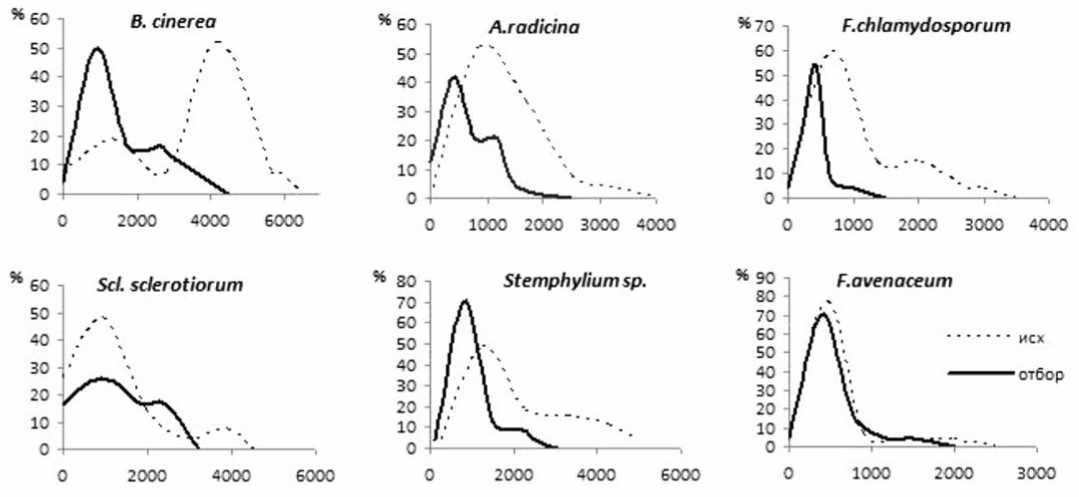
Рис.4. Кривые распределения генотипов по интенсивности поражения дисков маточных корнеплодов разными видами фитопатогенных грибов in vitro в исходной сортопопуляции Маргоша (исх) и полученном потомстве от группового отбора (отбор) относительно устойчивых генотипов (2020 год). По оси абсцисс – объем зоны поражения диска (V мм3); по оси ординат – доля генотипов с определенным уровнем устойчивости, в % от общего числа корнеплодов в группе
Fig. 4. Curves of the distribution of genotypes by the intensity of damage to discs of uterine root by different types of phytopatho-genic fungi in vitro in the initial Margosha (Ref) and the offspring obtained from group selection (selection) of relatively stable genotypes (2020). On the abscissa axis is the volume of the lesion area of the disk (V mm3); along the ordinate axis – the proportion of genotypes with a certain level of resistance, in % of the total number of root crops in the group
ритетным является отбор на устойчивость к возбудителям черной и белой гнилей, а Маргоша – к фузариозной и серой гнилям. Тем не менее, несмотря на существенные различия в характере распределения генотипов по группам устойчивости, в каждой сортопопуляции был выделен определенный процент генотипов, обладающих относительной устойчивостью к нескольким видам возбудителей. Иммунологический анализ полученного потомства подтвер- дил высокую эффективность целенаправленного отбора на основе комплексной оценки устойчивости индивидуальных маточных корнеплодов в условиях in vivoи in vitro. В результате из сортопопуляции Маргоша были выделены ценные генотипы с высоким уровнем групповой устойчивости, которые в настоящее время включены в селекционный процесс как исходный материал для создания новых линий и гибридов моркови столовой.
Об авторах:
Еlena G. Kozar – Cand. Sci. (Agriculture), l eading researcher head of the laboratory of immunity and plant protection,
Irina A. Engalycheva – Cand. Sci. (Agriculture), head of the laboratory of immunity and plant protection, х
Svetlana A. Vetrova – Cand. Sci. (Agriculture), senior researcher of the laboratory of breeding and seed production of table root crops,
Kseniya S. Muhina – senior researcher of the laboratory of breeding and seed production of table root crops,
Tatiana S. Vjurtts – Cand. Sci. (Agriculture), researcher of laboratory of reproductive biotechnology in crop breeding, Viktor A. Stepanov – Cand. Sci. (Agriculture), leading researcher of the laboratory of breeding and seed production of table root crops,
Anna E. Markarova – Junior Researcher of Immunity and Plant Protection Laboratory,
Список литературы Анализ внутрипопуляционного полиморфизма сортов моркови столовой по устойчивости к возбудителям микозных гнилей корнеплодов
- Борисов В.А., Романова А.В., Янченко Е.В., Масловский С.А., Андрианов С.А., Янченко А.В., Гренадеров Н.В., Скрипник А.В. Технология хранения и сроки реализации столовых корнеплодов. Москва, 2010.
- Борисов В.А., Романова А.В., Янченко Е.В. Сохраняемость и сроки проявления болезней моркови столовой отечественной и зарубежной селекции. Хранение и переработка сельхозсырья. 2012;(11):44-46.
- Ганнибал Ф.Б., Орина А.С., Левитин М.М. Альтернариозы сельскохозяйственных культур на территории России. Защита и карантин растений. 2010;(5):30-32.
- Левитин М.М. Современные видовые названия фитопатогенных грибов. Защита и карантин растений. 2018;(8):8-11.
- Левитин М.М., Новожилов К.В., Афанасенко О.С., Михайлова Л.А., Мироненко Н.В., Гагкаева Т.Ю., Ганнибал Ф.Б. Миграции фитопатогенных грибов и ареалы популяций. Микология сегодня. Москва, 2011: 261-274.
- Левкина Л.М. Род Alternaria nees - новое в систематике и номенклатуре грибов. Москва, национальная академия микологии. 2013: 276-303
- Орина А.С., Ганнибал Ф.Б., Левитин М.М. Видовое разнообразие, биологические особенности и география грибов рода Alternaria, ассоциированных с растениями семейства Solanaceae. Микология и фитопатология. 2010;44(2):150-159.
- Пивоваров В.Ф., Пышная О.Н., Шмыкова Н.А., Гуркина Л.К. Создание исходного материала овощных культур: идеи Н. И. Вавилова и современные технологии. Сельскохозяйственная биология. 2012;(5):39-47.
- Пидополичко Н.М. Грибы-паразиты культурных растений. Киев: Наукова думка, 1977; Т.1-3.
- Соколова Л.М., Масловский С.А., Панова М.Б., Замятина М.Е., Карпова Н.А. Устойчивость сортообразцов моркови к болезням при хранении в зависимости от инфекционного фона и послеуборочного фитосанитарного состояния растений Аграрный научный журнал. 2019;(1):26-31.
- Степанов В.А., Федорова М.И., Ветрова С.А., Заячковский В.А., Заячковская Т.В., Вюртц Т.С. Новый сортимент для селекции овощных корнеплодов и технологии его поддержания. Овощи России. 2018;(2):28-31.
- DOI: 10.18619/2072-9146-2018-2-28-31
- Тимина Л.Т., Енгалычева И.А. Комплекс патогенов на овощных культурах в условиях центрального региона РФ. Овощи России. 2015;(3-4):123-129.
- DOI: 10.18619/2072-9146-2015-3-4-123-129
- Шипилова Н.П., Иващенко В.Г. Систематика и диагностика грибов рода fusarium на зерновых культурах. Санкт-Петербург, 2008.
- Gannibal Ph.B., Levitin M.M. A. manual. Monitoring of alternarioses of crops and identification of fungi of the genus Alternaria. St.-Petersburg: VIZR, 2011: 70.
- Johnson D.A., Simmons, E.G., Miller, J.S. & Stewart, E.L. Taxonomy and pathology of Macrospora/Nimbya on some North American bulrushes (Scirpus spp.). Mycotaxon. 2002;(84):413-428.
- Nelson P.E., Tousson T.A., Marasas W.F. Fusarium spesies: an Illustrated Manuall for Identification. Pennsylvania State University press, University Park and bndon. 1983: 193.
- Simmons E.G. Alternaria themes and variations. Species on Solanaceae. Mycotaxon, 2000;(75):1-115.
- Simmons E.G. Alternaria: an identification manual. CBS Biodiversity Series 6. 2007: 775.


