Анализ возможности репродукции тканей зуба in vitro с последующей реплантацией in vivo
Автор: Литвинов С.Д., Рахимов Р.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Физиология
Статья в выпуске: 6 (48), 2020 года.
Бесплатный доступ
В статье приводится прогноз получения (формирования, выращивания) зубного зачатка на материале «ЛитАр» с целью имплантации в альвеолярный отросток челюсти после потери постоянного зуба независимо от возраста пациента. Процедура должна состоять из двух этапов: 1) автономное выращивание (формирование) зачатка зуба; 2) имплантация полученного зачатка вместо утраченного постоянного зуба.
Имплантация, зубной зачаток, мезенхимальные стволовые клетки
Короткий адрес: https://sciup.org/143176778
IDR: 143176778 | УДК: 616.314-089.28 | DOI: 10.20340/vmi-rvz.2020.6.3
Текст научной статьи Анализ возможности репродукции тканей зуба in vitro с последующей реплантацией in vivo
В течение жизни у взрослого населения возникают проблемы с зубами, что ведет к неблагоприятным изменениям зубочелюстной системы [1, 2]. С целью восстановления функции зубочелюстной системы осуществляют ортопедическое лечение с помощью съемного и несъемного протезирования. Однако, все виды протезирования имеют недостатки, такие как развитие аллергической реакции, необходимость препарировать интактные зубы и длительная адаптация пациентов.
В литературе известны способы реимплантации ауто- и аллоимплантатов зубов на место утраченных [3–6]. Однако, при данной методике после реплантации организм не образует связочный аппарат вокруг корня и не восстанавливает пульпу зуба, что качественно отличает его от здорового зуба, а в случае аллоимплантата возможно отторжение организмом реципиента [7]. Таким образом, идеальной заменой утраченному зубу является новый зуб, выращенный в том же месте из тканей самого пациента.
Необходимые условия для формирования зубного зачатка
Для решения данной задачи необходимо изучить одонтогенез в эмбриональный период. Первые признаки развития зубов у человека отмечаются на 6-й неделе, когда длина тела эмбриона составляет 11 мм. В этот период формирования зачатка зуба участвуют многослойный эпителий полости рта эмбриона и подлежащей ткани мезенхима. Зубной зачаток имеет три постоянно взаимодействующие компоненты: эмалевый орган, который образуется из многослойного эпителия полости рта; зубной сосочек, образованный мезенхимой, заполняющий полость эмалевого органа; зубной мешочек, также являющийся производной мезенхимы, конденсирующийся вокруг эмалевого органа. Эмалевый орган участвует в образовании эмали зуба, зубной сосочек дает начало дентину и пульпе зуба, а зубной мешочек – цементу и периодонту (рис. 1, 2).
В период закладки зубных зачатков выстилка полости рта эмбриона образует вырост в подлежащую мезенхиму, имеющий вид зубной пластинки, на которой в дальнейшем под индуцирующим влиянием мезенхимы появляются разрастания в виде зубных почек. Каждая зубная почка на следующей стадии развития превращается в эпителиальный эмалевый орган, а взаимодействующие с ним мезенхима – в зубной мешочек. Эмалевый орган на 3 месяце внутриутробной жизни сохраняет связь с зубной пластинкой посредством эпителиального тяжа – шейки эмалевого органа (рис. 2). Этот тяж и сама зубная пластинка постепенно истончаются, а к концу 3 месяца распадаются, так как они прорастают мезенхимой. Остающиеся в результате дезинтеграции зубной пластинки эпителиальные клетки входят в состав эпителиальных островков (Малассе), которые в дальнейшем в основной массе подвергаются дегенеративным изменениям и рассасываются. Некоторые из них длительно сохраняются и служат источником развития кист и опухолей [8].
Таким образом, в эмбриональный период происходит формирование зубов, которые не способны к самостоятельной регенерации, что постепенно приводит к их потере в результате действия повреждающих факторов. Из анализа одонтогенеза в эмбриональный период становиться ясным, что для формирования тканей зуба важны, прежде всего, низкодифференцированные эпителиальные клетки ротовой полости и мезенхимальные клетки, причем в литературе указано [9], что мезенхимальные клетки могут быть различными по происхождению (мезенхима краниальной части эмбриона или стромальные клетки костного мозга). Что касается низкодифференцированных эпителиальных клеток эмбриона, то альтернатива этой ткани пока не выявлена во взрослом организме.
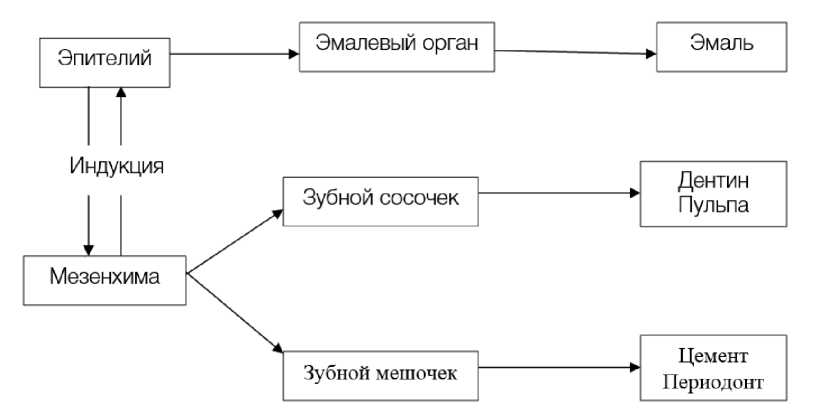
Рис. 1. Источники тканей зуба в эмбриогенезе
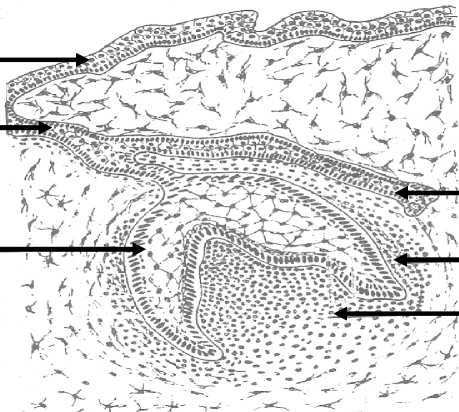
Рис. 2. Зубной зачаток:
1 – закладка постоянного зуба, 2 – зубной мешочек, 3 – зубной сосочек, 4 – эмалевый орган, 5 – эпителий полости рта эмбриона, 6 – шейка эмалевого органа
Возможный способ репродукции нового зуба в организме
Для формирования тканей зуба необходимо иметь низкодифференцированные эмбриональные эпителиальные и мезенхимальные клетки. В качестве мезенхимальных клеток эмбриона могут выступать стволовые клетки. Стволовые клетки являются прародительницами всех без исключения типов клеток в организме. Они способны самообновляться и образовывать специализированные клетки различных тканей. По своему происхождению стволо- вые клетки разделяют на эмбриональные, фетальные, стволовые клетки плацентарнопуповинной крови и стволовые клетки взрослого человека. Источником эмбриональных стволовых клеток является бластоциста – зародыш, который формируется к пятому дню оплодотворения. Эти стволовые клетки способны дифференцироваться во все типы клеток взрослого человека. Но у этого источника стволовых клеток есть недостатки: 1) эти клетки способны спонтанно перерождаться в раковые клетки, 2) на данный момент не выделена безопас- ная линия истинно эмбриональных стволовых клеток, годных для клинического применения. Фетальные стволовые клетки получают из абортного материала на 9–12 неделе беременности. Помимо этических и юридических трений, использование непроверенного абортированного материала чревато осложнениями, такими как заражения пациента вирусом герпеса, вирусными гепатитами и ВИЧ. Источником стволовых клеток является также плацентарнопуповинная кровь, собранная после рождения ребенка. Однако количество стволовых клеток не достаточно велико, и эффективное их применение возможно только однократно для самого ребенка до 10 лет. Самым доступным источником стволовых клеток является костный мозг человека, так как концентрация стволовых клеток в нем максимальна [10]. В костном мозге выделяют сразу два вида стволовых клеток: 1) гемопоэтические стволовые клетки, из которых формируются абсолютно все клетки крови, 2) мезенхимальные стволовые клетки, которые регенерируют все органы и ткани [11]. Таким образом, вероятными источниками мезенхимальних стволовых клеток является плацентарнопуповинная кровь и костный мозг.
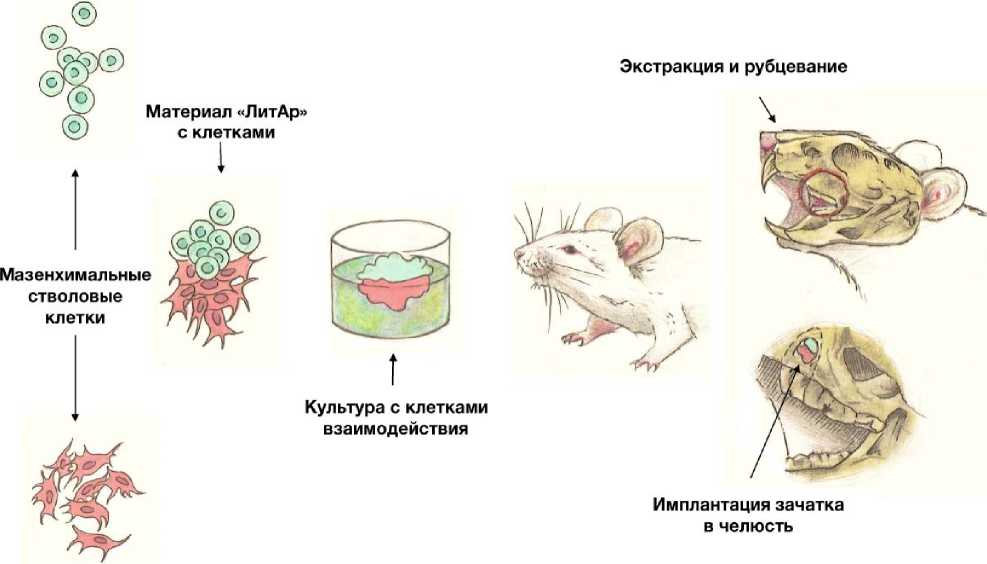
Рис. 3. Схема культивирования и имплантации зубного зачатка на материале «ЛитАр» [12]
В качестве низкодифференцированных эпителиальных клеток эмбриона можно использовать низкодифференцированные клетки базального слоя эпителия полости рта взрослого человека, так как базальные клетки уже существуют на 6-й неделе жизни эмбриона, что соответствует срокам закладки зуба.
Первый этап репродукции зуба – это культивирование чистой линии клеток in vitro. На этом этапе культуры клеток лише- ны структурной организации и, как следствие, теряют характерную гистиотипиче-скую архитектуру и связанные с ней биохимические признаки. Клетки в культурах размножаются, что обеспечивает большое количество клеток, затем их идентифицируют, разделяют на идентичные параллели и, если это необходимо, сохраняют. Второй этап – это культивирование зубной ткани. При культивировании клеток в суспензии (на первом этапе), когда они не прикрепле- ны к твердой поверхности, и поэтому имеют округлую форму, деление их происходит не так часто из-за того, что факторы роста и питательные вещества поступают в недостаточном количестве в клетку. Для увеличения скорости деления клеток необходимо дать им возможность прикрепиться к твердой поверхности, в результате чего форма клеток во время ее адгезии измениться вследствие ее распластывания и движения по поверхности субстрата на свободные места. Возможно, что сильно распластанные клетки могут улавливать больше молекул фактора роста и поглощать больше питательных веществ благодаря своей большой поверхности. В качестве цитоскелета, на котором клетка может закрепиться, необходимо использовать коллаген-апатитовый материал «ЛитАр» [13], так как он обладает большой площадью поверхности за счет своей пористости. На этом этапе низкодифференцированные клетки будут взаимодействовать со стволовыми клетками, в результате чего вероятно запустится процесс одонтогенеза, который имеет место на 6-й неделе развития эмбриона. Третий этап – это имплантация культивированной зубной ткани в живую ткань с целью окончательного формирования зуба и его прорезывания под воздействием окружающей костной ткани.
Немаловажным кажется вопрос контроля биотрансформации материала «ЛитАр» с мезенхимальными клетками, формирующими зубной зачаток. Здесь полезно будет отметить, что в состав «ЛитАр» входит ион Са+2 и РО4– 3. Если некоторые из этих элементов заменить на их изотопы (меченые атомы): кальций на Са45 а, фосфор на Р32, то появляется возможность контролировать процесс. Автор [14], пользуясь Р32О4– 3, определял количество способного обмениваться фосфата у ряда препаратов оксиапатита или гидроксоапа-тита (Са10(ОН)2 (РО4)6). Применяя Са45 и Р32О4– 3, автор [15] измерял количества обмениваемых кальция и фосфора, определяя молярное отношение Са/Р в препара- тах апатита. Таким образом, можно контролировать биотрансформацию материала «ЛитАр», а вместе с ним и события, происходящие с клеточной массой в этом материале.
Материал «ЛитАр» и его свойства
Материал «ЛитАр» (рис. 4, 5) представляет собой высокоинтегрированную смесь биополимера (коллагена или альгината кальция-натрия, который добывается из морских водорослей) и гидроксофосфата кальция, называемого также гидроксилапа-тит, гидроксидапатит или просто апатит. «ЛитАр» – коллаген-апатитовый или альги-нат-апатитовый материал, компоненты которого имеют:
-
• высокую степень структурной интегрированности, что выгодно отличает его от композитов подобного типа;
-
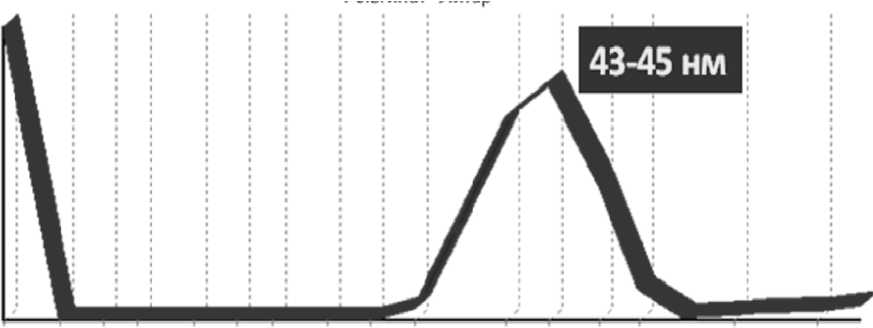
• кристаллы гидроксилапатита нано-метрических размеров (43–45 нм, рис. 6), при этом пористость материала составляет около 70 %.
Именно это обеспечивает преимущественный клинический эффект: если регенерация обычных резорбируемых материалов длится месяцы или годы, то для «ЛитАр» она исчисляется неделями.
В первые 10–15 дней имплантированный материал в дефектном участке био-трансформируется в соединительную ткань, которая затем оссифицируется, т.е. превращается в костную (в соответствии с нормальным анатомическим строением кости), хрящевую или паренхиматозную, то есть, тот тип ткани, который требует нормальное анатомическое строение [16].
Возможно как интраоперацинное (инъекционное) введение материала, так и пероральный прием. Необходимо отметить, что в первом случае характер поведения материала в организме и ожидаемый результат прогнозируется надёжно, а во втором случае ожидаемые результаты не всегда надёжно прогнозируются: иногда в организме происходят процессы, не представляющие собой 100 % очевидности, и хотя результаты за период многолетних наблюдений всегда положительные, но не всегда абсолютно ожидаемые. Особенно трудно прогнозировать результат перорального приёма, если у пациента кроме болей в опорно-двигательном аппарате, есть изменения желудочно-кишечного характера, диабетического (2-го типа) свойства, изменения сосудистого характера.
Взаимодействие выращенного (культивированного) зубного зачатка и биологической системы организма
После имплантации тканей зачатка зуба в организм окружающая костная ткань в дальнейшем будет оказывать основное влияние на его развитие. В зависимости от качества зачатка и условий окружающей среды вокруг него внутри организма (сте- пень дифференцировки зубных тканей на момент введения их в организм, форма и объем воспринимающего костного ложа альвеолярного отростка челюсти, скорость интеграции тканей зачатка зуба с окружающей костной тканью) будут определять сам факт прорезывания зуба и его ценность для зубочелюстной системы. При условии благополучного формирования тканей зачатка in vitro его последующее существование в организме может закончится ретенцией. Подобное осложнение можно наблюдать в практике детской хирургической стоматологии при несвоевременном лечении одонтогенных кист у детей. Зачатки постоянных зубов в детском возрасте могут быть вовлечены в патологический процесс при развитии радикулярной кисты от молочных зубов, что приводит к его ретенции (рис. 7, 8).

Рис. 4. Материал «ЛитАр»

Рис. 5. Электронная микроскопия материала «ЛитАр», ув. х ЗОО
dN/dlog(D)
3 4 5 6 8 10 12 16 20 25 40 50 65 80 130 200
Nanometers
Концентрация -5.92E3 шт/кубсм
Достоверность -0,164
Среднесчетный диаметр -48.7 нм
Среднеобъемный диаметр -71.3 нм
Среднегеометрический диаметр - 44.7 нм
Рис. 6. Результаты определения размеров кристаллов «ЛитАр» лазерной абляцией
К сожалению, хирургическое лечение кист в детском возрасте не гарантирует сохранения зачатка постоянного зуба или его правильное прорезывание в зубном ря- ду, так как цистэктомия, как хирургический метод лечения, не позволяет восстановить связь зачатка с костной тканью (рис. 9).
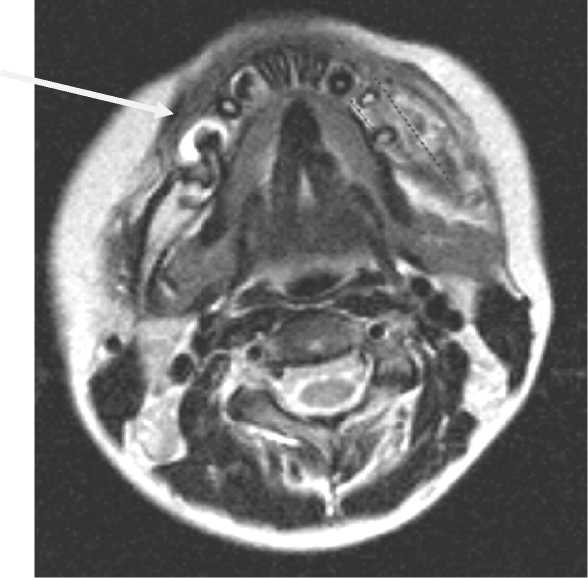
Рис. 7. МРТ. Зубосодержащая киста нижней челюсти пациента
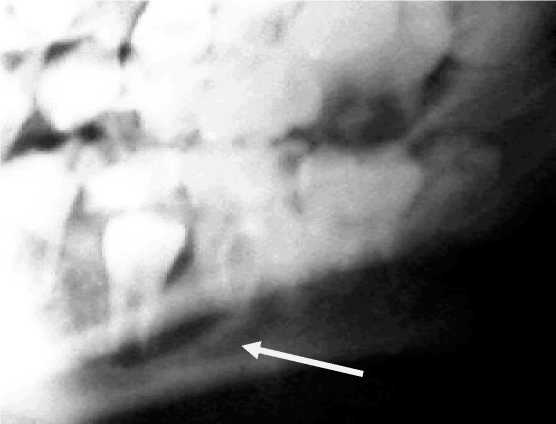
Рис. 8. Рентгенография нижней челюсти. Зубосодержащая киста
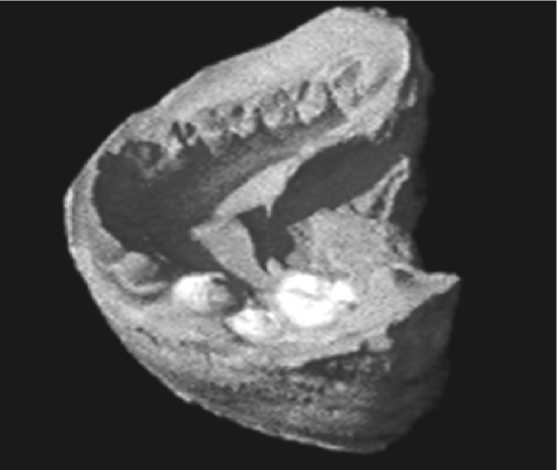
Рис. 9. Модель нижней челюсти через три месяца после операции
Таким образом, из опыта детской хирургической стоматологии становится ясным, что подобные осложнения очень вероятны после введения фолликула в организм. Для предупреждения данных осложнений нами было проведено исследование, целю которго была разработка и обоснование нового метода лечения радикулярных зубосодержащих кист с применением кол-лаген-апатитового материала для временной фиксации фолликула постоянного зуба и оптимизации остеогенеза в остаточной костной полости после цистэктомии. В результате проведенного исследования было доказано, что композит обеспечил первичную стабильность фолликула постоянного зуба, восстановил связь зачатка с окружающей костной тканью, что позволило продолжить развитие зачатка постоянного зуба лабораторного животного (собаки) и обеспечить его прорезывание в окклюзионной плоскости (рис. 10–12).
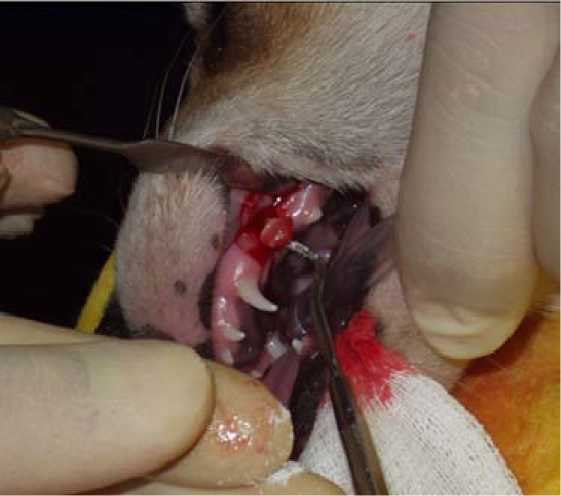
Рис. 10. Фотография этапа операции. Фолликул постоянного зуба собаки реплантирован в костный дефект
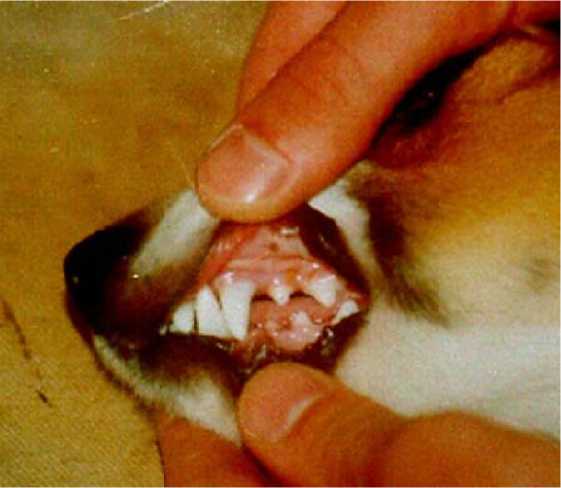
Рис. 11. Фотография, спустя три месяца после операции. Зачаток постоянного зуба собаки прорезался в окклюзионной плоскости
Таким образом, использование нового метода лечения зубосодержащих кист позволит нам обеспечить оптимальные условия для продолжения развития фолликула в живом организме и иметь уверенность, что зуб прорежется и встанет в правильную окклюзионную плоскость.
Выводы
Для решения задачи выращивания зубного зачатка необходимо:
-
1. Сравнить клетки базального слоя эпителия ротовой полости взрослого человека с эпителием ротовой полости эмбриона.
-
2. Овладеть методикой получения питательной среды и специальных условий для культивирования клеток.
-
3. Овладеть методикой получения и поддержания постоянной клеточной линии.
-
4. Овладеть методикой получения и поддержания в жизнеспособном состоянии тканей нового зуба.
-
5. Выяснить, есть ли прямая зависимость формы зуба от локализации клеток эпителия (при условии, что предложенные
-
6. Выяснить, какое влияние окажет окружающая костная ткани челюсти на развитие и прорезывание нового зуба.
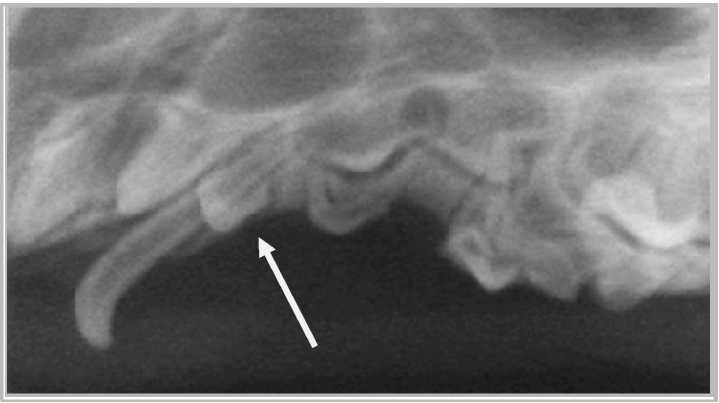
а
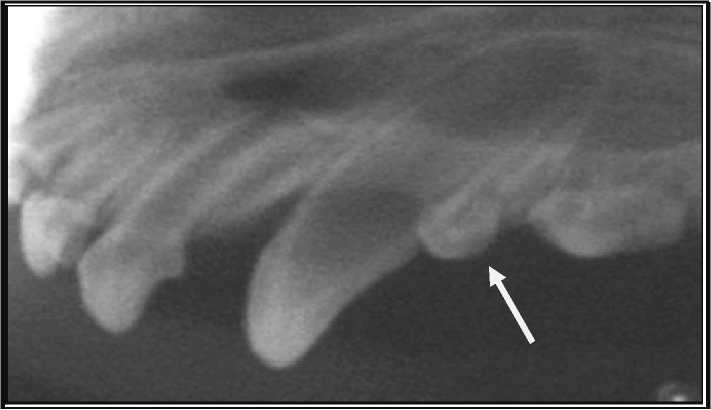
б
Рис. 12. Рентгенография верхней челюсти собаки справа:
а – рентгенография через два дня после операции; б – рентгенография через два месяца после операции
базальные клетки эпителия полости рта взрослого человека трансформируются в эмалевый орган).
Список литературы Анализ возможности репродукции тканей зуба in vitro с последующей реплантацией in vivo
- Akerman K., Venz V. Bokovaya augmentaciya grebnya al'veolyarnyh otrostkov s ispol'zovaniem blochnogo transplantata i zashchita ego poverhnosti s pomoshch'yu zamenitelej kostnoj tkani. Opisanie klinicheskih slu-chaev. Novoe v stomatologii. 2005;3:34-38.
- Potapov V.P. Izbiratel'noe vyravnivanie okklyuzionnoj ploskosti u bol'nyh, nuzhdayushchihsya v ortopedicheskoj pomoshchi. Aktual'nye voprosy v stomatologicheskoj praktike: sbor. nauch. st. SamGMU. Samara, 2001. S. 221-222.
- Pat. 639536 SSSR, MPK A 61 V 17/00. Sposob allotransplantacii zubnyh zachatkov / Maksudov M.M., Dranovskij G.E.; № 2488861/28-13; zayavl. 26.05.77; opubl. 30.12.78. Byul. № 48. 1 s.
- Ermolov V.F. Peresadka zubnyh follikul u detej. Stomatologiya. 1967; 1:100.
- Kozlov V.A. Autotransplantaciya zubov. Stomatologiya. 1967;1:101.
- Maksudov M.M., Dranovskij G.E., Hasanov R.A., Shakirova G.R. Izucheniya srokov zhiznisposobnosti zubnyh zachatkov, vzyatyh u donorov posle ih gibeli s cel'yu transplantacii. Stomatologiya. 1985;1:16-17.
- Belozerov M.N. Ocenka osteoplasticheskih svojstv razlichnyh biokompazicionnyh materialov dlya zapolneniya defektov chelyustej (eksperimental'no klinicheskoe issledovanie): avtoref. dis. ... kand. med. nauk. Moscow, 2004. 22 s.
- Bykov V.L. Gistologiya i embriologiya organov polosti rta. Saint Petersburg,1999:164-175.
- Smith A.T. Tooth tissue engineering and regeneration - a translational vision! JDent Res. 2004;83(7):517.
- Markov I.I., Litvinov S.D., Markov A.I. Implantacionnyj material "LitAr" induciruet angiogenez. Morfologiches-kie vedomosti. 2003;1-2:74-76.
- Vajnbojm P. Stvolovye kletki i regenerativnaya medicina. Partnyor. 2004;7(82):1-4.
- Magloire H., Couble M.-L. L'implant dentaire biologique : mythe ou réalité ? Revue de Stomatologie et de Chirurgie Maxillo-fasciale. 2011;112(4):240-248.
- Litvinov S.D. Nanorazmernyj kompozitnyj material "LitAr" - universal'nyj implantat (monografiya). Samara: Kniga, 2008. 250 s.
- Olsen S.B. J. Phys. Chem. 1952, N 56. P. 630. (po U. N'yuman, M. N'yuman. Mineral'nyj obmen kosti. Moscow: Izd-vo Inostrannoj lit., 1961. S. 83.)
- Neuman, William F., Margaret W. The Chemical Dynamics of Bone Mineral. Chicago: The University of Chicago Press. 1958. 209 p.
- Litvinov S.D. The cytoactive biopolyver-salt base composite material (LitAr) with nanosized crystals. News of science and education, Sheffield (GB). 2014;13:32-50.


