Анализ возможных маркеров эффективного противоопухолевого клеточного иммунного ответа при назначении ингибиторов контрольных точек
Автор: Малкова А.М., Орлова Р.В., Жукова Н.В., Губаль А.Р., Шаройко В.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Цель исследования - анализ возможных маркеров эффективного противоопухолевого клеточного иммунного ответа. Материал и методы. С помощью ключевых слов: ингибиторы контрольных точек, иммунотерапия, Т-лимфоциты, истощенные Т-лимфоциты, противоопухолевый иммунный ответ - были отобраны обзорные и оригинальные статьи (n=34), опубликованные с 2005 по 2020 г. в международных базах данных PubMed, Web of Science, Elsevier. Результаты. Исследование выявило потенциальные маркеры, отражающие высокую активность адаптивного иммунного ответа, основанного на эффективном распознавании антигенов опухоли через молекулы главного комплекса гистосовместимости (MHC), достаточном количестве Т-лимфоцитов и преобладании Т-цитотоксических клеток, а также на низком уровне экспрессии ингибиторных рецепторов и малых молекул. Свою предиктивную значимость показали наличие полиморфизмов единичных нуклеотидов в генах HLA-I и HLA-II, кодирующих белки MHC-I и MHC-II соответственно, высокий уровень лимфоцитов, среди которых наиболее важно преобладание CD8+ Т-клеток и низкий уровень Т-регуляторных клеток (Т-рег), а также наличие полиморфизмов единичных нуклеотидов в генах, кодирующих FcγR рецепторы Т-лимфоцитов. Также была выявлена диагностическая значимость определения экспрессии ингибиторных рецепторов Т-лимфоцитов - TIM3, LAG3, TIGIT, особенно в комплексе с определением уровня экспрессии PD1. Заключение. Полученные результаты могут быть актуальны для внедрения новых методов оценки функциональной активности Т-клеточного иммунного ответа перед назначением ИКТ, а также для разработки новых диагностических панелей, что может представлять интерес для сотрудников клинико-диагностических лабораторий и исследовательских центров.
Опухоль, адаптивный иммунный ответ, маркеры, эффективность, противоопухолевая терапия
Короткий адрес: https://sciup.org/140293891
IDR: 140293891 | УДК: 616-006.6:615.37:612.017.1
Текст научной статьи Анализ возможных маркеров эффективного противоопухолевого клеточного иммунного ответа при назначении ингибиторов контрольных точек
Наиболее доступными препаратами для иммунной терапии (ИТ) являются ингибиторы контрольных точек (ИКТ), моноклональные антитела, ингибирующие рецепторы CTLA-4 (cytotoxic T-lymphocyte-associated protein 4 – гликопротеин цитотоксических T-лимфоцитов 4) и PD-1 (programmed cell death 1 – рецептор программируемой клеточной гибели 1) на Т-клетках и PD-L1 (ligand of programmed cell death 1 receptor – лиганд рецептора программируемой клеточной гибели 1) на опухолевых клетках. Ингибирование контрольных точек CTLA-4 и PD-1, лиганда PD-L1 помогает CD-8+ T-клеткам идентифицировать опухолевый антиген в комплексе с молекулами гистосовместимости MHC-I. Этот процесс способствует дифференциации Т-лимфоцитов (Т-ЛФ) в цитотоксические клетки. Одновременно происходит активация CD4+ Т-лимфоцитов, которые распознают опухолевый антиген в комплексе с молекулой МНС-II антигенпрезентирующих клеток (АПК). Т-хелперы способствуют дифференциации CD-8+ Т-клеток через продукцию IL-2. Цитотоксические
Т-лимфоциты начинают секретировать различные цитокины, в основном интерферон γ (IFN-γ), фактор некроза опухоли α (TNF-α), вызывая цитотоксические реакции, осуществляемые Т-клетками и натуральными киллерами (НК). Кроме того, ингибирование контрольных точек снижает активность Т-регуляторных клеток (Т-рег), синтезирующих противовоспалительный IL-10, что также способствует противоопухолевому иммунному ответу [1]. Таким образом, препараты индуцируют и усиливают цитотоксический иммунный ответ.
Подобный патогенетический подход в лечении неоплазий показал высокую цитотоксическую активность препаратов в экспериментальных работах, но в клинической практике данная терапия оказалась эффективной не во всех случаях [2]. Поэтому анализ возможных характеристик Т-клеточного иммунного ответа является весьма важным при назначении и контроле эффективности иммунотерапии.
В клинической практике в качестве предиктивного маркера при назначении ИКТ используется определение суррогатных маркеров – PD1/PDL1
молекул, экспрессируемых опухолевыми или иммунными клетками [3]. Однако иммуногистохимический анализ описанных молекул не отражает полной картины состояния адаптивного иммунного ответа пациента. Более того, в клинических исследованиях применения ИКТ при немелкоклеточном раке легкого (НМРЛ) и меланоме было показано, что определение уровня экспрессии контрольных точек не позволяет объективно оценить прогностическую значимость этих маркеров [4, 5].Поэтому представляется важным выявление дополнительных критериев, согласно которым назначение терапии ИКТ будет оправдано и результативно.
Цель исследования – анализ возможных маркеров эффективного противоопухолевого клеточного иммунного ответа.
Материал и методы
Были исследованы обзорные и оригинальные статьи (n=34), опубликованные с 2005 по 2020 г. в международных базах данных PubMed, Web of Science, Elsevier, отобранные с использованием ключевых слов: ингибиторы контрольных точек, иммунотерапия, Т-лимфоциты, истощенные Т-лимфоциты, противоопухолевый иммунный ответ.
Результаты и обсуждение
Для эффективного иммунного ответа необходима активация каскада последовательных реакций, в которых участвуют различные рецепторы Т-клеток, опухоли и антиген-презентирующие клетки. Развитие цитотоксического ответа зависит от пре- обладания стимулирующих или ингибирующих молекул на поверхности всех клеток – участников процесса. Данная система способствует защите от аутоиммунных реакций, которая основана на взаимодействии Т-клеток с ингибирующими рецепторами при контакте с нормальными клетками. Способность опухолевых клеток избегать иммунный ответ, в частности, основана на гиперэкспрессии ингибирующих рецепторов, среди которых в качестве таргетного белка известна молекула PD-L1 [6]. Другие стимулирующие и ингибирующие рецепторы представлены на рис. 1.
Характеристика опухолевых антигенов
Так как активация цитотоксического иммунного ответа инициируется распознаванием чужеродных антигенов в комплексе с молекулами MHC, можно предположить, что чем более вариабельны антигены опухоли или молекулы MHC, тем эффективнее Т-клеточный иммунный ответ [7]. Характеристиками разнообразия мутаций могут служить несинонимичные варианты одиночных нуклеотидных полиморфизмов (ОНП), которые определяют уровень мутационной нагрузки опухоли (tumor mutational burden – TMB). Для меланомы и НМРЛ была показана положительная взаимосвязь высокого уровня несинонимичных вариантов одиночных нуклеотидов (nonsynonymous single nucleotide variants – nsSNVs) с ответом на иммунотерапию и увеличением общей выживаемости [7–9]. Наличие микросателитных нестабильностей (MSI) или нарушения восстановления ДНК (MMRd) также оказалось положительным предиктивным фактором
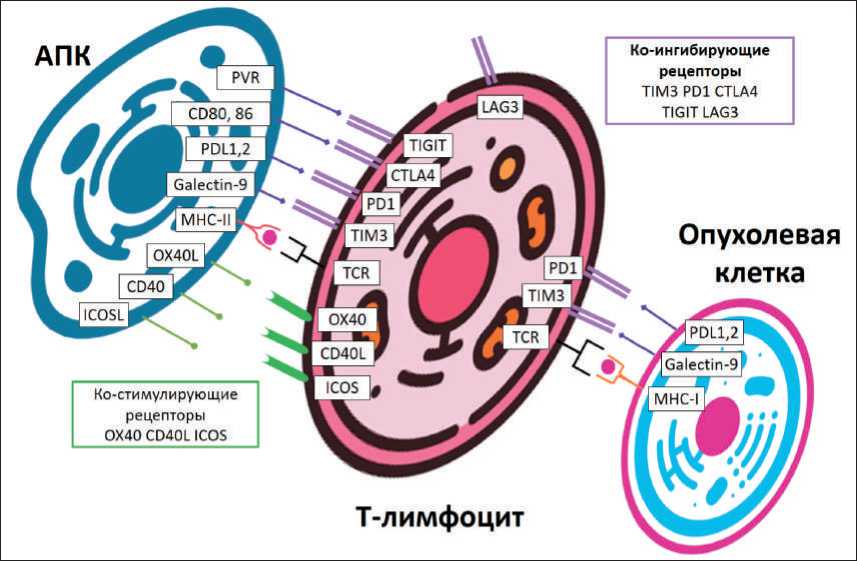
Рис. 1. Ко-стимулирующие и ко-ингибирующие рецепторы, экспрессируемые АПК, Т-лимфоцитами и опухолевыми клетками Fig. 1. Co-stimulating and co-inhibiting receptors expressed by antigen-presenting cells, T-lymphocytes, tumor cells
в независимости от типа солидной опухоли [10]. Исследовательская группа Ascierto et al. выявила, что наличие гиперэкспрессии 5 генов (IGK, GBP1, STAT1, IGLL5, OCLN) при раке молочной железы может использоваться в качестве биомаркеров эффективности терапии ИКТ [11]. Важно отметить, что уровень мутаций в циркулирующих ДНК (цДНК) коррелирует с относительным уровнем TMB и ответом на терапию, а, значит, результаты генотипирования цДНК также могут отражать мутагенную вариабельность опухоли и служить предиктивным маркером [12].
Вариабельность генотипов HLA, кодирующих молекулы MHC, также показала свою предиктивную значимость при оценке эффективности терапии ингибиторами контрольных точек. D. Chowell et al. выявили, что при наличии гетерозиготности по генотипам HLA-B and HLA-C наблюдается более высокая общая выживаемость, в частности, среди пациентов с меланомой, получающих ИКТ, наиболее благоприятным генотипом является HLA-B44 [13]. У пациентов с меланомой, принимающих ипилимумаб, обнаружена взаимосвязь увеличения общей выживаемости и выживаемости без прогрессирования с общей мутационной нагрузкой, неоантигенной нагрузкой, экспрессией цитолитических маркеров в иммунном микроокружении, а также высоким уровнем вариабельности генотипов HLA класса I – эволюционной дивергенцией HLA-I (HLA evolutionary divergence -HED) [14]. У пациентов с высоким уровнем HED и TMB выживаемость была значительно выше, чем при высоком уровне каждого параметра в отдельности [15].
В исследовании D.B. Johnson et al. показано, что экспрессия MHC-II на опухолевых клетках меланомы ассоциирована с терапевтическим ответом, более высоким уровнем выживаемости без прогрессирования и общей выживаемости, а также с инфильтрацией опухоли CD4 и CD8 Т-лимфоцитами [16], что впоследствии было подтверждено для других типов опухолей [17, 18] и при комбинированной иммунотерапии [19].
У HR+/HER2-негативных пациентов экспре-сия MHC-II опухолевыми клетками показала свою предиктивную значимость для анти-PD-1 терапии в комбинации с химиотерапией, но не для химиотерапии в монорежиме [18]. Авторы объясняют данную закономерность тем, что экспрессия MHC-II на опухолевых клетках способствует более эффективному распознаванию антигенных пептидов T- и B-клетками, что может усиливать ответ на лечение. При этом в микроокружении опухолей, экспрессирующих MHC-II, позже был выявлен лиганд молекулы MHC-II, подобный рецептору Fc6 (FCRL6), который активируется после проведения иммунотерапии анти-PD-1 препаратами. Рецептор FCRL6, взаимодействуя с MHC-II, обеспечивает иммуносупрессивный сигнал, который напрямую подавляет цитотоксическую активность НК и секрецию эффекторных Т-клеточных цитокинов. В связи с этим авторы предлагают рассматривать FCRL6 как новую мишень для иммунотерапии [20].
Количество и функциональная активность Т-лимфоцитов
Наиболее простым критерием функциональности адаптивного иммунитета является количество лимфоцитов. В многочисленных исследованиях был показан предиктивный потенциал определения соотношения нейтрофилов и лимфоцитов в периферической крови [21]. По данным T. Jiang et al., при соотношении нейтрофилов и лимфоцитов (НФ:ЛФ) до лечения более 5:1 уровень общей выживаемости и выживаемости без прогрессирования на терапии анти-CTLA4 и анти-PD1 снижается [22]. Также важно соотношение активных и регуляторных Т-клеток. Увеличение количества CD4+ и CD8+ Т-клеток памяти и IL-2, активатора Т-клеточного цитотоксического ответа на фоне общего повышения лимфоцитов ассоциировано с улучшением противоопухолевого ответа при терапии ипилимумабом при меланоме [23–25]. При этом, согласно другим исследованиям, эффективность ИКТ при лечении метастатической меланомы также ассоциирована с низким уровнем Т-рег, продуцируемого ими IL-10, и миелоидных клеток супрессоров [25–27].
Помимо количества лимфоцитов весьма важно определять и их функциональную активность [28]. F. Arce Vargas et al. показали, что при наличии однонуклеотидных полиморфизмов (single nucleotide polymorphisms – SNP) в генах, кодирующих FcγR рецепторы Т-лимфоцитов, наблюдается повышение эффективности анти-CTLA4 терапии. Наблюдаемая закономерность объясняется тем, что при большем разнообразии рецепторов Т-клеток повышается их способность реагировать на большее количество антигенов, что способствует более эффективному противоопухолевому иммунному ответу [29].
Одной из причин снижения эффективности является увеличение количества истощенных Т-лимфоцитов, у которых снижена функциональная способность к делению и продукции цитокинов. Истощенные Т-клетки характеризуются гиперэкспрессией ингибиторных рецепторов: PD-1, CTLA-4, муцинового домена-3 (TIM3), белка, кодируемого геном активации лимфоцитов-3 (LAG3), иммуноглобулина T-клеток и доменов ITIM (TIGIT), CD160, CD244 и др [30]. Ниже перечислены причины, которые отвечают за подобную гиперэкспрессию:
– повышенная антигенная нагрузка [31, 32]. С ростом опухоли антигенная нагрузка растет, а значит, размер опухоли может отражать вероятность наличия истощенных Т-клеток. Подтверждением данной гипотезы может служить исследование
M. Katsurada et al., показавшее, что при исходном размере опухоли более 10 см (basal tumor size-BTS) у пациентов с НМРЛ на монотерапии ИКТ выживаемость без прогрессирования и общая выживаемость были значительно короче [33]. Поэтому назначение ИКТ в качестве первой линии имеет патогенетическое значение и обладает большей эффективностью при сравнении с назначением данных препаратов во второй линии, в том числе в комбинации с химиотерапией [34];
– повышение уровня Т-рег, синтезирующих иммуносупрессивные молекулы: IL-10, IL-35, трансформирующий ростовой фактор бета (TGFβ), индоламин-2,3-диоксигеназа (IDO), аденозин [34, 35]. Т-рег активируют несколько ингибирующих рецепторов, включая PD-1, CTLA-4, Tim-3 и TIGIT [34, 36–38]. Они также активируют молекулы, участвующие в дисфункции Т-клеток: CD39, CD73 и CCR4 [39];
– нарушение распознавания антигенов CD4-Т-клетками;
– конкуренция с костимулирующими рецепторами за связывание с лигандами [40, 41];
– усиление экспрессии ингибиторных генов, например, при активации генов BATF при связывании с PD-1 [42];
– дисбаланс ингибиторных рецепторов и кости-мулирующих рецепторов, конкурирующих за один и тот же лиганд, например, лиганды, активирующие TIGIT и ингибирующие CD226 [43].
Помимо определения экспрессии рецепторов лимфоцитов в качестве предиктивных маркеров были предложены растворимые показатели, ассоциированные с низкой функциональностью адаптивного иммунного ответа. Например, IL-10, синтезируемый Т-лимфоцитами, НК, антигенпрезентирующими клетками и клетками опухоли [52], повышение уровня которого оказалось взаимосвязано с неблагоприятном прогнозом для паци- ентов [53]. Среди малых молекул можно выделить аденозин, который нарушает эффекторные функции Т-клеток непосредственно через активацию аденозинового рецептора A2aR [54] и косвенно за счет увеличения функций Т-рег, уменьшения активации антиген-презентирующих клеток и индукции миелоидных супрессорных клеток [55], и индоламин-2,3-диоксигеназу (IDO), которая подавляет активность Т-клеток за счет уменьшения незаменимой аминокислоты триптофана и активирует T-регуляторные клетки за счет биосинтеза кинуренина [56]. Было показано, что IDO способствует развитию резистентности к терапии ИКТ анти-CTLA-4 и анти-PD-1 [57].
Новые подходы усиления Т-клеточного иммунного ответа
В настоящее время имеется достаточно доказательств того, что двойное ингибирование ингибиторных рецепторов более эффективно, чем однократное ингибирование с целью усиления опухоль-специфичной цитотоксической активности CD8+ Т-клеток in vitro и in vivo , что было показано при изучении комбинаций ингибиторов PD-1 и CTLA-4, PD-1 и Tim-3, PD-1 и LAG-3 и PD-1 и TIGIT, PD1 и CD137 [43, 45, 58–61].
В качестве стимулирующего воздействия изучалось воздействие агонистами рецепторов-индукторов Т-лимфоцитов OX-40 [62]. Инъекция OX-40L:Ig или анти-OX-40R in vivo мышам с различными неоплазиями привела к активации противоопухолевого иммунного ответа CD4+ Т-лимфоцитов даже при малоиммуногенных опухолях.
В клинической практике можно найти примеры применения иммуномодуляторов совместно с ИКТ. D. Rafei-Shamsabadi et al. выявили стимулирующую роль IL-2 у пациентов с начальной резистентностью к терапии ингибиторами PD-1. После локального введения цитокина наблюдался полный или частичный ответ у 6 из 9 пациентов, а в биоптатах опухоли обнаружили образование воспалительного инфильтрата, включающего Т-лимфоциты и повышенный уровень эозинофилов [63].
В экспериментах in vitro и in vivo показана иммуностимулирующая функция D-изомера 1-метил-триптофана, ингибитора индоламин-2,3-диоксигеназы (IDO), что усиливало противоопухолевый эффект в режимах химио-иммунотерапии с использованием циклофосфамида, паклитаксела или гемцитабина на мышиных моделях трансплантируемой меланомы и трансплантируемого и аутохтонного рака молочной железы [64]. Клиническая эффективность двойной блокады IDO/PD-1 наблюдалась в ходе продолжающегося исследования эпакадостата (ингибитор IDO) в комбинации с пембролизумабом (моноклональные антитела к PD-1) у пациентов с запущенными формами рака, включая меланому [65].
Заключение
Анализ литературных источников выявил потенциальные маркеры, отражающие высокую активность адаптивного иммунного ответа, основанного на эффективном распознавании антигенов опухоли через молекулы MHC, достаточном количестве Т-лимфоцитов и преобладании Т-цитотоксических клеток, а также на низком уровне экспрессии ингибиторных рецепторов и малых молекул. Согласно ряду исследований, свою предиктивную значимость показали наличие полиморфизмов единичных нуклеотидов в генах HLA-I
Список литературы Анализ возможных маркеров эффективного противоопухолевого клеточного иммунного ответа при назначении ингибиторов контрольных точек
- DarvinP., Toor S.M., SasidharanNair V., ElkordE. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. 2018; 50(12): 1-11. doi: 10.1038/s12276-018-0191-1.
- Longo V., Brunetti O., AzzaritiA., GalettaD., NardulliP., LeonettiF., Silvestris N. Strategies to Improve Cancer Immune Checkpoint Inhibitors Efficacy, Other Than Abscopal Effect: A Systematic Review. Cancers (Basel). 2019; 11(4): 539. doi: 10.3390/cancers11040539.
- Kambayashi Y., Fujimura T., Hidaka T., Aiba S. Biomarkers for Predicting Efficacies of Anti-PD1 Antibodies. Front Med. 2019; 6: 174. doi: 10.3389/fmed.2019.00174.
- Davis A.A., Patel V.G. The role of PD-L1 expression as a predictive biomarker: an analysis of all US Food and Drug Administration (FDA) approvals of immune checkpoint inhibitors. J Immunother Cancer. 2019; 7(1): 278. doi: 10.1186/s40425-019-0768-9.
- Aguiar P.N. Jr., Santoro I.L., Tadokoro H., de Lima Lopes G., Filardi B.A., Oliveira P., Mountzios G., de Mello R.A. The role of PD-L1 expression as a predictive biomarker in advanced non-small-cell lung cancer: a network meta-analysis. Immunotherapy. 2016; 8(4): 479-88. doi: 10.2217/imt-2015-0002.
- Munhoz R.R., Postow M.A. Recent advances in understanding antitumor immunity. F1000Res. 2016; 5: 2545. doi: 10.12688/f1000re-search.9356.1.
- McGranahanN., FurnessA.J., RosenthalR., RamskovS., LyngaaR., Saini S.K., Jamal-Hanjani M., Wilson G.A., Birkbak N.J., Hiley C.T., Watkins T.B., Shafi S., Murugaesu N., Mitter R., Akarca A.U., Linares J., Marafioti T., Henry J.Y., Van Allen E.M., Miao D., Schilling B., Schadendorf D., Garraway L.A., Makarov V., Rizvi N.A., Snyder A., Hell-mannM.D., Merghoub T., WolchokJ.D., Shukla S.A., Wu C.J., PeggsK.S., Chan T.A., Hadrup S.R., Quezada S.A., Swanton C. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science. 2016; 351(6280): 1463-9. doi: 10.1126/science.aaf1490.
- Rizvi N.A., Hellmann M.D., Snyder A., Kvistborg P., Makarov V., Havel J.J., Lee W., Yuan J., Wong P., Ho T.S., Miller M.L., Rekhtman N., Moreira A.L., Ibrahim F., Bruggeman C., Gasmi B., Zappasodi R., Ma-eda Y, Sander C., GaronE.B., Merghoub T., WolchokJ.D., Schumacher T.N., Chan T.A. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science. 2015; 348(6230): 124-8. doi: 10.1126/science.aaa1348.
- Snyder A., Makarov V., Merghoub T., Yuan J., Zaretsky J.M., Desrichard A., Walsh L.A., Postow M.A., Wong P., Ho T.S., Hollmann T.J., Bruggeman C., Kannan K., Li Y., Elipenahli C., Liu C., Harbison C.T., Wang L., Ribas A., Wolchok J.D., Chan T.A. Genetic basis for clinical response to CTLA-4 blockade in melanoma. N Engl J Med. 2014; 371(23): 2189-99. doi: 10.1056/NEJMoa1406498.
- Le D.T., Durham J.N., Smith K.N., Wang H., Bartlett B.R., Aulakh L.K., Lu S., Kemberling H., Wilt C., Luber B.S., Wong F., Azad N.S., Rucki A.A., Laheru D., Donehower R., Zaheer A., Fisher G.A., Crocenzi T.S., Lee J.J., Greten T.F., Duffy A.G., Ciombor K.K., Eyring A.D., Lam B.H., Joe A., Kang S.P., Holdhoff M., Danilova L., Cope L., Meyer C., Zhou S., Goldberg R.M., Armstrong D.K., Bever K.M., Fader A.N., Taube J., Housseau F., Spetzler D., Xiao N., Pardoll D.M., Papadopoulos N., Kinzler K.W., Eshleman J.R., Vogelstein B., Anders R.A., Diaz L.A. Jr. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017; 357(6349): 409-13. doi: 10.1126/science.aan6733.
- Ascierto M.L., Kmieciak M., Idowu M.O., Manjili R., Zhao Y., GrimesM., Dumur C., WangE., Ramakrishnan V., WangX.Y., BearH.D., Marincola F.M., Manjili M.H. A signature of immune function genes associated with recurrence-free survival in breast cancer patients. Breast Cancer Res Treat. 2012; 131(3): 871-80. doi: 10.1007/s10549-011-1470-x.
- Simeone E., Gentilcore G., Giannarelli D., Grimaldi A.M., Caracd C., CurviettoM., Esposito A., PaoneM., PallaM., Cavalcanti E., Sandomenico F., Petrillo A., Botti G., Fulciniti F., Palmieri G., Queirolo P., Marchetti P., Ferraresi V., Rinaldi G., PistilloM.P., Ciliberto G., Mozzillo N., Ascierto P.A. Immunological and biological changes during ipilimumab treatment and their potential correlation with clinical response and survival in patients with advanced melanoma. Cancer Immunol Im-munother. 2014; 63(7): 675-83. doi: 10.1007/s00262-014-1545-8.
- ChowellD., MorrisL.G.T., GriggC.M., Weber J.K., SamsteinR.M., Makarov V., Kuo F., Kendall S.M., Requena D., Riaz N., Greenbaum B., Carroll J., Garon E., Hyman D.M., Zehir A., Solit D., Berger M., Zhou R., Rizvi N.A., Chan T.A. Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy. Science. 2018; 359(6375): 582-7. doi: 10.1126/science.aao4572.
- Van Allen E.M., Miao D., Schilling B., Shukla S.A., Blank C., Zimmer L., Sucker A., Hillen U., Foppen M.H.G., Goldinger S.M., Utikal J., Hassel J.C., Weide B., Kaehler K.C., Loquai C., Mohr P., Gutzmer R., DummerR., GabrielS., Wu C.J., Schadendorf D., GarrawayL.A. Genomic correlates of response to CTLA-4 blockade in metastatic melanoma. Science. 2015; 350(6257): 207-11. doi: 10.1126/science.aad0095.
- Bradburn M.J., Clark T.G., Love S.B., Altman D.G. Survival analysis part II: multivariate data analysis--an introduction to concepts and methods. Br J Cancer. 2003; 89(3): 431-6. doi: 10.1038/sj.bjc.6601119.
- JohnsonD.B., EstradaM.V., SalgadoR., Sanchez V., DoxieD.B., OpalenikS.R., VilgelmA.E., Feld E., JohnsonA.S., GreenplateA.R., Sanders M.E., Lovly C.M., Frederick D.T., Kelley M.C., RichmondA., Irish J.M., Shyr Y., Sullivan R.J., Puzanov I., Sosman J.A., Balko J.M. Melanoma-specific MHC-II expression represents a tumour-autonomous phenotype and predicts response to anti-PD-1/PD-L1 therapy. Nat Commun. 2016; 7: 10582. doi: 10.1038/ncomms10582.
- RoemerM.G.M., Redd RA., CaderF.Z., PakC.J., AbdelrahmanS., Ouyang J., Sasse S., Younes A., Fanale M., Santoro A., Zinzani P.L., Timmerman J., Collins G.P., Ramchandren R., Cohen J.B., De Boer J.P., Kuruvilla J., Savage K.J., Trneny M., Ansell S., Kato K., Farsaci B., Sumbul A., Armand P., Neuberg D.S., Pinkus G.S., Ligon A.H., Rodig S.J., Shipp M.A. Major Histocompatibility Complex Class II and Programmed Death Ligand 1 Expression Predict Outcome After Programmed Death 1 Blockade in Classic Hodgkin Lymphoma. J Clin Oncol. 2018; 36(10): 942-50. doi: 10.1200/JC0.2017.77.3994.
- Wulfkuhle J.D., Yau C., Wolf D.M., Gallagher R.I., SwigartL.B., Hirst G.L., Campbell M., Nanda R., Liu M.C., Pusztai L., Esserman L., Berry D.A., VeerL., Petricoin E. Quantitative MHC II protein expression levels in tumor epithelium to predict response to the PD1 inhibitor pem-brolizumab in the I-SPY 2 Trial. J Clin Oncol. 2019; 37(15).
- Rodig S.J., GusenleitnerD., JacksonD.G., GjiniE., Giobbie-Hur-der A., Jin C., ChangH., Lovitch S.B., HorakC., Weber J.S., Weirather J.L., Wolchok J.D., Postow M.A., Pavlick A.C., Chesney J., Hodi F.S. MHC proteins confer differential sensitivity to CTLA-4 and PD-1 blockade in untreated metastatic melanoma. Sci Transl Med. 2018; 10(450). doi: 10.1126/scitranslmed.aar3342.
- Johnson D.B., Nixon M.J., Wang Y., Wang D.Y., Castellanos E., EstradaM.V., Ericsson-GonzalezP.I., Cote C.H., SalgadoR., Sanchez V., Dean P.T., Opalenik S.R., Schreeder D.M., Rimm D.L., Kim J.Y., Bordeaux J., Loi S., HornL., SandersM.E., FerrellP.B. Jr., Xu Y., Sosman J.A., Davis R.S., Balko J.M. Tumor-specific MHC-II expression drives a unique pattern of resistance to immunotherapy via LAG-3/FCRL6 engagement. JCI Insight. 2018; 3(24). doi: 10.1172/jci.insight.120360.
- De Angulo G., Yuen C., Palla S.L., Anderson P.M., Zweidler-McKay P.A. Absolute lymphocyte count is a novel prognostic indicator in ALL and AML: implications for risk stratification and future studies. Cancer. 2008; 112(2): 407-15. doi: 10.1002/cncr.23168.
- Jiang T., Qiao M., Zhao C., Li X., Gao G., Su C., Ren S., Zhou C. Pretreatment neutrophil-to-lymphocyte ratio is associated with outcome of advanced-stage cancer patients treated with immunotherapy: a meta-analysis. Cancer Immunol Immunother. 2018; 67(5): 713-27. doi: 10.1007/ s00262-018-2126-z.
- Martens A., Wistuba-Hamprecht K., Yuan J., Postow MA., Wong P., Capone M., Madonna G., Khammari A., Schilling B., Sucker A., Schadendorf D., Martus P., Dreno B., Ascierto P.A., Wolchok J.D., Pawelec G., Garbe C., Weide B. Increases in Absolute Lymphocytes and Circulating CD4+ and CD8+ T Cells Are Associated with Positive Clinical Outcome of Melanoma Patients Treated with Ipilimumab. Clin Cancer Res. 2016; 22(19): 4848-58. doi: 10.1158/1078-0432.CCR-16-0249.
- Subrahmanyam P.B., Dong Z., GusenleitnerD., Giobbie-Hurder A., Severgnini M., Zhou J., Manos M., Eastman L.M., Maecker H.T., Hodi F.S. Distinct predictive biomarker candidates for response to anti-CTLA-4 and anti-PD-1 immunotherapy in melanoma patients. J Immunother Cancer. 2018; 6(1): 18. doi: 10.1186/s40425-018-0328-8.
- Reuben J.M., LeeB.N., Li C., Gomez-Navarro J., Bozon V.A., Parker C.A., HernandezI.M., Gutierrez C., Lopez-Berestein G., CamachoL.H. Biologic and immunomodulatory events after CTLA-4 blockade with ticilimumab in patients with advanced malignant melanoma. Cancer. 2006; 106(11): 2437-44. doi: 10.1002/cncr.21854.
- Kelderman S., HeemskerkB., van Tinteren H., van den Brom R.R., Hospers G.A., van den Eertwegh A.J., Kapiteijn E.W., de Groot J.W., Soetekouw P., Jansen R.L., Fiets E., Furness A.J., Renn A., KrzystanekM., Szallasi Z., Lorigan P., Gore M.E., Schumacher T.N., Haanen J.B., Larkin J.M., Blank C.U. Lactate dehydrogenase as a selection criterion for ipilimumab treatment in metastatic melanoma. Cancer Immunol Im-munother. 2014; 63(5): 449-58. doi: 10.1007/s00262-014-1528-9.
- Xia A., Zhang Y., Xu J., Yin T., Lu X.J. T Cell Dysfunction in Cancer Immunity and Immunotherapy. Front Immunol. 2019; 10: 1719. doi: 10.3389/fimmu.2019.01719.
- Arce VargasF, FurnessA.J.S., LitchfieldK., JoshiK., RosenthalR., Ghorani E., Solomon I., Lesko M.H., Ruef N., Roddie C., Henry J.Y., Spain L., Ben Aissa A., Georgiou A., Wong Y.N.S., Smith M., Strauss D., Hayes A., Nicol D., O 'Brien T., Martensson L., Ljungars A., Teige I., Frendeus B.; TRACERx Melanoma; TRACERx Renal; TRACERx Lung consortia, Pule M., Marafioti T., Gore M., Larkin J., Turajlic S., Swanton C., Peggs K.S., Quezada S.A. Fc Effector Function Contributes to the Activity of Human Anti-CTLA-4 Antibodies. Cancer Cell. 2018; 33(4): 649-63. doi: 10.1016/j.ccell.2018.02.010.
- Fujii S., ShimizuK., Shimizu T., LotzeM.T. Interleukin-10 promotes the maintenance of antitumor CD8(+) T-cell effector function in situ. Blood. 2001; 98(7): 2143-51. doi: 10.1182/blood.v98.7.2143.
- Wherry E.J., Blattman J.N., Murali-Krishna K., van der Most R., AhmedR. Viral persistence alters CD8 T-cell immunodominance and tissue distribution and results in distinct stages of functional impairment. J Virol. 2003; 77(8): 4911-27. doi: 10.1128/jvi.77.8.4911-4927.2003.
- Gros A., Robbins P.F., Yao X., Li Y.F., Turcotte S., Tran E., Wunderlich J.R., Mixon A., Farid S., Dudley M.E., Hanada K., Almeida J.R., Darko S., Douek D.C., Yang J.C., Rosenberg S.A. PD-1 identifies the patient-specific CD8+ tumor-reactive repertoire infiltrating human tumors. J Clin Invest. 2014; 124(5): 2246-59. doi: 10.1172/JCI73639.
- Katsurada M., Nagano T., Tachihara M., Kiriu T., Furukawa K., Koyama K., Otoshi T., Sekiya R., Hazama D., Tamura D., Nakata K., Katsurada N., Yamamoto M., Kobayashi K., Nishimura Y. Baseline Tumor Size as a Predictive and Prognostic Factor of Immune Checkpoint Inhibitor Therapy for Non-small Cell Lung Cancer. Anticancer Res. 2019; 39(2): 815-25. doi: 10.21873/anticanres.13180.
- Qu J., Wang L., Jiang M., Zhao D., Wang Y., Zhang F., Li J., Zhang X. A Review About Pembrolizumab in First-Line Treatment of Advanced NSCLC: Focus on KEYNOTE Studies. Cancer Manag Res. 2020; 12: 6493-6509. doi: 10.2147/CMAR.S257188.
- Wherry E.J., Kurachi M. Molecular and cellular insights into T cell exhaustion. Nat Rev Immunol. 2015; 15(8): 486-99. doi: 10.1038/ nri3862.
- Francisco L.M., Sage P.T., Sharpe A.H. The PD-1 pathway in tolerance and autoimmunity. Immunol Rev. 2010; 236: 219-42. doi: 10.1111/j.1600-065X.2010.00923.x.
- Joller N., Lozano E., Burkett P.R., Patel B., Xiao S., Zhu C., Xia J., Tan T.G., Sefik E., Yajnik V., Sharpe A.H., Quintana F.J., Mathis D., Benoist C., Hafler D.A., Kuchroo V.K. Treg cells expressing the coin-hibitory molecule TIGIT selectively inhibit proinflammatory Th1 and Th17 cell responses. Immunity. 2014; 40(4): 569-81. doi: 10.1016/j. immuni.2014.02.012.
- Kurtulus S., Sakuishi K., Ngiow S.F., JollerN., Tan D.J., TengM.W., Smyth M.J., Kuchroo V.K., Anderson A.C. TIGIT predominantly regulates the immune response via regulatory T cells. J Clin Invest. 2015; 125(11): 4053-62. doi: 10.1172/JCI81187.
- SugiyamaD., NishikawaH., Maeda Y., NishiokaM., TanemuraA., Katayama I., Ezoe S., Kanakura Y., Sato E., Fukumori Y., Karbach J., Jäger E., Sakaguchi S. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci U S A. 2013; 110(44): 17945-50. doi: 10.1073/pnas.1316796110.
- Egen J.G., Allison J.P. Cytotoxic T lymphocyte antigen-4 accumulation in the immunological synapse is regulated by TCR signal strength. Immunity. 2002; 16(1): 23-35. doi: 10.1016/s1074-7613(01)00259-x.
- Quigley M., Pereyra F., Nilsson B., Porichis F., Fonseca C., Eichbaum Q., JulgB., Jesneck J.L., BrosnahanK., Imam S., RussellK., Toth I., Piechocka-Trocha A., Dolfi D., Angelosanto J., Crawford A., Shin H., KwonD.S., Zupkosky J., FranciscoL., Freeman G.J., WherryE.J., Kaufmann D.E., WalkerB.D., EbertB., Haining W.N. Transcriptional analysis of HIV-specific CD8+ T cells shows that PD-1 inhibits T cell function by upregulating BATF. Nat Med. 2010; 16(10): 1147-51. doi: 10.1038/ nm.2232.
- Chauvin JM., Pagliano O., Fourcade J., Sun Z., WangH., Sander C., Kirkwood J.M., Chen T.H., MaurerM., KormanA.J., ZarourH.M. TIGIT and PD-1 impair tumor antigen-specific CD8+ T cells in melanoma patients. J Clin Invest. 2015; 125(5): 2046-58. doi: 10.1172/JCI80445.
- He Q.F., Xu Y., Li J., Huang Z.M., Li X.H., WangX. CD8+ T-cell exhaustion in cancer: mechanisms and new area for cancer immunotherapy. Brief Funct Genomics. 2019; 18(2): 99-106. doi: 10.1093/bfgp/ely006.
- Fourcade J., Sun Z., Benallaoua M., Guillaume P., Luescher I.F., Sander C., Kirkwood J.M., Kuchroo V., Zarour H.M. Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+ T cell dysfunction in melanoma patients. J Exp Med. 2010; 207(10): 2175-86. doi: 10.1084/jem.20100637.
- Piao Y.R., Piao L.Z., Zhu LH, Jin Z.H., DongX.Z. Prognostic value of T cell immunoglobulin mucin-3 in prostate cancer. Asian Pac J Cancer Prev. 2013; 14(6): 3897-901. doi: 10.7314/apjcp.2013.14.6.3897.
- Yuan J., Jiang B., Zhao H., Huang Q. Prognostic implication of TIM-3 in clear cell renal cell carcinoma. Neoplasma. 2014; 61(1): 35-40.
- Jiang J., Jin M.S., Kong^ F., Cao D., Ma H.X., Jia Z., Wang Y.P., Suo J., Cao X. Decreased galectin-9 and increased Tim-3 expression are related to poor prognosis in gastric cancer. PLoS One. 2013; 8(12). doi: 10.1371/journal.pone.0081799.
- Cao Y., Zhou X., Huang X., Li Q., Gao L., Jiang L., Huang M., Zhou J. Tim-3 expression in cervical cancer promotes tumor metastasis. PLoS One. 2013; 8(1). doi: 10.1371/journal.pone.0053834.
- Chen J., Chen Z. The effect of immune microenvironment on the progression and prognosis of colorectal cancer. Med Oncol. 2014; 31(8): 82. doi: 10.1007/s12032-014-0082-9.
- Kotaskova J., Tichy B., TrbusekM., FrancovaH.S., Kabathova J., Malcikova J., Doubek M., Brychtova Y., Mayer J., Pospisilova S. High expression of lymphocyte-activation gene 3 (LAG3) in chronic lympho-cytic leukemia cells is associated with unmutated immunoglobulin variable heavy chain region (IGHV) gene and reduced treatment-free survival. J Mol Diagn. 2010; 12(3): 328-34. doi: 10.2353/jmoldx.2010.090100.
- Chen Q., Daniel V., Maher D.W., Hersey P. Production of IL-10 by melanoma cells: examination of its role in immunosuppression mediated by melanoma. Int J Cancer. 1994; 56(5): 755-60. doi: 10.1002/ ijc.2910560524.
- Koustas E., Sarantis P., Papavassiliou A.G., Karamouzis M.V. The Resistance Mechanisms of Checkpoint Inhibitors in Solid Tumors. Biomolecules. 2020; 10(5): 666. doi: 10.3390/biom10050666.
- Raskovalova T., Lokshin A., Huang X., Su Y., Mandic M., Zarour H.M., Jackson E.K., Gorelik E. Inhibition of cytokine production and cytotoxic activity of human antimelanoma specific CD8+ and CD4+ T lymphocytes by adenosine-protein kinase A type I signaling. Cancer Res. 2007; 67(12): 5949-56. doi: 10.1158/0008-5472.CAN-06-4249.
- Ohta A., Sitkovsky M. Extracellular adenosine-mediated modulation of regulatory T cells. Front Immunol. 2014; 5: 304. doi: 10.3389/ fimmu.2014.00304.
- MunnD.H., Mellor A.L. Indoleamine 2,3-dioxygenase and tumor-induced tolerance. J Clin Invest. 2007; 117(5): 1147-54. doi: 10.1172/ JCI31178.
- Holmgaard R.B., ZamarinD., Munn D.H., Wolchok J.D., Allison J.P. Indoleamine 2,3-dioxygenase is a critical resistance mechanism in antitumor T cell immunotherapy targeting CTLA-4. J Exp Med. 2013; 210(7): 1389-402. doi: 10.1084/jem.20130066.
- Woo S.R., Turnis M.E., Goldberg M.V., Bankoti J., Selby M., Nirschl C.J., Bettini M.L., Gravano D.M., Vogel P., Liu C.L., Tangsom-batvisit S., Grosso J.F., Netto G., Smeltzer M.P., Chaux A., Utz P.J., Workman C.J., Pardoll D.M., Korman A.J., Drake C.G., Vignali D.A. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape. Cancer Res. 2012; 72(4): 917-27. doi: 10.1158/0008-5472.CAN-11-1620.
- Fourcade J., Sun Z., Pagliano O., Guillaume P., Luescher I.F., Sander C., Kirkwood J.M., Olive D., Kuchroo V, Zarour H.M. CD8(+) T cells specific for tumor antigens can be rendered dysfunctional by the tumor microenvironment through upregulation of the inhibitory receptors BTLA and PD-1. Cancer Res. 2012; 72(4): 887-96. doi: 10.1158/0008-5472.CAN-11-2637.
- CurranM.A., Montalvo W, YagitaH., Allison J.P. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Proc Natl Acad Sci U 5 A. 2010; 107(9): 4275-80. doi: 10.1073/pnas.0915174107.
- Shayan G., Srivastava R., Li J., Schmitt N., Kane L.P., Ferris R.L. Adaptive resistance to anti-PD 1 therapy by tim-3 upregulation is mediated by the PI3k-akt pathway in head and neck cancer. Oncoimmunology. 2017; 6(1). doi: 10.1080/2162402X.2016.1261779.
- WeiH., ZhaoL., Li W., FanK., Qian W., Hou S., WangH., DaiM., Hellstrom I., Hellstrom K.E., Guo Y. Combinatorial PD-1 blockade and CD137 activation has therapeutic efficacy in murine cancer models and synergizes with cisplatin. PLoS One. 2013; 8(12). doi: 10.1371/journal. pone.0084927.
- Chen S., Lee L.F., Fisher T.S., Jessen B., ElliottM., Evering W., Logronio K., Tu G.H., Tsaparikos K., Li X., Wang H., Ying C., Xiong M., VanArsdale T., Lin J.C. Combination of 4-1BB agonist and PD-1 antagonist promotes antitumor effector/memory CD8 T cells in a poorly immunogenic tumor model. Cancer Immunol Res. 2015; 3(2): 149-60. doi: 10.1158/2326-6066.CIR-14-0118.
- Weinberg A.D., Rivera M.M., Prell R., Morris A., Ramstad T., Vetto J.T., Urba W.J., Alvord G., Bunce C., Shields J. Engagement of the OX-40 receptor in vivo enhances antitumor immunity. J Immunol. 2000; 164(4): 2160-9. doi: 10.4049/jimmunol.164.4.2160.
- Rafei-ShamsabadiD., Lehr S., vonBubnoffD., MeissF. Successful combination therapy of systemic checkpoint inhibitors and intralesional interleukin-2 in patients with metastatic melanoma with primary therapeutic resistance to checkpoint inhibitors alone. Cancer Immunol Immunother. 2019; 68(9): 1417-28. doi: 10.1007/s00262-019-02377-x.
- HouD.Y., Muller A.J., SharmaM.D., DuHadaway J., Banerjee T., JohnsonM., Mellor A.L., Prendergast G.C., Munn D.H. Inhibition of in-doleamine 2,3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses. Cancer Res. 2007; 67(2): 792-801. doi: 10.1158/0008-5472.CAN-06-2925.
- Gangadhar T.C., Hamid O., Smith D.C., Bauer T.M., Wasser J.S., Luke J.J., Balmanoukian A.S., Kaufman D.R., Zhao Yu., Maleski J., Leopold L., Gajewski T.F. Preliminary results from a Phase I/II study of epacadostat (incb024360) in combination with pembrolizumab in patients with selected advanced cancers. J Immunother cancer. 2015; 3(2). doi: 10.1186/2051-1426-3-S2-07.


