Анализ засухоустойчивости различающихся по стратегии адаптации к засухе растений пшеницы Triticum aestivum L. на начальном этапе онтогенеза
Автор: Авальбаев А.М., Юлдашев Р.А., Аллагулова Ч.Р., Плотников А.А., Ласточкина О.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Проблемы адаптации
Статья в выпуске: 1 т.59, 2024 года.
Бесплатный доступ
Ранний этап онтогенеза, во время которого растения наиболее чувствительны к дефициту влаги, - одна из самых критичных фаз в их развитии. Мягкая пшеница ( Triticum aestivum L.) относится к наиболее распространенным в мире и в Российской Федерации ценным культурам. В процессе естественного и искусственного отбора на территории России сформировались две существенно различающиеся по стратегии адаптации к засухе экологические группы пшеницы - лесостепной западносибирский и степной волжский экотипы. Для регионов Западной Сибири характерна весенняя засуха, в связи с чем растения пшеницы лесостепного западносибирского экотипа отличаются замедленным ростом на начальном этапе онтогенеза. В юго-восточных районах европейской части России, в частности в Поволжье, засуха наблюдается позднее, и сорта степного волжского экотипа, наоборот, интенсивно растут в начале вегетации, чтобы максимально развить разветвленную сеть корней к наступлению летней засухи. В настоящей работе впервые выявлены индуцированные засухой изменения в гормональном балансе и содержании аминокислоты пролина у лесостепного западносибирского и степного волжского экотипов пшеницы на начальном этапе онтогенеза. Цель работы состояла в оценке физиолого-биохимических показателей растений пшеницы сортов Зауральская Жемчужина (лесостепной западносибирский экотип) и Экада 70 (степной волжский экотип) в начальную фазу их онтогенеза в норме и в условиях засухи. В первой серии экспериментов семена раскладывали по 15 шт. в чашки Петри на фильтровальную бумагу, смоченную 5 мл растворов концентрированной сахарозы (4 %, 8 % и 12 %), моделирующих засуху. Чашки Петри помещали в термостат и проращивали семена в темноте при 22 °С в течение 3 сут. В качестве контроля использовали семена, пророщенные на дистиллированной воде. На 3-и сут рассчитывали энергию прорастания семян, которую определяли по соотношению (%) числа проросших семян к общему числу взятых для проращивания. У проросших семян измеряли длину главного корня. Во второй серии провели вегетационные опыты в контролируемых условиях. Семена высевали в емкости объемом 15 л (по 30 растений в каждой, глубина посева 4-5 см, расстояние между рядками 2,5 см, расстояние между растениями в ряду 2,5 см). Часть растений подвергалась ранней почвенной засухе. При ее моделировании полив не проводили до достижения значения 30 % влажности от полной влагоемкости почвы (ПВП). В контроле поддерживали влажность 70 % от ПВП. На 7-е, 8-е и 9-е сут измеряли сырую и сухую массу контрольных и подверженных действию почвенной засухи проростков. Содержание цитокининов (ЦК), индолилуксусной (ИУК) и абсцизовой (АБК) кислот в 10 проростках пшеницы (сырая масса 0,9-1,0 г) на 7-е, 8-е и 9-е сут определяли методом иммуноферментного анализа (ИФА) с использованием специфичных кроличьих антител и меченных пероксидазой антикроличьих антител. Также осуществляли экстракцию и определяли содержание свободного пролина. Установлено, что имитирующие засуху концентрированные растворы сахарозы снижали энергию прорастания семян и ингибировали длину главного корня у 3-суточных проростков пшеницы обоих экотипов. Необходимо отметить, что ингибирование прорастания семян и торможение роста главного корня было выражено гораздо сильнее у сорта Зауральская Жемчужина. Почвенная засуха также подавляла рост 7-9-суточных проростков, причем опять же этот процесс был более выражен у растений сорта Зауральская Жемчужина. Выявлен дисбаланс фитогормонов у 7-9-суточных проростков обоих сортов, связанный с индуцированным засухой накоплением АБК, падением содержания ЦК и особенно ауксинов. Однако в проростках сорта Экада 70 амплитуда сдвигов в гормональном балансе, вызываемых засухой, оказалась заметно меньше в сравнении с растениями сорта Зауральская Жемчужина. Также обнаружено, что почвенная засуха приводила к повышению содержания аминокислоты пролина - важного осмопротектора, при этом более высокая концентрация пролина была характерна для 7-9-суточных проростков сорта Экада 70 как в норме, так и при стрессе. Совокупность полученных результатов свидетельствует о более высокой засухоустойчивости растений степного волжского экотипа в сравнении с представителями лесостепного западносибирского экотипа на начальном этапе онтогенеза, что может быть обусловлено меньшей амплитудой стресс-индуцированных сдвигов в содержании фитогормонов и повышенным содержанием осмопротектора пролина у растений степного волжского экотипа.
Triticum aestivum, пшеница, экотипы, засуха, гормональная система, пролин
Короткий адрес: https://sciup.org/142241610
IDR: 142241610 | УДК: 633.111.1:581.1:632.112 | DOI: 10.15389/agrobiology.2024.1.131rus
Текст научной статьи Анализ засухоустойчивости различающихся по стратегии адаптации к засухе растений пшеницы Triticum aestivum L. на начальном этапе онтогенеза
Исследование устойчивости к неблагоприятным факторам среды, вызывающим нарушение водного режима, — одна из центральных проблем современных наук о растениях. Как известно, засуха относится к наиболее распространенным стрессам, приводящим к нарушению всех звеньев метаболизма и существенной потере урожая у культурных растений, в том числе у пшеницы (1-3). Наиболее критичная фаза в развитии пшеницы — ранний этап онтогенеза. В этот период растения особенно чувствительны к действию неблагоприятных факторов и дефицит влаги вызывает снижение всхожести семян, ингибирование их прорастания и роста всходов, а также отставание культуры в развитии, что, в свою очередь, приводит к значительному снижению продуктивности (4, 5). В связи с этим особый интерес представляет исследование механизмов формирования засухоустойчивости на раннем этапе развития растений с целью выявления наиболее эффективных компонентов защиты при нарушении водного режима и управления ими (5-7).
В процессе естественного и искусственного отбора в зависимости от вида засухи сформировались две существенно различающиеся по стратегии адаптации группы пшеницы — лесостепной западносибирский и степной волжский экотипы (8-10). Растения западносибирского экотипа отличаются замедленной всхожестью и довольно длительной фазой кущения из-за характерной для регионов Западной Сибири весенней засухи. Обильные летние дожди, типичные для западносибирского климатического пояса, используются растениями этого экотипа для быстрого роста и развития. Для сортов степного волжского экотипа характерен интенсивный рост в начале вегетации, для чего используются весенние запасы влаги в почве, поэтому к моменту наступления летней засухи растения образуют разветвленную сеть корней, что способствует формированию хорошего урожая. То есть различия в адаптации к засухе у сортов пшеницы лесостепного западносибирского и степного волжского экотипов особенно ярко проявляются на ранней стадии развития растений. Поэтому представляет интерес изучение особенностей защитных механизмов таких экотипов при дефиците влаги на начальном этапе онтогенеза, что позволит продвинуться в понимании механизмов формирования у них засухоустойчивости.
В настоящей работе впервые выявлены индуцированные засухой изменения в гормональном балансе и содержании аминокислоты пролина у лесостепного западносибирского и степного волжского экотипов пшеницы на начальном этапе онтогенеза. Проростки степного волжского экотипа проявили более выраженную устойчивость к обезвоживанию в сравнении с растениями лесостепного западносибирского экотипа, что обусловлено существенно меньшими по амплитуде стресс-индуцированными перестройками в содержании фитогормонов и более высоким накоплением пролина.
Цель работы состояла в оценке физиолого-биохимических показателей растений пшеницы сортов Зауральская Жемчужина (лесостепной западносибирский экотип) и Экада 70 (степной волжский экотип) в начальную фазу их онтогенеза в норме и в условиях засухи.
Методика. В качестве объектов исследования использовали растения мягкой яровой пшеницы (Triticum aestivum L.) степного волжского (сорт Экада 70) и лесостепного западносибирского (сорт Зауральская Жемчужина) экотипов, предоставленные Чишминским селекционным центром Башкирского НИИ сельского хозяйства (Республика Башкортостан, р.п. Чишмы). Семена предварительно стерилизовали 96 % этанолом и использовали в двух сериях опытов.
В первой серии семена раскладывали по 15 шт. в чашки Петри на фильтровальную бумагу, смоченную 5 мл растворов концентрированной сахарозы (4 %, 8 % и 12 %), моделирующих засуху (11, 12). После этого чашки Петри помещали в термостат ТСО-1/80 СПУ (ОАО «Смоленское специальное конструкторско-технологическое бюро систем программного управления», Россия) и проращивали семена в темноте при 22 ° С в течение 3 сут. В качестве контроля использовали семена, пророщенные на дистиллированной воде. На 3-и сут рассчитывали энергию прорастания, которую определяли по соотношению (%) числа проросших семян к общему числу заложенных на проращивание. Проросшими считали семена, давшие корешок минимальной длины. У проросших семян измеряли длину главного корня (13).
Во второй серии проводили вегетационные опыты в контролируемых условиях. Семена высевали в вегетационные сосуды (25½25½25 см) объемом 15 л (по 30 растений на емкость, глубина посева — 4-5 см, расстояние между рядками — 2,5 см, расстояние между растениями в ряду — 2,5 см). В каждый вегетационный сосуд на дно помещали керамзит агротехнический (слой 2-3 см) (ООО «Терра Мастер», г. Красноярск). Сверху керамзита засыпали почвогрунт с оптимальным соотношением NPK (pH 6,5, влажность 65 %; ООО «Велторф», Россия). Растения выращивали в контролируемых условиях (температура 21-23 ° С, 16-часовой фотопериод, освещенность 360 мкмоль^м 2•с ' , влажность воздуха 60 %). Часть растений подвергали ранней почвенной засухе: при ее моделировании полив не проводили до достижения значения 30 % влажности от полной влагоемкости почвы (ПВП). В контроле поддерживали влажность 70 % от ПВП.
Физиолого-биохимические показатели оценивали на этапе всходов (возраст проростков 7-9 сут). Использовали периодизацию онтогенеза хлебных злаков в разработке Т.Б. Батыгиной (14). На 7-е, 8-е и 9-е сут измеряли сырую и сухую массу контрольных и подверженных действию почвенной засухи проростков. Эксперименты по оценке показателей роста проводили в трех биологических повторах, каждый вариант включал не менее 30 растений.
Содержание цитокининов (ЦК), индолилуксусной (ИУК) и абсцизовой (АБК) кислоты в 10 проростках пшеницы (сырая масса 0,9-1,0 г) на 7-е, 8-е и 9-е сут определяли методом иммуноферментного анализа (ИФА) с использованием специфичных кроличьих антител и меченных пероксидазой антикроличьих антител (15). Проростки гомогенизировали в 80 % этаноле в соотношении масса: объем 1:10 с последующим инкубированием образцов при 4 ° С в течение 16 ч. После центрифугирования при 10000 g в течение 20 мин (центрифуга Avanti J-E, «Beckman Coulter, Inc.», США) супернатант упаривали в токе воздуха до водного остатка, в аликвоте которого определяли суммарное содержание свободных цитокининов. Из оставшегося водного остатка ИУК и АБК экстрагировали серным эфиром, метилировали их диазометаном, после упаривания сухой остаток растворяли в 80 % этаноле, в аликвоте определяли количество ИУК и АБК. Процедура очистки и извлечения ИУК и АБК, а также последовательность этапов иммуноанализа фитогормонов описаны ранее (15).
Экстракцию и определение свободного пролина проводили согласно L.S. Bates с соавт. (16). Образцы растительного материала (2 г) заливали кипящей дистиллированной водой (2,5 мл) и охлаждали. К 2 мл холодной пробы приливали 2 мл нингидринового реактива и 2 мл ледяной уксусной кислоты, смесь кипятили в течение 1 ч и охлаждали. Интенсивность окрашивания комплекса пролина с нингидрином определяли при λ = 522 нм. Содержание пролина рассчитывали с помощью калибровочной кривой, для построения которой использовали химически чистый пролин («Sigma Aldrich», США).
На рисунках и в таблицах представлены средние арифметические значения ( M ) по трем независимым опытам, каждый из которых проведен в трех биологических повторностях, и их стандартные ошибки (±SEM). Полученные результаты обрабатывали статистически с помощью дисперсионного анализа ANOVA, используя SPSS 13.0 для Windows («SPSS, Inc.», США). Достоверность различии между средними оценивали с помощью LSD-теста при p ≤ 0,05.
Результаты. Засуха как один из наиболее распространенных в природе неблагоприятных абиотических факторов среды существенно снижает показатели функциональной активности клеток у растений пшеницы, особенно на ранних этапах развития (17-19). В этот период семена и молодые проростки наиболее чувствительны к нарушению водного режима.
В процессе естественного и искусственного отбора на территории России сформировались две существенно различающихся по стратегии адаптации к засухе экологические группы пшеницы — лесостепной западносибирский и степной волжский экотипы. Для регионов Западной Сибири характерна весенняя засуха, в связи с чем растения пшеницы лесостепного западносибирского экотипа отличаются замедленным ростом на начальном этапе онтогенеза. В юго-восточных районах европейской части России, в частности в Поволжье, засуха наблюдается позднее, и сорта степного волжского экотипа интенсивно растут в начале вегетации, чтобы максимально развить разветвленную сеть корней.
1. Энергия прорастания (%) семян пшеницы Triticum aestivum L. яровых сортов Экада 70 (степной волжский экотип) и Зауральская Жемчужина (лесостепной западносибирский экотип) на растворах сахарозы разной концентрации ( M ±SEM, лабораторный опыт)
|
Сорт |
Контроль |
Раствор сахарозы, % |
||
|
4 |
8 |
12 |
||
|
Экада 70 |
91,1±3,9Aa |
80,2±3,4Ab |
71,1±3,1Ac |
40,7±1,7Ad |
|
Зауральская Жемчужина |
85,3±3,7Aa |
72,4±3,2Bb |
60,8±2,7Bc |
20,5±0,9Bd |
|
Пр и м еч ани е. Проведены три опыта в трех повторностях |
по 15 семян в каждой. Разными буквами |
|||
|
обозначены статистически значимые различия между вариантами при p ≤ 0,05 (ANOVA, LSD-тест). Боль- |
||||
|
шими буквами обозначены различия в столбцах, |
маленькими — |
в строках. |
||
2. Длина главного корня (см) у 3-суточных проростков пшеницы Triticum aes-tivum L. яровых сортов Экада 70 (степной волжский экотип) и Зауральская Жемчужина (лесостепной западносибирский экотип) на растворах сахарозы разной концентрации ( M ±SEM, лабораторный опыт)
|
Сорт |
Контроль |
Раствор сахарозы, % |
||
|
4 |
□ 8 1 |
12 |
||
|
Экада 70 |
2,95±0,13Aa |
1,91±0,08Ab |
0,86±0,04Ac |
0,23±0,01Ad |
|
Зауральская Жемчужина |
2,44±0,11Ba |
1,26±0,06Bb |
0,49±0,02Bc |
0,05±0,002Bd |
Пр и м еч ани е. Проведены три опыта в трех повторностях (от 25 до 125 проростков в варианте). Разными буквами обозначены статистически значимые различия между вариантами при p ≤ 0,05 (ANOVA, LSD-тест). Большими буквами обозначены различия в столбцах, маленькими — в строках.
В первой серии наших экспериментов засухоустойчивость растений оценивалась по энергии прорастания семян (табл. 1) и длине главного корня 3-суточных проростков (табл. 2) в растворах сахарозы разной концентрации (4, 8 и 12 %), моделирующих засуху. Было установлено, что имитирующие засуху растворы сахарозы подавляли прорастание семян обоих экотипов пшеницы, причем энергия прорастания снижалась с увеличением концентрации сахарозы.
В работах других авторов показано, что на начальных этапах онтогенеза воздействие обезвоживания приводит к торможению прорастания семян и роста всходов, что в дальнейшем существенно снижает урожай пшеницы (20, 21). Необходимо отметить, что процент проросших семян свидетельствует о способности растений определенного сорта использовать труднодоступную влагу и указывает на его относительную засухоустойчивость. Так, семена сорта Экада 70 характеризовались более высоким показателем энергии прорастания на концентрированных растворах сахарозы в сравнении с семенами сорта Зауральская Жемчужина (см. табл. 1). Эти результаты подтверждают приведенные ранее данные о более высокой засухоустойчивости пшеницы степного волжского экотипа на ранних этапах онтогенеза (22).
В то же время в условиях обезвоживания происходило ингибирование роста главного корня у 3-суточных проростков пшеницы обоих экотипов (см. табл. 2). Однако на растворах сахарозы у растений сорта Экада 70 — представителя степного волжского экотипа рост главного корня тормозился существенно меньше, чем у проростков сорта Зауральская Жемчужина.
Время после прорастания, сут
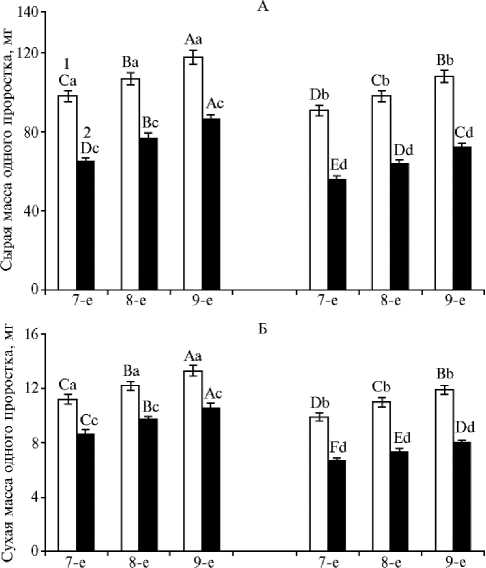
Рис. 1. Сырая (А) и сухая (Б) масса 7-9-суточных проростков пшеницы Triticum aestivum L. яровых сортов Экада 70 (слева) и Зауральская Жемчужина (справа) в условиях моделируемой почвенной засухи: 1 — контроль, 2 — опыт ( M ±SEM, вегетационный опыт). Проведены три опыта в трех повторностях, в каждой по 30 проростков. Разными строчными буквами обозначены статистически значимые различия между вариантами опыта в одно и то же время при р ≤ 0,05 (ANOVA, LSD-тест). Разными прописными буквами обозначены статистически значимые различия между показателями в варианте опыта для проростков разного возраста при р ≤ 0,05 (ANOVA, LSD-тест).
В лабораторных экспериментах можно получить представление лишь о потенциальной засухоустойчивости растений. Вместе с тем практическое значение имеют данные о поведении сортов в полевых или приближенных к ним условиях. В связи с этим мы изучили воздействие почвенной засухи, которую моделировали отсутствием полива, на ростовые процессы у проростков разных экотипов пшеницы в вегетационном опыте. Установлено, что растения сорта Экада 70 в контроле характеризовались повышенной массой проростков на протяжении всего опыта относительно менее устойчивого к засухе сорта западносибирской селекции (рис. 1).
Условия почвенной засухи привели к заметному торможению показателей роста у проростков обоих сортов, но у сорта Зауральская Жемчужина оно было более выражено (см. рис. 1). Можно констатировать, что разные по стратегии адаптации к засухе экотипы пшеницы различаются по устойчивости к дефициту влаги на начальном этапе развития: растения степного волжского экотипа более засухоустойчивы в сравнении с представителями лесостепного западносибирского экотипа. Изменения, которые мы наблюдали у исследуемых экотипов, обусловлены генетическими и эколого-физиологическими факторами (9, 10).
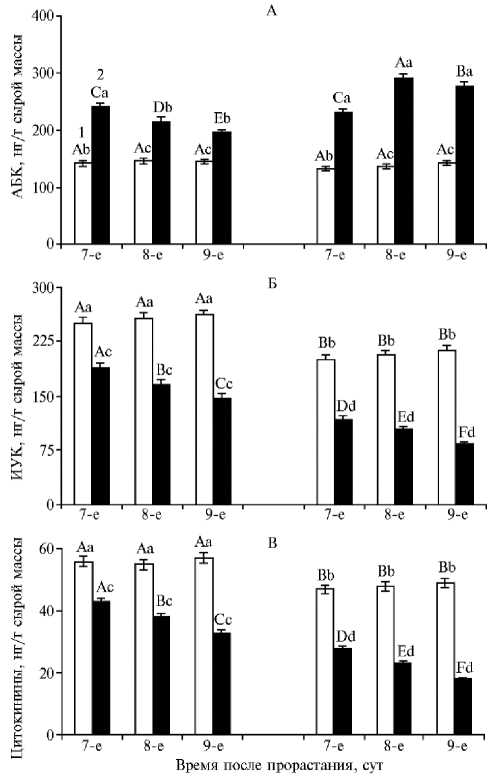
Рис. 2. Содержание абсцизовой (А), индолилуксусной кислоты (Б) и цитокининов (В) у 7-9-суточных проростков пшеницы Triticum aestivum L. яровых сортов Экада 70 (слева) и Зауральская Жемчужина (справа) в условиях моделируемой почвенной засухи: 1 — контроль, 2 — опыт (M±SEM, вегетационный опыт). Проведены три опыта в трех повторностях, в каждой по 10 проростков. Разными строчными буквами обозначены статистически значимые различия между вариантами опыта для проростков одного и того же возраста при р ≤ 0,05 (ANOVA, LSD-тест). Разными прописными буквами обозначены статистически значимые различия между показателями в варианте опыта для проростков разного возраста при р ≤ 0,05 (ANOVA, LSD-тест).
Ключевая роль в регуляции роста и развития растений отводится гормональной системе (23-25), в связи с чем важно было проследить изменения в ее состоянии у сравниваемых сортов пшеницы в условиях почвенной засухи (рис. 2). Согласно полученным результатам, контрольные растения устойчивого сорта Экада 70 характеризовались заметно большим содержанием ауксина и цитокининов по сравнению с сортом Зауральская Жемчужина, при этом концентрация АБК у обоих сортов оказалась практически одинаковой. Ранее во многих исследованиях был выявлен ярко выраженный ростостимулирующий эффект ИУК и ЦК (15, 17), вероятно, поэтому у растений сорта Экада 70 параметры, описывающие скорость роста, были выше в сравнении с проростками сорта Зауральская Жемчужина (см. рис. 1). Вместе с тем хорошо известно, что в неблагоприятных условиях, в частности при нарушении водного режима, происходят существенные перестройки в гормональном балансе растений, характеризующиеся резким повышением концентрации гормона стресса — абсцизовой кислоты и снижением количества ростостимулирующих гормонов ауксинов и цитокининов (17, 23, 26).
Действительно, можно видеть (см. рис. 2), что выращивание пшеницы в условиях моделируемой почвенной засухи также привело к изменениям в гормональном статусе проростков у обоих изученных сортов. Происходило накопление АБК и заметное снижение концентрации ИУК и ЦК, однако исследуемые сорта различались по этим показателям.
Так, у засухоустойчивого сорта Экада 70 максимальное 2-кратное накопление АБК в проростках наблюдалось только на 7-е сут, после чего количество АБК постепенно снижалось. У сорта Зауральская Жемчужина более чем 2-кратное стресс-индуцированное накопление АБК в проростках поддерживалось до конца опыта. Воздействие почвенной засухи привело к поступательному уменьшению концентрации ИУК и цитокининов в проростках у обоих сортов, но в растениях сорта Зауральская Жемчужина к концу опыта (9-е сут) содержание ИУК и цитокининов оказалось почти в 2,5 раза ниже контрольных значений (см. рис. 2). То есть при нарушении водного режима в растениях сорта Зауральская Жемчужина наблюдался резкий дисбаланс фитогормонов, что привело к выраженному торможению роста. В то же время растения сорта Экада 70 проявили устойчивость к дефициту влаги, что было обусловлено существенно меньшими по амплитуде стресс-индуцированными перестройками в состоянии гормональной системы.
В связи с тем, что дефицит влаги вызывает не только нарушение водного режима, но и осмотический стресс, мы проанализировали изменение количества аминокислоты пролина как одного из эффективных осмопротекторов в проростках пшеницы двух сортов (рис. 3). Контрольные варианты характеризовались относительно стабильным содержанием пролина на протяжении всего опыта, хотя корни растений сорта Зауральская Жемчужина отличались несколько меньшей величиной этого показателя (см. рис. 3). У обоих сортов в проростках при почвенной засухе наблюдалось существенное поступательное накопление пролина в сравнении с контролем (см. рис. 3), что указывает на участие этой аминокислоты в защите растений от обезвоживания. Так, у сорта Экада 70 в стрессированных проростках к 9-м сут опыта содержание пролина возросло более чем втрое по сравнению с контрольными значениями. У сорта Зауральская Жемчужина также наблюдалось стресс-индуцированное накопление пролина в проростках в течение опыта, но абсолютные значения этого показателя уступали таковым у сорта Экада 70 (см. рис. 3).
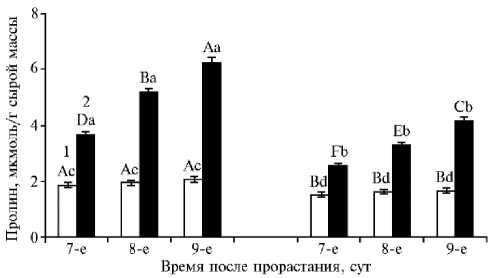
Рис. 3. Содержание пролина у 7-9-суточных проростков пшеницы Triticum aestivum L. яровых сортов Экада 70 (слева) и Зауральская Жемчужина (справа) в условиях моделируемой почвенной засухи: 1 — контроль, 2 — опыт ( M ±SEM, вегетационный опыт). Проведены три опыта в трех повторностях, в каждой по 20 проростков. Разными строчными буквами обозначены статистически значимые различия между вариантами опыта для проростков одного и того же возраста при р ≤ 0,05 (ANOVA, LSD-тест). Разными прописными буквами обозначены статистически значимые различия между показателями в варианте опыта для проростков разного возраста при р ≤ 0,05 (ANOVA, LSD-тест).
Как известно, засуха вызывает снижение осмотического потенциала растений, чем индуцируется накопление одного из ключевых осмолитов — пролина (27, 28). Во многих работах было показано, что увеличение содержания пролина сопровождалось повышением стресс-устойчивости растений (29, 30). Более того, накопление пролина способствует снижению содержания активных форм кислорода и значительно уменьшает повреждение мембран, вызванное воздействием неблагоприятных факторов, в том числе засухи (31). Наблюдается положительная корреляция между повышенным уровнем пролина и устойчивостью растений к экстремальным условиям. Мы установили, что в норме у устойчивого к засухе сорта Экада 70 в проростках содержалось в среднем на 25-30 % больше этого осмопротектора, чем у сорта Зауральская Жемчужина (см. рис. 3). В условиях моделируемой почвенной засухи у обоих сортов происходило поступательное накопление пролина в проростках, хотя у засухоустойчивого сорта Экада 70 оно во все сроки наблюдения было более чем в 1,5 раза выше, чем у сорта Зауральская Жемчужина, что, вероятно, способствует проявлению большей устойчивости степного волжского экотипа к засухе на начальном этапе онтогенеза.
Таким образом, полученные нами результаты свидетельствуют о различии в устойчивости к дефициту влаги у сортов Зауральская Жемчужина (лесостепной западносибирский экотип) и Экада 70 (степной волжский экотип) на начальном этапе развития растений. В условиях засухи у сорта Экада 70 энергия прорастания семян и показатели роста проростков были выше, то есть этот сорт проявлял большую засухоустойчивость в сравнении с сортом Зауральская Жемчужина. Различия в засухоустойчивости экотипов могут быть обусловлены неодинаковой реакцией гормональной системы на дефицит влаги. Растения сорта Зауральская Жемчужина характеризовались гораздо большими по амплитуде стресс-индуцированными изменениями в гормональном балансе, что привело к более выраженному торможению их роста. Значительный вклад в формирование лучшей засухоустойчивости 138
сорта Экада 70 вносит его способность индуцировать существенное накопление аминокислоты пролина — важного компонента защитной системы растений.
Список литературы Анализ засухоустойчивости различающихся по стратегии адаптации к засухе растений пшеницы Triticum aestivum L. на начальном этапе онтогенеза
- Razi K., Muneer S. Drought stress-induced physiological mechanisms, signaling pathways and molecular response of chloroplasts in common vegetable crops. Critical Reviews in Biotechnology, 2021, 41(5): 669-691 (doi: 10.1080/07388551.2021.1874280).
- Allagulova C.R., Lubyanova A.R., Avalbaev A.M. Multiple ways of nitric oxide production in plants and its functional activity under abiotic stress conditions. International Journal of Molecular Sciences, 2023, 24(14): 11637 (doi: 10.3390/ijms241411637).
- Riedesel L., Möller M., Horney P., Golla B., Piepho H.P., Kautz T., Feike T. Timing and intensity of heat and drought stress determine wheat yield losses in Germany. PLoS One, 2023, 18(7): e0288202 (doi: 10.1371/journal.pone.0288202).
- Stallmann J., Schweiger R., Müller C. Effects of continuous versus pulsed drought stress on phys-iology and growth of wheat. Plant Biology, 2018, 20(6): 1005-1013 (doi: 10.1111/plb.12883).
- Dietz K.J., Zörb C., Geilfus C.M. Drought and crop yield. Plant Biology, 2021, 23(6): 881-893 (doi: 10.1111/plb.13304).
- Fang Y., Xiong L. General mechanisms of drought response and their application in drought resistance improvement in plants. Cellular and Molecular Life Sciences, 2015, 72(4): 673-689 (doi: 10.1007/s00018-014-1767-0).
- González E.M. Drought stress tolerance in plants. International Journal of Molecular Sciences, 2023, 24(7): 6562 (doi: 10.3390/ijms24076562).
- Пшеница в СССР /Под ред. П.М. Жуковского. М., 1957.
- Цыганков В.И. Создание адаптивных сортов яровой пшеницы для условий сухостепных зон Казахстана. Известия Оренбургского государственного аграрного университета, 2011, 2(30): 46-50.
- Мухитов Л.А., Самуилов Ф.Д. Величина подколосового междоузлия и продуктивность сортов яровой мягкой пшеницы разных экологических групп в лесостепи Оренбургского Предуралья. Вестник Казанского государственного аграрного университета, 2014, 9(3): 135-138.
- Лиховидова В.А., Казакова А.С., Самофалова Н.Е. Влияние водного и температурного стрес-сов на всхожесть семян сортов твердой озимой пшеницы, полученных в контрастные по погодным условиям годы. Зерновое хозяйство России, 2019, 5(65): 34-39 (doi: 10.31367/2079-8725-2019-65-5-34-39).
- Шарафутдинов М.Х., Решетняк В.В., Валидов Ш.З., Сафин Р.И. Оценка влияния различ-ных факторов на разнокачественность семян яровой пшеницы. Вестник Казанского ГАУ, 2017, 2(44): 64-70 (doi: 10.12737/article_59ad0f0dcd2023.63206986).
- Lastochkina O., Yakupova A., Avtushenko I., Lastochkin A., Yuldashev R. Effect of seed priming with endophytic Bacillus subtilis on some physio-biochemical parameters of two wheat varieties exposed to drought after selective herbicide application. Plants, 2023, 12: 1724 (doi: 10.3390/plants12081724).
- Батыгина Т.Б. Хлебное зерно: атлас. Л., 1987.
- Shakirova F.M., Sakhabutdinova A.R., Bezrukova M.V., Fatkhutdinova R.A., Fatkhutdi-nova D.R. Changes in the hormonal status of wheat seedlings induced by salicylic acid and salin-ity. Plant Science, 2003, 164(3): 317-322 (doi: 10.1016/S0168-9452(02)00415-6).
- Bates L.S., Waldran R.P., Teare I.D. Rapid determination of free proline for water stress studies. Plant and Soil, 1973, 39: 205-207 (doi: 10.1007/BF00018060).
- Peleg Z., Reguera M., Tumimbang E., Walia H., Blumwald E. Cytokinin-mediated source/sink modifications improve drought tolerance and increase grain yield in rice under water-stress. Plant Biotechnology Journal, 2011, 9(7): 747-758 (doi: 10.1111/j.1467-7652.2010.00584.x).
- Hura T., Hura K., Ostrowska A. Drought-stress induced physiological and molecular changes in plants. International Journal of Molecular Sciences, 2022, 23(9): 4698 (doi: 10.3390/ijms23094698).
- Liu X., Quan W., Bartels D. Stress memory responses and seed priming correlate with drought tolerance in plants: an overview. Planta, 2022, 255(2): 45 (doi: 10.1007/s00425-022-03828-z).
- Guo Q., Wang Y., Zhang H., Qu G., Wang T., Sun Q., Liang D. Alleviation of adverse effects of drought stress on wheat seed germination using atmospheric dielectric barrier discharge plasma treatment. Scientific Reports, 2017, 7(1): 16680 (doi: 10.1038/s41598-017-16944-8).
- Kong H., Meng X., Akram N.A., Zhu F., Hu J., Zhang Z. Seed priming with fullerol improves seed germination, seedling growth and antioxidant enzyme system of two winter wheat cultivars under drought stress. Plants, 2023, 12(6): 1417 (doi: 10.3390/plants12061417).
- Мухитов Л.А., Самуилов Ф.Д. Засухоустойчивость разных экотипов яровой мягкой пше-ницы в лесостепи Оренбургского Предуралья. Вестник Казанского государственного аграр-ного университета, 2007, 2(1): 57-59.
- Shakirova F., Allagulova Ch., Maslennikova D., Fedorova K., Yuldashev R., Lubyanova A., Bezrukova M., Avalbaev A. Involvement of dehydrins in 24-epibrassinolide-induced protection of wheat plants against drought stress. Plant Physiology and Biochemistry, 2016, 108: 539-548 (doi: 10.1016/j.plaphy.2016.07.013).
- Andrade A., Boero A., Escalante M., Llanes A., Arbona V., Gómez-Cádenas A., Alemano S. Comparative hormonal and metabolic profile analysis based on mass spectrometry provides infor-mation on the regulation of water-deficit stress response of sunflower (Helianthus annuus L.) inbred lines with different water-deficit stress sensitivity. Plant Physiology and Biochemistry, 2021, 168: 432-446 (doi: 10.1016/j.plaphy.2021.10.015).
- Waadt R., Seller C.A., Hsu P.-K., Takahashi Y., Munemasa S., Schroeder J.I. Plant hormone regulation of abiotic stress responses. Nature Reviews Molecular Cell Biology, 2022, 23: 680-694 (doi: 10.1038/s41580-022-00479-6).
- Llanes A., Andrade A., Alemano S., Luna V. Alterations of endogenous hormonal levels in plants under drought and salinity. American Journal of Plant Sciences, 2016, 7(9): 1357-1371 (doi: 10.4236/ajps.2016.79129).
- Ozturk M., Turkyilmaz Unal B., García-Caparrós P., Khursheed A., Gul A., Hasanuzzaman M. Osmoregulation and its actions during the drought stress in plants. Physiologia Plantarum, 2021, 172(2): 1321-1335 (doi: 10.1111/ppl.13297).
- Du L., Huang X., Ding L., Wang Z., Tang D., Chen B., Ao L., Liu Y., Kang Z., Mao H. TaERF87 and TaAKS1 synergistically regulate TaP5CS1/TaP5CR1-mediated proline biosynthesis to enhance drought tolerance in wheat. New Phytologyst, 2023, 237(1): 232-250 (doi: 10.1111/nph.18549).
- Bhagyawant S.S., Narvekar D.T., Gupta N., Bhadkaria A., Koul K.K., Srivastava N. Variations in the antioxidant and free radical scavenging under induced heavy metal stress expressed as proline content in chickpea. Physiology and Molecular Biology of Plants, 2019, 25: 683-696 (doi: 10.1007/s12298-019-00667-3).
- Avalbaev A., Allagulova Ch., Maslennikova D., Fedorova K., Shakirova F. Methyl jasmonate and cytokinin mitigate the salinity-induced oxidative injury in wheat seedlings. Journal of Plant Growth Regulation, 2021, 40: 1741-1752 (doi: 10.1007/s00344-020-10221-1).
- Wani A.S., Ahmad A., Hayat S., Tahir I. Epibrassinolide and proline alleviate the photosynthetic and yield inhibition under salt stress by acting on antioxidant system in mustard. Plant Physiology and Biochemistry, 2019, 135: 385-394 (doi: 10.1016/j.plaphy.2019.01.002).


