Анатомические и гемодинамические изменения в сосудистом русле пуповины в интранатальный период
Автор: Клявлина М.Ю., Нигматуллин Р.Т., Рыбалко Д.Ю., Масленников А.В., Касаткин А.А., Воронцова Н.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Анатомия и антропология
Статья в выпуске: 1 т.21, 2025 года.
Бесплатный доступ
Цель: анализ анатомических и гемодинамических трансформаций в сосудистом русле пуповины в период родовой деятельности путем компьютерного моделирования физиологических процессов и связанного с этим изменением градиента внешнего давления. Материал и методы. Первый этап настоящей работы включал трехмерное моделирование в программе Ansys Fluent 2021 одиночной прямой пупочной артерии на фоне воздействия на нее внешнего давления, равного 120 мм рт. ст. Второй этап заключался в 3D-моделировании органокомплекса пупочных сосудов, окруженных эмбриональной слизистой соединительной тканью при аналогичном внешнем давлении.
Сосуды пуповины, эмбриональная слизистая соединительная ткань, трехмерное моделирование, интранатальный период
Короткий адрес: https://sciup.org/149148682
IDR: 149148682 | УДК: 611.08 | DOI: 10.15275/ssmj2101094
Текст научной статьи Анатомические и гемодинамические изменения в сосудистом русле пуповины в интранатальный период
EDN: WNMKVU
-
1 Введение. Пуповина закладывается на ранних стадиях эмбрионального периода и является жизненно важной морфофункциональной структурой на протяжении всего внутриутробного развития [1]. Она является единственным связывающим звеном между матерью и плодом [2]. Строение органного сосудистого русла пуповины в значительной степени определяет возможность гармоничного развития плода и влияет на перинатальный исход [1]. Нарушение фетоплацентарного кровотока — важный предиктор неблагоприятных исходов для детей первого года жизни, позволяющим прогнозировать у них проблемы физического и психомоторного развития [3]. Хроническая фетоплацентарная недостаточность (ХФПН) становится наиболее частой причиной антенатальной гибели плода, внутриутробной гипоксии и недостаточного роста. В литературе также имеются данные о нарушениях в иммунной системе у матери и плода при ХФПН [4]. Помимо периода внутриутробного развития, плоду необходимо пройти этап родовой деятельности, адаптироваться к воздействию внутриматочного давления, которое возникает в результате сокращения матки при взаимодействии гормональных и механических факторов [2]. В настоящее время актуальной проблемой для клинической практики является оценка влияния родовой деятельности и возрастающего при этом фактора внешнего давления на анатомические и гемодинамические параметры в сосудах пуповины. В связи с развитием новых компьютерных технологий, внедрением цифровизации в медицинскую практику, одним из адекватных методов решения указанной проблемы может служить 3D-моделирование пуповины и ее сосудов [5].
Цель — анализ анатомических и гемодинамических трансформаций в сосудистом русле пуповины в период родовой деятельности путем компьютерного моделирования физиологических процессов и связанного с этим изменением градиента внешнего давления.
Материал и методы. Забор биологического материала производили в условиях ГБУЗ РБ «Городской клинический перинатальный центр» г. Уфы с письменного согласия пациенток. Локальный этический комитет ФГБОУ ВО БГМУ Минздрава России от 23.10.2024 заключил, что проводимое научное исследование соответствует общепринятым нормам морали, требованиям соблюдения прав, интересов и личного достоинства, принимающих участие в исследовании согласно «ГОСТ Р 52379–2005. Надлежащая клиническая практика». Отбирались пуповины с классическим анатомическим строением по количеству сосудов, а именно имеющие две артерии и вену. Клиническими критериями включения в исследование со стороны матери выступило отсутствие тяжелой соматической патологии, осложнений беременности (преэклампсии, гестационного сахарного диабета) и инфекционных заболеваний. В отношении плода были применены условия доношенного гестационного возраста и оценка новорожденного неонатологом на 7/8 баллов по шкале Апгар. Забор пуповины для исследования производили сразу после ее пересечения.
В настоящей статье для выполнения морфологического исследования, изготовления коррозионных препаратов сосудов пуповины и подготовки базы
для программного обеспечения Ansys Fluent 2021 использован и обработан материал 20 пуповин.
Сосуды пупочного канатика промывали под проточной водой для предотвращения образования тромботических масс. Транспортировку биоматериала производили в физиологическом растворе натрия хлорида в течение 12 ч с момента забора. Дальнейший этап исследования проводили на кафедре анатомии человека ФГБОУ ВО БГМУ Минздрава России. В ходе работы отобранную пуповину с помощью скальпеля разделяли на три равных сегмента (проксимальный, срединный и дистальный). Проксимальный сегмент (представлен на рис. 1, а ) использовали для создания коррозионного препарата. Заливку сосудов производили зуботехническим материалом «Белакрил» — М ХО путем нагнетания смеси с помощью шприца и канюли до наполнения, с дальнейшим растворением органических тканей в растворе гидроксида калия. Данная методика является авторской и защищена патентом (Д. В. Шадуро, В. С. Пикалюк «Способ изготовления анатомических коррозионных препаратов») [6].
Создание 3D-моделей проводилось на базе лаборатории аддитивных технологий ФГБОУ ВО «Башкирского государственного медицинского университета» Минздрава России. Для построения 3D-моделей сосудов пуповины использовали проксимальный сегмент длиной 10 см. Данный размер был выбран с учетом размерных технических ограничений стационарного 3D-сканера RangeVision Spectrum российского производства и поворотного стола. Обработку данных проводили в программе ScanCenter NG 2022. Для дальнейшей работы с 3D-моделями использовали профессиональное открытое программное обеспечение Blender 4.2.
Трехмерное моделирование кровотока в пупочных сосудах на фоне воздействия внешнего давления проводили в универсальной программе анализа методом конечных элементов Ansys Fluent 2021 на базе ФГБОУ ВО «Уфимский университет науки и технологий». При этом использовали пакеты гидродинамического и прочностного анализа Fluid Flow (Fluent) и Transient Structural.
Первым этапом исследования было моделирование единичной прямолинейной артерии, изолированной от других структур пуповины, на основе реальной артерии в формате STL.
Для более точного приближения компьютерной модели к биологическому материалу в программу Ansys заданы дополнительные параметры: модуль Юнга (модуль продольной упругости), уравнение модуля объемной упругости, в котором ключевую роль играет коэффициент Пуасона. Эти параметры характеризуют упругие свойства и отражают эластичность стенки сосуда [7].
Деформацию стенки при внешнем давлении рассчитывали по формулам, встроенным в Ansys Mechanical. Проанализировав литературные источники, мы пришли к выводу о том, что оптимальный уровень оказываемого внешнего давления в нашем исследовании — 120 мм рт. ст., он отражает среднее давление во время родовой деятельности в активную фазу родов. Средняя скорость кровотока задана из полученных нами при ультразвуковом исследовании показателей. Для работы в программе Ansys данные автоматически преобразованы. Средняя скорость кровотока в артерии составила 0,3 м/с, в вене — 0,1 м/с.
Динамическую вязкость крови высчитывали исходя из эмпирического закона Карро — Яшида. Это одна из распространенных неньютоновских моделей крови, которая используется для описания артериального кровотока.
При проведении исследования выбрано ламинарное течение крови, так как кровь в большей части сосудов организма течет в данном режиме, в том числе в сосудах пуповины [8].
Вторым этапом исследования выступило 3D-моделирование комплекса пупочных сосудов, окруженных эмбриональной слизистой соединительной тканью (ЭССТ), в программе Ansys Fluent 2021; 3D-моделирование комплекса пупочных сосудов, окруженных ЭССТ, происходило на основании реальной пуповины в формате STL.
Модуль Юнга приравнен к 1,08 мПа, а коэффициент Пуассона, задействованный в уравнении, приравниваем к 0,49, стенки сосудов в таком случае будут эластичными, и представленные данные не внесут больших погрешностей в расчеты [9].
Известно, что плотность крови составляет примерно 1060 кг/м3 [10]. Вязкость измеряем в кг/(м*с). Задаем свойство Carreau (Карро), вычисляемое по формуле. Временную константу приравниваем к 3,313 с, индекс степени закона — к 0,3568, вязкость при нулевой деформации — к 0,056 кг/(м^с), а вязкость при бесконечной деформации — к 0,0035 кг/(м^с). Методом расчета выбирается Shear Rate Dependent — зависимая от скорости деформации. Интраваскулярное давление было выбрано из литературных источников и составило 88 мм рт. ст. для артерий и 41 мм рт. ст. — для вен [11].
Параметры, задаваемые в программу Ansys для ЭССТ: 4 кПа для модуля Юнга, коэффициент Пуассона — 0,47, а плотность — 1,63 г/см3 [12].
Оказываемое внешнее давление составляет также 120 мм рт. ст. Далее производится расчет интраваскулярных гемодинамических изменений в программе Ansys Fluent 2021 и анализ изменения анатомии пуповины и ее сосудов на фоне воздействия внешнего давления.
Статистическую обработку данных проводили в программе Statistica 10. Данные представлены в абсолютных и относительных числах (%). Значимость различий оценивали по критерию Уилкоксона. Критический уровень значимости — р <0,05.
Результаты. Разработку трехмерной модели пуповины и ее сосудов начинали с ее представления в программе Ansys Fluent 2021 в виде трехмерной сетки (меш). На рис. 1 а продемонстрирован отобранный биологический материал пуповины, который не имеет извитости. Данный вариант анатомии пупочных артерий не является патологическим и получен нами в результате физиологических неосложненных родов. На рис. 1 б представлена фотография коррозионного препарата, созданного из вышеописанной пуповины. Розовым цветом окрашены две пупочные артерии, сине-коричневым — вена. На рис. 1 в изображен меш одной прямолинейной пупочной артерии в интерфейсе программы Ansys Fluent 2021.
Толщина стенки сосудов, внутренний диаметр артерий и вены взяты из собственных данных морфометрического исследования, проведенного нами на биологическом материале с помощью программы ImageJ. Внутренний диаметр вены составил 4,4 мм, внутренний диаметр артерий 2,7 мм. Толщина стенок пупочных сосудов 0,3 и 0,5 мм соответственно.
В результате компьютерных вычислений с помощью программы Ansys Fluent 2021 нами получено, что в прямолинейной артерии при воздействии на нее внешнего давления (120 мм рт. ст.) скорость
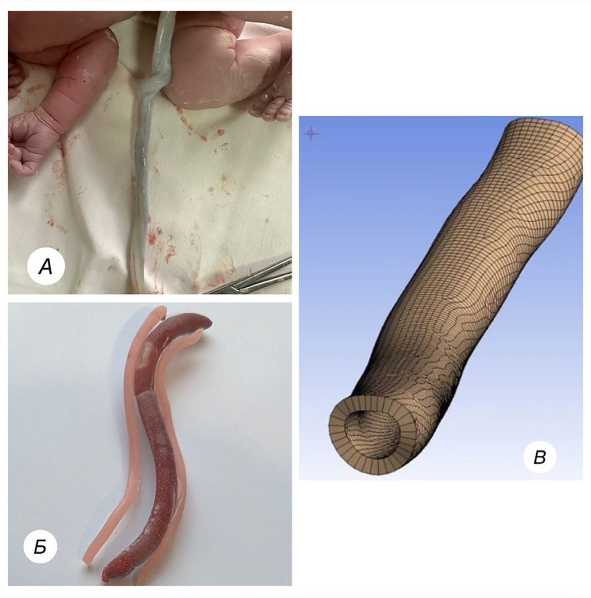
Рис. 1. Прямолинейная пупочная артерия:
а — проксимальный сегмент прямолинейной пупочной артерии на биологическом препарате; б — коррозионный препарат упомянутой пупочной артерии; в — пупочная артерия в интерфейсе программы Ansys Fluent 2021
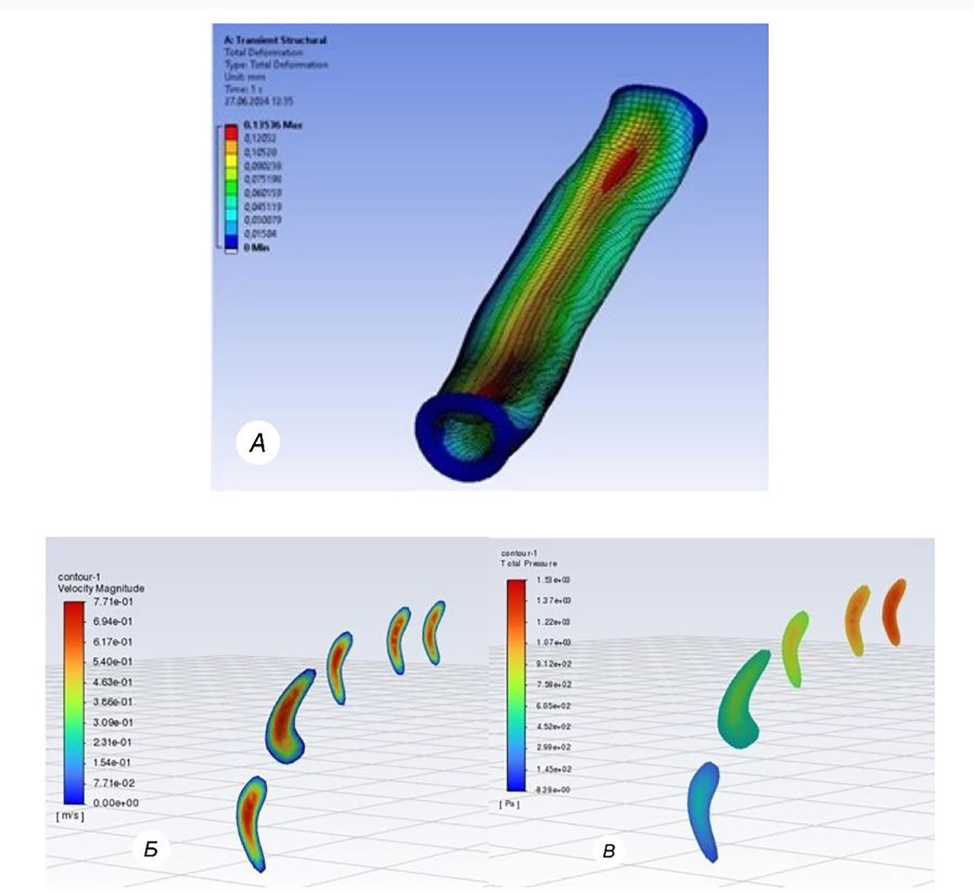
Рис. 2. Прямолинейная пупочная артерия под воздействием внешнего давления:
а — пупочная артерия под воздействием внешнего давления в продольном сечении; б — поперечное сечение пупочной артерии с изменением интраваскулярной скорости кровотока на фоне воздействия внешнего давления; в — поперечное сечение пупочной артерии с изменением интраваскулярного давления на фоне воздействия внешнего давления
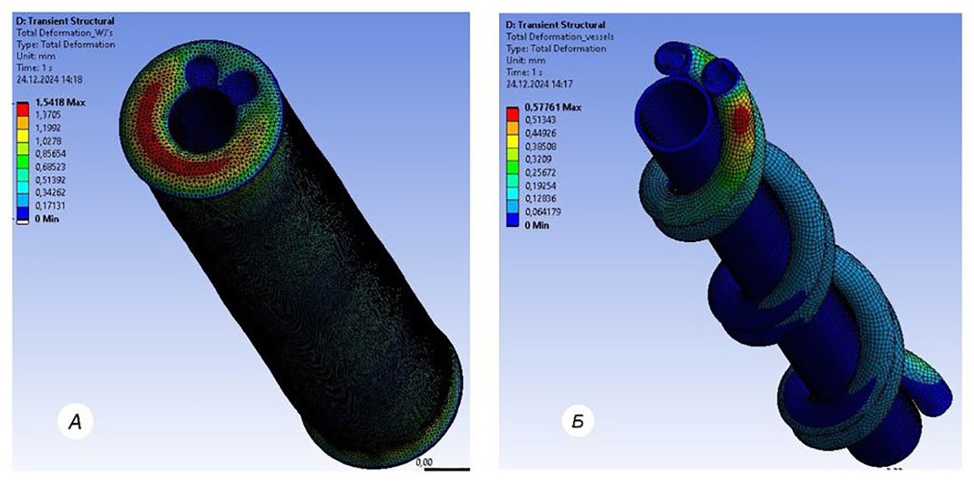
Рис. 3. Меш пуповины в интерфейсе программы Ansys Fluent 2021:
а — меш, имеющий две спиралевидные артерии, вену, эмбриональную слизистую соединительную ткань; б — иллюстрация хода пупочных правозакрученных пупочных артерий, находящихся внутри эмбриональной слизистой соединительной ткани
кровотока возрастает на 85,5% и составляет 0,56 м/с. Интраваскулярное давление при этом увеличилось на 38,5%, с 88 мм рт. ст. возросло до 122 мм рт. ст.
Что касается анатомических характеристик, стенки артериального сосуда деформируются, вследствие чего сужается его просвет во фронтальной или сагиттальной плоскостях в зависимости от направления вектора внешнего давления. На рис. 2а продемонстрировано изменение продольной конфигурации пупочной артерии под воздействием экстернальной силы. На рис. 2б показано изменение просвета сосуда в поперечном сечении с изменением интраваскулярной скорости кровотока. На рис. 2в изображено изменение просвета пупочной артерии в поперечном сечении с изменением интраваскулярного давления.
На рис. 3 представлен II этап исследования, в ходе которого нами смоделирован кровоток в сосудистом русле целостной пуповины. На рис. 3а показан меш двух артерий, вены и ЭССТ, построенный в программе Ansys Fluent 2021. На рис. 3б продемонстрирован спиралевидный правозакрученный ход артерий внутри ЭССТ с шагом 0,28 витков/см. Заданные в компьютерную программу физиологические параметры описаны в разделе «Материал и методы».
В результате трехмерного компьютерного моделирования в программе Ansys Fluent 2021 нами показано, что при воздействии внешнего давления на сосуды пуповины, окруженные ЭССТ, морфофункциональные изменения проявляются в значительно меньшей степени. Так, скорость кровотока в спиралевидных пупочных артериях увеличилась на 20% и составила 0,36 м/с, интраваскулярное давление возросло на 8% (95 мм рт. ст.). В пупочной вене скорость кровотока возросла на 24% (0,12 м/с), интраваскулярное давление на 10% (44 мм рт. ст.), что несколько выше, чем у пупочных артерий. Можем предположить, что это связано с менее эластичной сосудистой стенкой и линейной структурой пупочной вены.
По критерию Уилкоксона гемодинамические изменения в сосудистом русле пуповины на фоне воздействия внешнего давления статистически значимы ( р <0,05).
В трехмерной модели без воздействия внешнего давления площадь поперечного сечения пуповины составила 1,9 см². Площадь поперечного сечения артерий, вены и ЭССТ 0,12; 0,15 см и 1,48 см² соответственно.
Площадь поперечного сечения пуповины, ЭССТ, пупочных артерий и вены не претерпевала изменений, несмотря на внешнюю деформацию пуповины, сосудистой стенки и изменения просвета сосудов во фронтальной или сагиттальной плоскостях в зависимости от направления вектора внешнего давления.
Обсуждение. Проведенное нами исследование показало, что динамические изменения сосудистой циркуляции не всегда согласуются с классическими законами гидродинамики. По закону Бернулли в точках, где скорость флюида увеличивается, его давление уменьшается, и наоборот [13]. В нашем исследовании при воздействии внешнего давления, предположительно внутриматочного, отмечается увеличение и скорости кровотока, и интраваскулярного давления. По-видимому, это связано с тем, что система кровообращения является морфологически и функционально сложной. На давление и скорость кровотока влияет множество факторов, таких как сосудистое сопротивление, объем крови, состояние сердечно-сосудистой системы, нейроэндокринные процессы. При этом спиральная структура артерий пуповины помогает сохранять более стабильный кровоток и адаптирует гемодинамику к внешним изменениям. В нашем исследовании сделана попытка воссоздать близкую к биологическому состоянию 3D-модель сосудов пуповины, учесть, насколько это возможно, физические и анатомо-функциональные особенности пуповины, поэтому считаем возможным утверждать, что при изменении внешнего давления внутри пупочных сосудов возрастает и давление, и скорость кровотока. В литературе имеются данные о том, что на повышение интраваскулярного давления влияет увеличение количества витков пуповины [14]. При этом спиральная структура пуповины обеспечивает некоторую защиту сосудов от сдавливания и изменений условий кровотока, способствует минимизации нарушений напряжения сдвига сосудистой стенки [15, 16]. Наличие спиральности сосудов ослабляет экстремальное давление в артериальном цикле [17].
Уместно также отметить, что фактор извилистости артериальных сосудов пуповины не является уникальным в природе. Так, экспериментальные и клинические исследования коллатерального кровообращения позволили выявить феномен извилистости формирующихся путей окольного кровотока при окклюзии магистральной гемоциркуляции. В частности, В. Н. Тонков, изучая динамику формирования коллатералей в различных частях тела, описал спиралевидный ход сосудов как функциональный фактор адаптации к различным условиям циркуляции крови [см. подробнее: 18]. Таким образом, спиральный тип ориентации сосудов может способствовать адекватному перераспределению крови, что особенно важно в динамично меняющихся условиях кровотока.
В результате нашего исследования подтверждается важная защитная роль ЭССТ, так как при внешнем воздействии давления на изолированный сосуд наблюдалась его деформация, сужение просвета и изменение параметров гемодинамики в большей степени, чем при воздействии через ЭССТ.
ЭССТ плотно окружает сосуды пуповины [1]. Он представляет губчатую структуру с порами, которые заполнены гиалуроновой кислотой, протеогликанами, гидрофильными молекулами. Благодаря строению ЭССТ сопротивляется сжатию и тем самым защищает сосуды пуповины от механического сдавления [19]. Исходя из описанного, можно сделать вывод о том, что некорректно рассматривать влияние внешнего давления на пупочные сосуды изолированно: необходимо учитывать комплекс вены, двух артерий и плотно предлежащий к ним ЭССТ.
Новизна представляемой работы заключается в компьютерном моделировании сосудов пуповины и ЭССТ на основе собственного морфологического анализа и литературных данных в интранатальный период.
Заключение. Предлагаемая нами трехмерная модель, разработанная на основе коррозионных препаратов сосудов пуповины, является адекватным инструментом для морфофункционального исследования фетоплацентарного кровообращения. Анатомические и гемодинамические параметры в пупочных сосудах в интранатальный период претерпевают трансформации различной степени выраженности. Заключаются данные изменения в увеличении интраваскулярной скорости и давления кровотока, деформации пуповины и сосудистой стенки, сужении просвета сосудов при сохранении значения площади поперечного сечения пуповины и ее сосудов на фоне воздействия внешнего давления. Считаем, что проведенное исследование имеет клиническое значение и указывает на необходимость применения в процессе родов ультразвукового исследования пуповины и исследования фетоплацентарного кровообращения.
Вклад авторов: М. Ю. Клявлина — формирование идеи и концепции исследования, сбор и анализ данных, написание текста; Р. Т. Нигматуллин — анализ данных, редактирование текста; Д. Ю. Рыбалко — редактирование текста; А. В. Масленников — формирование идеи и концепции исследования; А. А. Касаткин — сбор данных; Н. А. Воронцова — сбор данных.


