Анатомическое и биомеханическое обоснование трансплантата для восстановительной хирургии костных стенок глазницы
Автор: Кутушев Р.З., Нигматуллин Р.Т., Мусина Л.А., Первушин Ю.С., Гизатуллина Э.Р.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель: комплексное исследование биомеханических параметров и фиброархитектоники эластинового биоматериала (БМ). Материал и методы. Для исследования использовали ксеногенный биоматериал, изготовленный на основе выйной связки (ligamentum nuchae (L. п.)) Bos taurus taurus, L. 1758. Для гистологического исследования БМ (п=24) применяли электронную микроскопию (микроскоп Jem-1011) и отраженную световую микроскопию гистотопографических срезов в трех плоскостях с учетом ориентации эластических волокон (ЭВ). Срезы окрашивали орсеином, а также по методам Маллори, Ван Гизона, импрегнировали по Футу. Механические свойства материала изучали на 11 образцах размером 10x8x16 мм с использованием разрывной машины Zwick/Roell Z010, позволяющей производить деформацию на сжатие. Прочность шовной фиксации определялась нагрузкой на растяжение (Ртах). Для характеристики упругих свойств БМ рассчитывали модуль Юнга. Результаты. В зоне упругой деформации модуль Юнга составил 1,74±0,1 Н/мм2. Последующее нагружение БМ приводит к деформациям с расслоением и образованием пластинчатых фрагментов. После снятия нагрузки БМ восстанавливает форму и размер. Фиброархитектоника БМ обеспечивает высокие показатели прочности шовной фиксации. Заключение. Фиброархитектоника БМ, совокупность его структур формируют единый эластико-коллагеновый комплекс. Результаты позволили разработать структурно модифицированные БМ с остеоиндуктивными свойствами.
Глазница, остеоиндуктивные биоматериалы, эластиновый биоматериал
Короткий адрес: https://sciup.org/149135445
IDR: 149135445 | УДК: 611.08-57.08,
Текст научной статьи Анатомическое и биомеханическое обоснование трансплантата для восстановительной хирургии костных стенок глазницы
1 Введение. Поражения костных структур и мягкого остова глазницы различного генеза составляют один из сложных разделов хирургической патологии органа зрения. Обширные дефекты опорного аппарата глазницы возникают как последствия травм челюстно-лицевой области, опухолевых процессов, пороков развития лицевого черепа и других патологических состояний [1].
Для выполнения костно-пластических операций использовались самые разнообразные трансплан-
тационные материалы: аутологичные, алло- и ксеногенные биоматериалы, эксплантаты, биокомпозиты. Так, широкое распространение получили аллогенные биоматериалы Аллоплант, разработанные Э. Р. Мул-дашевым [2], часть из которых успешно используется в реконструктивной хирургии глазницы [3]. В трудах В. В. Волкова [4] обобщен многолетний опыт использования полимерных биоматериалов в пластической офтальмохирургии. Для каждого из видов биоимплантатов отрабатывались свои показания и противопоказания, подробный обзор которых представлен в известном руководстве В. П. Николаенко и Ю. С. Астахова [5]. На основе проведенного ана- лиза авторами сформулированы общие требования к трансплантатам, используемым в восстановительной хирургии глазницы. В частности, выделяются такие критерии, как простота моделирования материала и последующей его хирургической пересадки, возможность имплантата поддерживать структуру глазницы, стабильность первоначального положения на период его интеграции с окружающими тканями, резистентность к бактериальной кантоминации и хорошая визуализация биоимплантата при использовании современных неинвазивных методов исследования. Следует отметить, что весь комплекс биологических и медико-технических требований к трансплантатам может быть реализован только при детальном анализе их структуры и механических параметров. На необходимость широкого использования методов биомеханики в различных сферах клинической офтальмологии указывается также в серии работ, выполненных Е. Н. Иомдиной и ее учениками [6].
При разработке дизайна настоящего исследования нами учитывался и тот факт, что, несмотря на широкий арсенал пластических материалов, реконструктивная офтальмохирургия нуждается в совершенствовании уже известных трансплантатов и в создании новых типов. Эта необходимость сопряжена с многочисленными биологическими, медицинскими, технологическими, а нередко и социальными проблемами, сопровождающими службу биоимплантологии. Достаточно сказать, что в случаях с тканевым донорством целый блок правовых, административных, законодательных и этических норм выcтупает на первый план. Кроме того, учитывался и собственный опыт разработки биоматериалов с остеоиндуктивными свойствами: в исследовании [7] было показано, что трансплантаты на основе эластина являются адекватным субстратом для пролиферации клеток остеогенного дифферона. В рамках протокола доклинических испытаний биоматериалов требуется изучение их биомеханических свойств в тесной связи с особенностями структурной организации.
Цель : комплексное исследование биомеханических параметров и фиброархитектоники структурных модификаций эластинового биоматериала.
Материал и методы. В качестве объекта исследования выбран разработанный во Всероссийском центре глазной и пластической хирургии (Уфа) ксеногенный биоматериал, изготовленный на основе выйной связки (ligamentum nuchae (L. n.)) Bos taurus taurus, L. 1758 с преимущественным содержанием эластина (патент RU2440148). Для исследования использованы 24 образца указанных биоматериалов, консервация и стерилизация которых отвечает требованиям указанного патента (базовая форма эластинового биоматериала). Кроме того, в ходе выполнения настоящей работы создана структурная модификация эластинового биоматериала в виде его пористой формы. Необходимость подобных морфологических изменений связана с тем, что базовая форма эластинового биоматериала отличается высокой плотностью волокнистых структур, что сопровождается относительно медленной интеграцией биоматериала с тканевым ложем области трансплантации и соответственно поэтапным процессом заместительной регенерации. При некоторых видах реконструктивных вмешательств требуется ускоренная реализация репаративного процесса. Как показали наши предварительные исследования, ускоренная динамика клеточной инвазии в биоматериал достигается при наличии тканевых щелей диаметром не менее двух микрометров, условно названного нами «правилом двух микрон». Созданный на данном принципе биоматериал определен нами как структурно модифицированный пористый эластиновый трансплантат, восемь образцов которого также использовано для морфологических исследований.
Гистотопографические срезы указанных типов биоматериалов готовились в трех взаимно перпендикулярных плоскостях с учетом ориентации эластических волокон (ЭВ). Срезы окрашивались орсеином, по методам Маллори, Ван Гизона, импрегнировались по Футу. Использовались методы поляризационной и трансмиссионной электронной микроскопии (микроскоп Jem-1011). Применен также оригинальный метод отраженной световой микроскопии (патент RU 2413943).
Механические свойства стандартных образцов биологических материалов (10х8х16 мм; n=11) изучали на универсальной испытательной машине Zwick/Roell Z010 при деформации на сжатие. Прочность шовной фиксации определялась путем наложения шелковой лигатуры № 7, отступая от края образца 2 мм, с последующей фиксацией разрушающей нагрузки на растяжение. Стандартные фрагменты биоматериала фиксировались через проведенную лигатуру к захватам разрывной машины ZM-20 с последующей регистрацией разрушающей нагрузки на растяжение (Рmax; г). Для изучения прочности шовной фиксации использованы по пять образцов каждого типа эластинового биоматериала. Для характеристики упругих свойств БМ рассчитывали модуль Юнга (Н/мм2).
Статистическая обработка результатов исследования произведена в программе Statistica. Рассчитывали минимальное и максимальное значение (мин-макс), а также среднюю арифметическую (М) и ее ошибку (m).
Результаты. Описываемая базовая форма биоматериала представляет собой ацеллюлярный гетероморфный матрикс, основу которого составляют эластические волокна диаметром 6,57±0,36 мкм с преимущественно одновекторной ориентацией (рис. 1, 2). Данные волокна формируют характерные пластины, имеющие синусоидальную извилистость. В зонах между эластическими волокнами выявляют-
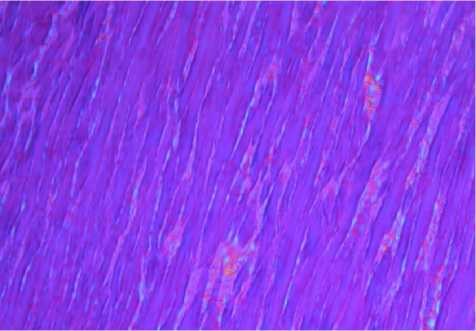
Рис. 1. Эластиновый биоматериал, базовая форма. Одновекторная ориентация эластических волокон. Оптически активные тонкие коллагеновые волокна локализованы между эластическими. Поляризационная микроскопия. Об. 20, ок. 7
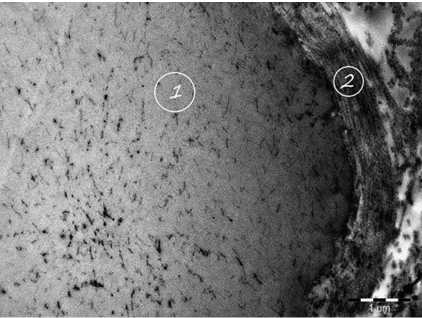
А Б
Рис. 2. Электронограмма базовой формы эластинового биоматериала:
А — поперечный срез эластинового волокна; Б — продольный срез эластического волокна: 1 — эластическое волокно с включениями фибриллиновых микрофибрилл; 2 — коллагеновые фибриллы
Сводные данные по прочности эластинового биоматериала при наложении ручного хирургического шва
|
Вид биоматериала |
Тип испытания |
||
|
вдоль пучков волокон (DM-2 мм) P max М±m (мин-макс) |
поперек пучков волокон (DM-2 мм) P max М±m (мин-макс) |
поперек пучков волокон (DM-5 мм) P max М±m (мин-макс) |
|
|
Ацеллюлярый базовый эластиновый биоматериал |
620,0±43,0 (500,4÷739,6) *прорезывание лигатуры |
1520,0±107,5 (1221,0÷1819,0) *фрагментация образца |
2400,0±123,0 (2041,0÷2759,0) *фрагментация образца |
|
Структурно модифицированный (пористый) эластиновый биоматериал |
210±32,25 (121,0÷299,0) *прорезывание лигатуры |
210,0±32,25 (121,0÷299,0) * фрагментация образца ввиду гомогенизации КВ происходит при нагрузках, идентичных продольной ориентации |
210,0±32,25 (121,0÷299,0) прочность шовной фиксации достоверно не изменяется при различных значениях DM |
П р и м еч а н и е : при наложении шва использовали шелк диаметром 700 мкм (метрический размер EP-7); DM — расстояние от края образца до лигатуры; P max — разрушающая нагрузка (г).
ся коллагеновые фибриллы (КФ) и фибриллиновые микрофибриллы (ФМ), тесно взаимосвязанные между собой и с корковой частью эластических волокон в виде зон плотной адгезии.
Коллагеновые фибриллы формируют тонкие коллагеновые волокна (0,5–2,0 мкм), часть из которых спирально охватывает отдельные эластические волокна, другие переходят от одного волокна к другому, располагаясь поперечно и связывая эластиновые структуры в пластинчатые комплексы (см. рис. 2).
Результаты проведенных механических исследований соотносятся с особенностями фиброструктуры эластинового биоматериала. Так, первоначальный отрезок диаграммы зависимости «деформация — напряжение» подчиняется закону Гука, а сам трансплантат ведет себя как упругий биоматериал. При этом в зоне упругой деформации (0,14±0,015) модуль Юнга составил 1,74±0,1 Н/мм2.
Столь высокое значение модуля упругости биоматериала связано с абсолютным доминированием в его структуре эластических волокон. Однако последующее нагружение образцов приводит к упруговязким деформациям с расслоением биоматериала по ходу коллагеновых прослоек и образованием пластинчатых фрагментов. Примечательно, что после снятия нагрузки происходит полное восстановление формы и размеров образцов биоматериалов, подтверждающих его упруговязкое поведение как гетероморфной системы. Упругий компонент обеспечивается пре- имущественно эластическими волокнами. Аморфный матрикс и ФМ в пространствах между эластическими волокнами определяют вязкое поведение биоматериала. Фиброархитектоника данного биоматериала также обеспечивает достаточно высокие показатели прочности шовной фиксации (таблица).
Как следует из данных таблицы, для базовой формы эластинового биоматериала вектор наложения лигатуры существенно влияет на прочность его шовной фиксации: в случае положения шва поперек ориентации волокон разрушающая нагрузка достоверно увеличивается. При этом данный показатель также возрастает при увеличении отступа накладываемой лигатуры от края биоматериала. В аналогичном испытании структурно модифицированной (пористой) формы эластинового трансплантата размерность отступа от его края, равно как и вектор ориентации лигатуры, не влияют на прочность шовной фиксации. Однако в целом консервация и стерилизация описываемого пористого матрикса приводят к снижению его прочностных параметров.
Обсуждение. Полученные данные указывают прежде всего на структурно-биомеханические корреляции в изучаемых трансплантатах, комплексные морфологические и биофизические исследования которых являются методической основой для создания модифицированных форм биоматериалов и определения показаний для их клинического применения.

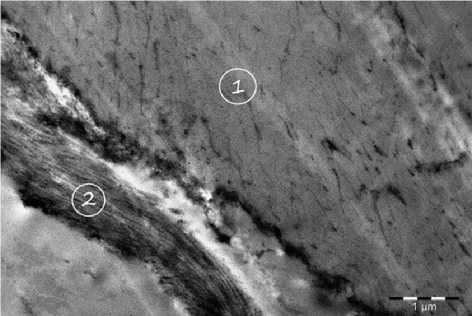
Рис. 3. Структурно модифицированная (пористая) форма эластинового биоматериала. Тканевые щели между эластическими волокнами. Окраска по Ван Гизону. Об. 20, ок. 7
Так, описанная фиброархитектоника базовой формы эластинового биоматериала, совокупность его эластических, фибриллиновых и коллагеновых структур формируют единый эластико-коллагено-вый комплекс, обладающий широким диапазоном упругодеформативных и прочностных свойств. Полученные данные по морфологии и биомеханическим свойствам внеклеточного матрикса и фиброархитек-тонике эластиновых структур позволили разработать модифицированные (пористые) биоматериалы для реконструктивной хирургии и расширить показания для их клинического применения, ускорив динамику заместительной регенерации. Данные виды трансплантатов содержат тканевые щели диаметром от 2,0 до 10,0 мкм, что создает оптимальные условия для клеточной миграции со стороны тканевого ложа эластинового биоматериала (рис. 3).
Полученные нами данные по структурно-биомеханическим параметрам эластиновых трансплантатов необходимо экстраполировать на морфологические особенности тканевого ложа реципиента и топографическую анатомию области реконструктивного вмешательства. Подобный подход позволяет реализовать полученные результаты в клинической практике биоимплантологии. В связи с этим следует отметить, что представляемые биоматериалы по упругодефор-мативным параметрам, и в частности по высокому показателю модуля упругости на сжатие, полностью отвечают одному из основных критериев — удерживать структуру стенок глазницы на период заместительной регенерации. Прочность же шовной фиксации биоматериала соответствует аналогичному показателю надкостницы глазницы, к которому и фиксируется трансплантат. Способность эластинового биоматериала к упруговязкой деформации позволяет адаптировать его к стенкам глазницы, моделируя трансплантат в соответствии с коэффициентом изгиба глазницы, ранее изученного автором настоящей статьи [8]. Как показывает клинический опыт биоимплантологии, с учетом индивидуальной изменчивости глазницы представляется возможным разрабатывать трансплантаты, моделируемые к каждой из восстанавливаемых опорных структур [9].
Изложенные в настоящей статье результаты позволяют сделать заключение общего характера в плоскости взаимодействия закономерностей вариантной анатомии и биоимплантологии. В нашем случае антропометрические параметры костных стенок глазницы с учетом границ их индивидуальной измен- чивости легли в основу разработки медико-технических требований для изготовления трансплантатов с остеоиндуктивными свойствами и последующего применения в реконструктивной хирургии глазницы. Другими словами, индивидуальный фенотип пациента, равно как и его генотип, могут быть логично встроены в концептуальную модель персонифицированной медицины. [10]. Следует отметить, что морфометрические параметры глазницы позволили не только обосновать форму, плоскостные размеры и толщину трансплантата с учетом необходимости его индивидуального моделирования, но и рассчитать комплекс требований по механическим свойствам, предъявляемых к биоматериалу для выполнения данного вида костно-пластических операций. Для включения в технические условия на изготовление описываемых трансплантатов нами отработаны следующие виды биомеханических испытаний: деформация на сжатие, прочность шовной фиксации, деформация на изгиб, реституция формы и размеров биоматериала после деформации.
Заключение . Эластиновые биоматериалы адекватны для выполнения восстановительных операций в краниофациальной хирургии не только по структурным и механическим характеристикам, но и в силу своих морфогенетических свойств. На наш взгляд, уместно сослаться также на опыт целого ряда зарубежных лабораторий, где в последние годы вышла серия публикаций по экспериментальной разработке биологических материалов на основе ксеногенного эластина, полученного из других источников. Результаты данных исследований показали, что эластиновые трансплантаты, в структуре которых присутствуют самые разнообразные адгезивные, хемотаксические и морфогенетические факторы, формируют адекватный субстрат для клеточной пролиферации.
Есть еще один довод в пользу разработки и внедрения эластиновых трансплантатов: результаты их клинической апробации в профильных центрах ортопедии и травматологии полностью подтверждают данные экспериментально-морфологических и биомеханических исследований.
Список литературы Анатомическое и биомеханическое обоснование трансплантата для восстановительной хирургии костных стенок глазницы
- Гундорова P.A., Нероев В.В., Кашникова В.В. Травмы глаза. М.: ГЭОТАР-Медиа, 2009; с. 13-25.
- Регенеративная медицина: Биоматериалы Аллоплант в офтальмохирургии/под общ. ред. Э.Р Мулдашева. Уфа: ГУП "Башкортостан", 2014; 432 с.
- Мулдашева И.Э. Хирургическое лечение посттравматических гипофтальма и энофтальма с применением биоматериала Аллоплант: автореф. дис.... канд. мед. наук. Челябинск, 2007; 19 с.
- Волков В.В. Офтальмохирургия с использованием полимеров. СПб.: Гиппократ, 2009; с. 448-97.
- Николаенко В.П., Астахов Ю.С. Орбитальные переломы: руководство для врачей. Эко-Вектор, 2012; 436 с.
- Иомдина E.H., Кошиц И.Н. Актуальные проблемы биомеханики глаза. В кн.: Биомеханика глаза: сборник трудов третьего семинара, 2002; с. 3-9.
- Нигматуллин P.Т., Кутушев P.3., Мотыгуллин Б.Р. Эластиновый биоматериал как индуктор остеогенеза. Практическая медицина 2017; 100 (9): 149-51.
- Мухаметова Д.А., Кутушев P.3., Шарипов Т.Н. Анатомические параметры глазницы в кононах конформной симметрии. Морфология 2019; 155 (2): 208.
- Derricks КЕ, Rich СВ, Buczek-Thomas JA, Nugent MA. Ascorbate enhances elastin synthesis in 3D tissue-engineered pulmonary fibroblasts constructs. Tissue and Cell 2013; 45: 253-60.
- Anabami N, Mithieux SM, Camci-Unal G, et al. Elastomeric recombinant protein-based biomaterials. Biochemical Engineering Journal 2013; (77): 110-8.


