Анатомическое обоснование изолированной долевой порто-кавальной перфузии печени
Автор: Тягун Валерий Сергеевич, Гайворонский Иван Васильевич, Суров Дмитрий Александрович, Рыбаков Александр Сергеевич, Ильина Виктория Анатольевна, Анохин Дмитрий Юрьевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.30, 2022 года.
Бесплатный доступ
С развитием перфузионных технологий в онкологии проблема поиска оптимальных путей введения перфузатов приобрела принципиальный характер и в этой связи изучение особенностей ангиоархитектоники печени в норме и при патологии не теряет своей актуальности. Целью нашего исследования явилось изучение особенностей портальной архитектоники печени применительно к возможности ее изолированной долевой перфузии. Методами цветовой перфузии (n=50), раздельных инъекций отвердевающей массой и изготовлением коррозионных препаратов (n=3), микрофокусной ангиографии (n=8), транспаренхиматозных секций и световой микроскопии (n=5) исследовано 53 препарата печени, эксплантированных из не бальзамированных трупов людей, умерших от заболеваний, не связанных напрямую с исследуемым органом. В результате исследования установлено, что граница зон кровоснабжения долевыми ветвями воротной вены при введении красителей проходит по латеральной границе четвертого сегмента печени в проекции основного ствола средней печеночной вены, а не по серповидной связке. По критерию распределения ветвей воротной вены анатомическое и хирургическое понятия о междолевых границах печени не совпадают. Макро- и микроскопически видимые междолевые интраорганные портальные анастомозы в норме отсутствуют, что указывает на относительную обособленность долевого портального кровотока печени. Внутрипеченочное русло собственной печеночной артерии имеет богатую архитектонику в поверхностных слоях паренхимы и обильно кровоснабжает капсулу печени. При выполнении транспаренхиматозных секций границы зон кровоснабжения долевыми ветвями воротной вены совпадали с междолевыми границами во всех случаях наблюдениях. Также отмечалось соответствие топографии границы зон кровоснабжения долевыми ветвями воротной вены на диафрагмальной поверхности печени и в ее паренхиме. Таким образом представляется возможным достоверно определить указанную границу по изменению картины на поверхности препарата печени. Относительная автономность русел долевых ветвей воротной вены может быть использована для разработки методик сосудистой изоляции долевого портального кровотока печени для оценки ее селективной изолированной перфузии.
Анатомия печени, воротная вена печени, портальные анастомозы, сегменты печени, методы перфузии
Короткий адрес: https://sciup.org/143178913
IDR: 143178913 | DOI: 10.20340/mv-mn.2022.30(3).589
Текст научной статьи Анатомическое обоснование изолированной долевой порто-кавальной перфузии печени
Тягун В.С., Гайворонский И.В., Суров Д.А., Рыбаков А.С., Ильина В.А., Анохин Д.Ю. Анатомическое обоснование изолированной долевой порто-кавальной перфузии печени. Морфологические ведомости. 2022;30(3):589. (3).589
Tyagun VS, Gayvoronskiy IV, Surov DA, Rybakov AS, Il'ina VA, Anokhin DYu. The anatomical grounding of isolated lobar portocaval perfusion of the liver. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(3):589. (3).589
Введение. Проблема поиска источников кровоснабжения метастазов печени крайне актуальна при разработке способов ее изолированной перфузии для улучшения результатов регионарной химиотерапии, и она до сих пор не решена [1-2]. Существует мнение, что метастазирование происходит опухолевыми эмболами через систему воротной вены в капиллярную сеть печени, которая служит первым фильтром на пути метастазов [1, 3-6]. Однако есть мнение, что метастазы печени в основном кровоснабжаются за счет артерий [1-2, 7-12]. Также в пользу этого свидетельствуют данные лучевой диагностики [13-15]. Кроме того, существует мнение, что метастазы имеют смешанное питание через артерио-портальные анастомозы [10, 16-18]. В 2003 году M. Nikfarjam et al. с помощью сканирующей микроскопии показали, что метастазы в подавляющем большинстве имели связь с синусоидами здоровой ткани печени [19]. С развитием перфузионных технологий в онкологии проблема поиска оптимальных путей введения перфузата обрела принципиальный характер и в этой связи изучение особенностей ангиоархитектоники печени в норме и при патологии не теряет своей актуальности.
Цель исследования: изучение особенностей портальной архитектоники печени применительно к возможности ее изолированной долевой перфузии.
Материалы и методы исследования. Исследовано 53 анатомических препаратов печени, из них методами цветовой перфузии, транспаренхиматозных секций и световой микроскопии - 50, раздельных инъекций отвердевающей массой и изготовлением коррозионных препаратов - 3, микрофокусной ангиографии - 8, эксплантированных из не фиксированных трупов людей, умерших от заболеваний, не связанных с исследуемым органом.
Материал для исследования получен в соответствии с Федеральным законом № 8-ФЗ от 12.01.1996 «О погребении и похоронном деле» и Постановлением Правительства РФ № 750 от 21.07.2012 «Об утверждении правил передачи невостребованного тела, органов и тканей умершего человека для использования в медицинских, научных и учебных целях, а также использования невостребованного тела, органов и тканей умершего человека в указанных целях». Проведение исследования разрешено независимым этическим комитетом Военномедицинской академии имени С.М. Кирова № 220 от 19.03.2019.
После эксплантации трупной печени производили ее подготовку к исследованию. Выполняли мобилизацию воротной вены (далее - ВВ), ее ветвей, нижнюю полую вену (далее - НПВ), лигировали круглую связку печени. Затем последовательно канюлировали ветви ВВ. В НПВ устанавливали перфорированную полихлорвиниловую дренажную трубку. В качестве канюль использовали армированные венозные канюли 12-24 Fr (Maquet, Германия) при проведении перфузионных методик и при выполнении рентген-или коррозионной методик – системы для внутривенных вливаний. К сосудистым канюлям подсоединяли перфузионный контур (рис. 1). Затем промывали русло ВВ от тромботических масс и крови водой при скорости подачи раствора – 200–250 мл/мин с температурой 18–25 °С, длительностью 5–10 мин.
После подготовки препаратов к исследованию проводили перфузию долей печени через установленные ранее канюли растворами водорастворимых красителей (0,05% бриллиантового зеленого, 1% метиленовой сини, 0,4% фуксина основного). Параметры перфузии подбирали опытным путем исходя из физиологических характеристик кровотока и объема печени, которые были представлены в следующих диапазонах: скорость подачи раствора – 350–600 мл/мин для перфузии через ВВ; длительность перфузии 20–90 мин, температура перфузата 21–43° С. При этом, выполняли визуальную оценку распространения красителя и характера топографии границы зон кровоснабжения долевыми ветвями ВВ на поверхности препарата печени. В основе определения междолевой границы печени придерживались международной терминологической номенклатуры анатомии и резекций печени [3-4].
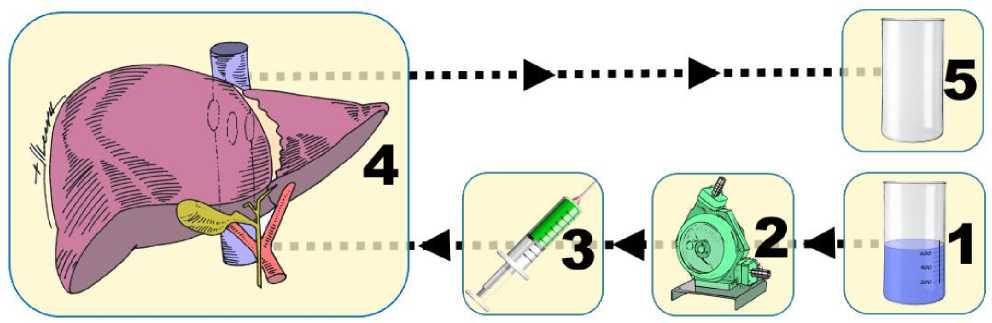
Рис. 1. Схема перфузионного контура для промывания порто-кавального русла печени. Обозначения: 1 – резервуар с раствором; 2 – насос для перфузии; 3 – соединители; 4 – печень; 5 – резервуар для сбора отработанного перфузата; пунктирная линия и стрелки – перфузионный контур и направление потока перфузата
В ходе раздельных инъекций долевых ветвей ВВ отвердевающей массой и изготовления коррозионных препаратов использовали специальный состав E20 Plus (BIODUR, Германия). Коррозию выполняли путем экспозиции препарата в 20% растворе гидроксида калия в течение 5 суток с последующим промыванием полученных препаратов в чистой воде и их сушкой в течение 48 часов.
Микрофокусную ангиографию проводили с помощью портативного рентгеновского аппарата ПАРДУС-У (ЭЛ-ТЕХ-МЕД, Россия) и цифровых рентген-кассет «crMD 1.0 General» (AGFA, Германия). Полученные снимки подвергали обработке и анализу с использованием программного обеспечения RadiAnt DICOM Viewer (Medixant, Польша). Перед исследованием маркировали рентген-позитивными объектами границы зон кровоснабжения долевыми ветвями ВВ, выявленных на диафрагмальной поверхности печени по результатам цветовой перфузии. В качестве рентгеноконтрастного вещества использовали порошок свинцового сурика и силикон марки СКТН-Б (ГОСТ 13835-73, Россия) в пропорции 1:20. На полученных рентгенограммах оценивали характер распространения рентгеноконтрастного вещества в паренхиме печени, а также его соотношение с изменениями на поверхности печени.
Транспаренхиматозные секции выполняли в сагиттальном и аксиальном направлениях. При этом, оценивали зоны распространения красителей и уточняли топографию границы зон кровоснабжения долевыми ветвями ВВ. Во время проведения транспаренхиматозных секций выполняли забор паренхимы в области выявленной границы зон кровоснабжения долевыми ветвями ВВ для дальнейшего гистологического исследования с помощью световой микроскопии.
Результаты исследования и обсуждение. В результате проведенных цветовых перфузий русла долевых ветвей ВВ во всех наблюдениях (50 из 50) отмечалось распространение красителей в пределах исследуемой доли. Границы зон кровоснабжения долевыми ветвями ВВ соответствовали топографии междолевых границ – линиям Rex-Cantlie и проходили также в проекции плоскости, расположенной от ямки желчного пузыря до борозды НПВ. Практически сразу после перфузии с использованием водорастворимых красителей на диафрагмальной поверхности печени отмечалось окрашивание русла ВВ, характерным отличием которого являлось появление редких звездчатообразных элементов неправильной формы, размерами до 0,8 см. Данные элементы определялись лишь в пределах исследуемой доли (рис. 2). Стоит отметить, что объективная оценка топографии границ зон кровоснабжения долевыми ветвями ВВ на поверхности препарата в ряде случаев была затруднительна из-за слабого прокрашивания русла долевых ветвей ВВ.
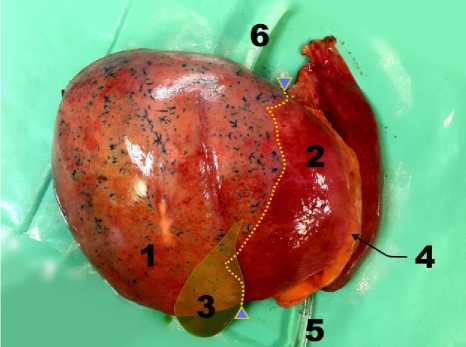
Рис. 2. Внешний вид печени после ее перфузии через правую ветвь ВВ. Определяется распространение красителя в границах правой доли. Обозначения: 1 – правая доля; 2 – левая доля; 3 – проекция желчного пузыря; 4 – серповидная связка печени; 5 – канюля в правой ветви ВВ; 6 – канюля в НПВ; пунктирная линия и треугольники – проекция выявленной границы зон кровоснабжения долевыми ветвями ВВ
Это, вероятно, было обусловлено особенностями архитектоники русла ВВ, которое располагается по большей части внутри паренхимы печени и не участвует в кровоснабжении ее капсулы. Наряду с этим внутрипеченочное русло собственной печеночной артерии (далее - СПА) имеет богатую архитектонику в поверхностных слоях паренхимы и обильно кровоснабжа-ет капсулу печени. Это показали комбинированные перфузии через русло СПА и ВВ в трех наблюдениях (рис. 3).
На коррозионных препаратах отмечалось раздельное окрашивание русла ветвей ВВ с четкими границами, соответствующими проекциям междолевых границ. Междолевая и межсегментарные границы определялись в виде щелевидных пространств (рис. 4). При исследовании долевого русла ВВ с помощью микрофо-кусной ангиографии также не было отмечено каких-либо междолевых сообщений, а рентген-контрастное вещество распространялось в пределах границ зон кровоснабжения долевыми ветвями ВВ, которые соответствовали проекции междолевой границы (рис. 5).
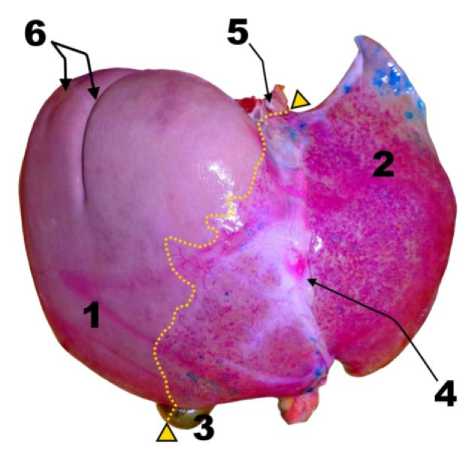
Рис. 3. Внешний вид печени после перфузии красителями русла ВВ (синий цвет) и русла СПА (пурпурный цвет) левой доли. Обозначения: 1 – правая доля, 2 – левая доля; 3 – желчный пузырь; 4 – серповидная связка; 5 – НПВ; 6 – кашлевые бороздки; пунктирная линия и треугольники – проекция выявленной междолевой границы
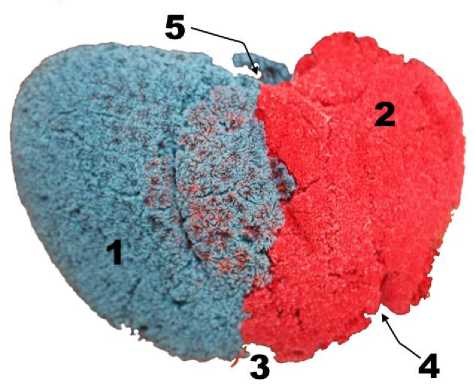
Рис. 4. Коррозионный препарат печени. Инъецировано синим правая ветвь, красным левая ветвь ВВ, артериальное русло оранжевым наполнителями. Обозначения: 1 – правая доля; 2 – левая доля; 3 – ямка желчного пузыря; 4 – левая продольная борозда, место прикрепления круглой связки печени; 5 – борозда НПВ
Использование высокоплотной и мелкодисперсной смеси свинцового сурика позволило детализировать воротное русло вплоть до терминальных венул (ветвей 6-7 порядков). Граница распространения контраста в сосудах находилась в пределах ±1,5 см от междолевой границы печени, промаркированной на ее поверхности. Таким образом, определение границы зон кровоснабжения долевыми ветвями ВВ возможно по внешним признакам. Нами не было найдено данных о наличии внут-рипеченочных макроскопических воротных анастомозов.
При выполнении транспаренхиматозных секций граница зон кровоснабжения долевыми ветвями ВВ совпадала с междолевой границей во всех наблюдениях. Также отмечалось соответствие топографии границы зон кровоснабжения долевыми ветвями ВВ на диафрагмальной поверхности печени и в ее паренхиме. Таким образом представляется возможным достоверно определить указанную границу по изменению картины на поверхности препарата печени. Участков с забросом красящих растворов в контрлатеральную долю не отмечалось. В ходе транспаренхиматозных секции после цветовых перфузий определялось уменьшение плотности портального русла в направлении от
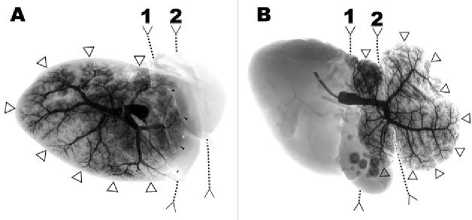
Рис. 5. Внутридолевая архитектоника ВВ. Рентгеноконтрастное вещество введено в правую ветвь (А) и в левую ветвь (В) ВВ. Обозначения: 1 – проекция границы зон кровоснабжения долевыми ветвями ВВ; 2 – проекция серповидной связки; треугольники – терминальные вены 6-7 порядка ворот печени к ее поверхности, в то время как артериальное русло однородно распространялось по всей паренхиме, о чем свидетельствовал характер распространения красителей (рис. 6).
При гистологическом исследовании паренхимы граница зон кровоснабжения долевыми ветвями ВВ определялась как условная неровная линия между участками скопления красителя в терминальных сосудах русла ВВ. С помощью световой микроскопии мы также не находили внутри- и внепеченочных междолевых макроанастомозов между ветвями ВВ (рис. 7).
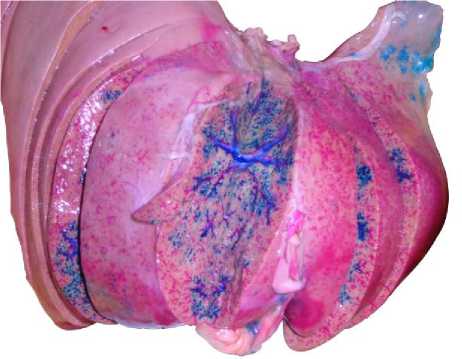
Рис. 6. Вид препарата печени после транспаренхиматозной саггитальной секции. Отмечается окрашивание русел СПА (пурпурный цвет) и ВВ (синий цвет) левой доли. Граница зон кровоснабжения долевыми ветвями СПА и ВВ соответствует латеральной границе сегмента печени S4
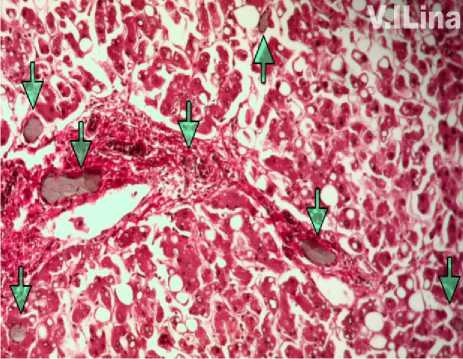
Рис. 7. Микрофото препарата печени. Срез через границу зон кровоснабжения долевыми ветвями ВВ. Стрелками указана граница отложения красителя в терминальных венулах. Окр. гематоксилином-эозином. Ув.: х200
Заключение. Таким образом, на основании полученных результатов исследования можно сделать вывод о том, что границы зон кровоснабжения долевыми ветвями воротной вены при введении красителей проходят по латеральной границе S4 в проекции основного ствола средней печеночной вены, а не по серповидной связке. Следовательно, по портальному признаку анатомическое и хирургическое понятия о междолевой границе печени не совпадают. Макро- и микроскопически видимые междолевые ин-траорганные портальные анастомозы в норме отсутствуют, что указывает на относительную обособленность долевого портального кровотока печени. Относительная автономность русел долевых ветвей воротной вены может быть использована для разработки методик сосудистой изоляции долевого портального кровотока печени для оценки ее селективной изолированной перфузии.
Список литературы Анатомическое обоснование изолированной долевой порто-кавальной перфузии печени
- Abdulaev MA, Napol'skaya EV, Tsikoridze MYu. Sovremennoe sostoyanie problemy maloinvazivnykh metodov lokal'nogo lecheniya metastazov kolorektal'nogo raka v pecheni (obzor literatury). Tazovaya khirurgiya i onkologiya. 2016;6(1):43-47. In Russian
- Nasyrov AR, Pirtskhalava TL, Korovina YaV. Khimioterapiya patsientov s nerezektabel'nymi kolorektal'nymi metastazami v pechen': sistemnaya ili regionarnaya? Voprosy onkologii. 2011;57(2):192-198. In Russian
- Murzaliev EM, Mamashev NDzh, Bebezov BKh. Khirurgicheskoe lechenie metastazov kolorektal'nogo raka v pechen'. Vestnik Vestnik Kyrgyzsko-Rossyskogo Slavyanskogo Universiteta. 2015;2(2):97-101. In Russian
- Aigner K, Walther H, Tonn J, et al. First experimental and clinical results of isolated liver perfusion with cytotoxics in metastases from colorectal primary. Recent Results Cancer Research. 1983;86:99-102. https://doi.org/10.1007/978-3-642-82025-0_18
- Solt DB, Hay JB, Farber E. Comparison of the blood supply to diethylnitrosamine-induced hyperplastic nodules and hepatomas and to the surrounding liver. Cancer research. 1977;37(6):1686-1691
- Voboril R. Blood supply of metastatic liver tumors: an experimental study. International surgery. 2005;90(2):71-77
- Cherkasov MF, Grоshilin VS, Pomazkov AA, Dmitriev AV. Surgical and combined treatment of liver metastases in colorectal cancer. Fundamental Research. 2015; (1): 1491-1499.
- Breedis C, Young G. The blood supply of neoplasms in the liver. American Journal of Pathology. 1954;30(5):969
- Favelier S, Germain T, Genson P-Y, et al. Anatomy of liver arteries for interventional radiology. Diagnostic and interventional imaging. 2015;96(6):537-546. https://doi.org/10.1016/j.diii.2013.12.001
- Matsui O, Kadoya M, Kameyama T, et al. Benign and malignant nodules in cirrhotic livers: distinction based on blood supply. Radiology. 1991;178(2):493-497. https://doi.org/10.1148/radiology.178.2.1846240
- Rogers W, Edlich RF, Aust JB. Tumor blood flow: II. Distribution of blood flow in experimental tumors. Angiology. 1969;20(7):374-387. https://doi.org/10.1177/000331976902000702
- Stribley KV, Gray BN, Chmiel RL, et al. Internal radiotherapy for hepatic metastases II: The blood supply to hepatic metastases. Journal of Surgical Research. 1983;34(1):25-32. https://doi.org/10.1016/0022-4804(83)90018-5
- Mitina LA, Stepanov SO, Sidorov DV i dr. Uzi pecheni s kontrastom pri metastazakh kolorektal’nogo raka v pechen’. Koloproktologiya. 2017;2(60)suppl.:32-36. In Russian.
- Bengmark S, Rosengren K. Angiographic study of the collateral circulation to the liver after ligation of the hepatic artery in man. The American Journal of Surgery. 1970;119(6):620-624
- Guadagni S, Pizzutilli A, Mancini E, et al. Significance of duplex/colour Doppler sonography in hepatic arterial chemotherapy for patients with liver metastases from colorectal carcinoma. European Journal of Surgical Oncology (EJSO). 2000;26(4):381-386. https://doi.org/10.1053/ejso.1999.0903
- Zogot SR, Akberov RF. Chastota, luchevaya semiotika metastazov v pechen' opukholey razlichnoy lokalizatsii po rezul'tatam kompleksnogo luchevogo issledovaniya. Prakticheskaya meditsina. 2013;2(67):119-122. In Russian
- Kan Z. Dynamic study of iodized oil in the liver and blood supply to hepatic tumors. An experimental investigation in several animal species. Acta Radiologica. Supplement. 1996;408:1-25.
- Taylor I, Bennett R, Sherriff S. The blood supply of colorectal liver metastases. British journal of cancer. 1978;38(6):749. https://doi.org/10.1038/bjc.1978.283
- Nikfarjam M, Muralidharan V, Malcontenti-Wilson C, Christophi C. Scanning electron microscopy study of the blood supply of human colorectal liver metastases. European Journal of Surgical Oncology (EJSO). 2003;29(10):856-861. https://doi.org/10.1016/j.ejso.2003.08.009
- Surov DA, Solov'yov IA, Gaivoronsky IV i dr. Metod izolirovannoy dolevoy arterio-kaval'noy perfuzii pecheni v eksperimente. Patent RU 2726591. 16.11.2020. In Russian
- Lin G, Lunderquist A, Hagerstrand I, Boijsen E. Postmortem examination of the blood supply and vascular pattern of small liver metastases in man. Surgery. 1984;96(3):517-526
- Lin G, Hagerstrand I, Lunderquist A. Portal blood supply of liver metastases. American journal of roentgenology. 1984;143(1):53-55. https://doi.org/10.2214/ajr.143.1.53
- Ackerman NB, Lien WM, Kondi ES, Silverman NA. The blood supply of experimental liver metastases. I. The distribution of hepatic artery and portal vein blood to «smaIl» and «large» tumor. Surgery 1969;66:1067-1072


