Анатомическое обоснование объема тканевого дефекта при биопсии сторожевого лимфатического узла: пилотное исследование на аутопсийном материале
Автор: Багателия З.А., Чижиков Н.П., Талыбова Н.Р., Кислов М.А., Степанкин А.Ю.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Актуальность. Несмотря на меньшую инвазивность по сравнению с подмышечной лимфодиссекцией, биопсия сторожевого лимфатического узла при раке молочной железы остаётся процедурой, ассоциированной с риском развития лимфореи и лимфедемы. Одним из теоретически обоснованных подходов к профилактике данных осложнений является аутотрансплантация жировой ткани для заполнения послеоперационного тканевого дефекта, однако доказательная база этого метода отсутствует, а оптимальный объём трансплантата не определён. Цель: получить предварительные анатомические данные об объёме тканевого дефекта, формирующегося при биопсии сторожевого лимфатического узла, в зависимости от антропометрических параметров для обоснования дизайна проспективного клинического исследования. Материалы и методы. Пилотное анатомическое исследование выполнено на 12 аутопсийных препаратах женского пола в возрасте 65,1±16,9 года с различным индексом массы тела. Моделирование биопсии сторожевого лимфатического узла включало стандартизированный разрез, удаление лимфоузла I уровня с окружающей клетчаткой и измерение объёма остаточного дефекта методом заполнения гипсовым раствором с последующей волюметрией. Проведён корреляционный анализ зависимости объёма дефекта от индекса массы тела и возраста. Результаты. Средний объём тканевого дефекта составил 3,5±0,6 см³. Выявлена положительная корреляция с индексом массы тела (r=0,70; p=0,012) и возрастом (r=0,61; p=0,035). Наибольший объём зафиксирован при индексе массы тела более 25 кг/м2 и в возрастной группе 72–82 года, наименьший – при индексе массы тела менее 18,5 кг/м2 и в группе 48–59 лет. Выводы. Получены предварительные анатомические данные о вариабельности объёма тканевого дефекта при моделировании биопсии сторожевого лимфатического узла. Результаты обосновывают необходимость проспективного клинического исследования для валидации метода измерения in vivo и оценки клинической значимости персонализированного подбора объёма аутотрансплантата. Трупный материал имеет критические ограничения и не позволяет экстраполировать данные в клиническую практику.
Биопсия сторожевого лимфатического узла [D021701], рак молочной железы [D001943], лимфорея [D008209], лимфедема [D008209], аутотрансплантация жировой ткани [D050152], мертвое пространство [D012771], послеоперационные осложнения [D011183]
Короткий адрес: https://sciup.org/143185340
IDR: 143185340 | УДК: 616.428-089.87:618.19-006.6-089.166-06-084 | DOI: 10.20340/vmi-rvz.2025.5.MORPH.3
Текст научной статьи Анатомическое обоснование объема тканевого дефекта при биопсии сторожевого лимфатического узла: пилотное исследование на аутопсийном материале
Клиническая проблема и её актуальность
Биопсия сторожевого лимфатического узла стала «золотым стандартом» стадирования подмышечных лимфоузлов при клинически негативной аксилле у пациенток с ранним раком молочной железы. Внедрение данной методики революционизировало хирургическое лечение, позволив отказаться от рутинной подмышечной лимфодиссек-ции у значительной части пациенток с клинически негативными лимфоузлами. Это привело к драматическому снижению частоты тяжёлой лимфедемы верхней конечности с 20–30% до 5–7%.
Однако биопсия сторожевого лимфатического узла не является безрисковой процедурой. Несмотря на минимально инвазивный характер вмешательства, частота осложнений остаётся клинически значимой. Лимфорея наблюдается у 3–10% пациенток, а субклинические и клинические формы лимфедемы развиваются в 6–8% случаев даже при изолированной биопсии сторожевого лимфатического узла. Учитывая, что ежегодно в мире выполняется более 500 000 таких операций при раке молочной железы, абсолютное число пациенток, страдающих от этих осложнений, исчисляется десятками тысяч.
Лимфорея удлиняет сроки дренирования в среднем на 3–5 дней, требует повторных пункций у 15–20% пациенток и задерживает начало адъювантной терапии. Лимфедема, даже в лёгкой форме, существенно снижает качество жизни и требует пожизненного консервативного лечения.
Патофизиология осложнений
Патогенез послеоперационных осложнений биопсии сторожевого лимфатического узла связан с формированием так называемого «мертвого пространства» – остаточного тканевого дефекта в подмышечной области после удаления лимфоузла с окружающей жировой клетчаткой. Этот дефект становится резервуаром для скопления лимфы из пересеченных лимфатических сосудов. В отличие от кровеносной системы, лимфатические сосуды не спазмируются самостоятельно и продолжают пассивно выделять лимфу в послеоперационную полость.
Объём и топография «мертвого пространства» определяются несколькими факторами. Во-первых, исходным объёмом подмышечной жировой клетчатки, который коррелирует с индексом массы тела. Во-вторых, возрастными изменениями тканей – снижением тургора и увеличением доли рыхлой клетчатки. В-третьих, техникой хирургического вмешательства и размером удаляемого тканевого блока. Наконец, динамическими послеоперационными процессами - формированием отёка, ретракцией окружающих тканей и началом фиброза.
Существующие подходы к профилактике осложнений
Традиционные методы профилактики осложнений биопсии сторожевого лимфатического узла включают дренирование подмышечной области, компрессию и различные техники ушивания тканей. Дренирование применяется у 40–60% пациенток, однако метаанализы не продемонстрировали снижения частоты сером при его использовании. Компрессия области характеризуется низкой ком-плаентностью и неоднозначными результатами. Различные техники ушивания тканей также не показали убедительной эффективности. Ни один из этих методов не устраняет первопричину проблемы, а именно наличие остаточного пространства и продолжающееся выделение лимфы в условиях отсутствия адекватных путей оттока.
Концепция аутотрансплантации жировой ткани
В последнее десятилетие активно изучается роль аутологичной жировой ткани в реконструктивной хирургии молочной железы. Многочисленные исследования продемонстрировали безопасность липофилинга после мастэктомии с точки зрения онкологических рисков. Более того, были обнаружены регенеративные свойства жировой ткани, связанные с высоким содержанием стволовых клеток и факторов роста в стромальноваскулярной фракции.
Теоретическое обоснование применения жировой аутотрансплантации для профилактики осложнений биопсии сторожевого лимфатического узла базируется на нескольких механизмах. Первый механизм - это механическое заполнение дефекта. Трансплантированная жировая ткань физически занимает «мертвое пространство», устраняя резервуар для накопления лимфы. В отличие от дренажей, которые удаляются через несколько дней, жировой трансплантат обеспечивает постоянное заполнение до завершения процессов репарации.
Второй механизм связан со стимуляцией лим-фангиогенеза. Адипоциты и клетки стромальноваскулярной фракции секретируют проангиоген-ные и пролимфангиогенные факторы, способствующие формированию новых лимфатических путей в обход зоны повреждения. Этот механизм может иметь долгосрочное профилактическое значение для предотвращения лимфедемы.
Третий механизм представлен противовоспалительным и антифибротическим эффектом. Мезенхимальные стволовые клетки жировой ткани модулируют воспалительный ответ и могут снижать ин- тенсивность рубцевания, что теоретически улучшает условия для восстановления лимфооттока.
Нерешенные вопросы и обоснование исследования
Несмотря на патогенетическую привлекательность концепции, её клиническое применение сдерживается отсутствием доказательной базы. Ключевые нерешенные вопросы включают определение необходимого объёма жировой ткани для эффективного заполнения дефекта, понимание того, как этот объём варьирует в зависимости от индивидуальных характеристик пациенток, возможность стандартизации подхода или необходимость персонализации, а также динамику «мертвого пространства» в послеоперационном периоде и процент приживаемости трансплантата в условиях нарушенного кровоснабжения подмышечной области.
Попытки ответить на эти вопросы сталкиваются с методологическими трудностями. Интраоперационная визуализация и измерение тканевого дефекта технически сложны. Динамическое наблюдение с помощью ультразвукового исследования или магнитно-резонансной томографии требует стандартизации методик и является затратным.
В этих условиях анатомическое исследование на аутопсийном материале, несмотря на очевидные ограничения, может служить первым этапом для получения предварительных количественных данных об объёме тканевого дефекта, оценки межиндивидуальной вариабельности, выявления возможных предикторов, обоснования дизайна и расчета размера выборки для проспективного клинического исследования, а также разработки методологии измерения для последующей валидации in vivo. Критически важно подчеркнуть, что данное исследование не ставит целью дать клинические рекомендации, а является методологической подготовкой к полноценному клиническому изучению проблемы.
Цель исследования: получить предварительные анатомические данные об объёме тканевого дефекта, формирующегося при моделировании биопсии сторожевого лимфатического узла, и оценить его зависимость от антропометрических параметров (индекс массы тела, возраст) для обоснования методологии и дизайна проспективного клинического исследования.
Материалы и методы
Дизайн и этические аспекты
Выполнено пилотное проспективное одноцентровое анатомическое исследование на аутопсийном материале. Исследование одобрено локальным этическим комитетом ГБУЗ ММНКЦ им. С.П. Боткина и проводилось на базе патологоанатомического отделения учреждения.
Характеристика материала
Исследование выполнено на 12 аутопсийных препаратах лиц женского пола в возрасте 65,1±16,9 лет (диапазон 48–82 года) с различным индексом массы тела (от 17,2 до 31,4 кг/м2). В качестве критериев включения использовались следующие параметры: аутопсийный материал лиц женского пола, возраст от 40 до 85 лет, соответствующий целевой популяции пациенток с раком молочной железы, наличие достоверных антропометрических данных в медицинской документации, время от момента смерти до вскрытия не более 24 часов и отсутствие признаков выраженных посмертных изменений. Критериями исключения служили предшествующие операции в подмышечной области, лимфедема верхней конечности в анамнезе, выраженная кахексия или морбидное ожирение, генерализованная подкожная эмфизема и выраженный посмертный аутолиз тканей.
Поскольку измерения проводились билатерально на правой и левой подмышечных областях, было получено 24 независимых измерения объёма тканевого дефекта. Распределение материала по индексу массы тела показало, что дефицит массы тела (индекс менее 18,5 кг/м²) наблюдался в 2 случаях, нормальная масса тела (индекс 18,5–24,9 кг/м2) – в 6 случаях, избыточная масса тела (индекс 25,0– 29,9 кг/м2) – в 3 случаях, а ожирение I степени (индекс 30,0 кг/м2 и выше) – в 1 случае. По возрастным группам материал распределился следующим образом: группа 48–59 лет включала 4 случая, группа 60–71 год – 5 случаев, группа 72–82 года – 3 случая.
Стандартизация антропометрических данных
Для каждого случая из медицинской документации извлекались дата рождения для расчёта возраста на момент смерти, масса тела перед госпитализацией в килограммах и рост в сантиметрах. Индекс массы тела рассчитывался по стандартной формуле: масса в килограммах, деленная на квадрат роста в метрах. Следует отметить, что использовались прижизненные антропометрические данные, что может не полностью соответствовать посмертному состоянию тканей из-за перераспределения жидкости.
Методика моделирования биопсии сторожевого лимфатического узла
Все манипуляции выполнялись единым оператором для минимизации межоператорской вариабельности. Аутопсийный препарат располагался на секционном столе в положении на спине с отведенной на 90 градусов верхней конечностью. Проводилась пальпаторная идентификация анатомических ориентиров, включая нижний край большой грудной мышцы, передний край широчайшей мышцы спины и латеральный край малой грудной мышцы.
Разрез кожи длиной 5 см выполнялся в проекции I уровня подмышечных лимфоузлов латераль-нее латерального края малой грудной мышцы, ориентируясь на стандартную хирургическую технику биопсии сторожевого лимфатического узла. После рассечения кожи и подкожной клетчатки идентифицировалась и рассекалась поверхностная фасция. Тупым и острым путём выполнялась мобилизация жировой клетчатки I уровня. Удалялся тканевой блок, имитирующий объём при стандартной биопсии сторожевого лимфатического узла, включающий один или два лимфоузла I уровня с окружающей жировой клетчаткой. Средний размер блока составлял приблизительно 3×2×1,5 см. Следует отметить, что размер удаляемого блока варьировал в зависимости от анатомических особенностей, что отражает реальную клиническую практику, но вносит элемент вариабельности.
После удаления тканевого блока визуально оценивалось сформированное «мертвое пространство» и производилась фотодокументация. Для предотвращения утечки измеряемого материала выполнялось ушивание поверхностной фасции непрерывным швом монофиламентной нитью, проводился контроль герметичности путём лёгкой компрессии окружающих тканей, и при необходимости выполнялось дополнительное ушивание участков потенциальной утечки.
Методика измерения объёма дефекта
Разработанная методика измерения основана на принципе волюметрии путём заполнения полости материалом известной плотности. Использовался стоматологический гипс класса III с соотношением порошок к воде 100 грамм на 50 миллилитров. Время замешивания составляло 60 секунд до получения однородной консистенции. Плотность готового раствора приблизительно равнялась 1,0 г/см3.
Гипсовый раствор набирался в градуированный шприц объёмом 10 миллилитров и медленно вводился в полость дефекта через иглу калибра 18G до появления сопротивления и визуального заполнения пространства. Контролировалось отсутствие утечки и фиксировался объём введенного раствора. Объём дефекта рассчитывался исходя из количества введённого раствора при допущении, что плотность раствора близка к 1,0 г/см3, следовательно, один миллилитр раствора соответствует одному кубическому сантиметру объёма дефекта.
После застывания гипса, которое занимало от 10 до 15 минут, производилась препаровка тканей для извлечения гипсового слепка, визуальная оценка полноты заполнения дефекта, и при обнаружении пустот делалась отметка об ограничении валидности измерения. На контралатеральной стороне выполнялась идентичная процедура для получения парного измерения.
Статистический анализ
Статистическая обработка данных проводилась с использованием программного обеспечения Statistica 10.0. Количественные данные представлены как среднее значение плюс-минус стандартное отклонение. Для малых подгрупп дополнительно указывались медиана и интерквартильный размах. Проверка нормальности распределения проводилась с помощью теста Шапиро – Уилка.
Для оценки связи между объёмом дефекта и непрерывными переменными, такими как индекс массы тела и возраст, использовался коэффициент корреляции Пирсона. Сила связи интерпретировалась следующим образом: значения менее 0,3 по модулю считались слабой связью, от 0,3 до 0,7 – умеренной связью, более 0,7 – сильной связью. Сравнение средних значений между группами проводилось с помощью однофакторного дисперсионного анализа с использованием post-hoc теста Тьюки для множественных сравнений. Уровень статистической значимости был установлен на уровне p<0,05.
Поскольку выполнялись парные измерения на одном объекте, для корреляционного анализа использовалось среднее значение правой и левой сторон для каждого случая, что дало выборку размером 12 наблюдений. Для оценки межсторонней вариабельности рассчитывался коэффициент вариации. При интерпретации результатов учитывалась малая выборка, что снижает статистическую мощность и не позволяет экстраполировать результаты на генеральную совокупность. Результаты рассматриваются как предварительные, требующие валидации на большей выборке.
Результаты
Общие характеристики объёма тканевого дефекта
При анализе всей совокупности измерений (24 билатеральных измерения) средний объём тканевого дефекта составил 3,5±0,6 см3. Медиана составила 3,4 см3, интерквартильный размах от 3,0 до 4,0 см3. Минимальное значение составило 2,0 см3, максимальное – 4,8 см3. Коэффициент вариации составил 17,1 процента. Тест Шапиро – Уилка подтвердил нормальность распределения.
При анализе парных измерений правой и левой сторон у одного пациента средняя разница составила 0,3±0,2 см3 с диапазоном от 0,1 до 0,7 см3, что составляет 8,6% от среднего значения. Это указывает на приемлемую воспроизводимость методики и относительную симметричность анатомии подмышечных областей.
Таблица 1. Количество исследованных трупов в зависимости от индекса массы тела
Table 1. Number of examined corpses depending on body mass index
|
Индекс массы тела |
Количество трупов |
|
<18,5 (дефицит массы тела) |
2 |
|
18,5–25 (норма) |
6 |
|
>25 (избыточная масса тела) |
4 |
Таблица 2. Количество исследованных трупов в зависимости от возраста
Table 2. Number of examined corpses depending on age
|
Возрастной диапазон |
Количество трупов |
|
48–59 |
4 |
|
60–71 |
5 |
|
72–82 |
3 |
Таблица 3. Объём «мертвого пространства» в зависимости от индекса массы тела
Table 3. Dead space volume depending on body mass index
|
Индекс массы тела |
Объем «мертвого пространства» (см3) |
|
<18,5 (дефицит массы тела) |
2,2±0,3* |
|
18,5–25 (норма) |
3,4±0,2 |
|
>25–30 (избыточная масса тела) |
4,1±0,5 |
Примечание: * – различия статистически значимы при p=0,05.
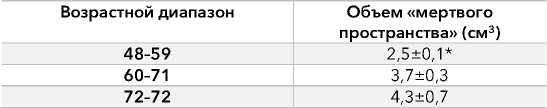
Таблица 4. Объём «мертвого пространства» в зависимости от возраста
Table 4. Volume of “dead space” depending on age
Примечание: * – различия статистически значимы при p=0,05.
Рисунок 1. Заполнение «мертвого пространства» гипсовым раствором при моделировании биопсии сторожевого лимфоузла на аутопсийном материале
Figure 1. Filling the “dead space” with plaster solution when modeling a sentinel lymph node biopsy on autopsy material
Корреляционный анализ
Обнаружена сильная положительная корреляция между объёмом тканевого дефекта и индексом массы тела с коэффициентом корреляции 0,70 (p=0,012) и 95% доверительным интервалом от 0,22 до 0,90. Это означает, что индекс массы тела объясняет примерно 49% вариабельности объёма дефекта. С увеличением индекса массы тела на 1 килограмм на квадратный метр объём дефекта увеличивается в среднем на 0,10 см3 по данным линейной регрессии.
Выявлена также умеренная положительная корреляция между объёмом дефекта и возрастом с коэффициентом корреляции 0,61 (p=0,035) и 95% доверительным интервалом от 0,06 до 0,87. Возраст объясняет примерно 37% вариабельности объёма дефекта. С увеличением возраста на 10 лет объём дефекта увеличивается в среднем на 0,25 см3.
При построении модели множественной линейной регрессии с включением обоих предикторов получено уравнение: объём = 0,8 + 0,08×индекс массы тела+0,02×возраст. Коэффициент детерминации составил 0,64, что означает, что модель объясняет 64% вариабельности. Критерий Фишера составил 8,9 с уровнем значимости 0,007, при этом оба предиктора остаются статистически значимыми. Следует отметить, что, учитывая малый размер выборки, данная модель имеет высокий риск переобучения и требует валидации на независимой выборке.
Стратификационный анализ
Объём тканевого дефекта в зависимости от категории индекса массы тела показал следующие результаты. При дефиците массы тела (индекс менее 18,5 кг/м2) на основании 2 наблюдений средний объём составил 2,2±0,3 см3 с медианой 2,2 см3 и диапазоном от 2,0 до 2,4 см3. При нормальной массе тела (индекс 18,5–24,9 кг/м2) на основании 6 наблюдений средний объём составил 3,4±0,2 см3 с медианой 3,4 см3а и диапазоном от 3,1 до 3,7 см3. При избыточной массе тела (индекс 25,0 кг/м2 и более) на основании 4 наблюдений средний объём составил 4,1±0,5 см3 с медианой 4,0 см3 и диапазоном от 3,6 до 4,8 см3. Дисперсионный анализ с post-hoc тестом Тьюки показал статистически значимые различия между группами с дефицитом и нормальной массой тела (p<0,05), а также между группами с дефицитом и избытком массы тела (p<0,01).
Разница между группами с дефицитом и избытком массы тела составила 1,9 см3, что представляет 86% от минимального значения. Это клинически значимая разница, которая может влиять на выбор объёма трансплантата. Группа с нормальной мас- сой тела демонстрировала наименьшую вариабельность с коэффициентом вариации 5,9%.
Объём тканевого дефекта в зависимости от возрастной группы показал следующее распределение. В возрастной группе 48–59 лет на основании 4 наблюдений средний объём составил 2,5±0,1 см3 с медианой 2,5 см3 и диапазоном от 2,4 до 2,6 см3. В группе 60–71 год на основании 5 наблюдений средний объем составил 3,7±0,3 см3 с медианой 3,6 см3 и диапазоном от 3,4 до 4,1 см3. В группе 72–82 года на основании 3 наблюдений средний объём составил 4,3±0,7 см3 с медианой 4,2 см3 и диапазоном от 3,7 до 5,0 см3.
Наблюдается прогрессивное увеличение объёма дефекта с возрастом. Разница между младшей и старшей группами составила 1,8 см3, что представляет 72% от минимального значения. Наибольшая вариабельность отмечена в старшей группе с коэффициентом вариации 16,3%, что может отражать большую гетерогенность возрастных изменений.
Для клинической интерпретации был проведён комбинированный анализ объёма дефекта при сочетании факторов риска. Группа низкого риска, включающая пациенток в возрасте менее 60 лет с индексом массы тела менее 25 кг/м2 (3 наблюдения), имела средний объем 2,3±0,2 см3. Группа среднего риска с наличием одного фактора (6 наблюдений) имела средний объём 3,5±0,3 см3. Группа высокого риска с возрастом 70 лет и старше и индексом массы тела 25 кг/м2 и более (3 наблюдения) имела средний объём 4,5±0,4 см3. Разница между группами низкого и высокого риска составила 2,2 см3 (p=0,003).
Качественные наблюдения
При выполнении процедуры были отмечены следующие закономерности. У пациенток с индексом массы тела более 25 кг/м2 жировая клетчатка I уровня имела более рыхлую консистенцию, что способствовало формированию больших дефектов. У пациенток старше 70 лет отмечалось снижение тургора тканей и лёгкость их мобилизации. В 3 случаях, что составляет 25%, при препаровке были обнаружены добавочные лимфоузлы, что потребовало расширения объёма удаляемого блока.
С технической точки зрения в 2 случаях, что составляет 16,7%, отмечена частичная утечка гипсового раствора при заполнении, что потребовало повторного ушивания фасции. Время застывания гипса варьировало от 8 до 17 минут. В 21 из 24 измерений, что составляет 87,5%, гипсовый слепок полностью соответствовал форме дефекта при визуальной оценке.
Обсуждение
Интерпретация основных результатов
Данное пилотное исследование впервые предоставляет количественные анатомические данные об объёме тканевого дефекта, формирующегося при биопсии сторожевого лимфоузла. Средний объём 3,5 см3в с вариабельностью от 2,0 до 4,8 см3 свидетельствует о значительной межиндивидуальной изменчивости, что обосновывает необходимость персонализированного подхода к выбору объёма аутотрансплантата.
Диапазон объёмов в 2,4 раза означает, что использование стандартизированного объёма жировой ткани для всех пациенток может быть либо недостаточным при большом дефекте, либо избыточным при малом дефекте. Недостаточный объём может привести к неполному заполнению дефекта и сохранению риска серомы или лимфореи. Избыточный объём может вызвать компрессию окружающих тканей с риском ишемии трансплантата и некроза.
Обнаруженная сильная корреляция между индексом массы тела и объёмом дефекта согласуется с анатомической логикой, согласно которой у пациенток с более высоким индексом массы тела подмышечная жировая клетчатка имеет больший объём. Сравнение с литературой показывает, что при магнитно-резонансной томографии-волюметрии объём подмышечной клетчатки у женщин с индексом массы тела более 30 кг/м2 в среднем на 40% больше, чем при индексе менее 25 кг/м2. Наши данные демонстрируют пропорциональное увеличение объёма дефекта на 86% при сравнении крайних групп по индексу массы тела. Практическое значение этого наблюдения состоит в том, что индекс массы тела может использоваться как простой и доступный предиктор для предоперационного планирования объёма жирового трансплантата.
Умеренная корреляция с возрастом может объясняться несколькими механизмами. Во-первых, возрастными изменениями жировой ткани с увеличением доли рыхлой клетчатки и снижением плотности коллагенового каркаса. Во-вторых, снижением тургора тканей, что облегчает мобилизацию и может приводить к формированию больших дефектов при том же объёме удаленной ткани. В-третьих, возрастным перераспределением жира с преимущественным накоплением в туловище, включая подмышечную область. Следует отметить, что связь возраста и объёма дефекта может быть частично опосредована индексом массы тела, поскольку с возрастом часто повышается индекс массы тела. Однако в модели множественной регрес- сии оба фактора остались значимыми, что говорит об их независимом вкладе.
Ограничения исследования
Данное исследование имеет критические ограничения, которые не позволяют экстраполировать полученные количественные данные на клиническую практику.
Использование трупного материала представляет фундаментальное ограничение. Посмертное отсутствие сосудистого тонуса и тканевого тургора приводит к тому, что ткани теряют эластичность и гидростатическое давление, что может завышать объём дефекта на 15–30% по сравнению с прижизненными условиями. Кроме того, отсутствуют динамические процессы, которые характерны для живых тканей, такие как формирование отёка, ретракция окружающих тканей и начало фибротиза-ции, которые могут изменять объём дефекта в 1,5–2 раза в течение первых 7–10 дней после операции. Отсутствие кровотечения в трупном материале также искажает картину, поскольку в живых тканях кровь и сгустки частично заполняют дефект. Посмертное перераспределение жидкости может дополнительно искажать анатомию.
Малый размер выборки в 12 наблюдений создает статистические ограничения, включая недостаточную мощность для выявления слабых эффектов, широкие доверительные интервалы для коэффициентов корреляции, риск ложноположительных результатов при множественных сравнениях и невозможность надежной стратификации на подгруппы. Выборка также не репрезентативна для целевой популяции пациенток с раком молочной железы, а средний возраст в выборке выше медианы возраста при диагностике рака молочной железы.
Метод измерения не был валидирован путём сравнения с «золотым стандартом», таким как магнитно-резонансная томография-волюметрия. Неизвестна точность метода заполнения гипсом из-за возможных микропустот. Не оценивалась межоператорская и внутриоператорская вариабельность. Влияние техники ушивания фасции на результат не изучено.
Невозможность учёта индивидуальной анатомии лимфоузлов, количество которых варьирует от одного до пяти на I уровне, а размер и расположение индивидуальны, влияет на объём удаляемого блока, но не было стандартизировано. Отсутствие учёта различий в хирургической технике, таких как острая versus тупая диссекция, использование энергетических устройств и техники гемостаза, также ограничивает применимость результатов.
Измерение проводилось однократно сразу после моделирования, что не позволяет оценить ди- намику дефекта во времени. Исследование не учитывает процент приживаемости трансплантата, который по литературным данным варьирует от 40% до 80% в условиях нарушенного кровоснабжения подмышечной зоны.
Несмотря на эти ограничения, исследование позволяет утверждать, что существует межиндивидуальная вариабельность объёма тканевого дефекта, выявлена корреляция с индексом массы тела и возрастом на трупном материале, предварительно оценен порядок величины объёма в диапазоне 3–4 см3, обоснована необходимость персонализированного подхода и разработана воспроизводимая методика анатомического измерения. Однако нельзя давать клинические рекомендации по объёму трансплантата, утверждать применимость данных к живым пациентам, говорить об эффективности аутотрансплантации для профилактики осложнений, определять оптимальный объём трансплантата с учётом резорбции или описывать динамику изменения дефекта в послеоперационном периоде.
Направления дальнейших исследований
Результаты данного пилотного исследования обосновывают необходимость многофазного подхода к клиническому изучению проблемы.
На первом этапе необходима валидация метода измерения in vivo. Проспективное обсервационное исследование на 30–50 пациентках с биопсией сторожевого лимфатического узла должно включать сравнение методов интраоперационной визуальной оценки, ультразвукового исследования на первые сутки и магнитно-резонансной томографии на третьи сутки. Целью является достижение согласованности между методами с коэффициентом внутриклассовой корреляции более 0,8, а также оценка межоператорской вариабельности, динамики объёма дефекта в первые семь дней и корреляции с прижизненными антропометрическими параметрами.
На втором этапе необходимо обсервационное исследование естественной эволюции тканевого дефекта. Проспективное когортное исследование на 100–150 пациентках с биопсией сторожевого лимфатического узла без трансплантации должно включать серийные ультразвуковые исследования в дни 1, 3, 7, 14 и 30. Первичной конечной точкой должна стать корреляция объёма дефекта с развитием серомы или лимфореи. Вторичные конечные точки должны включать скорость спонтанного заполнения дефекта, предикторы персистирующего дефекта и частоту лимфедемы через шесть месяцев в зависимости от исходного объёма дефекта.
На третьем этапе необходимо пилотное интервенционное исследование безопасности и выпол- нимости. Одногрупповое пилотное исследование на 30 пациентках должно включать интраоперационное измерение дефекта и немедленную трансплантацию жира в объёме 120–150% от измеренного дефекта с учётом частичной резорбции. Первичной конечной точкой должна стать безопасность с оценкой частоты серьёзных нежелательных явлений. Вторичные конечные точки должны включать выполнимость успешного заполнения в 80% случаев и более, приживаемость трансплантата по данным магнитно-резонансной томографии-волюметрии на третий и шестой месяцы, частоту лимфореи и серомы, а также онкологическую безопасность с мониторингом в течение двух лет.
На четвертом этапе должно быть проведено многоцентровое рандомизированное контролируемое исследование с включением 200 пациенток, по 100 в каждой группе. Группа вмешательства должна получать биопсию сторожевого лимфатического узла с персонализированной аутотрансплантацией, контрольная группа – стандартную биопсию сторожевого лимфатического узла. Первичной конечной точкой должна стать частота клинически значимой лимфореи, требующей более трёх пункций или дренирования более семи дней. Вторичные конечные точки должны включать частоту лимфедемы через 12 месяцев, время до начала адъювантной терапии, качество жизни по опроснику EORTC QLQ-BR23, онкологические исходы с оценкой безрецидивной выживаемости и экономическую эффективность.
Выводы
В пилотном анатомическом исследовании на трупном материале средний объём тканевого дефекта при моделировании биопсии сторожевого лимфоузла составил 3,5±0,6 см3 с вариабельностью от 2,0 до 4,8 см3.
Обнаружена статистически значимая положительная корреляция объёма дефекта с индексом массы тела (коэффициент корреляции 0,70; p=0,012) и возрастом (коэффициент корреляции 0,61; p=0,035), что свидетельствует о необходимости персонализированного подхода к выбору объёма аутотрансплантата.
Разработана стандартизированная методика моделирования биопсии сторожевого лимфоузла и измерения объёма остаточного тканевого дефекта на аутопсийном материале с приемлемой воспроизводимостью, о чём свидетельствует межсторонняя вариабельность 8,6%.
Критически важно подчеркнуть, что использование трупного материала не позволяет экстраполировать полученные количественные данные на клиническую практику. Результаты имеют исключи- тельно предварительный характер и требуют валидации в проспективных клинических исследованиях in vivo.
Полученные данные служат анатомическим обоснованием для разработки дизайна многофазного клинического исследования по изучению роли персонализированной аутотрансплантации жи- ровой ткани в профилактике осложнений биопсии сторожевого лимфоузла.
Клинические рекомендации по применению аутотрансплантации жировой ткани при биопсии сторожевого лимфатического узла могут быть разработаны только после завершения рандомизированных контролируемых исследований, оценивающих эффективность и безопасность метода.


