Анемия хронических заболеваний как фактор риска у больных со стволовым поражением коронарного русла
Автор: Абдуллаева Саодат Яшиновна, Никишин Алексей Геннадиевич, Пирназаров Махмуджон Махкамович, Якуббеков Надыр Тахирович, Хасанов Максуд Саидрахимович, Юлдашев Наби Примович, Ганиев Алиер Авазович, Бобожонова Нигина Жуманиязовна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Цель: в статье авторы проводят оценку анемии как предиктора неблагоприятного исхода у больных с поражением ствола левой коронарной артерии. Материал и методы. В исследование включено 112 больных обоего пола с поражением ствола ЛКА в сочетании с поражением одной коронарной артерии по данным коронароангио-графического исследования, находившихся на стационарном лечении в РСЦК в 2015-2016 гг. Результаты. Авторами установлено, что в большинстве случаев анемия у больных ИБС не является железодефицитной и, следовательно, введение железа бесполезно. Помимо этого анемия является самостоятельным предиктором неблагоприятных исходов у больных ИБС с поражением ствола левой коронарной артерии. В сложных группах больных необходимы коррекция и контроль уровня гемоглобина с целью предупреждения как снижения, так и повышения его уровня выше рекомендованных значений.
Ишемическая болезнь сердца, ствол левой коронарной артерии, анемия, предикторы неблагоприятных исходов
Короткий адрес: https://sciup.org/14343114
IDR: 14343114 | УДК: 616.155.194:
Текст научной статьи Анемия хронических заболеваний как фактор риска у больных со стволовым поражением коронарного русла
Анемический синдром – нередкое явление среди коронарных больных [1]. Установлено существенное значение анемии как фактора риска неблагоприятного прогноза при различных формах ишемической болезни сердца (ИБС), в частности при остром коронарном синдроме и сердечной недостаточности [1, 2].
При остром инфаркте миокарда анемия сочетается с повышенным риском развития постинфарктной стенокардии, рецидивированием инфаркта миокарда, неблагоприятным течением кардиогенного шока и развитием более тяжелых проявлений сердечной недостаточности после инфаркта миокарда [3]. Кроме того, анемический синдром считается одним из экстракардиальных механизмов, способствующих проявлению ишемической болезни сердца, в связи с чем считается целесообразным учитывать данный фактор у больных с нестабильной стенокардией [4].
Однако следует отметить, что анемия у стационарных больных с ишемической болезнью сердца недостаточно отражена как проблема. Данные о причинах развития анемического синдрома у коронарных больных немногочисленны и противоречивы [5]. В связи с этим мы хотели бы оценить влияние анемии на прогноз у больных с поражением ствола левой коронарной артерии
Цель: оценить анемию как предиктор неблагоприятного исхода у больных с поражением ствола левой коронарной артерии
МАТЕРИАЛ И МЕТОДЫ
Проведено наблюдение 112 больных с поражением ствола левой коронарной артерии (ЛКА) в сочетании с одной-двумя коронарными артериями меньшего калибра по данным коро-нарографического исследования, находившихся на стационарном лечении в РСЦК в 2015-2016 гг.
По данным 12 месячного наблюдения в зависимости от исходов больные были разбиты на 2 группы: благоприятного (n=70) и неблагоприятного (n=42) исхода через год от начала исследования. Понятие «неблагоприятный исход» включало в себя развитие одного из следующих событий: летальный исход, повторный ИМ (нефатальный), прогрессирование коронарной недостаточности, развитие и прогрессирование сердечной недостаточности (СН), по данным ШОКС в модификации В. Мареева [6], повторные госпитализации. В обеих группах изучались показатели липидного спектра, в частности уровень общего холестерина, триглицеридов, липопротеиды высокой, низкой и очень низкой плотности, а также коэффициент атерогенности, некоторые показатели биохимии: аланин- и аспартатаминотрансферазы, билирубин, мочевина, креатинин. Скорость клубочковой фильтрации подсчитывалась по формуле Кокрофта-Гауфта. Также рассматривались уровни гемоглобина, гематокрита, тромбоцитов, лейкоцитов, скорость оседания эритроцитов, ПТИ, МНО и фибриноген.
Статистическая обработка данных выполнялась с применением специализированной программы Statistica 6.0, а также MS Excel 2007. В связи с тем, что полученные данные относились к разряду непараметрических, для подсчета достоверности результатов были использована четырехпольная таблица и критерий Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По нашим данным, обе группы были сопоставимы по основным демографическим и клиническим показателям. Не отмечалось достоверных различий в отношении пола и возраста. В обеих группах наблюдалось подавляющее большинство лиц мужского пола: 85% к 15% и 91,7% к 8,3% с Р=0,00001. Средний возраст пациентов составил 56,7±4,62 лет в первой и 66,4±3,82 во второй группе (р=0,1).
Гипертоническая болезнь примерно в равном объеме присутствовала в обеих группах (95% в группе с благоприятными и 100% в группе с неблагоприятными исходами, р=0,1). Сахарный диабет незначимо преобладал в группе с неблагоприятными исходами: 50% к 40%, р=0,44. ЖЭ высоких градаций регистрировалась в 10% в группе с благоприятными и 16,7% в группе с неблагоприятными исходами, р=0,43, язвенная болезнь двенадцатиперстной кишки в стадии ремиссии (у различных пациентов) наблюдались у 15% пациентов благоприятной и у 83% неблагоприятной группы (р=0,35). В группе больных с неблагоприятными исходами впятеро больше больных с анемией 25% к 5%, р=0,002. Встречаемость ХОБЛ в обеих группах была примерно одинакова (20% и 16,7%, р=0,66).
Изначально в группе неблагоприятных исходов преобладали пациенты с анемией. При этом средний уровень гемоглобина в этой группе составил 114,4 г/л, тогда как в группе с благоприятными исходами он достигал 131,8 г/л. Р=0,0001.
Подобная ситуация сохранялась до конца 1-го года наблюдения включительно, что отражено на графике 1.
График 1. Сравнительная динамика уровня гемоглобина в группах
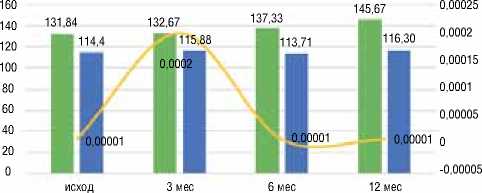
Благоприятный исход Неблагоприятный исход р
* Различия достоверны при р ≤ 0,05
Необходимо отметить прямую и сильную корреляцию уровня гемоглобина и количества эритроцитов в группах. Особенно это заметно в группе неблагоприятных исходов, в которой преобладает частота анемий (таблица 1).
Таблица 1. Корреляция между уровнем гемоглобина
|
и количеством эритр |
оцитов в группах |
||||
|
Благоприятные исходы |
Коэффициент корреляции |
Неблагоприятные исходы |
|||
|
g £ |
Гемоглобин г/л |
131,8±13,1 |
0,78 |
0,81 |
114,4±12,1 |
|
Эритроциты 1012/л |
4,34±0,39 |
3,84±0,53 |
|||
|
CO |
Гемоглобин г/л |
132,7±10,74 |
0,94 |
0,90 |
115,88±10,9 |
|
Эритроциты 1012/л |
4,48±0,33 |
4,07±0,31 |
|||
|
о £ co |
Гемоглобин г/л |
137,3±4,4 |
0,73 |
0,60 |
113,7±10,3 |
|
Эритроциты 1012/л |
4,46±0,18 |
3,85±0,28 |
|||
|
Гемоглобин г/л |
145,6±15,48 |
0,90 |
0,91 |
116,3±12,9 |
|
|
g |
Эритроциты 1012/л |
4,74±0,34 |
3,78±0,36 |
||
* коэффициент корреляции, близкий к 1, считается сильной прямой корреляцией
График 2 отражает низкий уровень эритроцитов в группе с неблагоприятными исходами. Обращает на себя внимание значительная и достоверная разница показателей на протяжении всего времени наблюдения.
График 2. Сравнительная динамикауровня эритроцитов в группах
4,5
3,5
2,5 2
1,5
0,5 0
0,0006
0 0,5 1 1,5 2 2,5 3 2,5 4 4,5
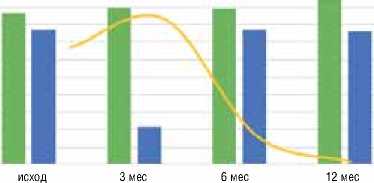
0,0005
0,0004
0,0003
0,0002
0,0001
Благоприятный исход Неблагоприятный исход
* Различия достоверны при р ≤ 0,05
Снижение гематокрита в группе неблагоприятных исходов значимо и достоверно как исходно, так и в динамике (график 3). Существенные различия сохраняются вплоть до 12-го месяца наблюдения.
График 3. Сравнительная динамика уровня гематокрита в группах
0 45,00 40,00 35,00
30,00
25,00
20,00
15,00
10,00 5,00
0,00
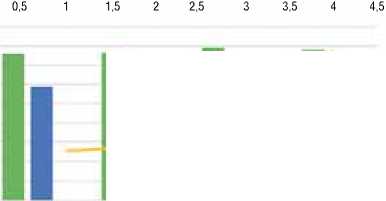
0,00035
0,0003
0,00025
0,0002
0,00015
0,0001
0,00005
Ill il
3 мес
6 мес
12 мес исход
Благоприятный исход Неблагоприятный исход р
лоэндотелиальной системе (РЭС) [7]. В случае наличия ХСН данный вид анемии является самым распространенным и отмечается у 58% пациентов [8]. Стоит отметить, что в изучаемых группах ХСН наблюдалась у подавляющего большинства пациентов: 93,5% в группе с благоприятными и в 100% случаев в группе с неблагоприятными исходами.
ОБСУЖДЕНИЕ
* Различия достоверны при р ≤ 0,05
Постоянная и сильная корреляция снижения уровня гемоглобина и количества эритроцитов вкупе с некоторыми другими показателями указывает на вид анемии.
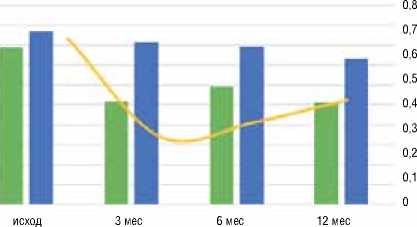
В обеих группах не было зафиксировано значимого снижения среднего объема эритроцита (MCV, N=82,0-95,0 ф/л): 86,8±2,36 ф/л в группе с благоприятными исходами, 83,2±2,64 ф/л в группе с неблагоприятными исходами, р=0,82, и среднего содержания гемоглобина в эритроците (МСН, аналог цветового показателя, N=27,0-32,0 п/г): 30,04±0,46 п/г в группе с благоприятными исходами, 29,5±1,32 п/г в группе с неблагоприятными исходами, р=0,72, а также роста анизоцитоза эритроцитов (RDW-CV, N=11,5-14,5 %): 13,44±0,58 % в группе с благоприятными исходами, 14,7±1,8 п/г в группе с неблагоприятными исходами, р=0,48, что позволяет исключить железодефицитную анемию. Также необходимо отметить повышенный уровень СОЭ в обеих группах. В динамике в группе неблагоприятных исходов уровень СОЭ несомненно выше, при этом превышает верхнюю границу нормы. С учетом несомненного превалирования мужчин в группах, за нормальные показатели принимались таковые для мужчин (график 4).
График 4. Сравнительная динамика COЭ в группах
Наличие анемии у пациентов само по себе ассоциировано с пожилым возрастом, нарушением функции почек, сахарным диабетом, тяжелой сердечной недостаточностью, снижением переносимости физических нагрузок и низкими показателями качества жизни [9]. Помимо этого, необходимо отметить, что снижение уровня гемоглобина уменьшает коронарный резерв, что в совокупности с сужением или закупоркой одной или нескольких коронарных артерий может привести к фатальным последствиям [10]. В этой связи наибольшую ценность представляют исследования, выполненные на больших выборках, позволяющие при анализе провести коррекцию на другие факторы риска.
Из исследований, проведенных на популяционном уровне, по данному вопросу можно выделить ARIC-study (Atherosclerosis Risk in Communities), в котором проводилось наблюдение более 6 лет за почти 14 000 пациентов без сердечно-сосудистых заболеваний (ССЗ) [11]. При оценке анемии как фактора риска ССЗ оказалось, что пациенты со сниженным уровнем гемоглобина имели риск развития указанных заболеваний почти в 1,5 раза выше вне зависимости от всех остальных факторов риска ССЗ (график 5).
График 5. Кривые Каплана-Мейера для ССЗ у мужчин и женщин, стратифицированных по наличию или отсутствию анемии [11]
1.0
0.98
0.96
0.94
0.92
0.90
0.88
0.86
0.84
0.82
0.80

Женщины ( р =0,4) (Hb<12 г/дл)
Женщины без анемии Женщины с анемией Мужчины без анемии Мужчины с анемией
Мужчины ( р =0,3)
(Hb<13 г/дл)
n=13,883
20,00 18,00 16,00 14,00 12,00 10,00 8,00
6,00 4,00
2,00 0,00
Дни
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
Благоприятный исход Неблагоприятный исход р
* Различия достоверны при р ≤ 0,05
Учитывая всё вышеперечисленное, можно с уверенностью сказать, что в данной группе больных наблюдается именно анемия хронических заболеваний (АХЗ). Характерной чертой этого типа анемии является сочетание пониженного уровня железа сыворотки с достаточными его запасами в ретику-
Анализ других работ по оценке популяционного риска анемии дал противоречивые результаты. Исследователи пришли к выводу о необходимости дополнительных изысканий для определенных рекомендаций в этой области [12].
Наши данные убедительно демонстрируют отрицательное влияние как исходной, так и сохраняющейся в динамике анемии на течение ИБС в группе больных с поражением ствола левой коронарной артерии. Не исключено, что сниженный уровень гемоглобина поддерживался лекарственными средствами, входящими в стандарт терапии подобных пациентов: ацетилсаллициловая кислота и ингибиторы ангиотензинпрев-ращающего фермента [13]. Кроме того, необходимо помнить, что нитраты способны вызывать метгемоглобинемию и привести к снижению кислородной емкости крови, правда этот эффект наблюдается в основном при использовании очень высоких доз [14]. Сходная картина также может наблюдаться при хронических заболеваниях почек (ХБП) и при кровопо-
терях на фоне приема антиагрегантов, однако в изучаемых группах зарегистрирован лишь 1 пациент с ХБП (в группе с благоприятными исходами), случаев кровотечения по тем или иным причинам за время наблюдения зафиксировано не было. Что касается связи анемии и хронической сердечной недостаточности, хотелось бы подчеркнуть, что по тяжести и встречаемости ХСН обе группы значимо не различались: 93,5% и 100%, р=0,92, общая частота ХСН 55% и 78,5%, р=0,1 – частота встречаемости ХСН II (А и Б), в группах с благоприятным и неблагоприятным исходом соответственно.
Однако, несомненно, основную роль в патогенезе анемии в этой группе больных играет именно воспаление. Ранее мы уже писали о повышении уровня маркеров воспаления в качестве предиктора неблагоприятных исходов в сложных группах больных [15]. Теперь хотелось бы добавить к этому, что воспаление приводит к неблагоприятным исходам также и опосредованно: цитокины и клетки РЭС вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [16]. При обосновании лечения анемии хронических заболеваний (АХЗ) исходят из того, что анемия сама по себе приводит к гипоксии тканей, формированию анемического сердца; ее развитие при различных заболеваниях связано с ухудшением прогноза. Выраженная АХЗ требует коррекции, особенно у пациентов с наличием дополнительных факторов риска (ИБС, заболевания легких, хронические заболевания почек) [17].
В связи с этим необходима как коррекция исходной анемии, так и наблюдение с последующим предупреждением развития анемии в дальнейшем. Однако прежде чем назначать препараты железа, необходимо определить сывороточный уровень ферритина. При этом у пациентов с АХЗ он повышен, при сопутствующем дефиците железа он снижается, но никогда не бывает таким низким, как при ЖДА. Распознать дефицит железа, сочетающегося с АХЗ у 27% пациентов с хроническими воспалительными заболеваниями, довольно трудно. Дефицитом железа у таких больных можно считать уровень ферритина в сыворотке крови <30 мкг/л, об отсутствии дефицита свидетельствует его уровень >200 мкг/л [18]. Разграничение АХЗ и ЖДА имеет важное практическое значение: некорректная трактовка пациента с АХЗ как имеющего дефицит железа влечет за собой неэффективную терапию железом с риском развития осложнений (перегрузки железом, особенно при внутривенном введении). К сожалению, у изученных нами пациентов отсутствуют вышеуказанные анализы в связи с тем, что выявление анемии явилось «побочным эффектом» общего исследования течения заболевания у пациентов со стволовым и многососудистым поражением. Поэтому данный вопрос требует дальнейшего подробного изучения.
Также следует обратить внимание, что данные, полученные в онкологических исследованиях, свидетельствуют о повышенной частоте сердечно-сосудистых неблагоприятных исходов (в основном за счет тромботических осложнений) при превышении уровня гемоглобина более 120 г/л [19]. С другой стороны, у пациентов с ХСН и ХПН не выявлено дополнительного преимущества повышения уровня гемоглобина выше 110-120 г/л, более того отмечено повышенное количество неблагоприятных исходов при повышении уровня гемоглобина выше 130 г/л, так называемая U-образная зависимость уровня гемоглобина и смертности [20]. В настоящий момент при отсутствии официальных рекомендаций по целевому уровню гемоглобина при ИБС и ХСН большинство исследователей сходятся на значении 120 г/л [21], что опять возвращает нас к необходимости дальнейшего изучения этой проблемы.
ВЫВОДЫ
-
• Анемия, в частности анемия хронических заболеваний, является самостоятельным предиктором неблагоприятных исходов у больных ИБС с поражением ствола левой коронарной артерии.
-
• В сложных группах больных необходимы коррекция и контроль уровня гемоглобина с целью предупреждения как снижения, так и повышения его выше рекомендованных значений.
-
• Снижение уровня гемоглобина даже на 4-5 г/л отражается на прогнозе заболевания и, следовательно, требует коррекции.
Список литературы Анемия хронических заболеваний как фактор риска у больных со стволовым поражением коронарного русла
- Ускач Т.М. Клинико-статистический анализ распространенности анемии у пациентов с хронической сердечной недостаточностью/Т.М. Ускач, А.Г. Кочетов, С.Н. Терещенко//Кардиология. 2011; 1: 11-17
- Adlbrecht C. Chronic heart failure leads to an expanded plasma volume and pseudoanaemia, but does not lead to a reduction in the body’s red cell volume/C. Adlbrecht, S. Kommata, M. Hulsmann//Eur. Heart J. 2008. Vol. 29,19: 2343-2350
- Шварц Ю.Г., Калюта Т.Ю., Каримов Р.Н. и др. Определение значения анемии в прогнозе рецидива острого инфаркта миокарда. Кардиоваскулярная терапия и профилактика. 2006; 4: 65-69
- AHA/ACC Guideline for the Management of Patients With Non-ST-Elevation Acute Coronary Syndromes 2014 A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines 7.18
- Суворова С.А. Завьялов А.И. Пархонюк Е.В. Шварц Ю.Г. Анемия у пациентов с ишемической болезнью сердца и гастроэзофагеальная рефлюксная болезнь. Фундаментальные исследования. 2011; 11 (2): 362-365
- Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. М.: Media Medica, 2001. С. 266
- Cash J.M., Slars D.A. The anemia of chronic disease: spectrum of associated diseases in series of unselected hospitalized patients. Am. J. Med. 1989; 87: 638
- Ezekowitz J.A., McAlister F.A., Armstrong P.W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new-onset heart failure. Circulation. 2003 Jan 21; 107 (2): 223-25
- Groenveld H.F., Januzzi J., Damman K. et al. Anemia and mortality in heart failure patients: a systematic review and metaanalysis. J Am Coll Cardiol. 2008; 52: 818-27
- Шилов А.М., Осия А.О. Ишемическая болезнь сердца, желудочно-кишечные кровотечения и железодефицитная анемия: принципы диагностики и лечения. Лечащий врач. 2012; 5: 71
- Sarnak M.J., Tighiouart H., Manjunath G. et al. Anemia as a risk factor for cardiovascular disease in The Atherosclerosis Risk in Communities (ARIC) study. J Am Coll Cardiol. 2002; 40: 27-33
- Pereira A.A., Sarnak M.J. Anemia as a risk factor for cardiovascular disease. KidneylntSuppl 2003; S32-S39
- Орлов В.А., Гиляревский С.Р., Урусбиева Д.М., Даурбекова Л.В. Влияние побочных эффектов ингибиторов ангиотензинпревращающего ферменты на тактику лечения сердечно-сосудистых заболеваний. Российский кардиологический журнал. 2005; 3: 45-49
- Штрыголь С.Ю. Нитраты: побочное действие, его профилактика и коррекция. Провизор. 2003; 9: 45-48
- Абдуллаева С.Я., Никишин А.Г., Пирназаров М.М, Якуббеков Н.Т. и соавт. Изучение маркеров воспаления (СРБ, ФНО-α и фибриногена), в качестве предикторов развития ХСН, у больных острым инфарктом миокарда с сахарным диабетом. Узбекистон Кардиологияси. 2013; 1-2: 141
- Weiss G., Goodnough L.T. Anemia of Chronic Disease//New. Eng. J. Med. -2005. -Vol. 352. -10. -1011-1023
- Murphy S.T., Parfrey P.S. The impact of anemia correction on cardiovascular disease in end-stage renal disease//Semin Nephrol. -2000; 20: 350-355
- Копылов Ф.Ю., Щекочихин Д.Ю. Анемии в кардиологической практике. Трудный пациент; том 9; № 4; 2011; стр. 50-56
- Bennett C.L., Silver S.M., Djulbegovic B.T et al. Venous thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia. JAMA. 2008; 299: 914-24
- KDOQI; National Kidney Foundation. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. Am J Kidney Dis. 2006; 47: 5: Suppl. 3: S11-145
- Silverberg D.S., Wexler D., laina A., Schwartz D. Chronic Heart Failure: The Cardiorenal Anemia Syndrome Transfusion Alter Transfusion Med. 2009; 10 (4): 189-196


