Аневризма подключичной артерии и критическая ишемия верхней конечности при синдроме грудного выхода
Автор: Шубин А.А., Карпов А.А., Магомадов Я.У., Паркин П.Н., Фаталиев Г.Б.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.20, 2025 года.
Бесплатный доступ
Обоснование. Учитывая редкость патологии, связанные с ней риски и вариабельность методов лечения, отсутствие аналогичных зарегистрированных случаев в научных базах данных, приводим клиническое наблюдение лечения пациентки с синдром грудного выхода в сочетании с добавочным шейным ребром слева, аневризмой левой подключичной артерии, тромбозом подключичной, подмышечной артерий слева, критической ишемией левой верхней конечности. Цель: демонстрация наблюдения хирургического лечения пациентки с синдром грудного выхода в сочетании с аневризма левой подключичной артерии, тромбозом подключичной, подмышечной и плечевой артерий слева, критической ишемией левой верхней конечности. Материалы и методы. Женщина 36 лет, поступила в отделение сосудистой хирургии с жалобами на боли в левой верхней конечности в покое, онемение и похолодание пальцев левой кисти. При обследовании по результатам МСКТ с внутривенным контрастированием определяются добавочные шейные рёбра, компрессия левой подключичной артерии срединной лестничной мышцей, окклюзия левых подключичной, подмышечной и плечевой артерий, а также аневризма левой подключичной артерии размерами 11х15 мм. Результаты. Выполнена резекция добавочного шейного ребра, резекция аневризмы подключичной артерии с аутовенозным протезированием, артерио-артериальной пластикой плечевой артерии слева. Послеоперационный период осложнился тромбозом плечевой артерии в средней и дистальной трети плеча слева, в связи с этим выполнена тромбэктомия из артерий левой верхней конечности, резекции дистальной трети плечевой артерии с аутовенозным протезированием слева. При контрольной МСКТ с внутривенным контрастированием аутовенозный протез проходим. Плечевая, локтевая и лучевая артерии контрастируются гомогенно на всем протяжении. Заключение. Клиническое наблюдение демонстрирует успешный результат одномоментного хирургического лечения пациентки с синдромом грудного выхода, сочетающимся с добавочным шейным ребром, аневризмой подключичной артерии и тромбозом артерий левой верхней конечности. Артериальная форма синдрома грудного выхода является самой редкой из описанных, но может быть самой опасной в перспективе сохранения конечности. При несвоевременном хирургическом лечении просвет аневризмы может тромбироваться и вызвать эмболию дистального русла с клинической картиной острой ишемии конечности.
Синдром грудного выхода, аневризма подключичной артерии, шейные ребра
Короткий адрес: https://sciup.org/140312877
IDR: 140312877 | DOI: 10.25881/20728255_2025_20_4_139
Текст научной статьи Аневризма подключичной артерии и критическая ишемия верхней конечности при синдроме грудного выхода
Понятие «синдром грудного выхода» трактуется как симптомокомплекс, проявляющийся болью, парестезиями, слабостью и/или дискомфортом в верхней конечности, связанными со сдавлением сосудисто-нервного пучка в области верхней апертуры грудной клетки [1–7]. В зависимости от формы данного синдрома и количества вовлеченных анатомических структур, характер хирургических вмешательств и их порядок может различаться или же проводиться в несколько этапов. Учитывая редкость патологии, связанные с ней риски и вариабельность методов лечения, отсутствие аналогичных зарегистрированных наблюдений в научных базах данных, мы сочли необходимым поделиться нашим опытом лечения пациентки с синдром грудного выхода в сочетании с добавочным шейным ребром слева, аневризмой левой подключичной артерии, тромбозом подключичной, подмышечной арте- рий слева, критической ишемией левой верхней конечности. Представлено наблюдение успешной резекции аневризмы левой подключичной артерии с аутовенозным протезированием, артерио-арте-риальной пластикой плечевой артерии с резекцией добавочного шейного ребра.
Женщина 36 лет, поступила в отделение сосудистой хирургии с жалобами на боли в левой верхней конечности в покое, онемение и похолодание пальцев левой кисти. Из анамнеза известно, что дли-
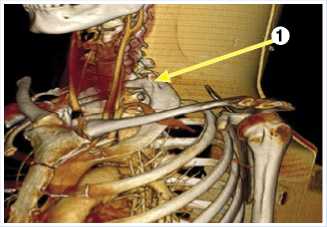
Рис. 1. МСКТ с внутривенным контрастированием, 3D-реконcтрукцией до хирургического лечения (1 – аномалия развития ребер).

тельное время находилась под динамическим наблюдением у врача-невролога и проводилось консервативное лечение по поводу парестезии пальцев левой верхней конечности. В связи с нарастанием симптомов госпитализирована по экстренным показаниям. Объективно (локальный статус): правая верхняя конечность теплая, не отечная, движения и чувствительность сохранены в полном объеме, артериальная пульсация определяется на подмышечной, плечевой, лучевой и локтевой артериях Левая кисть бледной окраски, прохладная наощупь, ладонная поверхность дистальных фаланг багровосинюшной окраски. Движения несколько ослаблены, поверхностная чувствительность дистальных фаланг пальцев снижена. Артериальная пульсация отсутствует на всех доступных пальпации уровнях. Провокационные пробы не проводились в связи с исходным отсутствием пульса на левой верхней конечности.
При обследовании по результатам МСКТ с внутривенным контрастированием определяются добавочные шейные рёбра, компрессия левой подключичной артерии срединной лестничной мышцей, окклюзия левых подключичной, подмышечной и плечевой артерий, а также аневризма левой подключичной артерии размерами 1115 мм (Рис. 1–2).
Учитывая клиническую картину и анамнез заболевания, данные инструментального обследования, пациентке установлен диагноз: синдром грудного выхода. Аневризма левой подключичной артерии. Тромбоз подключичной, подмышечной и плечевой артерий слева. Критическая ишемия левой верхней конечности. Выполнена резекция добавочного шейного ребра, резекция аневризмы подключичной артерии, с аутовенозным протезированием, артерио-артериальной пластикой плечевой артерии слева. Доступом в локтевом сгибе слева выделена
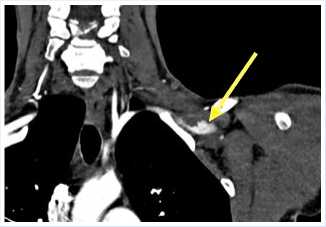
Рис. 2. МСКТ с внутривенным контрастированием (стрелкой указана аневризма левой подключичной артерии).
плечевая артерия, диаметром 3 мм, не пульсирует. Надключичным доступом с пересечением ключичной порции грудино-ключично-сосцевидной мышцы, рассечением фиброзно-измененных лестничных мышц, мобилизован I сегмент подключичной артерии (ПклА), диаметром 7 мм с отчётливой пульсацией (Рис. 3). Визуализированы сросшиеся воедино добавочное шейное и I ребро, вызывающие локальную компрессию подключичной артерии, дистальнее которой артерия имеет расширение до 15 мм (Рис. 3–4).
После системной гепаринизации и поперечной артериотомии плечевой артерии, антеградный кровоток отсутствовал, ретроградный кровоток резко ослаблен. Поочередно ретро- и анте-градно катетером Фогарти удалены «старые» гиалиновые тромбы. Восстановлен удовлетворительный антеградный и слабый ретроградный кровтоки. Арте-риотомическое отверстие ушито. Далее выполнена резекция добавочного шейного ребра, сместив плечевое сплетение каудально, удален отрезок ребра, полностью освободив сплетение. В верхней трети правого бедра осуществлен забор большой подкожной вены (БПВ). Пережата подключичная артерия в I сегменте, резецирована, далее артерия пережата и резецирована в интактном участке в III сегменте. Аневризматически расширенный фрагмент подключичной артерии из над- и подключичного доступов максимально иссечен с лигированием впадающих ветвей.
Сформирован дистальный анастомоз между III сегментом подключичной артерии и аутовеной по типу конец в конец непрерывным обвивным швом. Протез под ключицей выведен в рану над ключицей и сформирован проксимальный анастомоз между подключичной артерией и аутовеной по типу
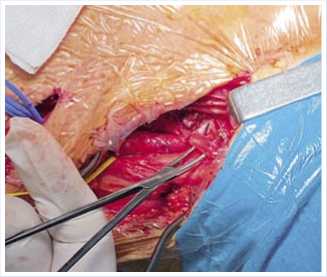
Рис. 3. Интраоперационный снимок. Рассечение фиброзно-измененных лестничных мышц, мобилизация I сегмента подключичной артерии.
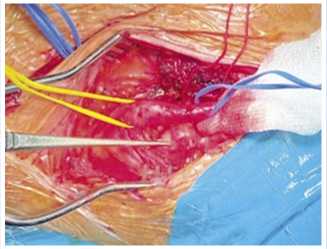
Рис. 4. Интраоперационный снимок. Аневризма левой подключичной артерии.
конец в конец непрерывным обвивным швом. Пуск кровотока – анастомозы герметичны, отчётливая пульсация аутовенозного протеза. Выполнена пункция аутовенозного протеза, установлен интродьюсер 6 Fr. При ангиографии определяется сужение плечевой артерии на уровне локтевого сгиба. Артерия пережата. Швы сняты, артерия дополнительно рассечена продольно. Выкроена заплата из ранее иссеченной подключичной артерии 1,0 х 1,0 см. Выполнена аутоартериальная пластика плечевой артерии непрерывным обвивным швом. При контрольной ангиографии гемодинамически значимых стенозов нет, плечевая, лучевая и локтевая артерии контрастируются гомогенно на всем протяжении. На 4-е сутки послеоперационного периода отмечено появление цианоза пальцев левой верхней конечности. Выполнено УЗДС зоны реконструкции: аутовенозный протез проходим, тромбоз плечевой артерии в средней и дистальной трети плеча. В экстренном порядке выполнена тромбэктомия из артерий левой верхней конечности, резекция дистальной трети плечевой артерии с аутовенозным протезированием слева: после снятия швов

с раны отмечено отсутствие пульсации плечевой артерии. В нижней трети правой голени забран отрезок БПВ длиной 10 см. После системной гепаринизации и пережатия плечевой артерии выполнена продольная артериотомия, в просвете тромботические массы. В проксимальном и дистальном направлениях катетером Фогарти удалены свежие тромботические массы. Участок плечевой артерии, включающий зону ранее выполненной пластики резецирован, выполнено аутовенозное протезирование. При пуске кровотока отмечена ослабленная пульсация аутовенозного протеза. При интраоперационном УЗДС – коллатеральный кровоток в локтевой, лучевой артериях. Плечевая артерия мобилизована дополнительно проксимально на 2 см, дистально до бифуркации. Забран дополнительно на левом бедре отрезок БПВ длиной 10 см. После дополнительной гепаринизации аутовенозный протез резецирован, в просвете тромботические массы. Попытка тромбэктомии катетером Фогарти проксимально и дистально – тромботических масс не получено, восстановлен пульсирующий антеградный кровоток. Выполнено повторное аутовенозное протезирование, анастомозы сформированы по типу конец в конец непрерывным обвивным швом. Пуск кровотока – отчётливая пульсация зоны реконструкции.
В дальнейшем послеоперационный период протекал без особенностей. Состояние пациентки с положительной динамикой. Пульсация артерий левой верхней конечности отчётливая на лучевой и локтевой артериях. Кровообращение компенсировано. При контрольной МСКТ с внутривенным контрастированием аутовенозный протез проходим. Плечевая, локтевая и лучевая артерии контрастируются гомогенно на всем протяжении (Рис. 5–6).
Обсуждение
Синдром грудного выхода – это собирательный термин, применяемый для описания симптомов, вызванных компрессией сосудисто-нервного пучка в области грудного выхода. Патология чаще встречается у молодых людей в возрасте от 20 до 40 лет, с соотношением мужчин и женщин 1: 4 [8]. Первые труды по изучению данного заболевания описаны еще в XXVIII веке немецким анатомом Hunau-ld, который впервые описал наблюдение патологического шейного ребра. Сам термин «синдром грудного выхода»» был введен R.M. Peet в 1956 г. [9]. Заболевае-
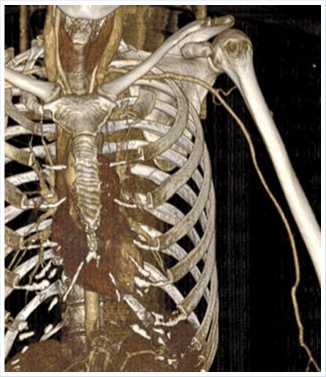
Рис. 5. МСКТ с внутривенным контрастированием после оперативного вмешательства.
мость данной патологией составляет от 3 до 80 случаев на 1000 человек [10]. В отличие от большинства других сосудистых заболеваний, истинная распространённость TOS остаётся неясной. Сочетание широкого спектра симптомов и недостаточно достоверных диагностических методов вызывает трудности с постановкой окончательного диагноза и продолжающимся спорам о распространённости в целом. Некоторые авторы предполагают, что истинная распространённость выше, чем указано в современной литературе. Аргумент в пользу высокой распространённости основан на том, что синдром грудного выхода недооценивается [11].
Синдром грудного выхода проявляется в трёх формах, которые соответствуют поражённому анатомическому элементу. Выделяют нейрогенную (nTOS), в случае сдавления плечевого сплетения, венозную (vTOS) при компрессии подключичной вены и артериальную форму (aTOS), при вовлечении подключичной артерии [12]. Реже встречаются смешанные формы. Частота возникновения нейрогенной формы синдрома составляет 95%, а венозной и артериальной – 3% и 1%, соответственно. Распространенность нейрогенной формы выше у женщин, чем у мужчин в соотношении 3,5:1, венозная форма чаще встречается у мужчин, а артериальная форма гендерной зависимости не имеет [11; 13].
Предрасполагающие факторы компрессии сосудисто-нервного пучка в области верхней апертуры грудной клетки объединены в две группы – врожденные и приобретенные. В первую группу включены такие факторы, как добавочное шейное ребро встречающееся у 0,5–0,6%
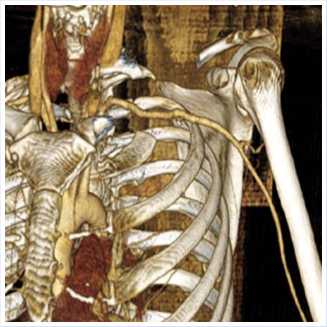
Рис. 6. МСКТ с внутривенным контрастированием после оперативного вмешательства.
популяции, при этом в 50–80% случаев они бывают двусторонними, а соотношение женщин и мужчин составляет 2:1; удлиненный поперечный отросток VII шейного позвонка; фиброзные аномалии [14; 15]. Вторая группа объединяет большое множество факторов, среди которых – функциональные, посттравматические, вторично поражающие факторы сосудисто-нервного пучка [16–18].
Клинические проявления у пациентов с синдромом грудного выхода зависят от патофизиологических механизмов, лежащих в его основе [19]. Установлено, что пациенты с артериальной формой данной патологии предъявляют жалобы на постоянную боль в конечности нерадикулярного характера, на парестезии и дискомфорт, которые усиливаются при физической нагрузке и уменьшаются в состоянии покоя [20].
Первым классическим симптомом венозной формы является отек верхней конечности, которому может предшествовать болевой синдром накануне. При объективном осмотре конечность имеет цианотичную окраску, отмечается расширение подкожных вен в области плеча и шеи [13; 21].
По мнению Franklin и соавт. нейрогенная форма проявляется болью, парестезиями в пальцах, слабостью верхней конечности [22]. Описанные симптомы, как правило, имеют тенденцию к усилению при интенсивных физических нагрузках и выраженном разгибании конечности [8]. В одном зарубежном исследовании также сообщалось о головных болях, преимущественно в затылочной области [19].
Нередко общий объективный осмотр пациентов с артериальной формой данного синдрома недостаточный

для постановки предварительного диагноза, поэтому осмотр рекомендовано дополнять провокационными процедурами [19; 23]. В литературе описаны так называемые провокационные маневры (тест Адсона, тест Roos, тест на растяжение верхних конечностей (ULTT)), которые имеют фундаментальное значение в диагностике данной патологии. С их помощью удается предположить синдром грудного выхода рутинно без проведения каких-либо специфических методов диагностики. Тем не менее, данные, полученные коллективом зарубежных авторов были противоречивы при изолированном применении единственного теста. Зафиксировано значительное количество ложноположительных результатов, что привело к предложению использовать несколько диагностических методов для одного пациента. В ином исследовании продемонстрировано, что специфичность тестов Адсона и Roos варьирует от 30 до 72% при их отдельном использовании, но возрастает до 82% при комбинированном применении обоих тестов у одного пациента [24]. Однако, стоит отметить, что несмотря на рекомендательный характер провокационных маневров, они не являются патогномоничными. В описанном нами клиническом случае не проводилась оценка данных диагностических приемов, что объяснимо исходным отсутствием пульсации артерий левой верхней конечности.
Инструментальная диагностика многогранна и специфична для каждой конкретной формы данного синдрома. Для подтверждения как формы, так и точной анатомической локализации проблемы, рекомендовано визуализирующее исследование. Рентгенография грудной клетки является рутинным инструментальным методом диагностики у пациентов с аномалией развития ребер [25; 26]. Учитывая наличие типичной клинической картины и соответствующий анамнез, пациентке в условиях городского стационара была выполнена МСКТ дуги аорты, её ветвей и артерий верхних конечностей, что позволило установить точный диагноз и спланировать объем хирургического вмешательства. Стоит упомянуть, что раннее она проходила диагностическое обследование в виде рентгенографии органов грудной клетки – костные аномалии по неопределенным причинам не визуализированы, вероятно, это связано с ограничением границ области съемки.
Для более точного выявления возможных сосудистых изменений целесо- образно использование дополнительных методов диагностики. УЗДС является эффективным методом первичной диагностики при подозрении на сосудистую форму синдрома. Диагностическая ценность данного метода важна в аспекте визуализации подключичной артерии для выявления аневризмы, стеноза или тромбоза подключичной или подмышечной артерий. Преимуществом является возможность оценки динамического кровотока во время провокационных маневров, при которых происходит сужение артерий и изменение пиковых скоростей, что является диагностическим признаком сосудистой формы синдрома. Исследование является неинвазивным, доступным и информативным [25; 26]. Однако, авторы одного крупного центра предпочли не выполнять УЗДС в своем исследовании в виду недостаточной информативности метода, поскольку визуализация аневризмы или стеноза артерии ограничена по причине наличия костных структур в области сканирования [27]. В таких случаях для более точного определения характера и локализации сосудистых изменений чаще применяются более информативные инвазивные методы – артериография и венография.
Катетерная артериография и венография традиционно считаются золотым стандартом диагностики сосудистой формы синдрома грудного выхода, поскольку исследование позволяет получить информацию о точном расположении и характере компрессии сосудов. Однако в виду своей инвазивности и отсутствия визуализации окружающих структур описанные методики в основном используются интраоперационно [26]. В том числе на примере нашего наблюдения продемонстрирована возможность использования ангиографии в ходе хирургического вмешательства. После аутовенозного протезирования, в связи с наличием сомнительной пульсации дистальнее зоны реконструкции, пунктирован аутовенозный протез и установлен интродьюсер, выполнена ангиография артерий левой верхней конечности и выявлено сужение плечевой артерии на уровне локтевого сгиба, потребовавшее хирургической пластики.
КТ с контрастным усилением и МРТ в настоящее время являются широкодоступными, надёжными и информативными методами, используемыми для постановки диагноза сосудистой формы синдрома грудного выхода. КТ и МРТ обычно проводятся в два этапа (в классическом горизонтальном положении и в том же положении, но при отведении руки) для визуализации компрессии сосудов, наблюдаемой при провокационных маневрах. КТ-ангиография обеспечивает более детальный анализ кровеносных сосудов по отношению к костным структурам, в то время как МР-ангиография позволяет четко дифференцировать прилежащие к сосудисто-нервному пучку мышечные анатомические элементы. Рекомендации Американского колледжа радиологии по критериям соответствия предполагают, что КТ и МР-ангиография или венография подходят для установления диагноза синдрома грудного выхода, а выбор метода визуализации, вероятнее всего, зависит от опыта и квалификации врача и учреждения, в котором проводится исследование [28].
Стратегия лечения артериальной формы синдрома грудного выхода определяется характером и тяжестью осложнений. При выборе хирургической стратегии описаны три руководствующих принципа: декомпрессия, резекция артерии и дистальная реваскуляризация [26].
Для принятия решений относительно необходимости артериальной реконструкции Sсher и соавт. предложили систему стадирования, основанную на визуализации и интраоперационных данных. Большинство пациентов, включенных в их исследование (n = 7), имели I стадию – стеноз подключичной артерии и её постстенотическое расширение. Декомпрессия, по мнению авторов, самый оптимальный вариант лечения без дополнения какими-либо иными вмешательствами, в том числе эндоваскулярными, это связано с тем, что опыт авторов демонстрирует последующий регресс постстенотического расширения [29]. У пациентов, которые перенесли декомпрессию, но не артериальную реконструкцию, следует регулярно контролировать состояние подключичной артерии клинически и с помощью периодического дуплексного сканирования в первые несколько лет после процедуры. Практика авторов показывает, что этот подход эффективен, так как ни у одного пациента не было зафиксировано артериальных осложнений в процессе наблюдения. У бессимптомных пациентов с компрессией подключичной артерии без признаков артериальной дегенерации хирургическое лечение не показано из-за низкого риска осложнений. Данной категории пациентов УЗДС-контроль рекомендовано повторять каждые шесть месяцев [26]. Хотя в проанализированных нами лите-
ратурных источниках нет достоверной информации о том, приводит ли подобная практика к более ранней диагностике артериальных осложнений.
В аспекте декомпрессии сосудистонервного пучка позиция большинства авторов едина – удаление шейных или первых ребер, фиброзных тяжей, скале-нэктомия и устранение любых иных сопутствующих аномалий. Позиция других авторов гласит о том, что резекция первого ребра рекомендуемая процедура, позволяющая минимизировать риск возникновения рецидива симптомов, поскольку именно ребро является точкой прикрепления фиброзно-мышечных тяжей, вызывающих компрессию сосудисто-нервного пучка [30]. Другие утверждают, что передняя и средняя скаленэкто-мия сама по себе так же эффективна, как и скаленэктомия с резекцией первого ребра и подобный щадящий подход к удалению рёбер приводит к меньшему количеству осложнений, в том числе снижение риска повреждения плевры, и снижение сроков нахождения в стационаре в том числе [31; 32]. Некоторые авторы придерживаются мнения, что первое ребро необходимо рутинно резецировать при aртериальной форме данного синдрома независимо от наличия или отсутствия компримирования сосудисто-нервного пучка [29; 30]. Другие утверждают, что первое ребро может быть резецировано в случае гемодинамически значимой компрессии артерии [30].
В одном крупном исследовании сравнивали результаты трансаксилляр-ной резекции первого ребра со скале-нэктомией (передней и средней) и надключичной резекцией первого ребра со скаленэктомией. С помощью методов анализа было установлено, что успешность всех операций одинакова: от 91% до 93% в течение 3 месяцев; от 76% до 79% в течение 1–2 лет; от 70% до 73% в течение 3–5 лет; и от 69% до 72% в течение 5–10 лет. Скаленэктомия является такой же результативной операцией, как и резекция первого ребра и имеет меньше серьёзных осложнений. Однако, неоднозначны результаты по отношению к возможным осложнениям: после резекции ребра повреждение нервных сплетений наблюдалось в 2,6% случаев. После скаленэктомии не было выявлено повреждений сплетений, но наблюдался временный паралич диафрагмального нерва в 4,4% случаев. Резекция ребра по-прежнему показана пациентам с нетравматическими причинами синдрома грудного выхода, такими как аномалии костей с компрессией артерий или вен, а также пациентам с рецидивом синдрома грудного выхода после скаленэктомии [31]. В нашем наблюдении у пациентки было принято решение в пользу комбинированного варианта лечения – резекция добавочного шейного ребра с дополнением скаленэктомией в связи с наличием выраженно измененных в виду фиброза лестничных мышц.
Для предотвращения ишемических осложнений верхней конечности необходимо устранить любой потенциальный источник артериальной эмболии – аневризму подключичной артерии или стеноз просвета артерии с диссекцией интимы. В зависимости от границ резекции подключичной артерии может потребоваться реконструкция сосудов в виде первичного анастомоза, протезирования или шунтирования. При наличии признаков дистальной эмболии в сочетании с реконструкцией сосудов может быть использован внутриартериальный тромболизис или катетерная тромбэктомия [26]. Наша позиция в отношении пациентов с наличием синдрома грудного выхода и при наличии аневризмы подключичной артерии с дистальной эмболией полностью представлена в рамках данного клинического наблюдения – одномоментное устранение компрессии, резекция аневризмы подключичной артерии с восстановлением кровотока в конечности. В одном проанализированном нами исследовании предложено разделить процедуру на два отдельных вмешательства. Первым этапом выполняется тромбэктомия с целью купирования ишемии конечности и назначение антикоагулянтной терапии в раннем послеоперационном периоде и вторым этапом рекомендовано вмешательство по поводу аневризмы подключичной артерии в рамках той же госпитализации [33]. В ином исследовании 20-летней давности так же описано несколько наблюдений применения комбинированного хирургического подхода – резекция добавочного шейного ребра над- или подключичным доступом, резекция аневризмы подключичной артерии с наложением аутовенозного шунта проксимально (к плечевой артерии) или дистально (к артериям предплечья), у части пациентов с клинико-инструментальной картиной дистальной эмболии выполнена баллонная катетерная тромбэктомия. Лишь в одном наблюдений послеоперационный период осложнился тромбозом дистального сегмента шунта, потребовавшим ревизии [29].
Заключение
Артериальная форма синдрома грудного выхода является самой редкой из описанных, но может быть самой опасной в перспективе сохранения конечности. Клиническая симптоматика у пациентов данной категории вариабельна – от отсутствия симптомов до острой ишемии конечности. Зачастую патология вызвана аномальным первым ребром или наличием шейного ребра, что приводит к компрессии подключичной артерии, постстенотической дилатации с возможным последующим прогрессированием до развития аневризмы. При несвоевременном хирургическом лечении просвет аневризмы может тромбироваться и вызвать эмболизацию дистального русла с клинической картиной острой ишемии конечности.
Мы считаем, что опыт подобных редких хирургических вмешательств следует обсуждать и делиться с широкой аудиторией, особенно учитывая факт отсутствия на сегодняшний день убедительных данных по наиболее оптимальной хирургической тактике ведения данной категории пациентов. Наблюдение демонстрирует успешный результат одномоментного хирургического лечения пациентки с синдромом грудного выхода, сочетающимся с добавочным шейным ребром, аневризмой подключичной артерии и тромбозом артерий левой верхней конечности.


