Ангиосаркома молочной железы (обзор литературы и описание двух клинических наблюдений)
Автор: Орлова Р.В., Андросова А.В., Топузов Э.Э., Беляк Н.П., Кутукова С.И., Авраменко И.В., Иванова А.К., Варанкина А.А., Коркина А.А., Рахимова Г.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 3 т.14, 2024 года.
Бесплатный доступ
Ангиосаркома молочных желез представляет собой редкое злокачественное заболевание, которое составляет менее 0,5% от всех случаев рака молочной железы. Характеризуется заболевание быстрым ростом, агрессивным течением, активной диссеминацией процесса и плохим ответом на лечение. Особенность заболевания состоит в сложности диагностики процесса, поскольку клиническая картина не является специфической и зачастую протекает под маской кожных заболеваний, такие как экзема, атопический дерматит, розацеа и т. д. Ведущим звеном лечения данного заболевания является хиругическое лечение. В данной статье представлен собственный опыт ведения пациентов с ангиосаркомами молочных желез, возникших после лечения карциномы молочной железы в СПб ГБУЗ ГКОД.
Ангиосаркома, молочная железа, радиоиндуцированная ангиосаркома
Короткий адрес: https://sciup.org/140310092
IDR: 140310092 | DOI: 10.18027/2224-5057-2024-012
Текст научной статьи Ангиосаркома молочной железы (обзор литературы и описание двух клинических наблюдений)
Ангиосаркома молочной железы (АСМЖ) — злокачественное новообразование, исходящее из эндотелиальных клеток сосудов, располагающееся на коже молочной железы. Разделяют первичную и вторичную АСМЖ. Одной из основных причин развития вторичной АСМЖ является проведение лучевой терапии (ЛТ) по поводу лечения рака молочной железы. Риск возникновения АСМЖ у данной группы пациентов составляет от 0,14 до 0,5 %. [1]. С учетом более частого проведения органосохраняющих операций с последующим проведением ЛТ, можно предположить увеличение заболеваемости АСМЖ в будущем. Средний срок развития ЛТ-индуцированной АСМЖ составляет 6–7 лет с момента проведенной ЛТ, тогда как для других ЛТ-ассоциированных сарком этот срок больше и составляет 10–12 лет [2]. Пятилетняя общая выживаемость (ОВ) при вторичной АСМЖ по разным данным варьирует от 43% до 88% (3), медиана ОВ составляет 53 месяца [4].
МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
Выделяют три степени дифференцировки АСМЖ — высоко-, умеренно- и низкодифференцированные. Гистологически ангиосаркомы низкой степени злокачественности состоят из анастомозирующих сосудов средней степени злокачественности, отличаются хорошо выраженным сосудистым ростом, для ангиосарком высокой степени злокачественности характерны локальные некрозы, кровотечения [5]. Большинство радиоиндуцированных АСМЖ являются низкодифференцированными опухолями [6]. Согласно данным ресурса Pathology Outlines, можно выделить характерные для АСМЖ иммуногистохимические (ИГХ) маркеры, указанные в таблице 1.
КЛИНИКА И ДИАГНОСТИКА
Обычно АСМЖ возникает в виде безболезненных синекрасных пятен на коже, похожих на гематому, которые образуются на ранее облученном участке. При прогрессировании заболевания могут образовываться красные или фиолетовые бляшки с изъязвлениями и узелками [7].
В диагностике АСМЖ наиболее точным методом, помимо морфологической верификации, является магнитно-резонансная томография (МРТ) молочных желез. По сравнению с маммографией и ультразвуковым исследованием, МРТ обеспечивает лучшую морфологическую характеристику опухоли. Во многих клинических случаях МРТ показывает неоднородную массу с низким уровнем Т1 и высоким уровнем Т2 сигналов, что предположительно связано с сосудистым происхождением опухоли [8,15].
Диагноз АСМЖ может так же быть выставлен в соответствии с критериями Кэхана, предложенными в 1948 году: саркома должна развиться в области, ранее подвергшейся облучению; между моментом облучения и развитием саркомы должен существовать латентный период (обычно в годах); саркома должна быть подтверждена гистологически [9].
ЛЕЧЕНИЕ
С учетом редкой встречаемости вторичной АСМЖ, единого стандарта лечения данной опухоли не существует. Основным методом лечения АСМЖ на данный момент является хирургическое удаление опухоли, если заболевание имеет локальный характер распространения [10]. Возможно выполнение как локального иссечения опухоли, так и мастэктомии. Лимфаденэктомия не выполняется, так как для данной опухоли не характерен лимфогенный путь метастазирования. Считается, что отрицательный край резекции имеет бóльшее значение, чем объем опе- ративного вмешательства [11]. Однако частота рецидивов, даже после радикальной операции с микроскопически отрицательными краями, остается высокой и составляет от 54 до 92 % [12]. Большинство рецидивов опухоли возникает в течение первого года после операции в области послеоперационного рубца [13].
Роль химиотерапии в лечении АСМЖ дискутабельна. По-видимому, существует умеренная чувствительность АСМЖ к антрациклинам c частотой объективного ответа от 20 % до 60 % [2]. Химиотерапия с применением доксорубицина или таксанов наиболее часто встречается в репортируемых клинических случаях и ретроспективных исследованиях [14,16].
Что касается неоадъювантного лечения, имеется очень мало данных о её роли при ангисаркоме молочной железы. В ретроспективном исследовании Cohen-Hallaleh etal2017 семь пациенток с радиоиндуцированной ангиосаркомой получали неоадъювантную химиотерапию в связи с неоперабельностью опухоли. Трое из них после лекарственной терапии были прооперированы, у двоих наблюдался полный патоморфоз [17]. Однако в связи с редкостью встречаемости радиоассоциированной ангиосаркомы молочной железы, доказать эффективность химиотерапии в неоадъювантном режиме в настоящий момент невозможно.
Лекарственная терапия местно-распространённых неоперабельных форм и метастатических форм ангиосарком молочной железы проводится в соответствии с рекомендациями по лечению сарком мягких тканей.
Применение лучевой терапии при АСМЖ в качестве адъювантного или неоадъювантного лечения остается неясным и противоречивым, учитывая тот факт, что это новообразование является радиационно-индуцированным. В одном из исследований были представлены доказательства потенциальной излечимостиАСМЖс помощью ЛТ с ускоренным гиперфракционированием, при этом 79% пациентов достигли порога 5-летней общей выживаемости [18].
НОВЫЕ МИШЕНИ СИСТЕМНОЙ ТЕРАПИИ
Хотя патогенетические пути, лежащие в основе ангиосарком, до конца не изучены, многие научные группы были заинтересованы изучением вопроса применения новых мишеней в лечении ангиосарком, уделяя особое внимание ингибиторам тирозинкиназ. Данные по исследованиям, которые посвящены терапии АСМЖ, представлены в таблице 2.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ №1
Пациентка А., 65 лет, с образованием в области послеоперационного рубца, ранее, в 2014 г., получала комплексное лечение по поводу рака правой молочной железы (cT4bN2M0/ypT0N0M0 — III В стадия, люминальный В подтип). Было выполнено 9 циклов ПХТ по схеме: фторурацил, доксорубицин и циклофосфамид, далее дистанционная
Таблица 2. Исследования в которых изучались варианты терапии АСМЖ
Table 2. Studies that examined treatment options for breast angiosarcoma
При УЗИ молочных желез в октябре 2021 года: на границе внутренних квадрантов правой молочной железы выявлено внутрикожное солидное инкапсулированное неоднородной структуры образование 22 × 12 мм. Выполнена биопсия. Результат гистологического и иммуногистохимического исследования опухолевого материала: фиброзная ткань с опухолью, образованной умеренно полиморфными клетками, формирующими солидные и сосочковые структуры, сосудистые полости. Оценка уровней экспрессии рецепторов эстрогена и прогестерона: Er: 0, Pr: 0 Her2/neu — (негативная (0). (Ki67): 60%, CD 34 — негативное окрашивание. CD 31, Fli 1, виментин положительная экспрессия, иммунофенотип опухоли и гистологическое строение соответствуют ангиосаркоме.
В начале декабря 2021 года была выполнена радикальная мастэктомия справа. Заключение гистологического исследования операционного материала: правая молочная железа с двумя образованиями. Образование на коже размером 20 × 15 мм представлено низкодифференцированной эпителиоидно-клеточной солидной опухолью с высокой митотической активностью, инвазией в сосочковый слой дермы с фокусами периневральной инвазии. Гистологическая картина и иммунофенотип образования с учётом проведённого ранее ИГХ-исследования соответствуют ангиосаркоме Grade 2.
Через полгода после операции при УЗИ молочных желез был выявлен в аксиллярной области слева, т. е. контрлатеральный гипохогенный лимфоузел размером 4,3 × 2,5 × 3,0 см. Рекомендовано выполнение тонкоигольной биопсии данного лимфоузла. Иммуногистохимический профиль соответствуют метастазу ангиосаркомы в ткань подмышечных лимфатических узлов слева (рис. 1).
С целью оценки распостраненности опухолевого процесса выполнено дообследование. По данным ПЭТ-КТ с 5ФДГ определялось увеличение надключичного лимфоузла справа, ретропекторальных, подмышечных слева,
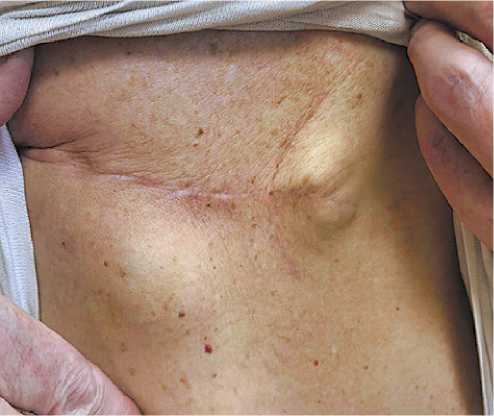
Рисунок 1. Клиническое наблюдение № 1
Figure 1. Clinical observation No. 1
сливающихся в конгломераты, лимфоузлов переднего средостения с прорастанием в переднюю грудную стенку. В мягких тканях ложа удаленной правой молочной железы узловые образования размером 29 × 17 мм. Очаги деструкции костной ткани с патологическим захватом радиофармпрепарата в грудине, в переднем отрезке 3,5 ребра справа, заднем отрезке 9 ребра справа, в левой подвздошной кости.
В декабре 2022 года начата химиотерапия в режиме: паклитаксел + бевацизумаб + золедроновая кислота. При плановой контрольной оценке (ПЭТ КТ с 5ФДГ всего тела от января 2023 года) — в мягких тканях ложа удаленной правой молочной железы узловое образование размерами до 15 × 28 мм (ранее 17 × 29 мм). Надключичный л/ у справа 21 × 23 мм (ранее 26 × 26 мм), ректопекторальные и подмышечные л/у слева, сливающиеся в конгломераты 44 × 36 мм (ранее 55 × 41 мм), лимфатические узлапереднего средостения до 12 мм (ранее 22 × 29 мм). Парастернально с прорастанием в переднюю грудную стенку образование размерами 25 × 33 мм (ранее 50 × 40 мм). Жидкость в правой плевральной полости до 3 мм, ранее до 6 мм. В левой подвздошной кости очаг 12 × 16 мм, ранее 14 × 10 мм. Ответ оценен как стабилизация. Лечение продолжили до 6 циклов, после чего при плановом контрольном обследовании зарегистрировано прогрессирование опухолевого процесса — рост всех ранее отмечаемых очагов на 57% (согласно критериям RECIST 1.1). В качестве 2 линии системной терапии выбран режим пазопаниб, который пациентка принимала с апреля 2023 года по июль 2023 года. Вторая линия лекарственной терапии оказалась неэффективной. В связи с прогрессированием опухолевого процесса и ухудшением общего состояния пациентки проведение дальнейшего специфического лечения оказалось невозможным.
Далее в статье будет представлен собственный опыт терапии АСМЖ. Пациенты подписали информированное согласие на публикацию.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ №2
Пациентка В. 72 лет получала комплексное лечение по поводу рака правой молочной железы pT1bN0M0 (люминальный В подтип) в 2017 году. Комплексное лечение включало в себя следующие этапы: секторальная резекция правой молочной железы + подмышечная лимфаденэктомия, далее 3Д-конформная лучевая терапия (СОД = 51 Гр), тамоксифен с 06.2017 г. по 02.2022 г.
В феврале 2022 года при плановом контрольном обследовании выявлен внутрикожный метастаз в области передней грудной стенки. Выполнена биопсия образования. Заключение гистологического и иммуногистохимического исследований биоптата: в препарате кожи интрадермально низкодифференциированная опухоль — ангиосаркома. Ki-67 = 95 %.В связи с верификацией мягкотканного образования установлен диагноз: постлучевая ангиосаркома передней грудной стенки — Т1N0M0.
В марте 2021 года выполнено широкое иссечение опухоли кожи, Т-инверсивная редукция левой молочной железы + реконструкция экспандером и местными тканями. Заключение ГИ от 19.03.2021 г.: гемангиосаркома G3 макcимальным размером 5 см.
В апреле 2021 года появились новые внутрикожные метастазы. Проводилась 1 линия химиотерапии по схеме: паклитаксел + карбоплатин с 05.2021 г. по 10.2021 г. (шесть циклов). Наблюдался полный регресс.
В ноябре 2021 года прогрессирование в виде метастазов в мягких тканях передней грудной стенки, по поводу которого выполнено иссечение новообразования мягких тканей передней грудной стенки. В заключении протокола гистологического исследования от декабря 2021 г.: постлучевая ангиосаркома молочной железы Ki-67 = 95%.В январе 2022 г. прогрессирование: продолженный рост внутрикожных образований. Было выполнено 10 циклов 2 линии химиотерапии по схеме: гемцитабин + бевацизумаб с 02.2022 г. по 11.2022 г. В декабре 2022 г. по данным компьютерной томографии зафиксировано прогрессирование опухолевого процесса: на коже грудной стенки на уровне 1 ребра множественные образования размерами 7×5 мм и более мелкие образования каудальнее. С февраля по август 2023 года получала терапию пазопанибом. На фоне терапии пазопанибом отмечает побледнение образований кожи. Однако при компьютерной томографии в августе 2023 г. выявлено: в верхнем наружном квадранте левой молочной железы единичный узел размером 21 на 24 мм (ранее 10 на 13 мм), наличие аналогичного образования на уровне 1 ребра слева диаметром до 19 мм (ранее 14 мм), появление множественных аналогичных уплотнений левой молочной железы размерами до 24 мм, появление лимфоузлов подмышечной группы слева размерами 20 на 20 мм (ранее 8 на 10 мм). Выполнена биопсия одного из образований на коже грудной стенки. Иммунофенотип образования соответствует ангиосаркоме с Ki-67 = 90%.
В качестве 4 линии системной терапии был выбран режим паклитаксел + карбоплатин (выбор основывался на том, что на данной схеме у пациентки отмечался наилучший ответ в первой линии, на удовлетворительном
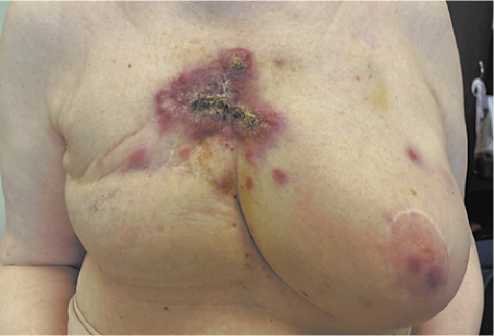
Рисунок 2. Клиническое наблюдение № 2. Фото ангиосаркомы пациентки до 1 цикла 4 линии терапии
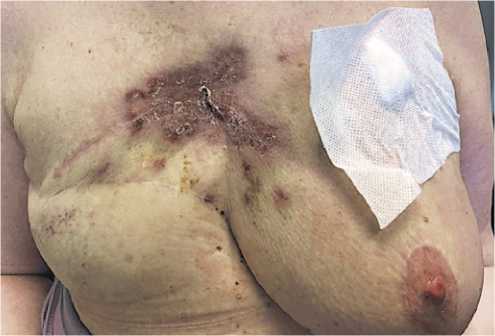
Рисунок 3. Клиническое наблюдение № 2. Фото ангиосаркомы пациентки после 2 цикла 4 линии терапии
Figure 2. Clinical observation No. 2. Photo of thepatient’s angiosarcoma before cycle 1, 4 lines of therapy
Figure 3. Clinical observation No. 2. Photo of a patient’s angiosarcoma after 2 cycles of 4 lines of therapy
состоянии больной и отсутствии периферической полинейропатии). В сентябре 2023 года был проведён первый цикл по данной схеме. В заключениях КТ ОГК, ОБП, ОМТ от ноября 2023 года: в сравнении с исследованием от 10.08.2023 г. определяется регресс ранее визуализируемых образований левой молочной железы, утолщения кожи справа и слева, левосторонней аксиллярной лимфаденопатии. В конце декабря 2023 года завершен 6 цикл 4 линии ПХТ в режиме паклитаксел + карбоплатин. По состоянию на январь 2024 года у пациентки нет данных за прогрессирование опухолевого процесса. На рисунках 2, 3, 4 и 5 представлена фотофиксация локального статуса на фоне 4 линии лекарственной терапии.
ЗАКЛЮЧЕНИЕ
Ангиосаркома молочной железы является чрезвычайно редкой и малоизученной опухолью. В связи со скудностью клинического опыта на данный момент не разработаны стандарты диагностики и лечения данной патологии. Возникновение минимальных клинических симптомов, таких как утолщение, изменение окраски кожи, в особенности после комплексного лечения по поводу рака молочной железы, позволяют заподозрить данное заболевание, а биопсия изменённого участка с выполнением патоморфо-логического исследования даёт возможность правильно установить такой редкий диагноз.
Единственным радикальным методом лечения ангиосаркомы молочной железы является её хирургическое удаление. В настоящее время отсутствуют стандарты лекарственного лечения этой опухоли. Данные анализов об эффективности адъювантных и неоадъюватных режимов лекарственной терапии противоречивы. Необходима кумуляция опыта лечения больных с ангиосаркомой молочной железы для разработки наиболее эффективного лечебнодиагностического алгоритма.
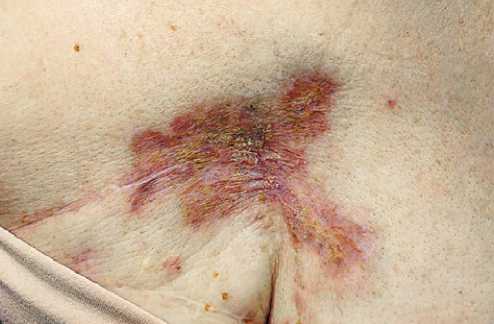
Рисунок 4. Клиническое наблюдение № 2. Ангиосаркома после 4 цикла 4 линии терапии
Figure 4. Clinical observation No. 2. Angiosarcoma after cycle 4, 4 lines of therapy
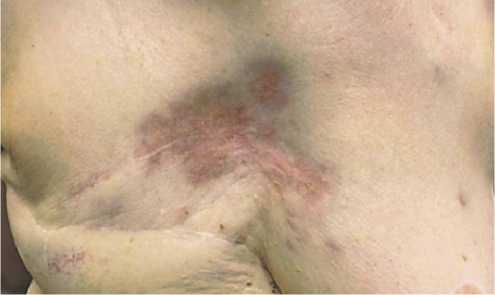
Рисунок 5. Клиническое наблюдение № 2. Фото ангиосаркомы после 6 цикла 4 линии терапии
Figure 5. Clinical observation No. 2. Photo of angiosarcoma after cycle 6, 4 lines of therapy


