Аномалии развития у потомков кур, подвергнутых хроническому воздействию
Автор: Бударков В.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Радиационная биология, протективные технологии
Статья в выпуске: 2 т.50, 2015 года.
Бесплатный доступ
В задачи радиационной биологии и медицины входит изучение отдаленных последствий хронического действия радионуклидов йода на состояние здоровья потомков облученных животных и людей. После аварии на Чернобыльской АЭС интерес к этой проблеме возрос. Проводятся исследования разнообразных нарушений в эмбриогенезе и врожденных пороков развития у потомков, полученных от родителей, щитовидная железа которых была облучена радиоактивным йодом. Однако долгосрочные прогнозы хронического действия радиоактивных изотопов йода в ряду поколений пока не ясны. Целью настоящей работы стало изучение аномалий развития у потомков кур, подвергнутых хроническому воздействию 131I. Опыты проводили на курах русской белой породы и полученных от них потомках семи поколений. Родительское стадо разделили на 4 опытные (183 птицы) и 4 контрольные (150 птиц) группы. Птицам в опыте в течение 30 сут вводили равными порциями 131I в суточных количествах соответственно 0,11; 1,1; 2,1 и 4,6 МБк/кг. Через 3, 6 и 12 мес от начала введения изотопа от кур было получено потомство. В течение 1,5-2,5 лет проводилось ежедневное наблюдение за общим состоянием и выживаемостью этой птицы. Ее взвешивали, оценивали прохождение ювенальной линьки и интенсивность периодической линьки, проводили патологоанатомические исследования внутренних органов убитых и погибших особей. Всего было получено 2573 опытных и 2782 контрольных цыпленка. Потомки облученных 131I кур характеризовались повышенной постнатальной смертностью, ускоренным половым созреванием, что проявлялось более ранним наступлением ювенальной линьки и сроков снесения первого яйца, пониженной массой тела у половозрелой птицы. У потомков первых трех поколений птицы, которой вводили 131I в количестве 1,1 МБк/кг, были выявлены новообразования на челюстях, в области шеи и слизистой оболочки глаз. В 4-м и 5-м поколениях с частотой 0,75 % рождались уроды, аномалии которых были представлены в основном дефектами в области головы (отсутствие или деформация глаз, X-образный перекрест челюстей). В первых четырех поколениях у подопытных потомков старше 6-месячного возраста в мягких тканях тела с частотой 0,8-4,7 % обнаруживались новообразования, по строению сходные с лимфоретикулосаркомой. Основными причинами гибели потомков кур, пораженных 131I, были заболевания органов желудочно-кишечного тракта, печени, сердца, почек. По-видимому, повышенная смертность таких цыплят связана с изменениями, происходящими в процессе эмбриогенеза, в результате чего в ранние периоды постнатальной жизни организм имел несовершенные механизмы регуляции и приспособления.
Инкорпорированный 131i, куры, потомки, аномалии развития
Короткий адрес: https://sciup.org/142133583
IDR: 142133583 | УДК: 636.5:591.1:539.1.047 | DOI: 10.15389/agrobiology.2015.2.225rus
Текст научной статьи Аномалии развития у потомков кур, подвергнутых хроническому воздействию
Изучение отдаленных последствий хронического действия радионуклидов йода на состояние здоровья в потомстве облученных животных и людей — одна из актуальных и сложных задач радиационной биологии и медицины (1-4). Важность таких работ связана возросшим интересом к проблеме после аварии на Чернобыльской АЭС (5-7).
Экспериментальные и эпидемиологические исследования показали, что облучение щитовидной железы родителей радиоактивным йодом может вызывать разнообразные нарушения в эмбриогенезе и врожденные пороки развития у потомков (8-10). Однако в связи с недостатком данных по тератогенному влиянию инкорпорированных радионуклидов необходимо продолжать изучение этой проблемы (11-15). Так, до сих пор не ясны долгосрочные прогнозы хронического действия радиоактивных изотопов йода в ряду поколений (16).
Целью настоящей работы было изучение аномалий развития у потомков кур, подвергнутых хроническому воздействию 131I.
Методика . Исследования проводили в условиях вивария на курах русской белой породы и полученных от них потомках семи поколений.
Родительское стадо разделили на 4 опытные (по 42-57 гол. в каждой, всего 183 птицы) и 4 контрольные (по 30-47 гол. в каждой, всего 150 птиц) группы. Всех кур содержали с петухами из расчета 1 петух на 10 кур. Птица из I, II, III и IV группы (опыт) в течение 30 сут равными порциями получала 131I в суточных дозах соответственно 0,11; 1,1; 2,1 и 4,6 МБк/кг, контрольным курам анологичного возраста давали обычную нерадиоактивную воду в тех же количествах. Птица получала изотоп в феврале— марте утром до кормления.
От кур родительского стада через 3, 6 и 12 мес от начала поступления изотопа были получены потомки 7 поколений (исследованы 6 поколений). В течение 1,5-2,5 лет проводилось однотипное наблюдение за общим состоянием и выживаемостью в каждом поколении. Массу тела определяли в возрасте 1, 10, 20, 30, 40, 50, 60 сут и 3, 6, 9, 12, 18, 24 мес. В возрасте до 30 сут взвешивали по 10 цыплят из каждой группы, на остальных сроках — всех имевшихся особей.
Прохождение ювенальной линьки оценивали по смене маховых перьев 1-го порядка у цыплят в возрасте 3, 4, 5 мес (17). Интенсивность периодической линьки у всех половозрелых птиц изучали в течение сентября, октября и ноября по смене маховых перьев 1-го порядка.
Проводили патологоанатомические исследования внутренних органов убитых и погибших потомков (18). По 3-5 цыплят из каждой группы убивали в возрасте 1 сут, 1, 3, 6 и 12 мес посредством обескровливания. Внутренние органы после макроскопического исследования взвешивали. Образцы ткани печени, селезенки, почек, сердца, щитовидной железы, надпочечников, семенников фиксировали в 10 % растворе нейтрального формалина и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином и по Ван-Гизону.
Данные экспериментов обрабатывали с использованием стандартных методов вариационной статистики (19).
Результаты . Всего от кур было получено 2573 опытных и 2782 контрольных потомка (рис. 1).
В 1-суточном воз-
P -
(0,11 МБк/кг)
-Fi(0,ll3)
-Fi(0,ll12) -► F2^F3^F4
'FKLF)
p2—► F3—► F4—► F5—► Fe—► F7
P
(1,1 МБк/кг)
^(U6)
-Fi(l,l12)
F2— F3—F4— Fs— F6
P -
(2,1 МБк/кг)
■Fi(2,P)
-Fi(2,l12)
P
(4,6 МБк/кг)
Fi(4,63)
Рис. 1. Схема получения потомков от кур русской белой породы, пораженных 131I: P — родители, F1-F7 — потомки 1-7-го поколений (опыт проводился в усло-
расте подопытные цыплята 1-го, 2-го, 3-го, 6-го и 7-го поколений по внешнему виду не отличались от своих сверстников из соответствующих контрольных групп. В 4-м и 5-м поколениях кур, получавших 131I в количестве 1,1 МБк/кг, с частотой 0,75 % выявлялись уродства, представленные в основном дефектами в области головы. У подопытного цыпленка из F4(1,13) отсутст- виях вивария). В скобках приведена суточная доза 131I вовал правый глаз. Челюсти
(МБк/кг), полученная родителями. Число в верхнем индексе указывает, через сколько месяцев от начала получения 131I были выведены цыплята F1.
были деформированы и образовали X-образный перекрест (рис. 2, А). Пальцы
на конечностях оказались согнуты, шея искривлена. Он с трудом передвигался и пал через 2 сут после вылупления.
А
Б

Рис. 2. Патологии в развитии у потомков кур русской белой породы, пораженных 131I: А — отсутствие глаза и деформация челюстей у цыпленка из F4(1,13), Б — новообразование на шее у курицы из F2(1,112) в возрасте 11 мес (опыт проводился в условиях вивария). В скобках приведена суточная доза 131I (МБк/кг), полученная родителями. Число в верхнем индексе указывает, через сколько месяцев от начала получения 131I были выведены цыплята F1.
Цыпленок из F4(1,112) на правой стороне брюшной стенки имел щель размером 1,5½0,5 см, закрытую прозрачной кожей с изреженным перьевым покровом, за которой содержался светлый экссудат. Были отчетливо видны органы брюшной полости. Впоследствии щель исчезла, а на ее месте к 6-м сут жизни образовался соединительнотканный рубец размером 1,5½0,5 см. Через 7 сут после вылупления цыпленок погиб.
В этой же группе F4(1,112) вылупился цыпленок с нераскрывшими-ся глазами. При искусственном раскрывании глаза в узкую щель был виден зрачок. Цыпленок погиб через 1 сут после вылупления.
У цыпленка из F5(1,13), который прожил 18 сут, левый глаз оказался расположен ниже правого, представлял собой припухлое круглое образование размером с лесной орех и имел похожую на тесто консистенцию. Зрачок едва просматривался сквозь узкую щель.
У остальных новорожденных подопытных и контрольных цыплят отклонений в строении тела отмечено не было.
Изменения внешнего вида подопытных птиц наблюдали в возрасте 7-21 мес. Они возникали лишь в потомстве первых трех поколений кур, пораженных 131I в дозе 1,1 МБк/кг, и представляли собой новообразования на челюстях, шее и слизистой оболочке глаз. Новообразования регистрировали в F1 и F2 у относительно молодых (7-12 мес), в F3 — у более взрослых (20-21 мес) птиц (см. рис. 2, Б). В остальных группах потомков в опыте и контроле подобных аномалий не отмечали.
Живая масса у 1-суточных подопытных цыплят увеличивалась в F 1 (0,1112), F 1 (1,16), F 1 (2,112), F 3 (0,1112), F 5 (1,112) и уменьшалась в F 1 (1,13), F2(1,13), F2(1,112), F2(2,112), F3(1,13), F4(1,13) относительно контроля. В течение последующих 18-30 мес жизни потомки облученных кур (как курочки, так и петушки), начиная с периода половой зрелости, имели достоверно более низкие приросты массы, чем потомки от здоровых родителей.
Ювенальная линька у подопытных и контрольных особей во всех исследованных поколениях начиналась с 30-суточного возраста.
У 3-месячных подопытных и контрольных курочек в F1, F2 и F3 из группы 0,1112 не было установлено существенных различий по числу заменившихся первичных перьев. У петушков в F2 из этой же группы смена пера проходила достоверно интенсивнее, чем в контроле. У подопытных особей из группы 1,13 по сравнению с контрольными увеличивалось число сменившихся перьев в F5. Подопытные курочки F2(1,112) име- ли достоверно пониженное, а петушки F1(1,112) — повышенное число сменившихся маховых перьев. Группа 2,112 характеризовалась ускоренной заменой первичного пера в F2 как у курочек, так и у петушков (Р < 0,05).
Как следует из полученных данных, у потомков кур, облученных различными дозами 131I, ювенальная линька чаще проходила активнее, чем у контрольных цыплят. Отклонения в процессе периодической линьки у потомков зависели от времени, прошедшего от начала радиационного воздействия на родителей: у птиц первой генерации линька была ускорена, в последующих поколениях — замедлена.
В возрасте 5,5 и 6,0 мес у контрольных и опытных курочек начиналась яйцекладка. У подопытных кур трех поколений из группы 0,1112 сроки наступления репродуктивного периода были такими же, как в контроле. У потомков из группы F1(1,13) это произошло на 14 сут раньше, чем у контрольной птицы, из F2(1,112) — с опережением на 3 сут, F3(1,112) — на 32 сут, F4(1,13) — на 6 сут и F4(1,112) — на 16 сут. В F1 у кур, получавших 131I в количестве 2,1 МБк/кг, начало яйцекладки задерживалось на 20 сут. Периодическая линька у кур F1(1,23) проходила интенсивнее, а в F2(1,23) и F3(1,23) — медленнее, чем в контроле. Замедление периодической линьки отмечалось также у подопытных потомков из группы 1,212.
Динамика возрастных изменений внутренних органов у подопытных и контрольных потомков была однотипной. У убитой птицы до 6-месячного возраста отклонений в морфологии внутренних органов не наблюдали. В старшем возрасте у погибших и убитых подопытных особей обнаруживали патологические изменения, которые не встречались у контрольных кур.
А Б
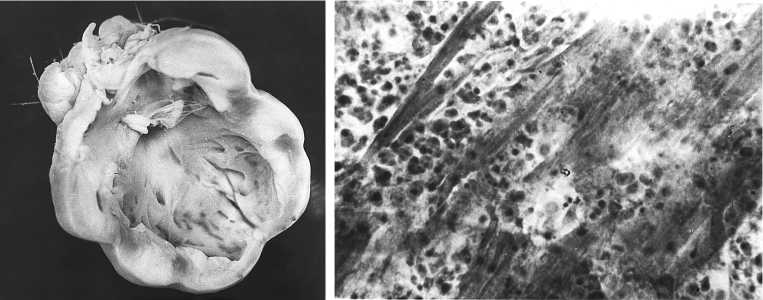
Рис. 3. Патология сердца у 7-месячного петушка из F2(2,13) — одного из потомков кур русской белой породы, пораженных 131I: А — общий вид увеличенного в объеме бугристого сердца, Б — микрофотография ткани сердца (наблюдается пролиферация лимфоидных и ретикулярных клеток, атрофия мышечных волокон; опыт проводился в условиях вивария). Окрашивание гематоксилином и эозином, увеличение ½400. Суточная доза 131I, полученная родителями, — 2,1 МБк/кг; цыплята F1 были выведены через 3 мес от начала получения 131I.
Отклонения в строении сердца выражались в разращении беловато-желтой ткани на эпикарде, эндокарде и в миокарде. При относительно небольшом поражении в органе отмечались отдельные узелки, при сильном — сердце становилось бугристым, его масса увеличивалась и достигала в некоторых случаях 26 г (рис. 3, А).
При гистологическом исследовании между мышечными волокнами сердца наблюдалась инфильтрация клеток лимфоидного и ретикулярного типа. В местах крупных скоплений этих клеток сохранялись лишь отдель- ные пучки истонченных мышечных волокон со слабо выраженной поперечной исчерченностью (см. рис. 3, Б). У подопытных птиц патологию сердца, по макро- и микроскопическому строению напоминавшую лейкозное поражение, регистрировали неоднократно: по одному случаю — в F1(0,1112), F1(2,112) и F2(1,112), по пять случаев — в F2(1,13) и F2(2,112).
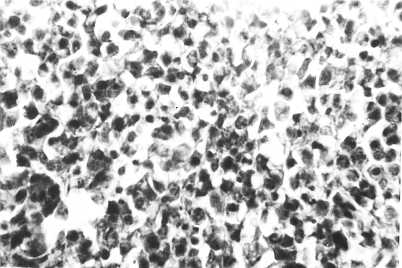
Рис. 4. Микрофотография ретикулосаркомы печени у 9-месячной курицы из F2(1,13) — одной из потомков кур русской белой породы, пораженных 131I (опыт проводился в условиях вивария). Окрашивание гематоксилином и эозином, увеличение ½400. Суточная доза 131I, полученная родителями, — 1,1 МБк/кг; цыплята F1 были выведены через 3 мес от начала получения 131I.
Аналогичные участки ткани новообразования беловатого цвета встречались в печени у подопытных кур. Размер узелков в паренхиме колебался от просяного зерна до лесного ореха, объем органа был увеличен.
В зависимости от степени поражения при микроскопии печени отмечали более или менее выраженную пролиферацию недифференцированных ретикулярных и лимфоидных клеточных элементов по ходу кровеносных сосудов. Крупные очаги этих клеток были похожи на ретикулосаркому. Печеночная ткань при этом оказывалась фрагментирована, ее клетки находились в состоянии мел- кокапельной жировой дистрофии и некробиоза (рис. 4). Изменения печени такого рода установлены в пяти случаях, из них два — в F1(1,13) и три — в F2(1,13).
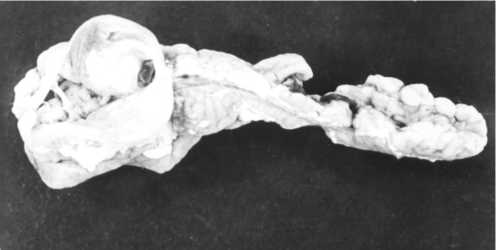
Рис. 5. Новообразование на почке 7-месячного петуха из F4(1,13) — одного из потомков кур русской белой породы, пораженных 131I (опыт проводился в условиях вивария). Окрашивание гематоксилином и эозином, увеличение ½400. Суточная доза 131I, полученная родителями, — 1,1 МБк/кг; цыплята F1 были выведены через 3 мес от начала получения 131I.
Наиболее часто у потомков пораженных 131I кур встречались нарушения морфологии почек. У двух подопытных особей — курицы из F2(1,112) и петуха из F1(1,13) наблюдали атрофию левой почки и гипертрофию правой. В 12 случаях морфологические изменения почек у подопытных кур выражались узелковыми разращениями беловатой ткани в паренхиме органа, а также выступающими с поверхности обра- зованиями светлого цвета, плотной консистенции, округлой формы, размером с лесной или грецкий орех, нередко слоистыми на разрезе (рис. 5). Масса почек при этом была увеличена и иногда достигала 25 г.
При гистологическом исследовании отмечали сильное полнокровие органа, дискомплексацию и cлущивание эпителия канальцев, скопления между канальцами молодых ретикулярных клеток. При сильном поражении почек эти клетки почти полностью замещали почечную паренхиму, что указывало на ретикулез. Такие макро- и микроскопические изменения почек наблюдали в одном случае в F1(1,13), в двух — в F1(1,112), в одном — в F1(2,112), в двух — в F2(1,112), в одном — в F2 (1,112), в трех — в F3(1,13), в одном — в F3(1,112), в одном — в F4(1,13).
Морфологические изменения щитовидной железы отмечали у двух подопытных кур — из F1(2,112) и F2(1,13). Щитовидные железы были увеличенными в объеме, бугристыми, неравномерно окрашенными. При гистологическом исследовании выявили уменьшение числа фолликулов и замещение паренхимы железы лимфоидными и ретикулярными клетками.
Изменение морфологии яичников отмечали в по одному — в F1(1,13), F1(2,112) и F2(1,112) и дважды — в F2(1,13). Яичники этих кур имели вид кочана цветной капусты с желточными шарами, окрашенными в цвета от белого до черного, часто с кровоизлияниями. При гистологиче- ском исследовании установили петлистое строение органа со скоплением в паренхиме клеточных элементов лимфоидного и ретикулярного типов.
У двух подопытных кур — в F1(1,13) и F2(1,13) на брыжейке и кишечнике обнаружили многочисленные желтоватые узелки упругой консистенции, размером от горошины до грецкого ореха. При микроскопии опухолевидных разращений наблюдали скопления ретикулярных клеток.
При вскрытии трупа 7-месячной курицы из F2(1,13) на легком нашли образование желтоватого цвета, упругой консистенции, cаловидное на разрезе, размером с лесной орех. При гистологическом исследовании установили, что клеточный состав новообразования неоднороден. Среди лимфоидных и ретикулярных клеток преобладали лимфоидные при обогащении органа стромой, был выражен распад клеток. Отмеченные признаки свидетельствовали о том, что это лимфоретикулоcаркома.
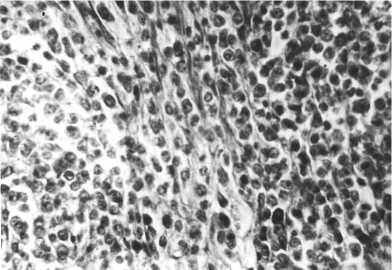
Рис. 6. Микрофотография опухоли на спине 7месячного подопытного петуха из F2(1,13) — одного из потомков кур русской белой породы, пораженных 131I (наблюдается пролиферация ретикулярных клеток; опыт проводился в условиях вивария). Окрашивание гематоксилином и эозином, увеличение ½400. Суточная доза 131I, полученная родителями, — 1,1 МБк/кг; цыплята F1 были выведены через 3 мес от начала получения 131I.
У двух подопытных потомков были обнаружены опухоли в грудной полости, которые по клеточному составу напоминали рети-кулосаркому. У курицы из F2(1,112) опухоль размером с куриное яйцо, плотной консистенции, слоистая на разрезе располагалась рядом c правым легким и проросла в межреберные мышцы. У курицы из F3(1,112) опухолевидное разращение занимало большую часть грудной полости.
В одном случае у 7-месячного подопытного петушка из F2(1,13) нашли округлое, размером с куриное яйцо новообразование на спине под кожей между крыльями, упругой консистенции, саловидное на разрезе. При микроско- пии установлено, что его ткань была отчетливо васкуляризирована, выра-
жена строма, которая окружала скопления незрелых клеток ретикулярного типа. По строению ткань новообразования оказалась сходна с ретикуло-саркомой (рис. 6).
Выживаемость потомков облученных 131I кур была сниженной (табл. 1). Наибольшую смертность подопытных цыплят отмечали в течение 1-го мес жизни. В F1 в группах 0,1112; 1,13; 1,16,; 1,112; 2,112 и 4,63 к концу 1-го мес жизни погибло на 10,2; 7,0; 7,8; 7,7; 41,5 и 45,5 % больше цыплят, чем в контроле.
-
1. Возрастная динамика выживаемости (%) в поколениях потомков от кур русской белой породы, подвергшихся экспериментальному воздействию разных доз 131I (опыт в условиях вивария)
Возраст
^ Группа
] F1
1 F2 1
F3 1
F4
1 F5 1
F6
1 мес
0,1112
69,8
78,0
76,5
–
–
–
Контроль
78,0
81,1
78,0
–
–
–
1,13
79,0
78,8
76,8
52,3
71,4
72,3
Контроль
86,0
84,7
87,2
71,2
81,7
80,3
1,16
72,2
–
–
–
–
–
Контроль
80,0
–
–
–
–
–
1,112
83,4
76,9
57,7
81,7
69,8
–
Контроль
91,1
93,7
74,3
85,3
78,0
–
2,112
36,5
59,6
–
–
–
–
Контроль
78,0
81,1
–
–
–
–
4,63
32,5
–
–
–
–
–
Контроль
78,0
–
–
–
–
–
2 мес
0,1112
65,6
69,2
74,3
–
–
–
Контроль
75,0
79,2
73,8
–
–
–
1,13
77,2
75,9
71,6
51,2
66,9
47,9
Контроль
82,0
83,6
83,9
69,4
81,2
67,9
1,112
81,4
73,5
50,8
75,5
60,3
–
Контроль
90,0
90,6
67,3
83,2
73,8
–
2,112
32,4
59,6
–
–
–
–
Контроль
75,0
79,2
–
–
–
–
3 мес
0,1112
65,6
69,2
72,0
–
–
–
Контроль
75,0
79,2
67,7
–
–
–
1,13
77,2
74,6
70,5
50,0
66,9
47,9
Контроль
81,3
82,6
82,6
69,4
80,3
67,9
1,112
80,7
73,5
49,2
75,5
60,3
–
Контроль
90,0
89,1
65,3
82,7
67,7
–
2,112
32,4
59,6
–
–
–
–
Контроль
75,0
79,2
–
–
–
–
6 мес
0,1112
63,4
69,2
68,2
–
–
–
Контроль
73,5
78,3
67,1
–
–
–
1,13
74,6
67,0
69,5
46,5
66,9
46,9
Контроль
81,3
80,5
81,7
67,6
79,8
67,4
1,112
75,8
72,7
48,5
74,7
60,7
–
Контроль
88,9
87,5
65,3
82,3
67,1
–
2,112
32,4
59,6
–
–
–
–
Контроль
73,5
78,3
–
–
–
–
12 мес
0,1112
63,4
68,9
68,2
–
–
–
Контроль
72,0
78,3
67,1
–
–
–
1,13
71,9
60,3
64,2
42,0
66,9
46,9
Контроль
78,6
77,8
79,0
64,7
79,4
65,8
1,112
71,8
64,9
43,8
72,2
60,3
–
Контроль
84,4
86,7
65,3
81,2
67,1
–
2,112
29,6
–
–
–
–
–
Контроль
72,0
–
–
–
–
–
18 мес
0,1112
61,2
68,9
68,2
–
–
–
Контроль
70,5
78,3
67,1
–
–
–
1,13
67,6
55,5
59,9
33,6
65,7
46,9
Контроль
77,3
76,7
78,5
62,2
78,9
46,8
1,112
68,9
57,3
41,5
72,2
60,3
–
Контроль
84,4
83,6
63,4
80,7
67,1
–
2,112
28,2
–
–
–
–
–
Контроль
70,5
–
–
–
–
–
24 мес
1,13
66,7
51,7
57,4
–
–
–
Контроль
75,9
75,1
78,5
–
–
–
1,112
64,0
52,3
–
–
–
–
Контроль
84,4
82,3
–
–
–
–
30 мес
1,13
66,7
50,0
–
–
–
–
Контроль
75,9
75,1
–
–
–
–
1,112
62,6
–
–
–
–
–
Контроль
82,2
–
–
–
–
–
П р и м е
ч а н и е. В графе «Группа» приведена суточная доза 131I, полученная родителями.
Число в
верхнем индексе указывает, через сколько месяцев от начала Прочерки означают, что исследования не проводили.
получения
131I были выведены цыплята F1.
-
2. Частота смертельных исходов в зависимости от вызвавшей их причины в поколениях потомков от кур русской белой породы, подвергшихся экспериментальному воздействию разных доз 131I (опыт в условиях вивария)
Пониженная выживаемость подопытных цыплят из F1 сохранялась и в старшем возрасте, однако в группах 0,113; 1,13; 1,112; 2,12 их гибло значительно меньше, чем в 1-й мес жизни. Различия в выживаемости подопытной и контрольной птицы к 18-месячному возрасту в этих группах по сравнению с соответствующими показателями в 1-месячном возрасте увеличились не более чем на 3 %. В группе 4,63 смертность подопытных цыплят с возрастом прогрессивно возросла, и к концу 2-го мес жизни все они погибли.
Сниженной жизнеспособностью характеризовалась подопытная птица и в последующих поколениях. К 6-месячному возрасту выживаемость особей F2 в группах 0,1112; 1,13; 1,112 и 2,112 была ниже, чем в контроле, соответственно на 9,1; 13,5; 14,8 и 17,7 %. Сходная динамика выживаемости подопытной птицы наблюдалась в 3-6-м поколениях.
В общем числе смертельных исходов у контрольных и подопытных потомков наибольший удельный вес имели слабые новорожденные цыплята, которые погибали главным образом в течение 1-го мес жизни (табл. 2).
|
Поколение |
Группа |
Всего пало |
Слабые от рождения |
С заболеваниями |
||
|
органов желудочно-кишечного тракта, печени |
сердца |
почек |
||||
|
F 1 |
0,1112 |
36 |
29/80,6 |
5/13,9 |
2/5,5 |
– |
|
Контроль |
20 |
17/85,0 |
3/15,0 |
– |
– |
|
|
1,13 |
39 |
24/61,5 |
14/36,0 |
1/2,5 |
– |
|
|
Контроль |
36 |
21/58,3 |
14/39,0 |
1/2,7 |
– |
|
|
1,112 |
54 |
24/44,5 |
25/46,3 |
3/5,5 |
2/3,7 |
|
|
Контроль |
16 |
8/50,0 |
7/43,7 |
1/6,6 |
– |
|
|
2,112 |
51 |
45/88,4 |
4/7,8 |
2/3,8 |
– |
|
|
Контроль |
20 |
17/85,0 |
3/15,0 |
– |
– |
|
|
4,63 |
28 |
28/100 |
– |
– |
– |
|
|
Контроль |
20 |
17/85,0 |
3/15,0 |
– |
– |
|
|
F 2 |
0,1112 |
23 |
17/74,0 |
6/26,0 |
– |
– |
|
Контроль |
23 |
20/87,0 |
3/13,0 |
– |
– |
|
|
1,13 |
118 |
50/42 3 |
58/49,0 |
2/1,8 |
– |
|
|
Контроль |
47 |
29/62,0 |
16/34,0 |
– |
– |
|
|
1,112 |
50 |
27/54,0 |
20/40,0 |
2/4,0 |
– |
|
|
Контроль |
23 |
8/34,8 |
15/65,2 |
– |
– |
|
|
2,112 |
23 |
22/95,5 |
– |
1/4,5 |
– |
|
|
Контроль |
23 |
20/87,0 |
3/13,0 |
– |
– |
|
|
F 3 |
0,1112 |
42 |
31/74,0 |
10/23,7 |
1/2,3 |
– |
|
Контроль |
66 |
38/57,5 |
27/41,0 |
1/1,5 |
– |
|
|
1,13 |
81 |
44/54,5 |
33/40,7 |
2/2,4 |
2/2,4 |
|
|
Контроль |
40 |
24/60,0 |
15/37,5 |
1/2,5 |
– |
|
|
1,112 |
76 |
55/72,4 |
20/26,3 |
1/1,3 |
– |
|
|
Контроль |
37 |
26/70,2 |
11/29,8 |
– |
– |
|
|
F 4 |
1,13 |
57 |
41/72,0 |
15/26,3 |
1/1,7 |
– |
|
Контроль |
42 |
32/76,2 |
10/23,8 |
– |
– |
|
|
1,112 |
76 |
50/65,8 |
24/31,6 |
2/2,6 |
– |
|
|
Контроль |
38 |
29/76,4 |
8/21,0 |
1/2,6 |
– |
|
|
F 5 |
1,13 |
46 |
39/84,8 |
6/13,0 |
1/2,2 |
– |
|
Контроль |
46 |
40/87,0 |
6/13,0 |
– |
– |
|
|
1,112 |
25 |
16/64,0 |
8/32,0 |
1/4,0 |
– |
|
|
Контроль |
54 |
37/68,6 |
15/27,8 |
2/3,6 |
– |
|
|
F 6 |
1,13 |
50 |
26/52,0 |
22/44,0 |
1/2,0 |
1/2,0 |
|
Контроль |
66 |
38/57,5 |
27/41,0 |
1/1,5 |
– |
|
П р и м е ч а н и е. В графе «Группа» приведена суточная доза 131I, полученная родителями. Число в верхнем индексе указывает, через сколько месяцев от начала получения 131I были выведены цыплята F1. Перед косой чертой — абсолютное значение, после косой — процент от общего числа погибших особей. Прочерки означают, что случаев гибели птицы не отмечали.
Как в опытных, так и в контрольных группах процент погибшего молодняка в F4 и F5 по отношению к F1 возрастал.
Основной причиной смертельных исходов у потомков кур, облученных 131I, было рождение слабого молодняка, затем — заболевания органов желудочно-кишечного тракта и печени, сердца, почек. У подопытных потомков старше 6-месячного возраста возникали опухолевидные поражения мягких тканей тела. По отношению к общему числу цыплят частота появления таких образований составляла в F1(0,1112) — 1,1 %, 232
F 1 (1,13) — 3,5 %, F 1 (1,112) — 3,4 %, F 1 (2,112) — 3,8 %, F 2 (1,13) — 4,7 %, F 2 (1,112) — 3,4 %, F 2 (2,112) — 1,4, F 3 (1,13) — 1,0 %, F 3 (1,112) — 0,7 %, F4(1,112) — 0,8 %. В среднем доля новообразований внутренних органов у потомков 1-й генерации, полученных через 3 мес от начала воздействия на родительский организм 131I в дозе 1,1 МБК/кг, равнялась 3,3 %, у потомков 2-й генерации, выведенной через 12 мес, — 2,9 %. Местами локализации опухолей были скелетная мускулатура, органы грудной и брюшной полости. По строению опухоли оказались сходны с лимфоретикуло- или с ретикулосаркомой. Онкогенные процессы, по-видимому, становились одним из факторов, снижающих выживаемость подопытной птицы.
Смертность молодняка зависела от дозы 131I, полученной родителям: при высоких дозах гибло больше цыплят, чем при меньших. Дозозависимого эффекта по частоте распределения заболеваний органов желудочно-кишечного тракта, печени, сердца отмечено не было. Поражения почек и новообразования в контроле не встречались.
Наши результаты согласуются с экспериментальными данными, полученными на крысах, подвергнутых воздействию 131I в период беременности (20). Установлено, что у потомков, рожденных от носителей 131I, возможны нарушения физического развития, увеличение частоты опухолей различной локализации, повреждения генетического аппарата в половых клетках. Основной причиной этих явлений признается прямое действие излучений на яйцеклетку, эмбрион и плод. Полученные данные сопоставимы и с результатами исследования потомства людей, облученных в Восточно-Уральском и Чернобыльском следе (21-26). Изучение последствий аварийного и профессионального облучения показывает, что в результате пролонгированного действия радиации возможно нарушение функции воспроизводства: увеличение частоты неблагоприятных исходов беременностей, задержка и нарушение физического развития рожденных потомков, повышенная смертность и онкологическая заболеваемость (27-33).
В XXI веке негативное влияние комплекса техногенных факторов, включающего ионизирующее излучение, на организм человека и его репродуктивное здоровье намного возросло (34, 35). Всесторонняя объективная оценка этой серьезной угрозы, научное обоснование и реализация наиболее эффективных мер по предотвращению или максимальному смягчению отрицательного воздействия радиационных факторов, которые могут передаваться следующим поколениям, — одна из наиболее важных задач научного сообщества (36, 37).
Таким образом, установлен ряд аномалий развития у потомков кур, подвергнутых хроническому воздействию 131I в дозах от 0,11 до 4,6 МБк/кг. Эти нарушения имели фенотипические проявления в виде пониженной постнатальной выживаемости, уменьшения массы тела, врожденных аномалий, склонности к неоплазиям. По-видимому, повышенная смертность потомков от облученных 131I кур связана с изменениями, происходящими в процессе эмбриогенеза, в результате чего в ранние периоды постнатальной жизни организм имел несовершенные механизмы регуляции и адаптации. Основными причинами гибели потомков кур, пораженных 131I, были заболевания органов желудочно-кишечного тракта, печени, сердца, почек. У потомков F1-F4 старше 6-месячного возраста отмечено появление новообразований, локализованных в мягких частях тела. По строению опухоли были сходны с лимфоретикуло- или с ретикулосаркомой.
Л И Т Е Р А Т У Р А
М., 1996.
ГНУ Всероссийский НИИ ветеринарной Поступила в редакциювирусологии и микробиологии Россельхозакадемии, 17 ноября 2014 года
Sel’skokhozyaistvennaya biologiya / Agricultural Biology , 2015, V. 50, ¹ 2, pp. 225-236
ABNORMALITIES IN THE OFFSPRING OF HENS SUBJECTED TO CHRONIC EFFECT OF 131I
Список литературы Аномалии развития у потомков кур, подвергнутых хроническому воздействию
- Радионуклидное загрязнение окружающей среды и здоровье населения/Под ред. И.Я. Василенко, Л.А. Булдакова. М., 2004.
- Хрущ В.Т., Гаврилин Ю.И., Шинкарев С.М. Характеристика индивидуального и группового облучения щитовидной железы у детей г. Минска, имеющих результаты дозиметрического обследования щитовидной железы в мае-июне 1986 года. В сб.: Экология и состояние здоровья детей города Минска после катастрофы на ЧАЭС. Медико-экологический мониторинг. Минск, 1994: 28-32.
- Kosenko M.M., Izhevsky P.V., Degteva M.O., Akleev A.V., Vyushkova O.V. Pregnancy outcome and early health status of children born to the Techa river population. The Science of Total Environment, 1994, 142: 91-100 ( ) DOI: 10.1016/0048-9697(94)90076-0
- Garsi J.P., Schlumberger M., Ricard M., Labbe M., Ceccarelli C., Schvartz C., Henry-Amar M., Bardet S., Rubino C., De Vathaire F. Health outcomes of children fathered by patients treated with radioiodine for thyroid cancer. Clin. Endocrinol., 2009, 71(6): 880-883 ( ) DOI: 10.1111/j.1365-2265.2009.03561.x
- Глазко Т.Т., Архипов Н.П., Глазко В.И. Популяционно-генетические последствия экологических катастроф на примере аварии на Чернобыльской АЭС. М., 2008.
- Наумчик И.В., Ильина Е.Г., Румянцева Н.В. Структура множественных врожденных пороков развития по данным Белорусского генетического регистра. Тез. докл. Первого съезда врачей Республики Беларусь. Минск, 1998: 148-149.
- Чернобыль: последствия катастрофы для человека и природы/Под ред. А.В. Яблокова, А.Б. Нестеренко, В.А. Нестеренко. СПб, 2007.
- Коренев М.М. Дiти iз сiмей лiквiдаторiв наслiдкiв аварiї на ЧАЕС на порозi передачi до терапевтичної лiкувальної мережi. Педiатрiя, акушерство та гiнекологiя, 2008, 4: 9-10.
- Медичнi наслiдки аварiї на Чорнобильськiй атомнiй електростанцiї/За ред. О.Ф. Возi-анова, В.Г. Бебешка, Д.А. Базики. Київ, 2007.
- Панасюк Г.Д., Надыров Э.А., Рожко А.В. Показатели тиреоидного статуса у детей, подвергшихся воздействию радионуклидами йода во внутриутробном периоде развития. Проблемы здоровья и экологии, 2008, 2: 19-23.
- Алексанин С.С., Астафьев О.М., Рожко А.В., Хирманов В.Н., Тихомирова О.В. 25 лет после Чернобыля: состояние здоровья, патогенетические механизмы, опыт медицинского сопровождения ликвидаторов последствий аварии на ЧАЭС (руководство для врачей). СПб, 2011.
- Лягинская А.М. Актуальные проблемы действия ионизирующей радиации на плод. В сб.: Биологическое действие малых доз радиации. М., 1983: 122-132.
- Медицинские последствия Чернобыльской аварии. Результаты пилотных проектов АЙФЕКА и соответственных национальных программ. Женева, 1996: 153-169.
- Bairacova A. Postnatal development and genetic damage in mice receiving iodine-131 treatment in foetal. Рентгенология и радиология, 1969, 8(1): 36-41.
- Лягинская A.M., Осипов В.А., Смирнова О.В., Исиченко И.Б., Романова С.В. Функция воспроизводства у участников ликвидаций последствий аварии на Чернобыльской АЭС и здоровье их детей. Медицинская радиология и радиационная безопасность, 2002, 47(1): 5-10.
- Гуськова А.К. Радиационная патология человека. В кн.: Радиационная медицина. Руководство для врачей исследователей организаторов здравоохранения и специалистов по радиационной безопасности. Т. 1. Теоретические основы радиационной медицины/Под ред. Л.А. Ильина. М., 2004: 90-121.
- Ларионов В.Ф., Котова О.Д. Биологические закономерности роста цыплят. Успехи зоотехнической науки, 1936, 2: 1-4.
- Боль Б.К. Патологоанатомическое вскрытие сельскохозяйственных животных. М., 1950.
- Плохинский Н.А. Биометрия. М., 1970.
- Бурыкина Л.Н. К токсикологии радиоактивного йода. В сб.: Материалы по токсикологии радиоактивных веществ. М., 1972, вып. 8: 3-11.
- Головко О.В., Ижевский П.В. Изучение репродуктивного поведения в популяциях России и Беларуси, подвергшихся воздействию ионизирующего излучения в результате аварии на Чернобыльской АЭС. Радиационная биология. Радиоэкология, 1996, 36(1): 3-8.
- Балонов М.И. Медицинские и экологические последствия Чернобыльской аварии в докладе НКДАР ООН (2008): уроки для реагирования на ядерные аварии. Медицинская радиология и радиационная безопасность, 2011, 56(6): 15-23.
- Рожко А.В., Масякин В.Б., Власова Н.Г. Особенности развития тиреоидной патологии у населения, облученного в детском и подростковом возрасте. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях, 2008, 4: 19-22.
- Кравцов В.Ю., Рожко А.В., Никонович С.Н., Надыров Э.А., Ибрагимова Н.В. Кариопатологические изменения в клеточных популяциях тироцитов у жителей Гомельской области, облученных в детском и подростковом возрасте в результате аварии на ЧАЭС. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях, 2009, 2: 64-68.
- Дедов И.И., Дедов В.И. Чернобыль: радиоактивный йод -щитовидная железа. М., 1996.
- Патология отдаленного периода у ликвидаторов последствий аварии на Чернобыльской АЭС./Под ред. А.М. Никифорова. СПб, 2004.
- Abouzeid Ali H.E., Barber R.C., Dubrova Y.E. The effects of maternal irradiation during adulthood on mutation induction and transgenerational instability in mice. Mutat. Res., 2012, 732(l-2): 21-25 ( ) DOI: 10.1016/j.mrfmmm.2012.01.003
- Barber R.C., Dubrova Y.E. The offspring of irradiated parents, are they stable? Mutat. Res., 2006, 598(l-2): 50-60 ( ) DOI: 10.1016/j.mrfmmm.2006.01.009
- da Cruz A.D., de Melo e Silva D., da Silva C.C., Nelson R.J., Ribeiro L.M., Pedrosa E.R., Jayme J.C., Curado M.P. Microsatellite mutations in the offspring of irradiated parents 19 years after the Cesium-137 accident. Mutat. Res., 2008, 652(2): 175-179 ( ) DOI: 10.1016/j.mrgentox.2008.02.002
- Lushnikov E.F., Abrosimov A.Yu., Troshin V.P., Frank G.A., Williams D., Thomas G., Davis S., Kopecky K.J. Pathology of post-Chernobyl thyroid carcinoma in children from Bryansk oblast of Russia. Virchows Archiv, 1999, 435(3): 338.
- Little M.P., Goodhead D.T., Bridges B.A., Bouffler S.D. Evidence relevant to untargeted and transgenerational effects in the offspring of irradiated parents. Mutat. Res., 2013, 753(l): 50-67 ( ) DOI: 10.1016/j.mrrev.2013.04.001
- Miller A.C., Stewart M., Rivas R. Preconceptional paternal exposure to depleted uranium: transmission of genetic damage to offspring. Health Phys., 2010, 99(3): 371-379 ( ) DOI: 10.1097/HP.0b013e3181cfe0dd
- Wu J., Morimyo M., Hongo E., Higashi T., Okamoto M., Kawano A., Ohmachi Y. Radiation-induced germline mutations detected by a direct comparison of parents and first-generation offspring DNA sequences containing SNPs. Mutat. Res., 2006, 596(1-2): 1-11 ( ) DOI: 10.1016/j.mrfmmm.2005.09.004
- Лягинская А.М., Булдаков Л.А., Сауров М.М., Филюшкин И.В., Осипов В.А., Ермалицкий А.П. Последствия для здоровья населения радиоактивного загрязнения откружающей среды в результате ипытаний ядрного оружия и аварии на ЧАЭС. В кн.: Радионуклидное загрязнение окружающей среды и здоровье населения/Под ред. И.Я. Василенко, Л.А. Булдакова. М., 2004: 215-335.
- Иванов В.И., Бочков И.П., Гинтер Е.К., Севанькаев А.В. Генетические последствия в популяциях России, подвергшихся радиационному воздействию в результате аварии на ЧАЭС. Мат. Межд. семинара «Проблемы смягчения последствий Чернобыльской катастрофы». Ч. 2. Брянск, 1993: 227-230.
- Исамов Н.Н., Исамов Н.Н. (мл.), Саруханов В.Я. Влияние радиационного фактора на воспроизводство сельскохозяйственных животных. Сельскохозяйственная биология, 2006, 2: 3-17.
- Гуськова А.К. Медицинские последствия аварии на Чернобыльской АЭС. Основные итоги и нерешенные проблемы. Медицинская радиология и радиационная безопасность, 2010, 55(3): 17-28.


