Антагонист бомбезиновых рецепторов BBN/C1-C2 в модели колоректального рака in vitro
Автор: Белобородов Е.А., Юрова Е.В., Сугак Д.Е., Фомин А.Н., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Колоректальный рак является третьим по распространенности и вторым по количеству смертей онкологическим заболеванием в мире. Одна из стратегий лечения колоректального рака заключается в использовании таргетной пептидной терапии, нацеленной на определенные типы рецепторов, сверхэкспрессирующихся на поверхности клеток. Перспективной мишенью является бомбезиновый рецептор GRPR, для которого характерна аномальная экспрессия при колоректальном раке. В данной работе для лечения колоректального рака предлагается использовать молекулу BBN/C1-C2, созданную на основе бомбезина – короткого пептида, тропного к GRPR, и кноттина, который выступает в качестве каркаса для стабилизации молекулы. BBN/C1-C2 выступает в роли антагониста рецептора GRPR, что определяет его роль в выживаемости раковых клеток. Цель. Изучение влияния пептида BBN/C1-C2 на выживаемость клеточной культуры колоректального рака. Материалы и методы. Влияние пептида BBN/C1-C2, полученного с помощью твердофазного синтеза, на выживаемость раковых клеток оценивали в культуре HCT-116 с использованием флуоресцентной микроскопии (апоптоз, некроз) и клеточного анализатора (динамика адгезии клеток) через 3 и 24 ч после воздействия. Результаты. Пептид BBN/C1-C2 в концентрациях от 0,2 до 20 мкМ показал себя как молекулу, способную не только ингибировать пролиферацию клеток, но и вызывать клеточную гибель путем апоптоза уже через три часа после инкубации. Выводы. Таким образом, молекула BBN/C12-C2, созданная на основе агониста GRPR, встроенного в молекулу кноттина, может рассматриваться в качестве прототипа для создания радиофармпрепарата для лечения новообразований толстого кишечника.
Колоректальный рак, бомбезин, таргетная терапия
Короткий адрес: https://sciup.org/14132980
IDR: 14132980 | УДК: 615.849.12;615.277.3 | DOI: 10.34014/2227-1848-2025-1-114-123
Текст научной статьи Антагонист бомбезиновых рецепторов BBN/C1-C2 в модели колоректального рака in vitro
Введение. Колоректальный рак, представленный раком толстой или прямой кишки, является третьим по распространенности и вторым по количеству смертей онкологическим заболеванием в мире. В 2020 г. он стал причиной 9,4 % смертей [1]. Стандартным методом лечения колоректального рака является лапароскопическая резекция. Однако существует проблема определения целесообразности данной процедуры [2, 3]. К недостаткам классической химиотерапии можно отнести развитие устойчивости к применяемым препаратам [4]. Важным достижением в области лечения онкопатологии стала таргетная пептид-рецепторная радионуклидная терапия (ПРРТ).
Одна из стратегий ПРРТ колоректального рака заключается в воздействии на сверхэкс- прессирующий фактор роста эндотелия сосудов (VEGF). В качестве препарата может использоваться, например, бевацизумаб, представляющий собой моноклональное антитело, связывающееся с изоформами VEGF [5]. Противоопухолевый эффект бевацизумаба проявляется в противоангиогенном действии, изменении функциональности уже имеющихся в опухоли сосудов, а также непосредственном воздействии на VEGF-рецепторы опухолевых клеток [6]. Еще большим, чем бевацизумаб, сродством к VEGF обладает рекомбинантный белок афлиберцепт, представляющий собой внеклеточный домен VEGFR-1 и VEGFR-2 [7].
Другой стратегией ПРРТ является нацеливание на рецептор эпидермального фактора роста человека (EGFR), сверхэкспрессия кото- рого наблюдается в 65–75 % случаев колоректального рака [8]. Для реализации данного подхода используется цетуксимаб – антитело, которое после конкурентного связывания с внешним доменом рецептора способствует интернализации и разрушению EGFR, что приводит к ингибированию роста клеток, снижению выработки матриксной металлопротеиназы и VEGF, а также к индукции апоптоза [9, 10].
В данной работе для ПРРТ колоректального рака мы предлагаем использовать молекулу BBN/C1-C2, созданную на основе бомбе-зина – короткого пептида, тропного к GRPR, и кноттина, который выступает в качестве каркаса для стабилизации молекулы.
Цель исследования. Обобщить имеющиеся на сегодняшний день данные, касающиеся участия дофамина в регуляции сердечно-сосудистой системы.
Материалы и методы. Синтез BBN/C1-C2. Пептид BBN/C1-C2 получали с помощью твердофазного синтеза на основе Fmoc-химии (все аминокислоты производства Intavis (Германия)) на пептидном синтезаторе ResPep SL (Intavis, Германия) по стандартному протоколу. В качестве активатора использовали HBTU («Кемикал Лайн», Россия). Анализ пептида проводили на хроматографе LC-20AD XR (Shimadzu, Япония) методом обращенно-фазовой хроматографии и на масс-спектрометре MALDI-TOF MS FLEX (Bruker Daltonics, Германия). Очистку проводили на хроматографе
AutoPure25 (Inscinstech, Китай) методом обращенно-фазовой хроматографии.
Клеточная культура и условия эксперимента. В экспериментах использовали клеточную культуру HCT-116 (рак толстого кишечника человека), которую содержали в среде RPMI-1640 («ПанЭко», Россия) с добавлением 10 % фетальной бычьей сыворотки (Global Kang, Китай) и гентамицина. Пассажи проводили каждые 3–4 дня с использованием 0,25 % трипсина.
Перед экспериментом проводили пассаж в 24-луночные планшеты в концентрации 50 000 клеток на лунку. После достижения экспоненциальной стадии к культуре добавляли BBN/C1-C2 в фосфатно-солевом буфере с добавлением 0,1 % бычьего сывороточного альбумина для предотвращения неспецифического связывания и инкубировали 3 ч. После этого буфер заменяли на питательную среду и инкубировали. Для оценки апоптоза и некроза добавляли 20 мкМ пептида, результат фиксировали через 3 и 24 ч. Для анализа клеточного индекса добавляли 0,2, 2 и 20 мкМ BBN/C1-C2.
Флуоресцентная микроскопия . Уровни апоптоза и некроза оценивали с использованием флуоресцентных красителей Yo-Pro 1 (1 мкМ) и PI (1 мкМ), оптической системы Nikon Ti серии S (Nikon, Япония), камеры DS-Qi1MC и соответствующих фильтров. Фиксировали сигнал флуоресценции и обрабатывали информацию с использованием программы ImageJ. После этого получали данные в виде относительных флуоресцентных единиц (сигнал флуоресценции клеток за вычетом сигнала фона) [15].
Клеточный индекс. Анализ динамики адгезии клеток проводили с использованием клеточного анализатора xCellingence RTCA-S16 (ACEA Biosciences, США) [16]. Для этого культуру засеивали в 16-луночные планшеты, предварительно зафиксировав нулевую точку. В режиме реального времени фиксировали изменение клеточного индекса. Далее добавляли BBN/C1-C2, через 3 ч буфер заменяли на среду. Индекс фиксировали при всех манипуляциях.
Статистическая обработка данных. Каждый эксперимент проводили три раза в трех повторах. Статистическую обработку данных проводили с использованием критерия Стьюдента (апоптоз и некроз) и критерия Манна – Уитни (клеточный индекс). Различия считались достоверными при p<0,05.
Результаты. BBN/C1-C2 был получен с помощью твердофазного пептидного синтеза и очищен до 95 %. Далее его инкубировали с культурой HCT-116 3 ч, измеряли динамику клеточного индекса и уровень апоптоза и некроза после 3 и 24 ч восстановления в питательной среде. Данный подход позволяет оценить способность пептида не только непо- средственно вызывать гибель клеток, но и удерживаться на поверхности раковых клеток и обуславливать ингибирование целевого рецептора, что сказывается на динамике роста культуры в период восстановления.
При анализе клеточного индекса, который показывает динамику адгезии клеток как реакцию на внешнее воздействие, видно, что в первые 5 ч эффект BBN/C1-C2 носит дозозависимый характер (рис. 1). При этом действие BBN/C1-C2 в концентрации в 0,2 мкМ неотличимо от контрольных условий.
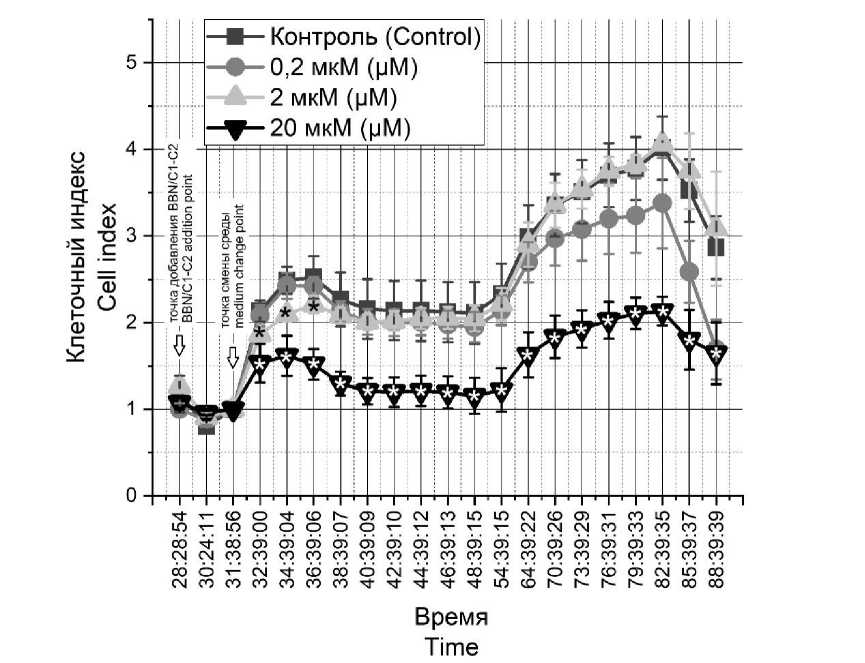
Рис. 1. Дозозависимое изменение клеточного индекса при добавлении к культуре HCT-116 пептида (точка нормализации 31:38:56, * – достоверное отличие от контрольной группы)
Fig. 1 . Dose-dependent change in the cell index while adding different concentrations of BBN/C1-C2 peptide to HCT-116 culture
(normalization point 31:38:56, * – the difference is significant compared with the control)
После воздействия пептида в концентрации 2 мкМ культура восстанавливается до контрольного уровня после 5 ч инкубации в среде. А в концентрации 20 мкМ в это же время продолжает снижаться. Даже несмотря на то что культура постепенно начинает восстанавливаться, клеточный индекс остается пониженным относительно контрольных условий, и со временем культура начинает погибать.
При анализе уровня клеточной гибели, сопровождающей изменение клеточного индекса, отмечается, что в первые 3 ч при инку- бировании культуры в фосфатно-солевом буфере с добавлением бычьего сывороточного альбумина и 20 мкМ BBN/C1-C2 происходит незначительное развитие апоптоза (рис. 2А), при этом уровень некроза остается близким к контролю (рис. 2В).
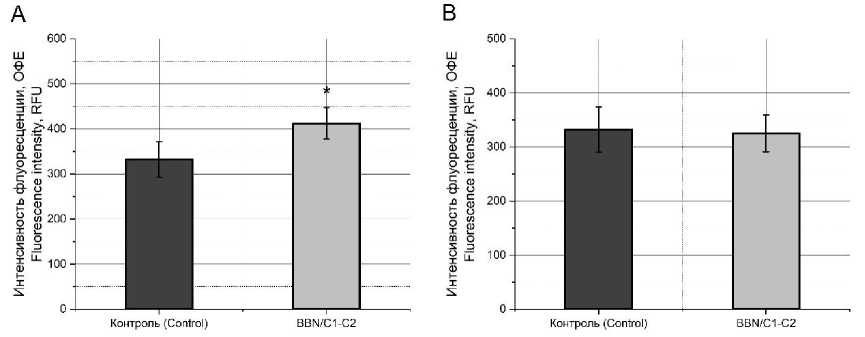
Рис. 2. Уровень апоптоза (А) и некроза (В) в культуре HCT-116 при добавлении BBN/C1-C2 в концентрации 20 мкМ через 3 ч (* – достоверное отличие от контрольной группы)
Fig. 2. Levels of apoptosis (A) and necrosis (B) in HCT-116 culture three hours after adding BBN/C1-C2 peptide (concentration 20 μM)
(* – the difference is significant compared with the control)
Но через 24 ч после смены буфера с BBN/C1-
C2 на питательную среду уровень апоптоза зна- чительно возрастает (рис. 3А), при этом уровень некроза остается прежним (рис. 3В).
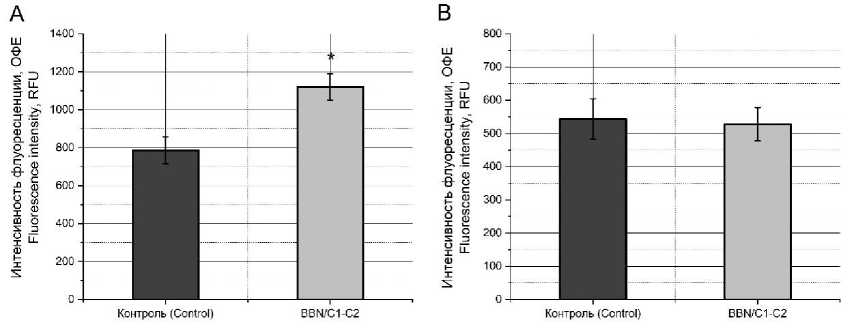
Рис. 3. Уровень апоптоза (А) и некроза (В) в культуре HCT-116 при добавлении BBN/C1-C2 в концентрации 20 мкМ через 24 ч (* – достоверное отличие от контрольной группы)
Fig. 3. Levels of apoptosis (A) and necrosis (B) in HCT-116 culture twenty-four hours after adding BBN/C1-C2 peptide (concentration 20 μM) (* – the difference is significant compared with the control)
Обсуждение. В последние десятилетия разработка радиофармпрепаратов на основе пептидов, нацеленных на бомбезиновые рецепторы, ведется достаточно успешно [17, 18]. Имеется ряд наблюдений, которые позволяют проводить дополнительные модификации пептидов для улучшения их свойств.
Так, в связи с тем, что качестве прототипов для создания радиофармпрепаратов используются пептиды, тропные к рецептору, в данном случае GRPR, эффект их может быть агонистическим, приводящим к биологическому отклику. В таком случае действие пептида на GRPR приведет к усилению трофики новообразования, что значимо скажется на развитии патологии. Ярким примером является агонист бомбезина AMBA (DOTA-Gly-4-аминобензоил-BBN(7–14), применение которого показывает хорошую результативность при визуализации и терапии рака предстательной и молочной желез [19, 20]. Однако у пациентов, прошедших лечением AMBA, наблюдалось его значительное поглощение поджелудочной железой и желудочно-кишечным трактом [21]. Кроме того, исследование фазы I, проведенное у пациентов с метастатическим ка-страционно-резистентным раком простаты, было прекращено из-за серьезных побочных эффектов, вызванных активацией GRPR после инъекции терапевтических доз [22].
Использование антагонистов рецепторов также может значительно изменить ход лечения новообразований. Например, одна из модификаций PD176252, непептидного ингибитора GRPR, обеспечивает значительное снижение скорости роста линий клеток HGC-27 (желудок), HCT-116 (толстый кишечник), PC-3 (простата), A549 (легкие) [23]. Кроме того, RC-3940-II вызывает ингибирование пролиферации клеточных линий рака толстой кишки человека HT-29, HCT-116 и HCT-15 in vitro и in vivo [24].
Нами предлагается создание антагониста на основе пептида бомбезина (агониста рецептора GRPR) с добавлением радиоизотопа, что приведет к развитию двойного эффекта: снижению пролиферации новообразования и ги-белю клеток в результате действия радиоактивности. BBN/C1-C2 был разработан на основе кноттина, содержащего в своем составе ингибиторный цистиновый узел, и короткого пептида – бомбезина, помещенного между первым и вторым остатками цистеина. Подобная структура показывает значительное увеличение стабильности в различных условиях, а также дозозависимое снижение пролиферации линии клеток HCT-116. Динамике клеточного индекса в условиях сразу после инкубации с пептидом в трех концентрациях и в условиях восстановления в питательной среде в течении 24 ч после воздействия свидетельствует о том, что пептид в концентрации 20 мкМ значительно снижает значения индекса, что говорит о нарушении адгезии клеток и неспособности к дальнейшему восстановлению. Данные подтверждаются развитием апоптоза в питательной среде через 3 ч после инкубации с пептидом в той же концентрации и его усилением через 24 ч.
Заключение. Таким образом, молекула BBN/C12-C2, созданная на основе агониста GRPR, встроенного в молекулу кноттина, может рассматриваться в качестве прототипа для создания радиофармпрепарата для лечения новообразований толстого кишечника. Кроме того, повышенная стабильность созданной молекулы позволит ей в полном объеме достигать цели, что снизит нагрузку на организм.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № 123020700216 (FEUF-2023-0004)).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Саенко Ю.В., Фомин А.Н.
Литературный поиск, участие в исследовании, обработка материала: Белобородов Е.А.,
Юрова Е.В., Сугак Д.Е.
Статистическая обработка данных: Белобородов Е.А.
Анализ и интерпретация данных: Юрова Е.В.
Написание и редактирование текста: Белобородов Е.А., Юрова Е.В., Саенко Ю.В.


