Антиангиогенные свойства бета-адреноблокаторов
Автор: Дубенский вЛ.В., Дубенский В.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 4 т.14, 2018 года.
Бесплатный доступ
Цель: определение сравнительной антиангиогенной эффективности и влияния бета-адреноблокаторов на уровень сосудистого эндотелиального фактора роста в эксперименте. Материал и методы. Для определения антиангиогенного эффекта бета-адреноблокаторов выполнено сравнительное изучение их влияния на уровень сосудистого эндотелиального фактора роста (VEGF) в эксперименте на 72 нелинейных лабораторных крысах средней массой 180±20 г, которые были условно разделены на шесть групп: 1-я - контрольная; 2-я - отрицательный контроль (экспериментальная ишемия (ЭИ), пересечение бедренных сосудов); 3- я - положительный контроль (ЭИ с введением бевацизумаба); 4-я - ЭИ с введением тимолола; 5-я - ЭИ с введением бетаксолола; 6-я - ЭИ с введением интерферона альфа-2Ь. Результаты. Уровни VEGF составили: в 1-й группе 1,50±0,3 пг/мл, во 2-й группе 20,3±3,2 пг/мл, в 3-й группе 5,8±0,9 пг/мл, в 4-й группе 13,8±1,4 пг/мл, в 5-й группе 19,2±2,3 пг/мл, в 6-й группе 11,1 ±2,2 пг/мл. Результаты микроскопии и иммуногистохимического исследования свидетельствуют об отсутствии активации процессов неоангиогенеза в 1-й группе животных. У животных 2-й и 5-й групп наряду с выраженными воспалительными процессами установлены явления неоангиогенеза. Заключение. Бета-адреноблокаторы проявляют прямое или опосредованное негативное влияние на синтез VEGF и угнетают неоангиогенез. Активность селективного бета-адреноблокатора в отношении подавления неоангиогенеза была ниже по сравнению активностью неселективного, что позволяет рассматривать тимолол как эффективное антиангиогенное средство.
Бета-адреноблокаторы, гемангиомы новорожденных, лечение, тимолол, ювенильные гемангиомы
Короткий адрес: https://sciup.org/149135178
IDR: 149135178 | УДК: 615.217.24.03:616.12-08
Текст научной статьи Антиангиогенные свойства бета-адреноблокаторов
-
1 Введение. Ювенильные гемангиомы, или гемангиомы новорожденных (ЮГ), представляют собой наиболее частые опухоли мягких тканей, возникающие у 4-10% детей в возрасте до 1 года [1, 2].
Ангиоархитектоника ЮГ представлена сложным сочетанием различных клеточных типов, включая преобладающие эндотелиальные клетки, ассоциированные с перицитами, дендритными и тучными клетками. Эндотелиальные клетки пролиферирующих гемангиом являются клональными по происхождению [1, 3, 4].
Эндотелиальные клетки ЮГ демонстрируют особый молекулярный фенотип, при иммуногистохимии в ранней фазе выявляются положительные маркеры: индоламин-2,3-диоксигеназа (IDO) и LYVE-1 и утрачиваются при формировании фенотипа зрелых кровеносных сосудов: переносчик глюкозы 1 (Glut-1), Lewis Y Ag (Le Y), FcRyll, мерозин, CCR6 и CD15 [1].
Mеханизмы регуляции роста и инволюции ЮГ до сих пор изучены недостаточно, однако установлено, что во время фазы роста активны два основных про-ангиогенных фактора: фактор роста фибробластов (bFGF) и сосудистый эндотелиальный фактор роста (VEGF), которые присутствуют in situ, а также в крови и моче детей [1, 2, 5, 6].
В сообщении группы исследователей детского госпиталя Бордо (Франция) во главе с С. Leaute-Labreze (2008) отмечен регресс сложной ЮГ при системном лечении неселективным бета-адреноблокатором (пропранололом). Лечение проводили ребенку с пролиферирующей гемангиомой и кардиомиопатией, обусловленной предшествующей системной кортикостероидной терапией [7]. В последние годы появилось еще несколько сообщений, подтверждающих клиническую эффективность препарата [8].
Адренергическая система представляет собой основной регулятор сердечной деятельности и состояния сосудистой ситемы. Капиллярные эндотелиальные клетки экспрессируют бета-2-адренергические рецепторы, которые модулируют высвобождение NO, вызывая зависимую от эндотелия вазодилатацию [9].
Кроме того, бета-адренергические рецепторы относятся к семейству связанных с G-белком рецепторов, и при их активации катехоламинами они могут способствовать активации внутриклеточных сигнальных путей [9, 10]. Стимуляция бета-рецептора может вызывать модуляцию путей передачи сигнала для ангиогенных факторов, таких как VEGF или bFGF. Установлено, что увеличение уровней сАMР (циклический аденозинмонофосфат) ингибирует вызванную VEGF и bFGF пролиферацию эндотелиальных клеток. Фармакологические или опосредованные бета-адренергическими рецепторами увеличения сАMР блокируют митоген-индуцируемую активацию сигнального пути MАРK (митоген-активируемая про-теинкиназа), приводя к блокированию активности Raf-1 путем увеличения активности РKА (протеинки-назы A) [9].
Цель: определение сравнительной антиангиоген-ной эффективности и влияния бета-адреноблокаторов на уровень сосудистого эндотелиального фактора роста в эксперименте.
Материал и методы. Для определения антианги-огенного эффекта бета-адреноблокаторов выполнено экспериментальное сравнительное изучение влияния бета-адреноблокаторов, а также лекарственных препаратов с известным отрицательным воздействием на уровень сосудистого эндотелиального фактора роста (VEGF). Объектами исследования служили 72 нелинейные лабораторные крысы средней массой 180±20 г, которые были условно разделены на шесть групп (табл. 1).
Таблица 1
Характеристика групп экспериментальных животных
|
Группы животных |
Экспериментальная хроническая ишемия |
Исследуемые фармакологические препараты |
|
1-я группа — контрольная (интактные животные, n=12) |
– |
– |
|
2-я группа (отрицательный контроль, n=12) |
+ |
– |
|
3-я группа (сравне- |
Бевацизумаб |
|
|
ния-1, положитель- |
+ |
(антитела против |
|
ный контроль, n=12) |
VEGF) |
|
|
4-я группа (наблюдения-1, n=12) |
+ |
Тимолол |
|
5-я группа (наблюдения-2, n=12) |
+ |
Бетаксолол |
|
6-я группа (сравне- |
+ |
Интерферон |
|
ния-2, n=12) |
альфа-2b |
Крысы 1-й группы являлись интактными (контрольная группа). Учитывая, что во взрослом организме при отсутствии провоцирующих факторов уровень VEGF находится на базальном уровне с крайне низкими значениями, которые не позволят в полной мере оценить развитие антиангиогенного эффекта, для его стимуляции выполнено моделирование хронической экспериментальной ишемии (ЭИ) одной конечности у крыс 2-й группы без введения фармакологических средств (отрицательный контроль). Крысам 3-й группы после операции ЭИ выполняли введение бевацизумаба. Введение бевацизумаба использовано в качестве «положительного контроля»: при введении данного препарата ожидается наибольшее угнетение синтеза VEGF. Бевацизумаб — рекомбинантные гиперхимерные (гуманизированные) моноклональные IgG1 антитела, которые селективно связываются и ингибируют биологическую активность фактора роста эндотелия сосудов (VEGF) in vitro и in vivo. Для сравнительного анализа антиангиогенного потенциала использовали: тимолол (неселективный бета-адреноблокатор), бетаксолол (селективный бета-адреноблокатор), бевацизумаб и интерферон альфа-2b. В 4-й группе животных выполняли ЭИ и вводили раствор тимолола, в 5-й группе животным с ЭИ вводили бетаксолол и в 6-й группе крысам на фоне ЭИ вводили интерферон альфа-2b. Животные 3-й и 6-й групп необходимы для сравнительной оценки потенциала ингибирования VEGF, так как беваци-зумаб обладает выраженной блокадой синтеза VEGF (положительный контроль), а интерферон альфа-2b оказывает умеренное ингибирующее действие на данный фактор роста.
Животные содержались в виварии, в металлических клетках с выдвижным дном, по 7–8 особей в каждой, в одинаковом световом и температурном режимах. Условия содержания животных и рацион питания соответствовали «Правилам лабораторной практики в Российской Федерации» (приказ MЗ РФ от 19.06.2003 г. №267). Крыс в эксперименте лечили в полном соответствии с Резолюцией ARVO «По использованию животных в экспериментальных исследованиях», с Принципами лечения экспериментальных животных (публикация №89–23 NIH от 1985 г.), Директивой Совета ЕС от 24 ноября 1986 г. о сближении законов, постановлений и административных положений государств ЕС по вопросам защиты животных, используемых для экспериментальных и других научных целей (86/609/EEС), а также ныне действующими стандартами GMP (Good Medical Practice) и GLP (Good Laboratory Practice). Эксперимент проводился в весенний период.
Влияние лекарственных средств на уровень VEGF крови крыс в каждой из групп определяли методом иммуноферментного анализа (ИФА) на 5-е и 10-е сутки после эксперимента. Активность лекарственных средств выражалась в индексе подавления VEGF (IVEGFSUP=отношение среднего значения VEGF в контроле к усредненному уровню VEGF в группе при воздействии исследуемого вещества*100 — коэффициент естественного снижения VEGF).
Оценка неоангиогенеза осуществлялась при микроскопическом и иммуногистохимическом исследовании (ИГХИ) биоптатов сегментов бедренной мышцы, которые были получены сразу после эвтаназии животных при выводе из эксперимента на 10-е сутки после операции. Окраска препаратов выполнена ге-матоксилином-эозином и антителами против СD34 (СD34 — маркер прогениторных клеток, в том числе клеток-предшественниц эндотелия, позволяющий выявить капилляры на более ранней стадии развития [2]). Определение площади (px2) СD34+ выполнено в программе NIS Elements Basic Research.
Техника моделирования хронической ишемии. Условия хронической ишемии выполнены у животных 2, 3, 4, 5 и 6-й групп, 1-я группа — контрольная (интактные животные). Перед операцией крысам выполнялась химическая депиляция шерсти в области нижней части брюшной стенки и правой нижней конечности.
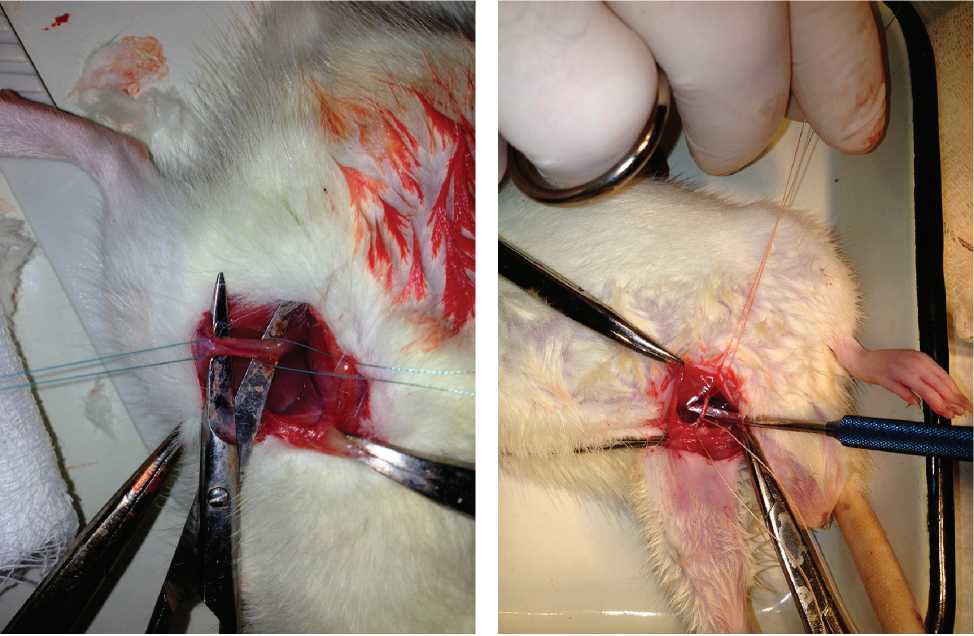
Рис. 1. Этапы моделирования хронической ишемии у экспериментальных животных: а — выделение магистральных сосудов правой нижней конечности; б — перевязка и пересечение сосудов между лигатурами
Протокол операции: после обработки операционного поля раствором 70% этанола под местной инфильтрационной анестезией (2ml 2% раствора лидокаина), в проекции правой паховой связки выполнен косой разрез кожи длиной до 10–14 мм. После разреза кожи и поверхностной фасции «тупо» выделялись бедренная артерия и вена, выполнялась перевязка и пересечение сосудов между лигатурами (рис. 1). Рана ушивалась отдельными узловыми швами синтетической рассасывающейся нитью.
Сравнительный анализ антиангиогенного потенциала бета-адреноблокаторов . Введение необходимой дозы лекарственных веществ осуществлялось в 1 мл стерильного 0,9% раствора натрия хлорида внутрибрюшинно. Количество вводимых веществ рассчитывалось исходя из суточной дозы для человека [11] (табл. 2).
Необходимая концентрация достигалась путем разведения 1 мл раствора с известным содержанием лекарственного вещества, физиологическим раствором. Растворы тимолола и интерферона альфа-2b с учетом времени полувыведения (TЅ) вводились дважды в сутки, бетаксалол — 1 раз, бевацизумаб — сразу после операции и на 5-е сутки.
Исследование уровня VEGF крови у крыс в каждой из групп проводили методом ИФА на 5-е и 10-е сутки у животных, выведенных из эксперимента. Кровь для исследования получали из хвостовой вены (0,5 мл). ИФА проводили по стандартной методике с набором реагентов Ratvascular endothelial cell growth factor, Сusabio Biotech Сo., LTD (Китай). Животные, которым выполнен забор крови на 5-е сутки, выводились из эксперимента в связи с тем, что травма во время забора крови могла стимулировать дополнительный выброс VEGF и исказить результаты анализа.
Оценка степени выраженности неоангиогенеза в зоне экспериментальной ишемии проводилась при ИГХИ биоптатов сегментов бедренной мышцы, которые были получены сразу после эвтаназии животных при выводе из эксперимента на 10-е сутки после операции. Окраска препаратов выполнена антителами против СD34 (маркер эндотелиоцитов кровеносных
Расчет доз лекарственных средств, использованных в эксперименте
Таблица 2
|
Препарат |
TЅ |
Доза для человека (70 кг), мг/сутки |
Доза для крысы (200 г), мг/сутки |
Кратность введения |
|
Тимолол |
4 часа |
1 |
0,02 |
2 раза в сутки |
|
Бетаксолол |
14–22 часа |
2 |
0,04 |
1 раз в сутки |
|
Бевацизумаб |
Начальное 1,4 дня; конечное 20 и 19 дней |
350 |
6,25 |
1 раз в 5 дней |
|
Интерферон альфа-2b |
2–6 часов |
5,7 млн MЕ |
100 тыс. MЕ |
2 раза в сутки |
сосудов, СD34 Antibody Rabbit Polyclonal Applications E, WB, IHС, ABBIOTEС, San Diego) и гематоксили-ном-эозином. Подготовка, проводка и окраска выполнены по общепринятым методикам.
При микроскопии препаратов обращали внимание на выраженность воспалительных реакций и некротических процессов, состояние капиллярной сети. При ИГХИ оценивали количество СD34+ клеток (окрашены в коричневый цвет, хромоген — диамино-бензидин). Определение площади (px2) СD34+, окрашенной диамино-бензидином выполнено в программе NIS Elements Basic Research. Гистологические исследования и ИГХИ выполнены на базе патоморфологической лаборатории ГУЗ «Тверской областной клинический онкологический диспансер» (заведующий лабораторией Н. А. Арестов).
Статистический анализ результатов ИГХИ и ИФА VEGF крови крыс выполнялся в программной среде IBM SPSS с применением бутстреп дисперсионного анализа и апостериорного критерия Дункана. Параметры бутстрепа: количество выборок — 1000, ДИ: 95%, тип доверительного интервала — процентиль; подмножество для α (p) =0,05.
Описание количественных переменных приведено в виде M±m.
Результаты. Уже на 1-е сутки после создания условий хронической ишемии у крыс всех экспериментальных групп отмечено развитие полного пареза нижней конечности на оперированной стороне, при этом на конечности определялся выраженный отек и цианоз. При макроскопической оценке состояния оперированных конечностей на 10-е сутки установлено хорошее заживление операционных ран во 2-й группе крыс (выполнена только экспериментальная ишемия) и в 5-й группе (экспериментальная ишемия и ежедневное введение бетаксолола), с явными процессами реваскуляризации конечности (за счет выраженного развития коллатералей).
Развитие значительных деструктивных процессов мягких тканей правой нижней конечности установлено у животных 3-й группы, которым выполнена экспериментальная ишемия и вводился бевацизумаб. Умеренно выраженные воспалительные и деструктивные изменения выявлены в 4-й и 6-й группах экспериментальных животных (экспериментальная ишемия в сочетании с ежедневным введением тимолола и интерферона соответственно).
При ИФА-исследовании показателей VEGF в плазме экспериментальных животных на 5-е сутки после формирования экспериментальной ишемии средние показатели составили: в 1-й группе (контрольная — интактные животные) 1,5±0,3 пг/мл; во 2-й группе (животные с хронической ишемией одной конечности) 20,3±3,2 пг/мл; в 3-й группе (хроническая ишемия и введение бевацизумаба) 5,8±0,9 пг/ мл; в 4-й группе (хроническая ишемия и введение тимолола) 13,9±1,4 пг/мл; в 5-й группе (хроническая ишемия и введение бетаксолола) 19,3±2,3 пг/мл; уровень VEGF у крыс 6-й группы (хроническая ишемия и введение интерферона альфа-2b) 11,1±2,2 пг/мл (рис. 2).
Таким образом, установлены достоверные отличия уровня VEGF на 5-е сутки в условиях экспериментальной ишемии между показателями в 1-й группе (контрольная), 3-й (группа сравнения-1 — положительный контроль), 4-й (группа наблюдения-1, которой вводился тимолол) и 6-й (группа сравнения-2, вводился интерферон) (p=0,05). Результаты ИФА во 2-й и 5-й группах также имели достоверные отличия от показателей в других экспериментальных группах, но между собой отличия были не достоверны (p=0,05).
Полученные результаты ИФА VEGF в различных экспериментальных группах животных свидетельствуют о низких (базальных) показателях VEGF в контрольной группе (интактные крысы: 1,5±0,3 пг/ мл). Отмечены компенсаторно высокие показатели VEGF в группе крыс, которым выполнены экспериментальные условия хронической ишемии (2-я группа — отрицательный контроль, 20,3±3,2 пг/мл). В 3-й группе животных (положительный контроль), которым вводился бевацизумаб, установлено значительное снижение VEGF (5,8±0,9 пг/мл), уровень которого должен увеличиваться в условиях экспериментальной ишемии.
Интересным представляется анализ результатов ИФА VEGF в группах животных, которым вводились бета-адреноблокаторы: 4-я группа (тимолол) и 5-я (бетаксолол). Несмотря на то что уровень VEGF у этих животных был выше (13,8±1,4 и 19,2±2,3 пг/ мл соответственно), чем в положительном контроле
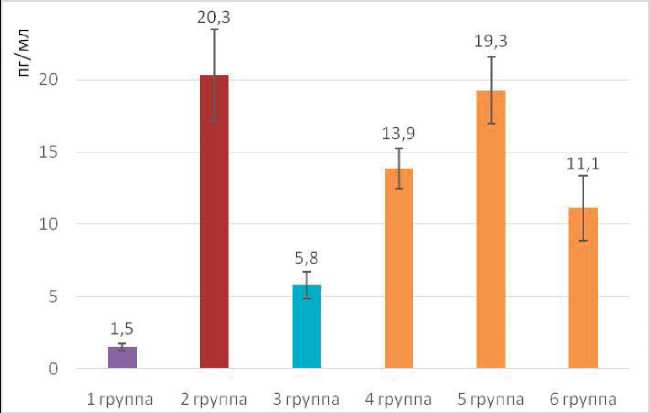
Рис. 2. Уровень VEGF сыворотки в группах животных на 5-е сутки в условиях экспериментальной ишемии при введении изучаемых средств, пг/мл
(3-я группа, 5,8±0,9 пг/мл) и при введении крысам интерферона альфа-2b (6-я группа, 11,1±2,2 пг/мл), обращает на себя внимание достоверное снижение показателя VEGF у крыс при введении раствора тимолола по сравнению с результатами отрицательного контроля (2-я группа, 20,3±3,2 пг/мл, p=0,05). Уровень VEGF при введении селективного бета-адреноблокатора бетаксолола (5-я группа, 19,3±2,3 пг/мл) в данной стадии эксперимента не имеет достоверных отличий при сравнении с показателями отрицательного контроля (2-я группа, 20,3±3,2 пг/мл, p=0,05).
На 10-е сутки в условиях экспериментальной ишемии исследован уровень VEGF сыворотки у оставшихся 36 крыс, при этом средние показатели VEGF плазмы крыс на 10-е сутки составили: в 1-й группе (контрольная — интактные животные) 1,6±0,2 пг/мл; во 2-й группе (животные с хронической ишемией одной конечности) 12,2±1,8 пг/мл; в 3-й группе (хроническая ишемия и введение бевацизумаба) 2,7±0,7 пг/мл; в 4-й группе (хроническая ишемия и введение тимолола) 7,2±1,2 пг/мл; в 5-й группе (хроническая ишемия и введение бетаксолола) 9,4±2,7 пг/мл; уровень VEGF у крыс 6-й группы (хроническая ишемия и введение интерферона альфа-2b) 6,2±1,3 пг/мл (рис. 3).
Анализ результатов ИФА на 10-е сутки указывает на снижение уровня VEGF во всех группах животных (рис. 4), за исключением контрольной 1-й группы крыс (с интактными), где установлено недостоверное увеличение показателя (1,5±0,2 пг/мл и 1,7±0,2 пг/ мл соответственно, p=0,05). Во 2-й группе животных, которым выполнена только экспериментальная ишемия, также отмечается снижение показателей VEGF (20,3±3,2 пг/мл и 12,2±1,8 пг/мл соответственно), что, вероятно, связано с восстановлением кровоснабжения за счет неоангиогенеза, реваскуляризации и развития коллатералей.
При статистическом анализе результатов исследования ИФА VEGF установлены однородные показатели в 1-й и 3-й группах крыс и 4-й и 6-й группах (p=0,05). Таким образом, анализ указывает на высокое угнетение VEGF при введении бевацизумаба (3-я группа), сходном антиангиогенном потенциале тимолола и интерферона (7,2±1,2 и 6,2±1,3 пг/мл соответственно, p=0,05) и меньшей активности селективного бета-адреноблокатора — бетаксолола (9,4±2,7 пг/мл, p=0,05).
Вместе с тем, учитывая высокую скорость реваскуляризации конечности у крыс в условиях экспериментальной ишемии, приводящей к восстановлению гемодинамики и снижению VEGF, что продемонстрировано при анализе результатов ИФА на 5-е и 10-е сутки в отрицательном контроле (2-я группа животных), выполнено определение индекса подавления VEGF (IVEGFSUP) для изучаемых лекарственных средств.
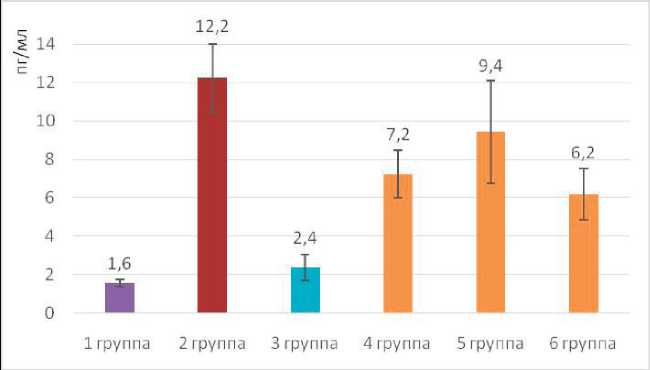
Рис. 3. Уровень VEGF сыворотки в группах животных на 10-е сутки в условиях экспериментальной ишемии при введении изучаемых средств, пг/мл
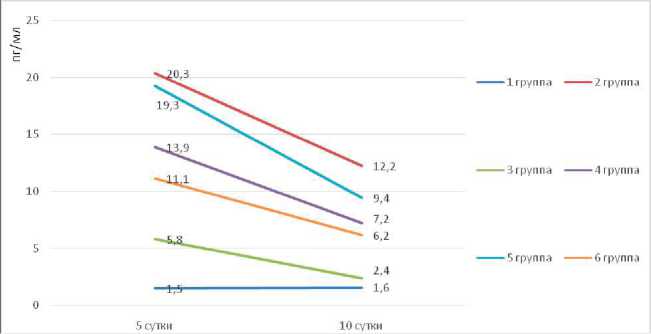
Рис. 4. Динамика уровня VEGF сыворотки крыс в экспериментальных группах на 5-е и 10-е сутки, пг/мл
Определение IVEGFSUP позволяет рассматривать антиангиогенный эффект исследуемых препаратов с учетом компенсаторного восстановления кровотока в экспериментальной зоне, приводящего к снижению уровня сосудистого эндотелиального фактора роста.
Показатели IVEGFSUP свидетельствуют об ожидаемо высокой активности негативного влияния бевацизу-маба на уровень VEGF (IVEGFSUP=28,3), умеренной при введении интерферона альфа-2b и раствора тимолола (8,3 и 5,1 соответственно). При этом установлено, что селективный бета-адреноблокатор бетаксолол оказывает наименьший эффект в отношении VEGF (I VEGFSUP =1,3).
Таким образом, бета-адреноблокаторы обладают антиангиогенным потенциалом, обусловленным отрицательным влиянием на VEGF, который оказался более выраженным у неселективного бета-адреноблокатора (тимолола) по сравнению с селективным — бетоксалолом.
При изучении морфологических препаратов мышечной ткани в биоптатах бедренных мышц у животных 1-й группы (интактные) выявлена мышечная ткань нормального строения, без признаков воспалительного процесса. При ИГХ-исследовании с антителами к СD34 у животных 1-й группы выявлена интактная капиллярная сеть, расположенная вокруг мышечных волокон, без признаков неоангиогенеза. В гистологических препаратах мышечной ткани 2-й группы крыс (выполнена экспериментальная хроническая ишемия), выявляются выраженные деструктивные и воспалительные изменения, определяются массивные полиморфные инфильтраты с выраженным неоангиогенезом.
При ИГХ-исследовании с антителами к СD34 био-птатов бедренных мышц у крыс 2-й группы выявляется выраженный неоангиогенез с формированием новых капилляров. Данные процессы свидетельствуют о выраженной ишемии и компенсаторном развитии новых путей для питания поврежденной конечности.
Mорфологическая картина биоптата бедренной мышцы крыс 3-й группы характеризовалась выраженными воспалительными инфильтратами, которые распространялись не только на мышечную ткань, но и на подкожную жировую клетчатку.
Mорфологическая картина мышечных биоптатов 4, 5 и 6-й групп экспериментальных животных характеризовалась умеренными воспалительными изменениями, признаками восстановления тканей и явлениями неоангиогенеза. Незначительные отклонения имелись в степени выраженности пролиферации эн-дотелиоцитов. Так, в 4-й группе экспериментальных животных отмечены умеренные явления неоангиогенеза, в 5-й — более интенсивные, с формированием полноценных микрососудов и в 6-й группе установлены начальные признаки пролиферации.
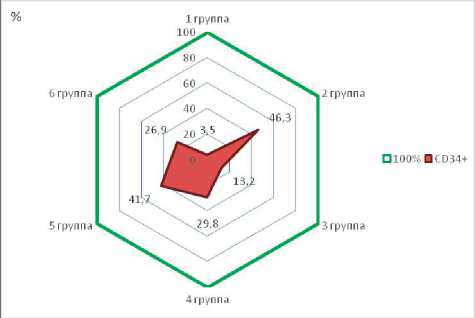
Рис. 5. Площадь СD34+ в препаратах экспериментальных групп, %
Проведено определение площади (px2) и процента СD34+, окрашенной диамино-бензидином, во всех экспериментальных группах животных (табл. 3).
Анализ результатов сравнения площади свидетельствует о достоверных отличиях между средними значениями экспериментальных групп (p=0,05). Наибольшие показатели СD34+ площади установлены в препаратах 2-й группы (животные с хронической ишемией одной конечности, 142102,0±32486,0 px2), наименьшая площадь выявлена в 1-й (контрольной) группе животных: 10880,0±5222,6 px2. Среди изучаемых групп меньшая площадь СD34+ установлена в препаратах животных 3-й группы (хроническая ишемия и введение бевацизумаба — положительный контроль, 40473,9±18034,3 px2). При сравнении результатов в 4-й и 5-й группах наименьшая площадь СD34+ определяется в образцах животных, которым выполнена хроническая ишемия и вводился тимолол, по сравнению с бетаксололом (91555,3±13083,4 px2 и 127967,23±28878,8 px2 соответственно). При введении интерферона альфа-2b (6-я группа, 82838,0±19460,1 px2) площадь препарата СD34+ оказалась меньше соответствующих показателей во 2-й (142102,0±32486,1 px2), 4-й (91555,3±13083,4 px2) и 5-й группах (127967,2±28878,8 px2), но превышала таковые в 3-й группе (положительный контроль, 40473,9±18034,3 px2) (рис. 5).
Результаты микроскопии и ИГХИ свидетельствуют об отсутствии активации процессов неоангиогенеза в 1-й (контрольной) группе животных. У животных в условиях экспериментальной хронической ишемии (2-я группа) и в группе оперированных крыс, которым вводился селективный бета-адреноблокатор (бе-таксолол, 5-я группа), наряду с выраженными воспалительными процессами (массивный полиморфно-клеточный инфильтрат) установлены явления неоангиогенеза.
Результаты определения площади (px2) и процента CD34+ в препаратах
Таблица 3
|
Показатели |
1-я группа, n=60 |
2-я группа, n=60 |
3-я группа, n=60 |
4-я группа, n=60 |
5-я группа, n=60 |
6-я группа, n=60 |
||||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Среднее |
10880,0 |
3,5 |
142102,0 |
46,3 |
40473,9 |
13,2 |
91555,3 |
29,8 |
127967,2 |
41,6 |
82838,0 |
27 |
|
Стандартное отклонение |
5222,6 |
1,7 |
32486,1 |
10,6 |
18034,3 |
5,9 |
13083,4 |
4,3 |
28878,8 |
9,4 |
19460,1 |
6,3 |
|
Ошибка средней (m) |
674,2 |
0,2 |
4193,9 |
1,4 |
2328,2 |
0,8 |
1689,0 |
0,5 |
378,2 |
1,2 |
2512,3 |
0,8 |
Характер неоангиогенеза в биоптатах животных 4-й и 6-й групп рассматривается как умеренно выраженный. Практически полное отсутствие эндоте-лиоцитов установлено у крыс 3-й группы (животные в условиях хронической ишемии, которым вводился бевацизумаб).
Полученные результаты свидетельствуют, что бета-адреноблокаторы обладают антиангиогенным потенциалом, обусловленным отрицательным влиянием на VEGF, который оказался более выраженным у неселективного бета-адреноблокатора (тимолола) по сравнению с селективным — бетоксалолом. При этом результаты гистологических и ИГХ-исследований коррелируют с показателями ИФА VEGF в группах экспериментальных животных и состоянием ран: высоком угнетении VEGF при введении бевацизума-ба (3-я группа), сходном антиангиогенном потенциале тимолола и интерферона (7,2±1,2 и 6,2±1,3 пг/ мл соответственно, p=0,05) и меньшей активности селективного бета-адреноблокатора — бетаксолола (9,4±2,7 пг/мл, p=0,05).
Обсуждение. Индекс подавления VEGF указывает на высокую активность угнетения бевацизумабом VEGF (IVEGFSUP=28,3), умеренную при введении интерферона альфа-2b и раствора тимолола (8,3 и 5,1 соответственно), селективный бета-адреноблокатор бетаксолол оказывает наименьший эффект в отношении VEGF (I VEGFSUP =1,3).
Изучая клиническую эффективность и безопасность тимолола, установили высокий профиль безопасности, в том числе при наружном применении и лечении детей с поверхностными очаговыми ювенильными гемангиомами [12]. Экспериментальные исследования in vitro обнаруживают полное отсутствие негативного влияния тимолола на жизнеспособность (LDH-тест и WST-1, модифицированный MTT-тест) эндотелиальных клеток, фибробластов и кератиноцитов, миграцию и подвижность эндотелиальных клеток in vitro [13], что в совокупности с результатами настоящего исследования позволяет рассматривать тимолол как препарат выбора первой линии для консервативной патогенетически обоснованной терапии ювенильных гемангиом.
Заключение. Таким образом, результаты проведенного исследования указывают на антиангио-генный потенциал бета-адреноблокаторов, оказывающих прямое или опосредованное негативное влияние на синтез VEGF и угнетение неоангиогенеза. При этом активность селективного бета-адреноблокатора (бетаксолола) в отношении подавления неоангиогенеза оказалась достоверно ниже по сравнению активностью неселективного (тимолола). Антиангиогенный эффект тимолола в эксперименте практически сопоставим с активностью интерферона и достоверно отличается от показателей негативного контроля, что позволяет рассматривать данное средство как эффективное и безопасное для профилактики и лечения ангиопролиферативных состояний, в том числе ювенильных гемангиом.
Список литературы Антиангиогенные свойства бета-адреноблокаторов
- Frieden IJ, etal. Infantile hemangiomas: current knowledge, future directions, proceedings of a research workshop on infantile hemangiomas. Pediatr Dermatol 2005; 22: 383-406
- Дубенский В.В., Дубенский Вл.В. Этиопатогенез и морфология ювенильных гемангиом. Российский журнал кожных и венерических болезней 2014; (4): 8-12
- Bielenberg DR, et al. Progressive growth of infantile cutaneous hemangiomas is directly correlated with hyperplasia and angiogenesis of adjacent epidermis and inversely correlated with expression of the endogenous angiogenesis inhibitor, INF-beta. Int J Oncol 1999; 14: 401-8
- Boye E, etal. Clonality and altered behaviour of endothelial cells from hemangiomas. J Clinlnvest 2001; 107: 745-52
- Дубенский В. В. Новое в патогенезе ювенильныхгемангиом. Современные проблемы дерматовенерологии, иммунологии, косметологии 2013; (3): 26-31
- ManciniAJ, etal. Proliferation and apoptosis within juvenile capillary hemangiomas. Am J Dermatopathol 1996; 18:505-14
- Leaute-Labreze C, Dumas de la Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy. NEngl J Med 2008; 358: 2649-51
- Drolet BA, Frommelt PC, Chamlin SL, et al. Initiation and use of propranolol for infantile hemangioma: report of a consensus conference. Pediatrics 2013; 131: 128-40
- D'Angelo G, et al. cAMP-dependant protein kinase inhibits the mitogenic action of vascular endothelial growth factor and fibroblast growth factor in capillary endothelial cells by blocking Raf activation. J Cell Biochem 1997; 67: 353-66
- Laccarino G, et al. Ischemic neoangiogenesis enhanced by beta2-adrenergic receptors over expression: a role for the endothelial adrenergic system. Circ Res 2005; 97: 1182-9
- Миронов A. H., Бунатян Н.Д. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К, 2012; 944 с.
- Дубенский В. В., Аун Р. Ю. Эффективность и безопасность применения топического р-адреноблокатора для лечения ювенильных гемангиом. Фарматека: Дерматология/Аллергология 2018; 32-9
- Дубенский В. В. Влияние неселективного бета-адреноблокатора на хемотаксис и активную миграцию клеток in vitro, в аспекте лечения ювенильных гемангиом. Иммунопатология, аллергология, инфектология 2016; (4): 50-9.


