Антиаритмические эффекты агониста ми- и дельта-опиатных рецепторов даларгина и блокатора опиатных рецепторов налоксона при экспериментальной жировой эмболии головного мозга. Актуальные вопросы экспериментальной кардиологии
Автор: Филиппов Эдуард Алексеевич, Тепляков Александр Трофимович, Гракова Елена Викторовна, Андриянова Анна Владимировна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.30, 2015 года.
Бесплатный доступ
Опиоидные пептиды (ОП) относятся к новому, активно изучаемому классу фармакологических средств, обладающих стресс-лимитирующим и, возможно, кардиопротективными эффектами, действуя на μ- и δ-опиоидные рецепторы. В связи с этим изучение перспектив клинического применения ОП представляется исключительно важным. Цель: изучить влияние агониста опиатных рецепторов (ОР) даларгина и блокатора ОР налоксона на характер нарушений ритма сердца (НРС), изменений фазы реполяризации желудочков сердца при экспериментальной жировой эмболии сосудов головного мозга (ЖЭМ) и, в частности, при повреждении гипоталамуса у кроликов. Обследовано 48 кроликов породы “шиншила” в условиях экспериментального моделирования аритмий сердца посредством ЖЭМ с оценкой антиаритмических и кардиопротективных эффектов агониста ОР даларгина и блокатора ОР налоксона. Установлено, что экспериментальная ЖЭМ вызывала различные по морфологии и тяжести НРС, инфарктоподобную и WPW-подобную электрокардиограмму (ЭКГ). Оба класса препаратов повышали выживаемость животных с ЖЭМ. Налоксон превосходил даларгин по способности снижать частоту желудочковой фибрилляции сердца и WPW-активности при ЖЭМ. Результаты проведенного исследования убедительно продемонстрировали, что экспериментальная ЖЭМ ассоциируется с повреждением гипоталамуса и высоким риском развития фатальных аритмий сердца. Профилактическое назначение агониста ОР даларгина или блокатора ОР налоксона обеспечивало стресс-лимитирующий, антиаритмический и, вероятно, кардиопротективные эффекты, явно улучшая выживаемость животных.
Опиоидные пептиды, даларгин, налоксон, жировая эмболия головного мозга, повреждение гипоталамуса, инфарктоподобная и wpw-подобная экг, антиаритмические и кардиопротективные эффекты
Короткий адрес: https://sciup.org/14920018
IDR: 14920018 | УДК: 616.831-005.7-06:615.24.035.036:577.354]-092.9
Текст научной статьи Антиаритмические эффекты агониста ми- и дельта-опиатных рецепторов даларгина и блокатора опиатных рецепторов налоксона при экспериментальной жировой эмболии головного мозга. Актуальные вопросы экспериментальной кардиологии
Концепция возможности использования экзогенного введения ОП в коррекции регуляторного дисбаланса, происходящего в организме при экстремальных стрес-сорных воздействиях, частным проявлением которых являются аритмии, стала платформой для создания ан-тистрессорных лекарственных средств нового поколения – синтетических аналогов ОП [7, 13, 28]. К препаратам с указанным механизмом действия могут быть отнесены агонист ОР даларгин и блокатор ОР налоксон [7, 12, 27]. В обзорных работах, посвященных оценке антиаритми-ческого действия опиатов с использованием селективных лигандов ОР на различных экспериментальных моделях стрессорных и ишемических повреждений сердца, показаны весьма противоречивые данные, свидетельствующие о наличии у таковых как аритмогенных, так и антиарит-мических эффектов [8, 9].
Цель: оценить как антиаритмические, так и проарит-могенные эффекты агониста µ - и δ -опиатных рецепторов даларгина и блокатора ОР налоксона, возможные механизмы их действия при экспериментальной ЖЭМ.
Материал и методы
Эксперименты по моделированию аритмий были проведены на 48 кроликах породы “шиншила” массой 3–3,5 кг. Всех животных перед опытом выдерживали в течение 1–2 недель в стандартных условиях вивария.
После предварительной подготовки (фиксация животных в положении на спине) под местной анестезией у кроликов выделяли сонную артерию и внедряли в нее 4-ходовую канюлю, предварительно промытую гепарином. Животные на все вышеуказанные манипуляции реагировали спокойно. Использование ангиостомических канюль позволяло осуществлять забор артериальной крови в исходном состоянии и в любой момент эксперимента для исследования уровня катехоламинов, Са2+ и Мg2+, а также вводить в сонную артерию оливковое масло или исследуемый фармакологический препарат, предусмотренные протоколом исследования. Общий объем взятой для анализа крови за период эксперимента не превышал 15 мл. Также в исходном состоянии и каждую минуту на протяжении эксперимента регистрировали ЭКГ. Регистрация ЭКГ и параметров нейрогуморальной регуляции сердца позволяла контролировать динамику изменений процесса реполяризации желудочков сердца, возникавших НРС и состояние нейрогормонального обмена.
Протокол исследования. Воспроизведение ЖЭМ у кроликов (n=24) осуществлялось введением 1 мл оливкового масла в сонную артерию через канюлю, что приводило к гибели 50% животных от развития фатальных осложнений (остановка дыхания или фибрилляция желудочков сердца). Выжившим после ЖЭМ кроликам (n=12) после обследования в течение 10 мин, включавшего регистрацию ЭКГ в трех стандартных отведениях на одноканальном электрокардиографе “Малыш” с оценкой НРС, фазы реполяризации желудочков сердца, уровня катехоламинов крови, Са2+ и Мg2+ осуществлялась повторная ЖЭМ, приводившая к гибели остальных животных.
Аналогичный эксперимент был проведен на 19 кроликах, которым непосредственно перед ЖЭМ болюсом в сонную артерию вводили ОП – аналог лей-энкефалина D-Ala2, Leu5, Arg6 – даларгин в дозе 100 мкг/кг. Время введения препарата перед ЖЭМ и доза были выбраны в соответствии с данными литературы, из которой следует, что время жизни синтетических аналогов энкефалинов и активности в сыворотке крови in vitro не превышает 30 мин [6, 7]. ЖЭМ на фоне введенного даларгина приводила к гибели только 4 животных (20%). Выжившим после ЖЭМ животным (n=15) осуществлялся вышеописанный дизайн исследований с последующей повторной ЖЭМ, также приводившей к гибели всех животных.
Блокатор µ - и δ -ОР налоксон (фирма “Serva”, ФРГ) вводили внутриартериально (в/а) кроликам (n=5) в дозе 200 мкг/кг перед ЖЭМ. Выбранная доза налоксона считается достаточной для блокады как высокоаффинных, так и низкоаффинных ОР [27]. ЖЭМ на фоне введенного налоксона приводила к гибели только 1 животного (20%). Выжившим после ЖЭМ животным (n=4) осуществлялся вышеописанный дизайн исследований с последующей повторной ЖЭМ, приводившей к гибели животных.
Контрольную группу составили 5 кроликов, которым также внедрялась канюля в сонную артерию, но вместо оливкового масла, даларгина и налоксона вводили 1,0 мл физиологического раствора (NaCl 0,9%) с вышеописанным дизайном исследований.
Сразу после выхода животных из эксперимента забирались образцы тканей (структур сердца и мозга) для гистологических, гистохимических и гистоэнзиматичес-ких исследований с целью оценки морфофункционального состояния адрен- и холинергических структур, согласно общепринятой методике [14].
Статистическая обработка полученных данных проводилась при помощи программного пакета “Statgraf” с использованием стандартных методов статистики, включая корреляционный анализ, а также вычислением непарного t-критерия Стьюдента для оценки достоверности различий между группами [2]. Статистически значимыми считали различия при р<0,05.
Результаты
ЖЭМ у кроликов сопровождалась возникновением периодических тоникоклонических судорог, нарушений дыхания, различных НРС, инфарктоподобной ЭКГ (ИП-ЭКГ) у 50% выживших животных (табл. 1, рис. 1). Нередко (12,5%) сразу же после ЖЭМ возникала асистолия с последующим идиовентрикулярным ритмом. В 25% случаев эксперимент заканчивался фибрилляцией желудочков (ФЖ).
Во всех случаях ЖЭМ сопровождалась увеличением электрической систолы (интервал QT) на 17,2% – с 0,128±0,002 до 0,150,009 с. Более чем у половины выживших животных (n=7) через 2–3 мин после ЖЭМ происходила нормализация ЭКГ.
При гистологическом исследовании препаратов миокарда и головного мозга после ЖЭМ (n=5) отмечалось отсутствие эмболизированного жира в коронарных артериях сердца, синоатриальном (САУ) и атриовентрикулярном (АВУ) узлах при наличии такового в сосудах гипоталамуса c преимущественным распределением его в заднем отделе (рис. 2).
При гистохимическом исследовании в вегетативных нервных структурах головного мозга выявляли значительные изменения нейромедиаторного обмена, сопровож-
Таблица 1
Частота возникновения НРС у кроликов при ЖЭМ и на фоне введения даларгина и налоксона, %
Аритмии, связанные с изменением нормального автоматизма САУ
|
Серии |
НЖК |
ЖК |
НЖР |
ЖР |
АВ дис. |
А |
|
Исходно, n=48 |
8,6 |
|||||
|
ЖЭМ, n=24 |
25 |
29,2 |
33,3 |
–37,5 |
66,6 |
12,5 |
|
Д + ЖЭМ, n=19 |
42 |
57,9 |
63,1 |
21 |
||
|
Н + ЖЭМ, n=5 |
20 |
40 |
60 |
|||
|
Аритмии, связанные с триггерной активностью специализированных |
||||||
|
и сократительных клеток |
||||||
|
Серии |
СБ |
ПЖТ |
НЖЭ |
ЖЭ |
СК |
ЖП |
|
Исходно, n=48 |
5,7 |
|||||
|
ЖЭМ, n=24 |
45,8 |
25 |
29,2 |
25 |
16,6 |
12,5 |
|
Д + ЖЭМ, n=19 |
42,1 |
10,5 |
15,8 |
36,8 |
26,3 |
10,5 |
|
Н + ЖЭМ, n=5 |
40 |
40 |
60 |
40 |
||
|
Аритмии, обусловленные нарушением проведения импульса |
||||||
|
Серии |
СПВЖЖ |
ПНЖТТТТ |
ФЖ |
АВ блок |
ИП ЭКГ |
|
|
Исходно, n=48 |
5,1 |
8,57 |
||||
|
ЖЭМ, n=24 |
20,8 |
12,5 |
25 |
12,5 |
41,6 |
|
|
Д + ЖЭМ, n=19 |
63,1 |
10,5 |
10,5 |
10,5 |
42 |
|
|
Н + ЖЭМ, n=5 |
20 |
40 |
||||
Примечание: А – асистолия, АВ – атриовентрикулярный, Д – даларгин, ЖЭМ – жировая эмболия сосудов головного мозга, ЖК – желудочковые комплексы, ЖП – желудочковые пробежки, ЖР – желудочковые ритмы, ЖЭ – желудочковые экстрасистолы. ИП ЭКГ – инфарктоподобная ЭКГ, НЖР – наджелудочковые ритмы, Н – налоксон, НЖК – наджелудочковые комплексы, НЖЭ – наджелудочковые экстрасистолы, ПЖТ – полиморфная желудочковая тахикардия, ПНЖТ – пароксизмальная наджелудочковая тахикардия, САУ – синоатриальный узел, СБ – синусовая брадикардия, СК – сливные комплексы, СПВЖ –синдром преждевременного возбуждения желудочков, ФЖ – фибрилляция желудочков.
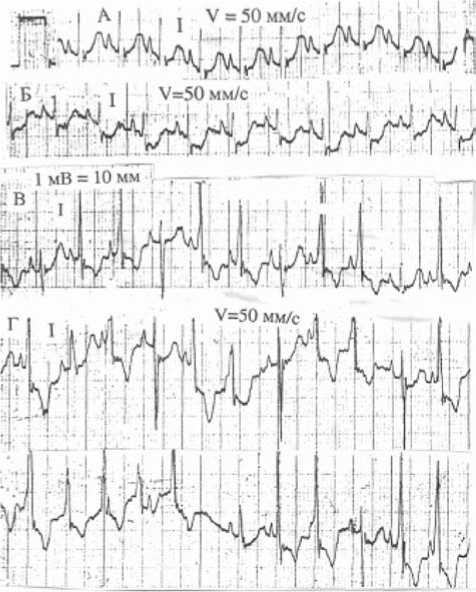
Рис. 1. Динамика изменений ЭКГ кролика после ЖЭМ:
А – исходная ЭКГ в 1 стандартном отведении: синусовый ритм, ЧСС 300 уд./мин, РQ – 0,06 с, QRS – 0,04 с, QT – 0,15 с, скорость регистрации 50 мм/с, 1 мВ =10 мм. Б – тот же случай. ЭКГ после ЖЭМ, 1-я мин исследования. Ритм синусовый, ЧСС 270 уд./мин, РQ – 0,06 с, QТ – 0,17 с. Депрессия SТ – 4 мм. Инфарктоподобная ЭКГ. В – 3-я мин исследования. На ЭКГ ритм синусовый, ЧСС 285 уд./мин, перемежающие захваты желудочков. В нормальных ЭКГ-комплексах сегмент ST на изолинии. Г – 6-я мин исследования. На ЭКГ ритм синусовый, 270 уд./мин, с захватами желудочков, частые, групповые желудочковые экстрасистолы, периодически желудочковый ритм с ЧСС 300 уд./мин
Таблица 2
Влияние агониста опиатных рецепторов даларгина и блокатора ОР налоксона на изменение электролитов крови интактных кроликов и при ЖЭМ (М±m)
|
Nа+ К+ |
Са2+ |
Mg2+ |
|
mmol/1 mmol/1 |
mmo1/1 |
mmo1/1 |
|
Исходно, n=29 145,3±1,9 4,48±0,2 |
1,77±0,146 |
1,167±0,05 |
|
ЖЭМ 3–5 мин, n=5 141,8±0,17 5,3±0,32 |
3,27±0,1* |
1,31±0,1 |
|
В/а введение даларгина 3–5 мин, n=5 177,5±3,7* 6,17±0,3* |
2,17±0,29* |
0,75±0,07* |
|
Даларгин + ЖЭМ 3–5 мин, n=5 141,5±1,8 5,05±0,287* |
2,35±0,05* |
1,132±0,05 |
|
В/а введение Н 3–5 мин, n=5 143,5±2,6 4,5±0,1 |
1,55±0,36 |
0,87±0,039* |
|
Налоксон + ЖЭМ, n=5 139,1±0,68 3,56±0,4* |
1,46±0,2 |
1,19±0,1 |
Примечание: * – статистически значимые различия по сравнению с контролем (р<0,05); ЖЭМ – жировая эмболия сосудов головного мозга.
давшиеся повышением интенсивности флюоресцирующих катехоламинов в САУ, снижением их содержания в АВ-со-единении и ушке левого предсердия (УЛП), рисунок 3. При этом активность МАО в переднем (ПГ) и заднем отделах гипоталамуса (ЗГ) повышалась как и интенсивность АХЭ в холинергических волокнах (ХЕ-в) САУ и АВУ при снижении уровня таковой в УЛП.
ЖЭМ у кроликов приводила к выраженному (р<0,05) изменению электролитного состава крови: повышению содержания К+, Mg2+, Ca2+ в крови на 3–5 мин после ЖЭМ (табл. 2).
Профилактическое введение агониста опиатных µ- и δ-рецепторов даларгина в сонную артерию кроликов в дозе 100 мкг/кг приводило живот- ных в кратковременное (1–2 мин) возбуждение, сопровождавшееся непродолжительным повышением уровня адреналина (А) в крови в 2 раза (с 0,23 до 0,476 мкг/л), незначительным повышением ЧСС при отсутствии изменений на ЭКГ. Через 2–3 мин животные засыпали, при этом уровень А в крови снижался до исходного.
Аналогичная динамика наблюдалась и в отношении содержания в крови норадреналина (НА).
Введение синтетического аналога лей-энкефалина даларгина не приводило к изменению активности МАО в гипоталамусе, но значимо (р<0,05) повышало уровень К+, незначительно – Са2+ и снижало содержание Mg2+ в крови к 3–5-й мин после введения препарата (табл. 2).
Введение 1 мл оливкового масла в сонную артерию на фоне предварительной премедикации даларгином не изменяло общей реакции поведения животных, наблюдаемой при ЖЭМ, однако выживаемость их увеличилась более чем в 2 раза, и уровни А и НА в крови повышались незначительно.
Профилактическое введение агониста опиатных µ - и δ -рецепторов даларгина в сонную артерию кроликов в дозе 100 мкг/кг приводило животных в кратковременное (1–2 мин) возбуждение, сопровождавшееся непродолжительным повышением уровня А в крови в 2 раза (с 0,23 до 0,476 мкг/л), незначительным повышением ЧСС при отсутствии изменений на ЭКГ. Через 2–3 мин животные
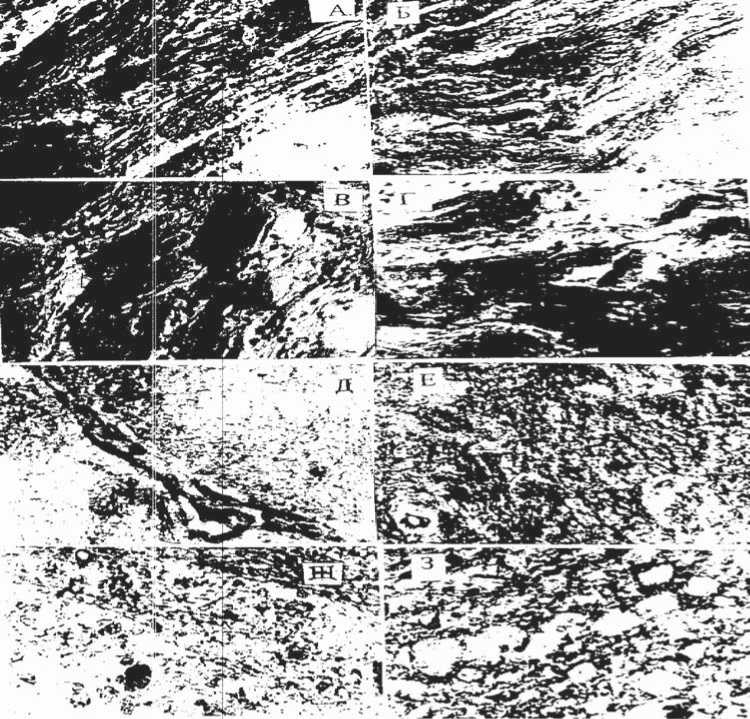
Рис. 2. Окраска судан-красным гематоксилином на наличие жира в синоатриальном (САУ) и атриовентрикулярном (АВУ) узлах, переднем (ПГ) и заднем (ЗГ) отделах гипоталамуса у кролика при ЖЭМ. Ув. 336; об. 20. А – САУ-контроль; Б – САУ+ЖЭМ; В – АВУ-контроль; Г – АВУ+ЖЭМ; Д – ПГ-контроль; Е – ПГ+ЖЭМ; Ж – контроль; З – ЗГ+ЖЭМ
засыпали, при этом уровень А в крови снижался до исходного.
Аналогичная динамика наблюдалась и в отношении содержания в крови НА.
Проведенный нами анализ плотности адренергических (АЕ-в) и холинергических волокон (ХЕ-в) в центрах автоматизма сердца (САУ и АВУ) показал, что даларгин не предотвращал снижение интенсивности флюоресценции АЕ-в в САУ на ЖЭМ, но сохранял фактически на исходном уровне активность АХЭ в ХЕ-в (рис. 3). В то же время в АВ-соединении (АВС) и ушке левого предсердия (УЛП) нейромедиаторный обмен претерпевал несколько иные изменения, в частности, выявлено повышение активности катехоламинов в АЕ-в АВС и снижение – в УЛП.
Даларгин также не предотвращал развитие электрической негомогенности миокарда, маркером которого является удлинение интервала QT, однако влиял на частоту (снижение в 2 раза) возникновения отдельных видов НРС после ЖЭМ (полиморфной желудочковой тахикардии, ФЖ, наджелудочковой экстрасистолии), таблица 1. Следует отметить, что на фоне даларгина в 3 раза чаще, чем в предыдущей серии с ЖЭМ, регистрировались WPW-подобные (20,8 и 63,1% соответственно), чаще сливные
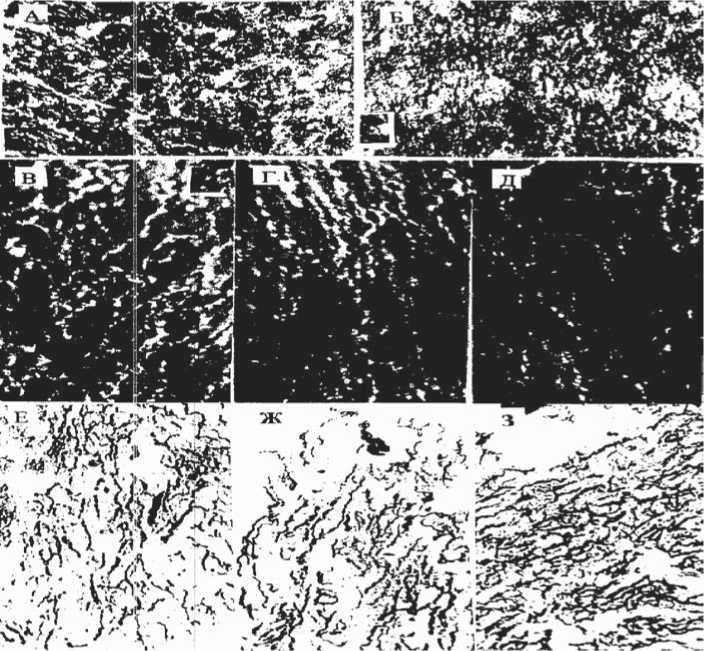
Рис. 3. Сравнительная оценка активности моноаминооксидазы в заднем гипоталамусе (А, Б), плотности флюоресцирующих адренергических волокон (В, Г, Д) и активность АХЭ (Е, Ж, З) в холинергических волокнах САУ при ЖЭМ кролика и на фоне предварительно введенного агониста ОР даларгина. Окраска на моноаминооксидазу (МАО): А – задний отдел гипоталамуса, уровень маммилярных тел. Окраска на моноаминооксидазу (МАО). Контроль. Б – сохранение активности МАО в заднем отделе гипоталамуса при ЖЭМ кролика на фоне предварительно введенного агониста ОР даларгина. Ув.-168. Об.10. В – флюоресцирующие адренергические волокна синоатриального узла (САУ). Контроль. Г – снижение плотности флюоресцирующих адренергических волокон в САУ при ЖЭМ кролика. Д – сниженная плотность флюоресцирующих адренергических волокон в САУ при ЖЭМ кролика на фоне предварительно введенного агониста ОР даларгина. Ув. 442. Об.40. Е – активность ацетилхолинэстеразы (АХЭ) в холинергических волокнах САУ. Контроль. Ж – снижение активности АХЭ в САУ при ЖЭМ кролика. З – сохранение активности АХЭ в САУ на исходном уровне на фоне предварительного, внутриартериально введенного даларгина при ЖЭМ. Реакция на ацетилхолинэстеразу. Ув. 168, об.10.
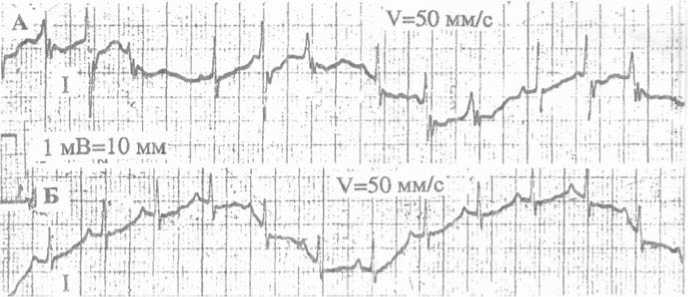
Рис. 4. Динамика изменений ЭКГ кролика после в/а введения даларгина (А). Исходная ЭКГ: на ЭКГ желудочковые экстрасистолы и сливные комплексы (AV-диссоциация); (Б) – ЭКГ после в/а введения даларгина. 1–3-я мин исследования: на ЭКГ – синусовый ритм
комплексы, желудочковые экстрасистолы и ритмы. Тем не менее введение даларгина 2 кроликам, в исходном состоянии которых на ЭКГ регистрировалась экстрасистолическая аритмия (в одном случае в виде WPW-подобных комплексов на фоне инфарктоподобной ЭКГ), привело к кратковременной нормализации ЭКГ (рис. 4).
По истечению 3–5 мин после ЖЭМ на фоне введенного агониста ОР происходила нормализация показателей электролитов – К+, Na+, Ca2+, Mg2+, а также уровня моноаминов в крови у 3 животных (табл. 2).
Профилактическое введение блокатора ОР налоксона кроликам в дозе 200 мкг/кг приводило к значительному (р<0,05) снижению НА в крови и отсутствию негативных поведенческих реакций во время эксперимента (рис. 5).
Показатели К+, Na+, Ca2+ в крови не претерпевали существенных изменений на введение налоксона, однако уровень Mg2+ достоверно снижался (табл. 2).
ЖЭМ на фоне введенного налоксона у всех животных протекала с ярко выраженной поведенческой реакцией (возбуждение, нарушение дыхания, судороги), однако выживаемость кроликов была более чем в 2 раза выше, чем при ЖЭМ. Содержание А и НА в крови имело тенденцию к снижению в сравнении с серией экспериментов с ЖЭМ без премедикации налоксоном. Показатели НА в ткани переднего и заднего отделов гипоталамуса находились на уровне значений контроля, а показатели А оказались высокими только в заднем его отделе. Чрезмерное высвобождение А и НА, отмеченное в САУ на фоне ЖЭМ, нивелировалось предварительным введением налоксона.
Анализ плотности АЕ-в и ХЕ-в в центрах автоматизма сердца (САУ и АВУ) показал, что на- локсон фактически не влиял на сниженную интенсивность флюоресценции АЕ-в в них и в ушке левого предсердия на ЖЭМ, но в то же время он восстанавливал пониженную активность АХЭ в ХЕ-в (рис. 6).
Ни в одном экспериментальном наблюдении на фоне премедикации налоксоном не возникали сложные и фатальные НРС (ФЖ), в отличие от группы животных, подвергшихся ЖЭМ без предварительного введения антагониста ОР налоксона, а также на фоне введенного даларгина (табл. 1), однако на фоне проводимой профилактической терапии НРС антагонистом ОР желудочковые НРС и АВ-проводимости возникали чаще: в 25% случаев при ЖЭМ, в 36,8% – с предварительным введением даларгина, в 60% – с предварительным введением налоксона; желудочковые пробежки – 12,5; 10,5 и 40 соответственно; полиморфная желудочковая тахикардия – 25; 10,5 и 40% соответственно; нарушения АВ-проводимости – 12,5; 10,5 и 20% соответственно.
Желудочковым НРС, как и в предыдущих наблюдениях, сопутствовало удлинение интервала QT (на 20%).
Обсуждение
Проведенный нами сравнительный анализ антиаритмической и аритмогенной активности агониста периферических µ - и δ -опиатных рецепторов D-Ala2, Leu5, Arg6-эн-кефалина даларгина и блокатора ОР налоксона при жировой эмболии центральных регулирующих структур головного мозга (в частности, гипоталамуса) у кроликов показал сложность в оценке данных эффектов, как и механизмов их возникновения. Патогенетическая роль гипоталамуса в поддержании гомеостаза, возникновения сердечных аритмий в условиях стрессорного воздействия известна [4, 21, 22]. Необходимо оценить эффективность антистрессорных препаратов нового поколения (синтетических аналогов опиоидных нейропептидов) на экспериментальной модели стрессорного воздействия (фиксация животного, оперативное вмешательство на сонной артерии) и жировой эмболии центральных регулирующих структур мозга (гипоталамуса), нередко встречающихся в клинической практике (тромбоэмболии, инсульты и другие повреждения головного мозга).
Как известно, µ - и δ -опиатные рецепторы, участвующие в регуляции сердечно-сосудистой системы, локализованы в кардиоваскулярных центрах гипоталамуса [9, 15] и широко представлены на периферии: в миокарде желудочков и предсердий, эндотелиоци-тах коронарных артерий [9, 25]. Некоторые
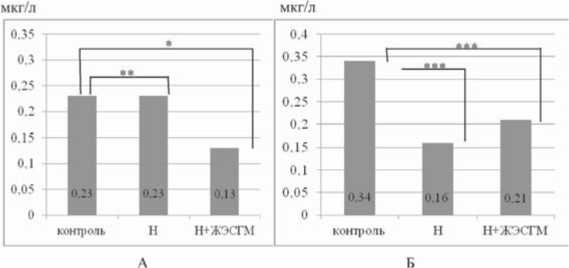
Рис. 5. Сравнительная характеристика влияния блокатора ОР налоксона (Н) на характер изменений количественных показателей А (А) и НА (Б) в крови, интенсивность флюоресцирующих катехоламинов (усл. ед.) при ЖЭМ у кроликов. Статистическая значимость различий: * – р<0,05; ** – р>0,05; *** – р<0,01

Рис. 6. Сравнительная оценка активности моноаминооксидазы в заднем гипоталамусе (А, Б, В), плотности флюоресцирующих адренергических волокон в САУ (Г, Д) и АВУ при ЖЭМ на фоне предварительно введенного антагониста опиатных рецепторов налоксона. Окраска на моноаминооксидазу (МАО): А – задний отдел гипоталамуса (ЗГ), уровень маммилярных тел. Окраска на моноаминооксидазу (МАО). Контроль. Б – cниженная активность МАО при ЖЭМ кролика в ЗГ. В – сохраненная активность МАО при ЖЭМ кролика в ЗГ на фоне предварительно введенного антагониста опиатных рецепторов (ОР) налоксона. Ув. 168, об.10. Г – снижение плотности флюоресцирующих адренергических волокон в САУ при ЖЭМ кроликов. Д – сохранение сниженной плотности флюоресцирующих адренергических волокон в САУ при ЖЭМ кролика на фоне предварительно введенного антагониста ОР налоксона. Е – снижение плотности флюоресцирующих адренергических волокон в АВУ при ЖЭМ кролика. Ж – сохранение сниженной плотности флюоресцирующих адренергических волокон в АВУ при ЖЭМ кролика на фоне предварительно введенного антагониста ОР налоксона. Ув. 442, об.40.
авторы указывают, что сам миокард способен секретировать опиаты [28]. В настоящее время уже не вызывает сомнений факт существования собственной опиатной системы сердца. Известно, что уровень циркулирующих энкефалинов и β -эндорфина значительно увеличивается во время стресса и в процессе адаптации к стрессор-ным воздействиям [9, 15]. В частности, установлено, что у пациентов с острым инфарктом миокарда (ОИМ) уровень β -эндорфина в плазме крови в 10 раз превосходит норму, а при возникновении кардиогенного шока – в 20 раз [28].
ЖЭМ на фоне предварительной премедикации даларгином хотя и не изменяла общей реакции поведения животных, наблюдаемой при ЖЭМ, однако выживаемость их увеличилась более чем в 2 раза. Уровень А и НА в крови повышался незначительно, тем самым подтверждая стресс-лимитирующие эффекты даларгина [7, 9].
По нашим данным, даларгин не предотвращал развитие электрической негомогенности миокарда при ЖЭМ, маркером которой является удлинение интервала QT, что, по-видимому, способствовало более частому появлению отдельных видов НРС при ЖЭМ и даже в 3 раза чаще способствовал выявлению WPW-подобных и в 2 раза – сливных комплексов, возникновению инфарктоподобной ЭКГ. Неполный антиаритмический эффект агониста ОР даларгина установлен и на других экспериментальных моделях воспроизведения НРС [8, 15], а также при клинической апробации даларгина у больных с ОИМ [17]. Однако наряду с этим на фоне введенного даларгина полиморфная желудочковая тахикардия и ФЖ наступала в 2 раза реже. Противоаритмическая эффективность метэнкефа-лина отмечена и другими авторами в условиях нейрогенной ФЖ [23].
Регистрация инфарктоподобной ЭКГ, WPW-подобных и сливных комплексов на ЭКГ в условиях эксперимента у кроликов при ЖЭМ, на наш взгляд, обусловлена модулирующим влиянием центральных регулирующих структур головного мозга (в частности, гипоталамуса) на вегетативную регуляцию сердца и функционирование дополнительных (возможно, еще не идентифицированных естественных) предсердно-желудочковых соединений сердца [14, 18, 19, 21], а не органическим (коронарным) повреждением миокарда. На это указывают быстрая сменяемость патологической картины ЭКГ на нормальную у одного и того же выжившего животного и, главное, по данным наших гистологических исследований структур сердца и мозга, – признаки жировой эмболии, выявленные только в сосудах гипоталамуса, преимущественно в заднем его отделе, что, вероятно, связано с особенностью кровоснабжения гипоталамуса из бассейна сонной артерии (обильностью васкуляризации), способностью нейронов к нейросекреции опиоидных пептидов, нейромедиаторов и других биологически активных веществ, что, по-видимому, и определяет роль гипоталамуса в нейрогормональном обмене, регуляции ритма сердца и нарушений реполяризации желудочков [4, 7].
Полученные нами данные о влиянии даларгина на разнонаправленность активности адрен- и холинергических структур в центрах автоматизма, преимущественно на уровне АВ-соединения, вероятно, способствовали изменению электрофизиологических свойств основного и дополнительных путей предсердно-желудочкового проведения, формированию желудочковых аритмий, ЭКГ-феномена WPW [5].
Установленное в нашем исследовании удлинение интервала QT при ЖЭМ также, возможно, связано с нарушением функции гипоталамуса. Высказанное нами предположение согласуется с данными литературы: в клинических наблюдениях у детей с удлиненным интервалом QT без кардиоваскулярной патологии, по данным семейного анамнеза, в 30% случаев имели место внутричерепные кровоизлияния и травмы [11].
В литературе обсуждается патогенетическая значимость центральных регулирующих структур мозга в изменении процессов реполяризации желудочков сердца на ЭКГ у больных с ишемическим инсультом, а также у пациентов с субарахноидальным кровоизлиянием. Так, почти у 80% пациентов с ишемическим инсультом, подтвержденным компьютерной томографией, на ЭКГ регистрировались нарушения реполяризации желудочков, напоминающие изменения при инфаркте миокарда [1]. У 59% этих пациентов выявлялись различные НРС, в частности, пароксизмы наджелудочковых тахиаритмий (у 22% больных). Отмечена важная роль дисфункции вегетативной регуляции сердечно-сосудистой системы и выживаемости после инсульта [24]. В частности, у больных с пароксизмальной формой ФП выявлены циклические изменения активности неспецифическиx систем мозга (НСМ), в центральной вегетативной регуляции [15]. Причем, как указывают авторы, функциональная дезинтеграция НСМ, включавшая восходящую ретикулярную формацию, таламо-кортикальную и лимбическую системы, максимально усиливалась у больных за 2–24 ч до развития пароксизма ФП каким-либо нервным фактором.
Опубликовано немало других работ, отметивших взаимосвязь между поражениями головного мозга и НРС, внезапной сердечной смертью, ЭКГ-изменениями фазы реполяризации желудочков сердца [10, 15, 18, 26]. Полученные нами результаты подтверждают клинические данные, выявленные этими авторами, на что указывают отсутствие органического поражения миокарда и проводящей системы сердца, вероятная роль центральных регулирующих структур мозга (гипоталамуса) по контролю опиатергических систем, НРС и появление инфарктоподобных изменений на ЭКГ, по-видимому, посредством гуморального и нервного путей. Аналогичную точку зрения высказывают и другие исследователи [4, 29]. Показано, что кардиоваскулярные, в том числе и антиаритми-ческие, эффекты опиоидных пептидов при их внутривенном введении связаны с активацией µ - и δ -опиатных рецепторов, локализованных не только на периферических афферентных терминалях вагуса [16, 18], но и центральных ОР, локализованных в ядрах вагуса [25]. С вегетативным дисбалансом в виде преобладания симпатических влияний связывают синдром преждевременного возбуждения желудочков сердца [3] .
Заключение
Результаты проведенных исследований свидетельствуют о том, что опиоидный пептид-синтетический аналог лей-энкефалина [Д-Ала2Лей5Арг6-энкефалин] – даларгин оказывал как антиаритмический, так и проаритмогенный эффекты, в генезе которых важную роль играет функционирование дополнительных предсердно-желудочковых проводящих соединений. Установлено, что даларгин оказывает стресс-лимитирующий эффект, предотвращая ги-перкатехоламинемию и, тем самым, способствуя повышению выживаемости животных.
Блокатор ОР налоксон также снижал гиперкатехола-минемию и, кроме того, поддерживал нормальный тканевой уровень нейрогормонов, оказывал антиаритмичес-кий эффект в отношении возникновения ФЖ, что способствовало, по-видимому, повышению выживаемости животных на стрессорное воздействие.
Полученные данные, касающиеся частоты возникновения WPW- и инфарктоподобных изменений на ЭКГ у интактных животных и на фоне ЖЭМ, представляют исключительный теоретический и практический интерес в вопросе патогенетической значимости эндогенной опиатной системы в функционировании аномальных (возможно, еще и не идентифицированных естественных) путей предсердно-желудочкового проведения в генезе WPW- и инфактоподобной ЭКГ.
Результаты наших исследований позволяют сказать, что пептидные опиоиды, в частности, агонист ОР даларгин и блокатор ОР налоксон, могут найти более широкое использование в кардиологической практике, вторичной профилактике и лечении стресс-индуцированной патологии сердца. Однако для окончательного решения этих вопросов, а также для оценки возможности применения опиоидных пептидов в лечении НРС в клинической практике необходимы дальнейшие, хорошо спланированные не только клинические, но и экспериментальные исследования на различных моделях воспроизведения нарушений ритма сердца.
Список литературы Антиаритмические эффекты агониста ми- и дельта-опиатных рецепторов даларгина и блокатора опиатных рецепторов налоксона при экспериментальной жировой эмболии головного мозга. Актуальные вопросы экспериментальной кардиологии
- Абдуллаев А.А., Магомедова А.Д., Умаханова З.Р. и др. Диагностика повреждения миокарда и устранение мельдонием нарушений реполяризации желудочков у пациентов с ишемическим инсультом//Интеграция знаний в кардиологии: матер. Российского национального конгресса кардиологов. -М., 2012. -С. 151.
- Боровиков В.П., Боровиков И.П. Statistica -Статистический анализ и обработка данных в среде Windows. -М.: Филинь, 1997. -608 с.
- Василец Л.М., Туев А.В., Григориади Н.Е. и др. Синдромы преждевременного возбуждения желудочков: особенности проводящей системы, вариабельности ритма и морфологических показателей сердца//Интеграция знаний в кардиологии: матер. Российского национального конгресса кардиологов. -М., 2012 г. -С. 92.
- Васюков С.С., Недоступ А.В., Федорова В.И. и др. Неспецифические системы мозга и пароксизмальная форма фибрилляции предсердий.//Интеграция знаний в кардиологии: матер. Российского национального конгресса кардиологов. -М., 2012 г. -С. 135.
- Ковалев И.В., Усенков С.Ю., Свинцова Л.И. и др. Перинатальные факторы риска аритмий у детей раннего возраста//Матер. отчетной научной сессии 13-14 марта 2012 г. -Томск, 2012. -С. 47-48.
- Кондратьев Б.Ю. Морфофункциональное состояние адренергических и холинергических структур при экспериментальном инфаркте миокарда в условиях введения энкефалинов: автореф. дис.. канд. мед. наук. -Томск, 1988. -18 с.
- Лишманов Ю.Б., Маслов Л.Н. Опиатные нейропептиды, стресс и адаптационная защита сердца. -Томск: Изд-во Том. ун-та. -1994. -352 с.
- Лишманов Ю.Б., Маслов Л.Н. Эндогенная опиатная система и устойчивость сердца к аритмогенным воздействиям//Кардиология. -2002. -№ 3. -С. 51-57.
- Лишманов Ю.Б., Маслов Л.Н., Нарыжная Н.В. и др. Эндогенная опиатная система как звено срочной и долговременной адаптации организма к экстремальным воздействиям. Перспективы клинического применения опиатных пептидов//Вестник РАМН. -2012. -№ 6. -С. 73-82.
- Магомедова А.Д., Абдуллаев А.А., Исламова У.А. Устранение нарушения реполяризации желудочков триметазидином у пациентов с ишемическим инсультом//Тез. Российского национального конгресса кардиологов. -2013. -С. 350.
- Макаров Л.М., Юматова О.И. Приобретенный синдром удлиненного интервала QT у детей без кардиоваскулярной патологии//Тез. Российского национального конгресса кардиологов. -2012. -С. 75.
- Маслов Л.Н., Карпов Р.С., Лишманов Ю.Б. и др. Пептидные агонисты опиатных рецепторов -новая группа препаратов с антиангинальным, антиишемическим и антиаритмическим действием?//Клин. фармакол. тер. -2001. -№ 2. -С. 11.
- Меерсон Ф.З. Стресс-лимитирующие системы и проблема защиты от аритмий//Кардиология. -1987. -T. 27, № 7. -С. 5-12.
- Микроскопическая техника: руководство для врачей и лаборантов/под ред. Д.С. Саркисова и Ю.Л. Перова.-М.: Медицина, 1996. -544 с.
- Михайлова С.Д., Глущенко Н.В., Семушкина Т.М. и др. Особенности возникновения ишемических аритмий сердца при раздражении сенсомоторной зоны коры головного мозга у кошек под влиянием селективных агонистов опиатных рецепторов//Бюл. экспер. биол. и мед. -2000. -Т. 129(5). -С. 504-506.
- Розенштраух Л.В., Данило П., Стайнберг Д. и др. Механизмы вагусной модуляции летальных аритмий, вызванных окклюзией коронарной артерии у кошек//Кардиология. -1994. -№ 10. -С. 28-33.
- Слепушкин В.Д., Павленко В.С., Золоев Г.К. и др. Патогенетические пути влияния отечественного гексапептида даларгина на течение острого инфаркта миокарда//Кардиология. -1989. -Т. 29(5). -С. 117-119.
- Струтынский А.В., Скворцова В.И., Глазунов А.Б. и др. Диагностика электрической негомогенности миокарда у больных с острым нарушением мозгового кровообращения (ОНМК) с помощью многополюсного ЭКГ-картирования сердца//Матер. Российского национального конгресса кардиологов. -2012. -С. 85.
- Филиппов Э.А. Тепляков А.Т. Возможность выявления скрытых дополнительных путей предсердно-желудочкового проведения неинвазивным методом//Матер. Российского национального конгресса кардиологов. -2010. -C. 340.
- Филиппов Э.А., Тепляков А.Т. Роль гипоталамуса в формировании инфарктоподобной электрокардиограммы в эксперименте//Матер. Российского национального конгресса кардиологов. -2010. -C. 340-341.
- Фонякин А.В., Самохвалова Е.В., Гераскина Л.А. Вегетативная регуляция сердца и риск кардиальных осложнений при ишемическом инсульте /Научный центр неврологии РАМН, Москва, 2012. -URL: http://www.prostokniga.com.ua/spravochniki/katalog_knig/id/3433 (дата обращения 20.11.2014 г.).
- Хорева С.А., Медведев М.А. Нейрогуморальная регуляция процессов срочной адаптации организма. -Томск: Изд-во Том. ун-та, 1993. -216 с.
- Чередник И.Л., Осадчий О.Е. Противоаритмическая эффективность метэнкефалина в условиях нейрогенной фибрилляция предсердий//Вестник аритмологии. -2000. -№ 19. -С. 64-67.
- Bozluolcay M., Ince B., Celik Y. et al. Electrocardiographic findings and prognosis in ischemic stroke//Neurol. India. -2003. -Vol. 51, Iss. 4. -P. 500-502.
- Cadet P., Bilfinger T.V., Fimiani C. et al. Human vascular and cardiac endothelia express mu opiate receptor transcripts//Endothelium. -2000. -No. 7. -P. 185-191.
- Dutsch M., Burger M., Dorfler C. et al. Cardiovascular autonomic function in poststroke patients//Neurology. -2007. -Vol. 69, No. 24. -P. 2249-2255.
- Huang X.D., Lee A.Y.S., Wong T.M. Naloxone inhibits arrhythmias iduced by coronary artery occlusion and reperfusion in anaesthetized dogs//Br. J. Pharmacol. -1986. -Vol. 87. -P. 475-477.
- Oldroid K.G., Harvey K., Gray C.E. et al. Beta-endorphin release in patients after spontaneous and provoked acute myocardial ischemia//Br. Heart J. -1992. -Vol. 67. -P. 230-235.
- Oppenheimer S.M., Cechetto D.F., Hachinski V.C. Cerebrogenic cardiac arrhythmias. Cerebral electrocardiographic influences and their role in sudden death//Arch. Neurol. -1990. -Vol. 47, No. 5. -P. 513-519.


